Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Наночастицы золота в качестве новых препаратов для терапии рака
 Наночастицы золота становятся перспективным средством для лечения рака и исследуются в качестве носителей лекарственных средств, фототермических агентов, контрастных агентов и радиочувствительных средств. В данном обзоре исследуется область нанотехнологий с акцентом на последних исследованиях наночастиц золота, которые привели к клиническим испытаниям ранней фазы. В частности, обсуждаются доклинические доказательства эффективности наночастиц золота в качестве сенсибилизаторов с ионизирующим излучением invitro и invivo при киловольтной и мегавольтной энергиях.
Нанотехнологии можно определить как проектирование, описание, производство и применение структур, устройств и систем путем управления формой и размерами в нанометровом масштабе 1). Потенциальные преимущества наноматериалов хорошо описаны в литературе, и некоторые комментаторы утверждают, что нанотехнология может значительно превзойти влияние промышленной революции, и в будущем стать триллионным рынком 2). В медицине, наибольший интерес заключается в использовании наночастиц для улучшения доставки лекарств, при этом интерес также представляет диагностика in vitro, новый дизайн биоматериалов, биоимиджинг, терапия и активные имплантаты. Согласно стандартному определению Американского общества по испытанию материалов (ASTM), наночастицы представляют собой частицы с длинами, которые варьируются от 1 до 100 нм в двух или трех измерениях. Наиболее изученными наночастицами являются углеродные нанотрубки, наночастицы золота и квантовые точки селенида кадмия. Этот обзор посвящен перспективным наночастицам золота в качестве новых препаратов для терапии рака.
Наночастицы золота становятся перспективным средством для лечения рака и исследуются в качестве носителей лекарственных средств, фототермических агентов, контрастных агентов и радиочувствительных средств. В данном обзоре исследуется область нанотехнологий с акцентом на последних исследованиях наночастиц золота, которые привели к клиническим испытаниям ранней фазы. В частности, обсуждаются доклинические доказательства эффективности наночастиц золота в качестве сенсибилизаторов с ионизирующим излучением invitro и invivo при киловольтной и мегавольтной энергиях.
Нанотехнологии можно определить как проектирование, описание, производство и применение структур, устройств и систем путем управления формой и размерами в нанометровом масштабе 1). Потенциальные преимущества наноматериалов хорошо описаны в литературе, и некоторые комментаторы утверждают, что нанотехнология может значительно превзойти влияние промышленной революции, и в будущем стать триллионным рынком 2). В медицине, наибольший интерес заключается в использовании наночастиц для улучшения доставки лекарств, при этом интерес также представляет диагностика in vitro, новый дизайн биоматериалов, биоимиджинг, терапия и активные имплантаты. Согласно стандартному определению Американского общества по испытанию материалов (ASTM), наночастицы представляют собой частицы с длинами, которые варьируются от 1 до 100 нм в двух или трех измерениях. Наиболее изученными наночастицами являются углеродные нанотрубки, наночастицы золота и квантовые точки селенида кадмия. Этот обзор посвящен перспективным наночастицам золота в качестве новых препаратов для терапии рака.
Наночастицы золота
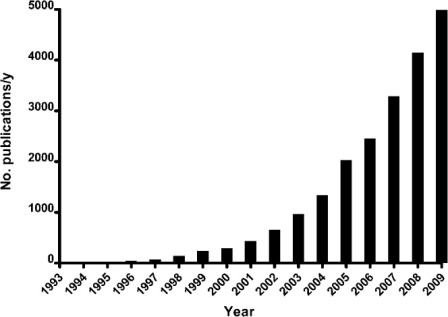
Общие состояния окисления золота включают +1 (Au [I] или золотосодержащие соединения) и +3 (Au [III] или золотосодержащие соединения). Наночастицы золота, однако, существуют в не окисленном состоянии Au [0]. Наночастицы золота не являются новыми; в 19-м веке, Майкл Фарадей 3) опубликовал первую научную работу по синтезу наночастиц золота, описывая производство коллоидного золота путем восстановления хлористоводородной кислоты фосфором. В конце 20-го века, такие методы, как просвечивающая электронная микроскопия (ПЭМ) и атомно-силовая микроскопия (АСМ), позволили осуществить непосредственную визуализацию наночастиц золота и контроль свойств, таких как размер и поверхностное покрытие. Общие методы производства наночастиц золота включают восстановление производных цитрата Au [III], таких как хлористоводородная кислота (HAuCl4) в воде до Au (0) и метод Бруста-Шиффрина, который использует двухфазный синтез и стабилизацию тиолами 4). В последние годы наблюдается бурный рост исследований наночастиц золота, с быстрым ростом публикаций в различных областях, в том числе в визуализации, биоинженерии и молекулярной биологии (рисунок 1). Вполне вероятно, что это имеет отношение к аналогичному расширению более широкой области нанотехнологий, повышению осведомленности и государственного финансирования, а также быстрый прогресс в области химического синтеза и молекулярной биологии.
 Наночастицы золота обладают уникальными физико-химическими свойствами, в том числе поверхностным плазмонным резонансом (ППР) и способностью связывать аминные и тиольные группы, что позволяет осуществлять модификацию поверхности и использовать их в биомедицине 5). Функционализация наночастиц является предметом интенсивных исследований в настоящее время, с быстрым прогрессом в направлении разработки биосовместимых, многофункциональных частиц для использования в диагностике и терапии рака. Например, в последнее время были разработаны многофункциональные мицеллярные гибридные наночастицы, содержащие наночастицы металла для обнаружения МРТ, квантовые точки для ближней инфракрасной флуоресцентной визуализации, полиэтиленгликоль (ПЭГ), чтобы увеличить время циркуляции, опухоль-специфический F3 пептид для ориентации и доксорубицин в качестве терапевтического средства. Эффективность была продемонстрирована in vitro и in vivo на мышиных моделях, имплантированных с клетками рака молочной железы человека 6).
Было много споров о способе вхождения наночастиц золота в клетки, при этом наиболее вероятным механизмом является неспецифический рецептор-опосредованный эндоцитоз (РОЭ). In vivo, даже при отсутствии функционализации, наночастицы пассивно накапливаются в опухолевых участках, которые имеют негерметичную, незрелую сосудистую сеть с более широкой фенестрацией, чем в нормальных зрелых кровеносных сосудах. Это известно как улучшенная проницаемость и удерживающая способность. Существуют трудности, связанные с использованием этого эффекта для доставки лекарственного средства в опухоль из-за неоднородности сосудистой сети опухоли, в частности, в центре низкодифференцированного рака, а также обнаружения частиц и поглощения ретикулоэндотелиальной системой (RES). Пегилирование является наиболее распространенным методом снижения поглощения RES, производящим гидратный барьер, вызывая стерические препятствия к присоединению фагоцитов 7). Эффект улучшенной проницаемости и удерживающей способности, в сочетании с увеличением циркуляции, часто достигаемой путем присоединения ПЭГ, может увеличить концентрацию препарата в опухоли в 10-100 раз по сравнению с использованием свободных препаратов. Дальнейшее нацеливание на опухоль может быть достигнуто за счет активного связывания опухоль-специфических молекул распознавания, таких как эпидермальный фактор роста (ЭФР), трансферрин, фолиевая кислота или моноклональные антитела к наночастицам 8). Исследования токсичности наночастиц золота были противоречивыми, при этом взаимодействия между тканью и наночастицами на клеточном, внутриклеточном и молекулярном уровне остались мало изучены. В то время как некоторые исследования показали отсутствие клеточной токсичности, другие исследования in vitro и in vivo показали клеточное производство реактивных форм кислорода, митохондриальную токсичность, высвобождение цитокинов, апоптоз и некроз 9).
Наночастицы золота обладают уникальными физико-химическими свойствами, в том числе поверхностным плазмонным резонансом (ППР) и способностью связывать аминные и тиольные группы, что позволяет осуществлять модификацию поверхности и использовать их в биомедицине 5). Функционализация наночастиц является предметом интенсивных исследований в настоящее время, с быстрым прогрессом в направлении разработки биосовместимых, многофункциональных частиц для использования в диагностике и терапии рака. Например, в последнее время были разработаны многофункциональные мицеллярные гибридные наночастицы, содержащие наночастицы металла для обнаружения МРТ, квантовые точки для ближней инфракрасной флуоресцентной визуализации, полиэтиленгликоль (ПЭГ), чтобы увеличить время циркуляции, опухоль-специфический F3 пептид для ориентации и доксорубицин в качестве терапевтического средства. Эффективность была продемонстрирована in vitro и in vivo на мышиных моделях, имплантированных с клетками рака молочной железы человека 6).
Было много споров о способе вхождения наночастиц золота в клетки, при этом наиболее вероятным механизмом является неспецифический рецептор-опосредованный эндоцитоз (РОЭ). In vivo, даже при отсутствии функционализации, наночастицы пассивно накапливаются в опухолевых участках, которые имеют негерметичную, незрелую сосудистую сеть с более широкой фенестрацией, чем в нормальных зрелых кровеносных сосудах. Это известно как улучшенная проницаемость и удерживающая способность. Существуют трудности, связанные с использованием этого эффекта для доставки лекарственного средства в опухоль из-за неоднородности сосудистой сети опухоли, в частности, в центре низкодифференцированного рака, а также обнаружения частиц и поглощения ретикулоэндотелиальной системой (RES). Пегилирование является наиболее распространенным методом снижения поглощения RES, производящим гидратный барьер, вызывая стерические препятствия к присоединению фагоцитов 7). Эффект улучшенной проницаемости и удерживающей способности, в сочетании с увеличением циркуляции, часто достигаемой путем присоединения ПЭГ, может увеличить концентрацию препарата в опухоли в 10-100 раз по сравнению с использованием свободных препаратов. Дальнейшее нацеливание на опухоль может быть достигнуто за счет активного связывания опухоль-специфических молекул распознавания, таких как эпидермальный фактор роста (ЭФР), трансферрин, фолиевая кислота или моноклональные антитела к наночастицам 8). Исследования токсичности наночастиц золота были противоречивыми, при этом взаимодействия между тканью и наночастицами на клеточном, внутриклеточном и молекулярном уровне остались мало изучены. В то время как некоторые исследования показали отсутствие клеточной токсичности, другие исследования in vitro и in vivo показали клеточное производство реактивных форм кислорода, митохондриальную токсичность, высвобождение цитокинов, апоптоз и некроз 9).
Наночастицы золота в качестве переносчиков лекарственных средств
Существует повышенный интерес к модификации существующих препаратов для улучшения фармакокинетики, а тем самым, снижения неспецифических побочных эффектов и доставки более высоких доз в целевые ткани. Важной демонстрацией потенциала полифункциональных наночастиц золота для доставки лекарственных средств было использование 5 нм наночастиц в качестве средств доставки, ковалентно связанных с цетуксимабом, как активным целенаправленным агентом и гемцитабином в качестве терапевтического полезного груза при раке поджелудочной железы. Рецептор эпидермального фактора роста (РЭФР) избыточно экспрессируется в до 60% видов рака поджелудочной железы, и комбинация цетуксимаба и гемцитабина была исследована в фазе II испытания этого заболевания. Патра и др. показали, что высокие концентрации золота внутри опухоли (4500 мкг г-1) могут быть достигнуты с помощью этого подхода, по сравнению с 600 мкг г-1 с нецелевыми наночастицами золота с минимальным накоплением в печени или почках. Нанокомплекс, состоящий из наночастицы золота, цетуксимаба и гемцитабина, превосходит любой из отдельно взятых препаратов или их комбинацию in vitro и in vivo. Низкие дозы комплекса гемцитабина (2 мг кг-1) привели к> 80% -ному подавлению роста опухоли в ортотопической модели рака поджелудочной железы по сравнению с 30%-ным ингибированием с использованием неконъюгированных агентов в комбинации 10). Jiang и др. синтезировали наночастицы золота с цитратным покрытием контролируемых размеров в пределах от 2 до 100 нм, связанных с несколькими антителами к трастузумабу, что способствовало нацеливанию и сшивке с рецептором эпидермального фактора роста человека (HER)-2 в человеческих SK-BR-3 клетках рака молочной железы. Более крупные наночастицы имели большее соотношение белка к наночастицам, чем более мелкие, более изогнутые частицы, с большим связыванием с трастузумабом. В этом исследовании, оптимальный размер для клеточного входа наночастиц составил 40-50 нм. Более мелкие частицы диссоциировали от клеточной мембраны, а более крупные частицы, как представляется, уменьшали мембранное покрытие. Кроме того, с частицами 40 нм наночастицы золота-HER, рецепторный комплекс HER-2 усваивался в цитоплазму, что привело к 40% снижению на поверхности HER-2, процесс, который не происходит при связывании трастузумаба в одиночку. Это привело к снижению экспрессии киназ вниз по течению, включая протеинкиназу В (Akt) и митоген-активируемую протеинкиназу (МАРК) и двукратному увеличению цитотоксичности трастузумаба. Концентрация наночастиц золота, используемых в данном исследовании, была крайне низкой (концентрации fM), но наночастицы золота-HER четко визуализировались в цитоплазматических лизосомах. Эта важная работа продемонстрировала, что наночастицы золота могут выступать не просто в качестве пассивных переносчиков лекарственных средств, но также могут влиять на препарат-клеточные взаимодействия и усиливать терапевтический эффект.
Термотерапия наночастицами золота
Гипертермия, как известно, индуцирует апоптотическую гибель клеток во многих тканях, и было показано, что она вызывает увеличение локального контроля и общую выживаемость, в сочетании с лучевой терапией и химиотерапией в рандомизированных клинических исследованиях 11). Гипертермия, как правило, используется в сочетании с другими методами лечения, включая лучевую терапию, и может использоваться экстернально, интерстициально или эндолюминально с тепловыделением от радиочастотных волн, микроволновых печей или ультразвука. В то время как нормальная сосудистая сеть опухоли расширяется, способствуя теплоотдаче, её сужение обеспечивает некоторую селективность опухоли. Тем не менее, в целом, отсутствие специфичности для опухолевой ткани, трудности при нагревании глубоких опухолей до терапевтических температур и термотолерантность после первичной обработки связаны с ограниченным применением гипертермии в лечении рака 12).
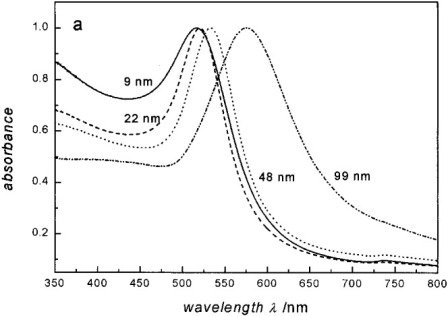
Прогресс в области наномедицинских исследований предлагает потенциал целенаправленного использования наночастиц металлов по отношению к опухолевым клеткам. Если применяется источник энергии, такой как лазер, производящий неионизирующее электромагнитное излучение, в металлических наночастицах происходит преобразование в тепловую энергию вследствие возбуждения и релаксации электронов. Кроме того, лазеры могут быть специально настроены на частоту ППР наночастиц, которая изменяется в зависимости от размера, формы и состава наночастиц (рисунок 2). В большинстве исследований использовались золотые нанооболочки, частицы с 100 нм ядрами диоксида кремния и золотым 15-нм покрытием, что сдвигало резонансный пик в ближнюю инфракрасную область спектра (650-950 нм), где кровь и ткани имеют максимальную пропускающую способность. Исследование in vivo показало, что 100 нм золотые нанооболочки максимально накапливались в SK-BR-3 опухолях молочной железы человека через 24 часа после внутривенной инъекции. Когда был применен лазер, настроенный на резонанс нанооболочки, средние опухолевые температуры увеличилась на 9°С у контрольных мышей, и на 37°С у мышей, обработанных нанооболочкой, с необратимым повреждением ткани в группе нанооболочки. Все мыши в группе нанооболочек выжили в течение 90 дней без признаков рецидива опухоли, тогда как все мыши в контрольной группе были подвергнуты эвтаназии через 20 дней вследствие неконтролируемого роста опухоли 13). Аналогичный подход применялся с использованием 110-нм пегилированных нанооболочек золота и лазерной терапии для лечения PC3 ксенотрансплантатов рака простаты человека. Наночастицы давали мышам внутривенно с лазерной терапией, применяемые через 18 часов после воздействия наночастиц. Полное исчезновение опухоли было отмечено у 93% мышей, получающих золотые нанооболочки и лазер, без каких-либо эффектов в опухолях, обработанных только лазером (рисунок 3) 14).
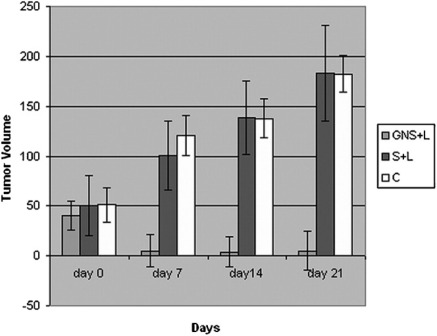 Некоторые ограничения этой техники по-прежнему существуют, в частности, для лечения глубоко расположенных опухолей, поскольку лазер проникает в мягкую ткань только на несколько сантиметров 15). Необходимо разработать другие способы, чтобы позволить осуществить количественное определение дозы нанооболочек in vivo,способствуя модификации лазерных доз. Кроме того, некоторые исследования показали, что ~5000 нанооболочек на клетку должны быть доставлены для достижения адекватного производства тепла для коагуляционного некроза. Ещё предстоит выяснить, является ли это достижимым в клинической практике с более разнородными опухолями, чем в доклинических моделях.
Некоторые ограничения этой техники по-прежнему существуют, в частности, для лечения глубоко расположенных опухолей, поскольку лазер проникает в мягкую ткань только на несколько сантиметров 15). Необходимо разработать другие способы, чтобы позволить осуществить количественное определение дозы нанооболочек in vivo,способствуя модификации лазерных доз. Кроме того, некоторые исследования показали, что ~5000 нанооболочек на клетку должны быть доставлены для достижения адекватного производства тепла для коагуляционного некроза. Ещё предстоит выяснить, является ли это достижимым в клинической практике с более разнородными опухолями, чем в доклинических моделях.
Наночастицы золота в качестве контрастных агентов
Свойства наночастиц золота, в том числе их небольшие размеры, биосовместимость, высокий атомный номер и способность связываться с целевыми агентами означает, что они имеют потенциал в качестве контрастных агентов. Контрастные вещества, такие как йод, улучшают определение васкуляризированных опухолей за счет увеличения фотоэлектрического поглощения фотонов, повышения точности диагностики опухолей, а также способствуют планированию радиотерапии16). При энергиях выше 80 кэВ, затухание колеблющейся массы золота выше, чем у йода. Предположительно, лучший контраст будет достигнут с золотом. Например, при 100 кВ затухание колеблющейся массы золота составляет 5,16 см2 г-1, для йода 1,94 см2г-1, для кости 0,186 см2 г-1, а для мягких тканей 0,169 см2 г-1, так что золото обеспечивает в 2,7 раза больший контраст на единицу веса, чем йод. 1.9 нм наночастиц золота (Aurovist™; Nanoprobes, Inc., Yaphank, NY), были использованы в естественных условиях, демонстрируя более длительное время удерживания и превосходный контраст к йоду с растворением ёмкостей размером до 100 мкм. Их вводили внутривенно мышам Balb / C с имплантированными EMT6 опухолями молочной железы и визуализировали с помощью маммографии 22-КВП через 2 мин-24 ч после инъекции. Несмотря на высокие начальные концентрации наночастиц золота в крови (10 мг мл-1 в крови), никаких гематологических или биохимических отклонений не было обнаружено через 11 или 30 дней после инъекции. Количественная фармакодинамика показала, что наночастицы золота выводились почками, и концентрации золота в крови уменьшались двухфазно, с 50% падением от 2 мин до 10 мин и с последующим дальнейшим 50% уменьшением от 15 мин до 1,4 ч. В противоположность этому, уровни опухоли через 24 ч составили 64% от пиковых уровней, достигаемых через 15 мин после инъекции, что предполагает излияние наночастиц в ткани опухоли. Усовершенствованные время удерживания и контраст могут позволить обнаружить небольшие опухоли при постановке, помочь при радиотерапии с наведением изображения и позволить количественно оценить внутриопухолевую дозу наночастиц золота. В то время как наночастицы золота потенциально могут улучшить контраст с условиями структурных изображений, в том числе КТ и МРТ, вполне возможно, что функционализированные наночастицы золота могут быть полезны в области молекулярной визуализации, чтобы дать in vivo информацию о метаболической активности раковых заболеваний и экспрессии молекулярных маркеров. В клиническом применении, позитронно-эмиссионная томография (ПЭТ) является наиболее широко используемым функциональным методом визуализации и ее преимущества по сравнению со стандартной визуализацией были хорошо продемонстрированы 17). На сегодняшний день, КТ не используется в качестве метода молекулярной визуализации, так как йод не может быть конъюгирован с молекулярными белками. Целевые наночастицы, в том числе суперпарамагнитные наночастицы и наночастицы золота, в настоящее время разрабатываются для улучшения визуализации с МРТ и КТ. Например, наночастицы золота конъюгировали с UM-A9 антителами, которые связываются с белком А9 (α4β6 интрегин), который сверхэкспрессируется во многих видах плоскоклеточного рака клеток головы и шеи и коррелирует с метастатическим потенциалом 18). В исследовании in vitro с использованием компьютерной томографии при 80 кВп, затухание КТ (в единицах Хаунсфилда [HU]) составило 168 HU в A9-экспрессирующих клетках и 28 HU в не-экспрессирующих клетках по сравнению с не подвергавшихся воздействию клетками. Это должно иметь клиническое значение, потому что HU для мягких тканей составляет 50; тем не менее, это должно быть проверено в исследованиях в естественных условиях. В дальнейшем исследовании использовались наночастицы золота, хелированные с гадолинием (Gd), чтобы включить как КТ вследствие высокого атомного номера золота и МРТ благодаря Gd. Опять же, было отмечено большее поглощение с наночастицами золота, с чем с йодом; HU были равны у 10 мг мл-1 золота и 35 мг мл-1 йода. Использование монохроматических рентгеновских лучей с Европейским синхротронным излучением обеспечили количественную оценку дозы наночастиц золота in vivo, потому что золото производит характерный спектр рентгеновских лучей, который обнаруживается с помощью ионизационной камеры. Наночастицы могут быть четко отображены с помощью КТ и МРТ, потому что они накапливаются в почках и мочевом пузыре во время почечной экскреции 19).
Золотые наночастицы как радиочувствительные вещества
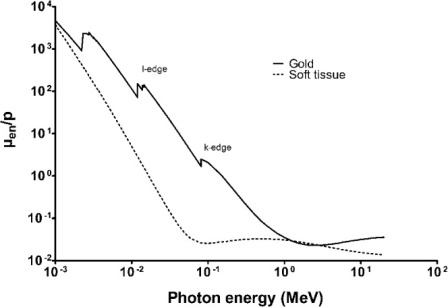
В то время как ВНП радиочувствительность наблюдается во многих исследованиях, как описано ниже, большая часть работы была феноменологической и механизмы, с помощью которых происходит сенсибилизация, остаются неясными. Большинство исследователей приписывают радиочувствительность наночастиц золота увеличению фотоэлектрического поглощения фотонов материалов с высоким атомным номером при киловольтных энергиях фотонов. Тем не менее, если происходит сенсибилизация при помощи этого физического механизма, эффекты не будут предсказаны при клинически значимых мегавольтных энергиях, где доминируют взаимодействия Комптона 20). Для клинического перевода и оптимизации эффекта, было бы полезно знать о важности размера ВНП, концентрации, поверхностного покрытия и расстояния от материала мишени, такого как ДНК радиочувствительности, опосредованной наночастицами золота. Знание диапазона и типа вторичных энергий, высвобожденных из наночастиц, например, низкоэнергетических электронов малого радиуса действия, Оже-электронов, фотоэлектронов или характерных рентгеновских лучей, и, в свою очередь, того, как они изменяются с энергией первичных фотонов, также будет способствовать развитию более рационально разработанных наночастиц золота для использования с излучением. Некоторые из исследований, пытающихся решить эти сложные вопросы, обсуждаются ниже. Понятие повышения дозы излучения материалов с высоким атомным номером было известно в течение многих лет 21). Это физическая концепция, которая использует гораздо большее фотоэлектрическое поглощение фотонов в материалах с высоким атомным номером по сравнению с мягкой тканью, особенно при киловольтных энергиях фотонов, как показано на рисунке 4. Увеличение радиационных побочных эффектов наблюдались на границе с материалами с высоким атомным номером вследствие большего поглощения фотонов и осаждения энергии в окружающие ткани от фотоэлектронов, Оже-электронов и характеристического рентгеновского излучения. В терапевтических терминах, если материал с высоким атомным номером присутствует в более высоких концентрациях в опухоли, чем в нормальной ткани, должно быть реализовано улучшение терапевтического индекса. Большая работа была проведена с йодом (Z = 53), обычно используемым контрастным веществом. Матсудайра и др. продемонстрировали увеличение гибели клеток в модели клеток in vitro с йодом, добавленным к среде роста. Сантос Мелло 22) достиг внутриопухолевой концентрации 5 мг мл-1 йода и продемонстрировал снижение задержки роста опухоли в модели кролика. Эти результаты привели к Этапу I исследования применимости, в котором 8 пациентов еженедельно получали 3-5 5-Грс 140-КВП рентгеновскими лучами до внутричерепных метастазов во время прохождения лучевой терапии всего мозга с 40 Gyв 20 фракциях в течение 4-х недель с 6-MV фотонами 23). Внутривенная контрастная йодная среда применялась перед излучением и 140-КВП рентгеновские лучи были доставлены в 360o вращениях в трех плоскостях, чтобы минимизировать дозу в черепе. Метастазы в головном мозге были измерены на еженедельных CTs до и во время лечения. Из восьми пациентов, наблюдался один полный ответ и четыре частичных реакции на терапию без увеличения ранних или поздних побочных эффектов радиации.
Исследования плазмиды ДНК
Модель ДНК плазмиды представляет собой относительно простую систему, которая позволяет исследовать радиационно-индуцированное повреждение ДНК и химическе эффекты свободных радикалов 24). Плазмидная ДНК относится к двухцепочечной экстрахромосомной ДНК, которая колеблется от нескольких сотен до нескольких тысяч пар оснований в длину и обычно присутствует у бактерий. Эта модель позволяет контролировать окружающую среду, воздействию которой подвергается ДНК, так как поглощающие условия радикалов могут варьироваться, что позволяет оценить прямые и косвенные воздействия радиации. Плазмидная модель позволяет проводить измерения сенсибилизации без биологических взаимодействий наночастиц золота с клетками и без воздействия репарации ДНК.
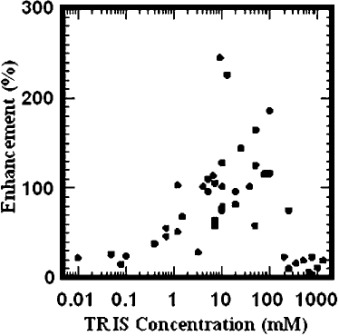
В исследовании моделирования и плазмиды, Картер и др. 25) исследовали распределение энергии из наночастиц, чтобы определить, насколько близко к целям, таким как ДНК, им нужно быть, чтобы произошла сенсибилизация. Этот вопрос важен, потому что, если выделение энергии присутствует на наноуровне, то должны быть предприняты усилия для нацеливания на наночастицу в ядре клетки, используя такие методы, как вложение сигнала ядерной локализации (NLS). Эта группа смоделированных 3-нм наночастиц золота, была интеркалирована к плазмидной ДНК в воде, облученной 100-КВП рентгеновскими лучами. Исследование показало, что, в то время как часть энергии была выпущена фотоэлектронами дальнего радиуса действия (которые могут перемещаться на расстоянии в несколько микрометров), большинство из них было в виде низкоэнергетических электронов (LEEs) (<100 эВ) с дальностью всего лишь несколько нанометров. Они подтвердили эти результаты моделирования с использованием плазмидной модели с возрастающими концентрациями трис (гидроксиметил) аминометана (TRIS) в качестве акцептора свободных радикалов. При низких поглощающих концентрациях, никакого увеличения числа наночастиц золота не наблюдалось из-за свободных радикалов, образующихся в результате взаимодействия фотонов с ДНК повреждением от воды. Поскольку концентрации TRIS были увеличены, а диапазон радикалов в воде снижался, и при физиологических поглощающих условиях, (~100 мМ TRIS), где диапазон радикалов составляет порядка 5 нм, повышение было максимальным при ~ 150% (рисунок 5). В этих условиях, только радикалы, производимые очень близко к ДНК, водой, либо наночастицами золота, могли вызвать повреждение, тем самым подтверждая наноразмерный характер энерговыделения наночастиц золота. Интересно, что с 6-нм наночастицами золота количество LEEs было значительно снижено, поскольку многие электроны не были освобождены из наночастиц.
 Boudaiffa и др 26) использовали плазмидную ДНК-модель, чтобы продемонстрировать, что LEEs(<20 эВ), которые не имеют достаточного количества энергии, чтобы вызвать прямую ионизацию ДНК или других молекул (например, воды), были способны вызывать повреждение ДНК. Эти LEEs являются наиболее распространенной формой вторичных видов, образующихся при взаимодействии фотонов с веществом (наиболее вероятная энергия: 10 эВ) и имеют диапазон в веществе 1-10 нм. Они предположили, что этот ущерб был нанесен посредством процесса, называемого диссоциативным прилипанием электронов (DEA), в результате чего падающие электроны присоединяются к основным компонентам ДНК, резонируют и образуют переходный молекулярный анион, который может привести к фрагментации малых молекул. Эти продукты затем реагируют с другими компонентами ДНК, вызывая однонитевые разрывы (SSBs) и двунитевые разрывы (DSBs). Чжэн и др. использовали эту модель для изучения радиочувствительности с цисплатином и наночастицами золота. 5 нм наночастиц золота при концентрации 12 мкм нековалентно связывались с плазмидной ДНК, и облучались 60 кэВ электронов в вакууме 27). При соотношении наночастиц золота к плазмидам 2: 1, образование DSB увеличилось в 2,6 раз. В отдельном эксперименте, комплексы наночастиц золота-плазмид различной толщины (10 нм и 2900 нм) облучали с гораздо большим повреждением ДНК, наблюдаемом в тонкой пленке, предполагая, что низкий уровень LEEs вызывал большую часть ущерба. Поскольку вторичные LEEs производятся фотонами всех энергий и несут ответственность за множество биологических повреждений, эта модель предполагает, что повышение также будет наблюдаться при мегавольтных энергиях фотонов. Эта работа была расширена за счет химического связывания цисплатина с плазмидной ДНК, облучаемой 60 кэВ электронами в присутствии и в отсутствие наночастиц золота. Чжэн и Санче показали, что радиационное повреждение было увеличено с коэффициентом 7,5, когда две молекулы цисплатина и одна наночастица золота были связаны с каждой плазмидой. Очевидно, что этот уровень усиления с такими низкими концентрациями наночастиц золота не может просто относиться к увеличению фотоэлектрического поглощения, и эта группа приписывала величину этого эффекта диссоциативному прилипанию электронов 28). Баттерворт и др. исследовали влияние размера и поглощающих условий на радиочувствительность. Коэффициент усиления дозы (DEF) 2 был отмечен для SSB и DSB с 50 мкг мл-1 5 нм наночастиц золота в 10 мМ TRIS буфере с 160-КВП рентгеновского излучения. Неожиданно было обнаружено, что наночастицы золота имеют радиопротекторные эффекты в условиях низкого поглощения (фосфатно-солевой буфер), предполагая, что сами по себе наночастицы золота могут иметь некоторые свойства, связанные с поглощением свободных радикалов. Золотые микрочастицы диаметром 1,5 мкм вызвали некоторое улучшение с SSB и DSB DEFs1,41 и 1,12, соответственно. 5 нм наночастиц золота при той же концентрации золота дали SSB и DSB DEFs 2,29 и 1,25, соответственно. ДНК-плазмидная модель может дать полезную информацию о механизмах, с помощью которых могут возникнуть сенсибилизация, и дать направление экспериментам с наночастицами золота in vitro и in vivo.
Boudaiffa и др 26) использовали плазмидную ДНК-модель, чтобы продемонстрировать, что LEEs(<20 эВ), которые не имеют достаточного количества энергии, чтобы вызвать прямую ионизацию ДНК или других молекул (например, воды), были способны вызывать повреждение ДНК. Эти LEEs являются наиболее распространенной формой вторичных видов, образующихся при взаимодействии фотонов с веществом (наиболее вероятная энергия: 10 эВ) и имеют диапазон в веществе 1-10 нм. Они предположили, что этот ущерб был нанесен посредством процесса, называемого диссоциативным прилипанием электронов (DEA), в результате чего падающие электроны присоединяются к основным компонентам ДНК, резонируют и образуют переходный молекулярный анион, который может привести к фрагментации малых молекул. Эти продукты затем реагируют с другими компонентами ДНК, вызывая однонитевые разрывы (SSBs) и двунитевые разрывы (DSBs). Чжэн и др. использовали эту модель для изучения радиочувствительности с цисплатином и наночастицами золота. 5 нм наночастиц золота при концентрации 12 мкм нековалентно связывались с плазмидной ДНК, и облучались 60 кэВ электронов в вакууме 27). При соотношении наночастиц золота к плазмидам 2: 1, образование DSB увеличилось в 2,6 раз. В отдельном эксперименте, комплексы наночастиц золота-плазмид различной толщины (10 нм и 2900 нм) облучали с гораздо большим повреждением ДНК, наблюдаемом в тонкой пленке, предполагая, что низкий уровень LEEs вызывал большую часть ущерба. Поскольку вторичные LEEs производятся фотонами всех энергий и несут ответственность за множество биологических повреждений, эта модель предполагает, что повышение также будет наблюдаться при мегавольтных энергиях фотонов. Эта работа была расширена за счет химического связывания цисплатина с плазмидной ДНК, облучаемой 60 кэВ электронами в присутствии и в отсутствие наночастиц золота. Чжэн и Санче показали, что радиационное повреждение было увеличено с коэффициентом 7,5, когда две молекулы цисплатина и одна наночастица золота были связаны с каждой плазмидой. Очевидно, что этот уровень усиления с такими низкими концентрациями наночастиц золота не может просто относиться к увеличению фотоэлектрического поглощения, и эта группа приписывала величину этого эффекта диссоциативному прилипанию электронов 28). Баттерворт и др. исследовали влияние размера и поглощающих условий на радиочувствительность. Коэффициент усиления дозы (DEF) 2 был отмечен для SSB и DSB с 50 мкг мл-1 5 нм наночастиц золота в 10 мМ TRIS буфере с 160-КВП рентгеновского излучения. Неожиданно было обнаружено, что наночастицы золота имеют радиопротекторные эффекты в условиях низкого поглощения (фосфатно-солевой буфер), предполагая, что сами по себе наночастицы золота могут иметь некоторые свойства, связанные с поглощением свободных радикалов. Золотые микрочастицы диаметром 1,5 мкм вызвали некоторое улучшение с SSB и DSB DEFs1,41 и 1,12, соответственно. 5 нм наночастиц золота при той же концентрации золота дали SSB и DSB DEFs 2,29 и 1,25, соответственно. ДНК-плазмидная модель может дать полезную информацию о механизмах, с помощью которых могут возникнуть сенсибилизация, и дать направление экспериментам с наночастицами золота in vitro и in vivo.
Исследования на основе моделирования в Монте-Карло
Cho 29) смоделировал эффекты с наночастицами золота и иридием-192, с киловольтной и мегавольтной энергий фотонов. С 140-КВП рентгеновского излучения и равномерным распределением 7 мг мл-1 наночастиц золота, было предсказано DEF 2,11. Однако, при мегавольтных энергиях, предсказанное физическое увеличение было крайне низким; например, физическое повышение дозы 1-7% прогнозировалось с 4-MV и 6-MV фотонами с концентрацией золота в диапазоне от 7 до 30 мг мл-1. Для источника иридий-192, помещенного в контакт с опухолевыми клетками, увеличения доз 8-30% были предсказаны с концентрациями наночастиц золота в пределах от 7 до 30 мг мл-1. Если золото было неравномерно распределено в опухоли, как этого можно ожидать, или скапливается рядом с клеточными мишенями (например, ДНК), потребуется оценка дозы на наноуровне. На сегодняшний день, эти исследования Монте-Карло (МК) не были выполнены из-за MC кода и расчетных ограничений. Дальнейшее исследование моделирования по сравнению повышенной дозы наночастиц золота с диапазоном рентгеновских энергий, в том числе часто используемых радиоизотопов брахитерапии, продемонстрировало, как и следовало ожидать, что материалы с большим атомным номером при более низких энергиях фотонов могут давать наибольшее физическое усиление. Было отмечено, что даже в поверхностном и ортовольтажномкиловольтажном диапазоне, где фотоэлектрические взаимодействия являются доминирующими, значительное усиление будет происходить только тогда, когда однородные концентрации наночастиц золота были больше, чем 1 мг мл-1. Другие модельные исследования MC оценивали целесообразность использования наночастиц золота с фотонами с киловольтной энергией и несколькими полями или методами вращательных дуг для лечения опухолей на разных глубинах. McMahon и др. вызвали показатель качества для учета увеличения поглощения излучения при опухолях, нагруженных 1% наночастиц золота, демонстрируя, что опухоли глубиной до 4 см могут преимущественно обрабатываться киловольтными фотонами. Тем не менее, данное исследование не учитывало увеличения дозы облучения кожи вследствие потери накопления излучения, которое может быть дозоограничивающим. Кроме того, вряд ли будет создан коммерческий киловольтный рентгеновский аппарат с возможностью доставки модулированного по интенсивности излучения. Другие исследования изучали возможность использования 150-КВП радиации для лечения рака предстательной железы, с равномерным распределением 1% золота 30). В то время как можно было доставить 72 Грв простату, не превышая допустимых доз в органы риска (в том числе прямую кишку, мочевой пузырь, головку бедра и кожу), гистограммы доза-объем уступали гистограммам, достигаемым с помощью линейного ускорителя 15-MV. Кроме того, изменения в концентрациях золота в пределах опухоли, как будет происходить клинически, привели к значительной деградации в органах в гистограммах риска доза-объем. Пациентов с локализованным раком простаты часто лечат при помощи брахитерапии с использованием йода-125 (I-125) или палладия-103, которые испускают гамма-лучи максимальной энергии 35 кэВ и 21 кэВ, соответственно. Cho и др. 31) специально смоделировали I-125 семена брахитерапии в опухолях, экспонированных 0-18 мг г-1 наночастиц золота. DEFs 1.68 были отмечены на расстоянии 1 см от источника I-125, когда было использовано 7 мг мл-1 наночастиц золота. В исследовании предполагается равномерное распределение атомов золота по всей опухоли. Фотоэлектронный флюенс был увеличен до двух порядков, в частности, при энергиях <20 кэВ, вследствие взаимодействия с l-краем и m-краем золота. Плотность энергии фотоэлектронов и оже-электронов была одинаковой; тем не менее, фотоэлектроны способствовали значительно большему локальному осаждению дозы, чем оже-электроны (по три раза). Таким образом, МС моделирование показывает, что значимое повышение физической дозы будет наблюдаться только при киловольтной энергии фотонов, где доминирует фотоэлектрическое сечение, даже когда используются высокие дозы наночастиц золота.
Исследования in vitro
Первоначальные биологические исследования повышения дозы золота были проведены с монослоями мышиных клеток С3Н 10T1 / 2, выращенных на тонких слоях золотой фольги. Используя физическую дозиметрию, Regulla и др. показали массивные Defs из 55-114, когда детекторы были помещены рядом с золотой фольгой, заключенной в полиметилметакрилат (ПММА) и облученной средними рентгеновскими энергиями 33-100 кВ. При 80 кВ рентгеновского излучения, вторичное излучение экспоненциально уменьшалось с расстоянием от золотой фольги и было незначительным при 30 мкм. В биологических экспериментах с монослоями клеток, наблюдались биологические факторы повышения на 30 для клеток, помещенных на расстоянии 2 мкм от золотой фольги. Поскольку золотая фольга имеет ограниченный терапевтический потенциал, в еще одной важной работе Herold и др. 32) было исследовано усиление с 3 золотыми микрочастицами с микромиллиметровым диаметром in vitro и in vivo. Повышение дозы с 1% микрочастицами золота в растворе без клеток определяли с использованием химической дозиметрии Фрике. Было обнаружено, что оно составляет 1,42 на 200 КВП рентгеновских лучей. Интересно отметить, что Cs-137, который производит 662 кэВ фотонов, не продемонстрировал усиление дозы. При этой энергии, эффекты Комптона являются доминирующими, и, в то время как доза перед материалами с высоким атомным номером будет увеличиваться за счет обратного рассеяния, доза позади материала снизится из-за экранирования, без чистого общего расширения. Затем было исследовано клоногенное выживание в трех клеточных линиях различной радиочувствительности, CHO-K1, DU-145 и ЕМТ-6, с радиационными энергиями 100 и 240 кВп и Cs-137. Для 200-КВП рентгеновского излучения, общая DEF составила 1,43; для Cs-137 наблюдалось небольшое повышение. Линейные квадратичные аппроксимации продемонстрировали увеличение как альфа, так и бета компонента кривой выживаемости. В исследованиях vivo/ex vivo с непосредственным впрыском 1% микрочастиц в имплантированные ЕМТ-6 опухоли, было продемонстрировано снижение эффективности нанесения покрытия от 0,248 в контрольной группе до 0,149 в опухолях, подвергшихся воздействию микрочастиц (р = 0,06). Микроскопия показала, что частицы были слабо распространены по всей интерстиции опухоли и не наблюдались в областях с плотно упакованными клетками опухоли. Ясно, что частицы такого размера являются слишком большими, чтобы проникать в клетки, которые имеют типичный диаметр 10-15 мкм. Chithrani и др 33) исследовали влияние размера наночастиц золота, концентрации и энергии излучения на in vitro радиочувствительность в клетках HeLa. Предыдущие исследования показали, что 50 нм наночастиц золота были взяты в клетках в большем количестве, чем 14 нм или 74 нм наночастиц золота, хотя наибольшее количество золота было доставлено с частицами 74 нм. В соответствии с этим, наибольшая радиочувствительность наблюдалась с 50-нм наночастицами по сравнению с 14-нм и 74-нм частицами с 220-КВП рентгеновскими лучами (DEFs были 1,43, 1,2 и 1,25, соответственно). Было обнаружено, что величина радиочувствительности зависела от концентрации наночастиц золота с 50 нм наночастиц и коррелировала с количеством внутриклеточных наночастиц, но не с общим количеством внутриклеточного золота, когда были рассмотрены различные размеры наночастиц. Рахман и др. исследовали эффекты радиочувствительности in vitro 1,9 нм наночастиц золота (Aurovist), которые также были использованы в исследованиях в естественных условиях 34). Бычьи эндотелиальные клетки аорты (BAEC) подвергались воздействию высоких концентраций (до ВНП до 1 мм) до облучения 80-КВП или 150-КВП рентгеновских лучей. Анализ пролиферации клеток использовали для расчета токсичности и радиочувствительности золота в одиночку. Наночастицы золота вызвали до 30% потери клеточной пролиферации при использовании в одиночку и большой радиации DEFs (до 24) с 80-КВП рентгеновскими лучами. Повышение дозы было снижено с 150-КВП рентгеновскими лучами и электронами MeVс DEFs 1,4 и 2,9, соответственно. В исследовании in vitro использовалось 30-нм наночастицы золота с цитратным или тиоглюкозным покрытием с DU145 клетками, облученными 200-КВП рентгеновскими лучами после 24 часов воздействия наночастиц 35). Трехкратное увеличение поглощения наночастиц золота наблюдалось в наночастицах, покрытых глюкозой, с уменьшением клеточной пролиферации при воздействии любых наночастиц. Сочетание наночастиц золота с излучением было в значительной степени аддитивным, при этом наночастицы золота с глюкозой имели большее влияние на клеточную пролиферацию, чем цитратные наночастицы золота с 2-Гризлучением (46% и 30,6% сокращение соответственно). В дальнейшем исследовании сравнивалось 10,8 нм наночастиц золота, покрытых тиоглюкозой и цистеамином при MCF7 раке молочной железы и нормальные клетки MCF10a молочной железы, облученные 200-КВП, цезий-137 или кобальтом-60 излучением. Токсичность наночастиц золота в одиночку составила <10% при анализе пролиферации клеток. Клоногенный анализ разовой дозы радиации проводился с тиоглюкозными наночастицами золота, что продемонстрировало сверхаддитивный эффект с наночастицами золота и излучением. В ходе дальнейшей работы, эта группа ученых рассмотрела механизмы сенсибилизации наночастиц золота в клетках DU145, подвергнутых воздействию тиоглюкозидных 15 нм 10,8 нм наночастиц золота в течение 2 ч облучаемых 2-ГрCs-137 гамма-лучами. Клоногенное выживание, которое было измерено выжившей фракцией в 2 Гр(SF2), снизилось с 1,0 до 0,38, когда наночастицы золота объединяли с радиацией, и наблюдалось соответствующее увеличение апоптотических клеток. Доля клеток в радиочувствительной G2 / M фазе клеточного цикла увеличилась с 18,4% в необработанных клетках до 29,9%, когда излучение применялось в сочетании с наночастицами золота. В дальнейших исследованиях использовались высокие концентрации 20 нм наночастиц золота: 0,25-2 мм (50-400 мг мл-1) в сочетании с 6 МэВ электронами, демонстрируя радиочувствительность с КТ-26 мышиными колоректальными клеточными линиями. В то время как некоторых больных раком лечат киловольтным излучением с брахитерапией, интраоперационной лучевой терапией, радионуклидной терапией и поверхностной рентгенотерапией, большинство пациентов лечат при помощи мегавольтных фотонов с помощью клинического линейного ускорителя. Два недавних исследования сообщили об in vitro сенсибилизации наночастиц золота при мегавольтных энергиях фотонов. В одном исследовании использовали клетки HeLa, подвергаемые воздействию 50-нм наночастиц золота, покрытых цитратом в течение 24 часов с DEFs 1,66, 1,43 и 1,17, наблюдаемых с 105-КВП, 220-КВП и 6-MV рентгеновского излучения, соответственно 36). Радиочувствительность была меньше при мегавольтных энергиях, но намного больше, чем предсказывало MC моделирование. В дальнейших исследованиях использовали КТ-26 мышиные раковые клетки, обработанные высокой концентрацией (500 мкМ) 6,1 нм пегилированных наночастиц золота в течение 48 ч. Клетки облучали 8 кэВ, 160-КВП и 6-MV рентгеновского излучения, достигая DEFs~1.44, 1,1 и 1,32, соответственно. Радиочувствительность с мегавольтными электронами была отмечена в других исследованиях. Рахман и др. сообщили о DEFs2,9 и 3,7 с использованием 0,5 мМ концентрации 1,9 нм при 6 ВНП МэВ и энергий электронов 12 МэВ, соответственно. Эти исследования, наряду с увеличением данных о биологической активности наночастиц золота, свидетельствуют о том, что механизм радиочувствительности может включать в себя больше, чем просто повышение дозы с большим атомным номером.
Исследования in vivo
Несмотря на рост публикаций о наночастицах золота в последние годы и увеличение числа исследований in vivo, исследующих поглощение и распределение наночастиц золота, имеется недостаток исследований об in vivo радиочувствительности наночастиц золота. Эти исследования будут иметь решающее значение для успешного применения такого подхода в клинических условиях.
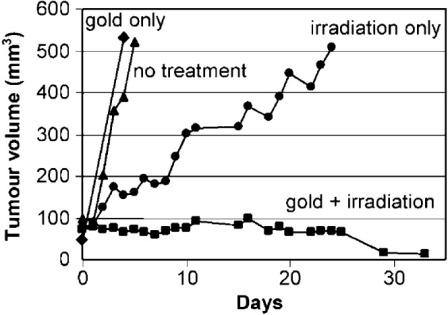
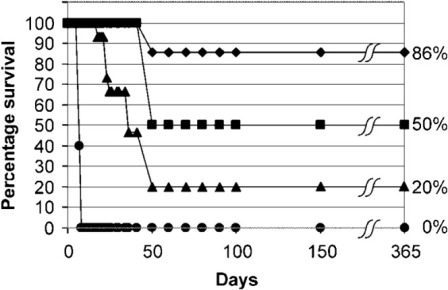
1.9 нм наночастиц золота (Aurovist) в сочетании с 250 кВп излучением продлевает выживаемость мышей с опухолями. В первом эксперименте мышей Balb / C с EMT-6 мышиными опухолями молочной железы получали однократную дозу 30 Грс использованием 250-КВП излучением в одиночку или в сочетании с высокой концентрацией наночастиц золота (1,35 г Au кг-1), которые вводили внутривенно за 5 мин до облучения. Излучение в одиночку индуцировало задержку роста опухоли; однако, радиация и наночастицы золота фактически привели к резкому снижению роста опухоли при оценке через 1 месяц после лечения. Наночастицы золота в одиночку не оказывают влияния на рост опухоли (рисунок 6). Этот обнадеживающий результат спровоцировал второй эксперимент с более длительным наблюдением, в котором мыши получали немного более низкую дозу облучения (26 Гр) в одиночку или с 1,35 г Au кг-1 или 2,7 г Au кг-1 наночастиц золота. 50% (1,35 г Au кг-1) и 86% (2,7 г Au кг-1) мышей, подвергавшихся воздействию наночастиц золота, обработанных излучением, выжили в течение 1 года, по сравнению с 20% при одном только излучении и 0% только с золотом или без лечения (р <0,01) (рисунок 7). Фармакокинетика показала, что концентрации золота достигли пика в сосудистой сети опухоли через 7 минут после инъекции. Наночастицы в два раза быстрее высвобождались из окружающей мышечной ткани, чем из опухоли. Наночастицы золота больше аккумулировались на периферии опухоли, чем в основной массе опухоли, при этом концентрации достигали пика на уровне 6,5 мг Au г-1 опухоли. Концентрации наночастиц золота вскоре после инъекции были выше в опухолях, чем в печени; тем не менее, требуется более подробная информация о биораспределениии экстравазации тканей наночастиц золота. В этом исследовании, оставшиеся в живых мыши оставались живыми в течение 1 года после лечения без очевидной долгосрочной токсичности.
 В исследовании изучались 5-нм наночастицы золота с покрытием Gd у мышей с MC7-L1 клетками рака молочной железы 37). In vitro, эти наночастицы золота продемонстрировали заметную цитотоксичность с 55% потерей в формировании колонии при отсутствии радиации и отсутствии радиочувствительности при концентрациях до 5 мкМ. Gd позволил контролировать биораспределение наночастиц золота in vivo и продемонстрировал максимальное поглощение опухоли через 10 минут при соотношении опухоль-к-мышце 3: 1, при введении 13,5 мг золота. Мыши подвергались воздействию только наночастиц золота или их комбинации с 10 Гр 150 КВП рентгеновских лучей через 20 мин после инъекции наночастиц золота. Не наблюдалось никакой разницы в продолжительности жизни при использовании наночастиц золота и радиации по сравнению с использованием только радиации, со средней продолжительностью жизни в 17 дней и 14 дней, соответственно. Чанг и др. 38) использовали 13-нм цитратно-покрытые наночастицы золота в мышиной модели с B16F10 мышиными клетками меланомы. Интересно отметить, что незначительный эффект был отмечен в клоногенных анализах in vitro с концентрацией наночастиц золота 180 мкг мл-1, достигающих DEFs 1,08. Значительная задержка роста опухоли in vivo и увеличение выживаемости отмечались при 36 мг кг-1 наночастиц золота, вводимых за 24 ч до облучения с 25 Гр 6 МэВ электронов, с помощью линейного ускорителя. Средняя продолжительность жизни была короче, чем в исследовании Hainfeld, с медианой выживаемости 20 дней у необлученных мышей, 5 дней при использовании только излучения, и 65 дней в группе с наночастицами золота и излучением. В отдельном эксперименте наблюдалось значительное увеличение апоптоза у мышей, получавших наночастицы золота плюс излучение по сравнению с монотерапией излучением, что было измерено с помощью терминальной дезоксинуклеотидилтрансферазы дезоксиуридинтрифосфата. Это исследование является важным, поскольку в нем использовались более низкие дозы наночастиц золота с клинически значимыми энергиями электронов. Исследования биораспределения показали, что золото накапливалось в опухолях через 24 ч (74,24 мкг мг-1 ткани), а также в печени и селезенке (147 мкг мл-1 и 350 мкг мл-1 соответственно), что свидетельствует о поглощении ретикулоэндотелиальной системой, которое может быть уменьшено путем пегилирования или активного таргетинга. Hainfeld и др недавно опубликовали дальнейшее исследование in vivo с использованием 1,9 нм наночастиц золота. В этом исследовании, мышей, больных высоко радиорезистентным мышиным плоскоклеточным раком, SCCVII, облучали фильтрованными фотонами в синхротроне. При использовании 68-кэВ фотонов, наблюдалось значительное замедление роста опухоли и достигался долгосрочный контроль над опухолью, когда 1,9 г Au кг-1 были объединены с 42 Гр излучения по сравнению только с излучением. Этот эффект не наблюдался при использовании 30 Гр излучения. Точно так же, как при использовании 157-кэВ фотонов, больший эффект наблюдался при сочетании наночастиц золота 50,6 Гр, чем с 44 Гр. Не было проведено никакого анализа поглощения опухоли или распределения наночастиц золота.
В исследовании изучались 5-нм наночастицы золота с покрытием Gd у мышей с MC7-L1 клетками рака молочной железы 37). In vitro, эти наночастицы золота продемонстрировали заметную цитотоксичность с 55% потерей в формировании колонии при отсутствии радиации и отсутствии радиочувствительности при концентрациях до 5 мкМ. Gd позволил контролировать биораспределение наночастиц золота in vivo и продемонстрировал максимальное поглощение опухоли через 10 минут при соотношении опухоль-к-мышце 3: 1, при введении 13,5 мг золота. Мыши подвергались воздействию только наночастиц золота или их комбинации с 10 Гр 150 КВП рентгеновских лучей через 20 мин после инъекции наночастиц золота. Не наблюдалось никакой разницы в продолжительности жизни при использовании наночастиц золота и радиации по сравнению с использованием только радиации, со средней продолжительностью жизни в 17 дней и 14 дней, соответственно. Чанг и др. 38) использовали 13-нм цитратно-покрытые наночастицы золота в мышиной модели с B16F10 мышиными клетками меланомы. Интересно отметить, что незначительный эффект был отмечен в клоногенных анализах in vitro с концентрацией наночастиц золота 180 мкг мл-1, достигающих DEFs 1,08. Значительная задержка роста опухоли in vivo и увеличение выживаемости отмечались при 36 мг кг-1 наночастиц золота, вводимых за 24 ч до облучения с 25 Гр 6 МэВ электронов, с помощью линейного ускорителя. Средняя продолжительность жизни была короче, чем в исследовании Hainfeld, с медианой выживаемости 20 дней у необлученных мышей, 5 дней при использовании только излучения, и 65 дней в группе с наночастицами золота и излучением. В отдельном эксперименте наблюдалось значительное увеличение апоптоза у мышей, получавших наночастицы золота плюс излучение по сравнению с монотерапией излучением, что было измерено с помощью терминальной дезоксинуклеотидилтрансферазы дезоксиуридинтрифосфата. Это исследование является важным, поскольку в нем использовались более низкие дозы наночастиц золота с клинически значимыми энергиями электронов. Исследования биораспределения показали, что золото накапливалось в опухолях через 24 ч (74,24 мкг мг-1 ткани), а также в печени и селезенке (147 мкг мл-1 и 350 мкг мл-1 соответственно), что свидетельствует о поглощении ретикулоэндотелиальной системой, которое может быть уменьшено путем пегилирования или активного таргетинга. Hainfeld и др недавно опубликовали дальнейшее исследование in vivo с использованием 1,9 нм наночастиц золота. В этом исследовании, мышей, больных высоко радиорезистентным мышиным плоскоклеточным раком, SCCVII, облучали фильтрованными фотонами в синхротроне. При использовании 68-кэВ фотонов, наблюдалось значительное замедление роста опухоли и достигался долгосрочный контроль над опухолью, когда 1,9 г Au кг-1 были объединены с 42 Гр излучения по сравнению только с излучением. Этот эффект не наблюдался при использовании 30 Гр излучения. Точно так же, как при использовании 157-кэВ фотонов, больший эффект наблюдался при сочетании наночастиц золота 50,6 Гр, чем с 44 Гр. Не было проведено никакого анализа поглощения опухоли или распределения наночастиц золота.
Клинические исследования наночастиц золота
Наномедицинские исследования остаются относительно незрелой отраслью, и полное клиническое воздействие наночастиц золота на человека пока не известно. Разрабатывается множество новых нанокомплексов для лечения рака, и существует необходимость провести клинические испытания. В 2004 году была образована Лаборатория характеризации нанотехнологий (NCL) благодаря официальному сотрудничеству между тремя американскими федеральными организациями: Национальным институтом рака, Управлением за контролем качества пищевых продуктов и медикаментов США и Национальным институтом стандартов и технологий 39). Эта лаборатория выполняет и стандартизирует доклиническую характеристику наноматериалов, предназначенных для лечения рака. NCL будет выполнять физико-химическую in vitro и in vivo характеризацию и испытала на настоящий момент более 180 наноматериалов. Первое средство с использованием наночастиц золота, достигшее ранней фазы клинических испытаний, - это CYT-6091, 27-нм наночастицы золота с цитратным покрытием, связанные с тиолированным ПЭГ и фактором некроза опухоли-альфа (TNF-α) (Aurimmune; CytImmuneSciences, Rockville, MD), который имеет двойной эффект повышения адресности опухоли и токсичности опухоли. TNF-α представляет собой многофункциональный цитокин, известный как цитотоксическое и иммуномодулирующее средство. Предыдущие клинические испытания TNF-альфа продемонстрировали дозоограничивающую токсичность гипотонии и тошноту при концентрации 225 мкг м-2, что ограничивает его более широкое клиническое применение. В недавних доклинических исследованиях TNF сравнивалась с комплексами наночастиц золота и TNF. В то время как токсичность, связанная с TNF, улучшилась, неприемлемое поглощение наблюдалось при использовании РЭС. Наблюдалось резкое улучшение в опухолевой специфичности, когда PEG-тиол добавляли с активным поглощением опухоли, с плато через 6 часов, а также постепенным снижением концентрации в печени и селезенке в течение того же времени 40). Исследование фазы I CYT-6091 началось в 2005 году, и включало 29 пациентов с солидным раком, нечувствительным к обычным методам лечения. Уровни доз TNF составили 50-600 мкг м-2, без токсичности, которая вызвала бы ограничение дозы. Лихорадка II степени, которую лечили при помощи жаропонижающих средств, была основным побочным эффектом. Самая высокая доза TNF, используемая в этом испытании, была более чем в три раза выше максимально переносимой дозы в исторических исследованиях TNF. Наблюдался один частичный ответ и три устойчивых заболевания. В настоящее время планируется проведение дальнейших испытаний в сочетании с химиотерапией. Внутриклеточные наночастицы золота были обнаружены в ходе опухолевых биопсий после лечения, но не в нормальной ткани. Доклинические исследования цитохром-6091, связанного с паклитакселом (известный как синергист с TNF), показали в 10 раз большее поглощение паклитаксела в солидных опухолях, по сравнению только с паклитакселом. Однодозное экспериментальное исследование частиц AuroShell® (NanospectraBiosciences, Inc., Хьюстон, штат Техас) при внутривенном введении пациентам с рецидивирующим или резистентным раком головы и шеи для плановой фототермической терапии будет включать 15 пациентов. Пациенты будут получать частицы AuroShell внутривенно, а после этого последует междоузельное освещение с 808-нм лазером. Биопсия после лечения поможет оценить поглощение наночастиц в опухоли с использованием нейтронного активированного анализа 41).
Вывод
Наночастицы золота обладают многими свойствами, которые являются привлекательными для их использования в терапии рака. Они имеют малый размер и могут широко проникать по всему телу, преимущественно накапливаясь в опухолевых участках вследствие эффекта ЭПР. Важно то, что они могут связывать многие белки и лекарственные средства и могут быть активно направлены на раковые клетки с гиперэкспрессией рецепторов клеточной поверхности. Являясь биологически совместимыми, препараты с наночастицами золота могут быть токсичными в системах in vitro и in vivo. Наночастицы золота имеют высокий атомный номер, что приводит к большему поглощению киловольтного рентгеновского излучения и обеспечивает больший контраст по сравнению со стандартными средствами. Они резонируют при воздействии света конкретных энергий, производя тепло, которое может быть использовано в селективной к опухолям фототермической терапии. Было показано, что наночастицы золота вызывают радиочувствительность при киловольтных и мегавольтных энергиях фотонов. Точный механизм их действия еще предстоит понять, но он может быть физическим, химическим или биологическим. Необходимо ответить на множество вопросов, прежде чем вводить комплексы с наночастицами золота в клиническое применение. Факторы, влияющие на фармакокинетику, биораспределение и токсичность наночастиц золота в естественных условиях, необходимо прояснить. Специфичным наночастицам золота необходимо покинуть сосудистую сеть опухоли, пересечь интерстиции опухоли, проникнуть в клетки и потенциально покинуть лизосомы, чтобы быть эффективными в естественных условиях. Они должны быть в состоянии достигнуть гипоксических клеток, которые находятся далеко от сосудистой системы, так как эти клетки, как известно, являются химиорезистентными и радиорезистентными. Необходимы долгосрочные исследования для оценки токсичности и мутагенного потенциала поглощения наночастиц золота, поскольку частицы могут оставаться в клетках в течение многих месяцев. Должен быть реализован стандартный подход для физико-химических характеристик и доклинических испытаний, и этому процессу в настоящее время способствует NCL. Необходим строгий контроль качества, чтобы обеспечить минимальную вариацию наночастиц от партии к партии, особенно когда производство масштабируется для клинического использования. Существует огромный потенциал для использования наночастиц в терапии рака. Учитывая глобальный интерес к области нанотехнологий и, в частности, к области наномедицины, вполне вероятно, что многие из этих вопросов будут рассмотрены в ближайшее время.










