Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Ридафоролимус
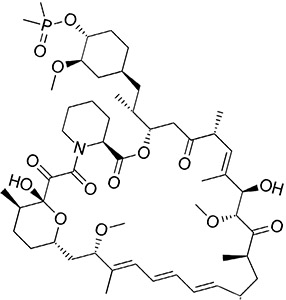
Ридафоролимус (или АР23573 и МК-8669, ранее известный как Дефоролимус), является исследуемым нацеленным и низкомолекулярным ингибитором белка МТор, белка, действующего в качестве центрального регулятора синтеза белков, пролиферации клеток, прогрессии клеточного цикла и выживаемости клеток, интегрирующего сигналы от таких белков, как PI3K, АКТ и PTEN, играя важную роль в подавлении образования злокачественных опухолей. Блокировка МТор создает эффект «голодания» опухолевых клеток, вмешиваясь в рост, деление, метаболизм и ангиогенез клеток.
В клинических испытаниях вещество продемонстрировало многообещающие результаты в случаях прогрессирующей саркомы мягких тканей и костей.
Фармакологическая группа: противоопухолевые препараты; ингибиторы mTor
Систематическое (IUPAC) название: диметилфосфинат
Формула: C53H84NO14P
Коммерческие соглашения
Ридафоролимус – это совместная разработка компаний Merck и ARIAD Pharmaceuticals. 5 мая 2010 года Ariad Pharmaceuticals и Merck & Company объявили о планах клинического развития препарата и о подписании маркетингового соглашения. Благодаря этому соглашению, Ariad получила от Merck $125 млн в виде авансовых платежей и $53 млн в виде поэтапных выплат. Будущие платежи вступают в силу при принятии заявки на одобрение лекарственного средства в FDA, а остальные выплаты – с того момента, когда препарат получил разрешение на продажу. Аналогичные этапы принятия и одобрения лекарственных средств практикуются в Европе и Японии. Другие поэтапные выплаты привязаны к планам продаж препарата. ARIAD решили совместными усилиями продвигать Ридафоролимус в США. Merck планирует представить новую лекарственную форму Ридафоролимуса в FDA и маркетинговую заявку в Европейский Союз в 2011 году.
Клинические испытания
Этап III SUCCEED
6 июня 2011 года Ariad и Merck объявили подробные результаты крупнейшего из когда-либо проводившихся рандомизированных исследований пациентов с саркомой мягких тканей и костей, о III фазе клинических испытаний SUCCEED. В ходе испытаний SUCCEED были протестированы результаты перорального приема ридафоролимуса у пациентов с метастатическими саркомами мягких тканей или костей, которые ранее показывали благоприятный ответ на химиотерапию. В этой группе пациентов, Ридафоролимус улучшил показатели выживаемости без прогрессирования заболевания по сравнению с плацебо, что послужило первичной конечной точкой исследования. Полные результаты исследования были представлены Сантом П. Чавла, доктором медицинских наук и директором Онкологического Центра лечения саркомы, Санта-Моника, штат Калифорния, в ходе ежегодной встречи Американского общества клинической онкологии (ASCO) 2011 года.
Испытание SUCCEED было рандомизированным (1:1), плацебо-контролируемым, двойным слепым исследованием перорального приема Ридафоролимуса в дозе 40 мг/день (пять из семи дней в неделю) у пациентов с метастатической саркомой мягких тканей или костей, ранее показавших благоприятный ответ на химиотерапию. Для испытания SUCCEED FDA предоставил ридафоролимусу специальный протокол оценки.
На основании 552 случаев выживаемости без прогрессирования заболевания у 711 пациентов (ридафоролимус (N = 347), плацебо (N = 364), определенных независимым радиологическим комитетом по рассмотрению, исследование достигло своей первичной конечной точки улучшения выживаемости без прогрессирования заболевания (ВБП), со статистически значимым (р=0,0001) 28-процентным сокращением риска прогрессирования или смерти, наблюдавшимся у пациентов, принимавших ридафоролимус, по сравнению с плацебо (отношение рисков=0,72). Медиана ВБП составила 17,7 недель у пациентов, получавших ридафоролимус, по сравнению с 14,6 неделями в группе плацебо. Кроме того, на основе полного анализа ВБП, определяемого оценкой исследования, наблюдалось статистически значимое (р<0,0001) 31-процентное сокращение риска прогрессирования или смерти при приеме ридафоролимуса по сравнению с плацебо (отношение рисков = 0,69). В анализе оценки исследования, медиана ВБП составила 22,4 недель у пациентов, получавших ридафоролимус, по сравнению с 14,7 неделями в группе плацебо.
:Tags
Читать еще: Горянка (Эпимедиум) , Дигидроэрготоксин , Динитрофенол (2,4-динитрофенол) , Марганец , СДВГ (Синдром дефицита внимания с гиперактивностью) ,










