Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Аминокислоты
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH 2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот. Известно около 500 аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты. Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.). В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Аминокислоты и питание человека
При введении в организм человека с пищей, 22 стандартные аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
Пирролизин входит в состав только нескольких микробов, и только в одном организме имеется как Pyl, так и Sес. Из 22 стандартных аминокислот, 9 называют незаменимыми потому, что человеческий организм не может синтезировать их самостоятельно из других соединений в необходимых для нормального роста количествах, их можно получить только с пищей. Кроме того, цистеин, таурин, тирозин и аргинин считаются полузаменимыми аминокислотами у детей (хотя таурин технически не является аминокислотой), потому что метаболические пути, которые синтезируют эти аминокислоты, у детей еще не полностью развиты. Необходимые количества аминокислот также зависят от возраста и здоровья человека, поэтому довольно сложно давать здесь общие диетические рекомендации.
Список Аминокислот
- 5-гидрокситриптофан (5-HTP)
- D-аспарагиновая кислота
- D-серин
- Ilex guayusa (гуаюса)
- L-карнитин
- L-Тирозин
- S-аденозилметионин
- Агматин
- Аланилглютамин (Сустамин)
- Аланин
- Аминокислоты
- Аминокислоты с разветвленной цепью (BCAA)
- Аминокислоты шелка
- Аргинин
- Аспарагин
- Аспарагиновая кислота
- Ацетил L карнитин (ALCAR)
- Бета-аланин
- Валин
- Гамма-аминомасляная кислота (ГАМК), Аминалон
- Гепа-Мерц (Орнитин)
- Гистидин
- Глицин
- Глютамин
- Глютаминовая кислота
- ГМБ (гидроксиметилбутират)
- Гонадорелин
- Изолейцин
- Лейцин
- Лейциновая кислота
- Лизин (L-лизин)
- Метионин
- Нейротрансмиттер
- Норвалин
- Пролин
- Серин
- Спирулина
- Таурин
- Теанин
- Треонин
- Триптофан
- Фенилаланин
- Цистеин
- Цитруллин
- Ягоды Годжи
Аминокислоты белков
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота «относится именно к ним. Это 23 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров). 20 из 23 протеиногенных аминокислот кодируются непосредственно триплетными кодонами в генетическом коде и известны как «стандартные» аминокислоты. Остальные три («нестандартные» или «неканонические») – это пирролизин (встречается у метаногенных организмов и других эукариотов), селеноцистеин (присутствует во многих прокариотах и в большинстве эукариотов) и N-формилметионин. Например, 25 человеческих белков включают в свою первичную структуру селеноцистеин, и структурно характеризуются как ферменты (селеноэнзимы), использующие селеноцистеин в качестве каталитического фрагмента на своих активных участках. Пирролизин и селеноцистеин кодируются с помощью вариантных кодонов; например, селеноцистеин кодируется стоп-кодоном и элементом SECIS (инсерционной последовательностью селеноцистеина). Комбинации кодон-тРНК (транспортная рибонуклеиновая кислота), которые не встречаются в природе, также можно использовать для «расширения» генетического кода и создания новых белков, известных как аллопротеины.
Функции аминокислот
Многие протеиногенные и непротеиногенные аминокислоты также играют важную, не связанную с образованием белка, роль в организме. Например, в головном мозге человека глутамат (стандартная глутаминовая кислота) и гамма-аминомасляная кислота (»ГАМК», нестандартная гамма-аминокислота), являются основными возбуждающими и тормозящими нейромедиаторами. Гидроксипролин (основной компонент соединительной ткани коллагена) синтезируют из пролина; стандартная аминокислота глицин используется для синтеза порфиринов, используемых в эритроцитах. Нестандартный карнитин используется для транспорта липидов.
9 из 20 стандартных аминокислот являются «незаменимыми» для человека, потому что они не производятся организмом, их можно получить только с пищей. Другие могут быть условно незаменимы для людей определенного возраста или людей, имеющих какие-либо заболевания.
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
Аминокислоты. История
Первые несколько аминокислот были открыты в начале 19 века. В 1806 году французские химики Луи Николя Воклен и Пьер Жан Робике изолировали в аспарагине первую аминокислоту, аспарагин. Цистеин был обнаружен в 1810 году, хотя его мономер, цистеин, оставался неоткрытым аж до 1884 года. Глицин и лейцин были обнаружены в 1820 году. Термин «аминокислота» был введен в английский язык в 1898 году. Было установлено, что аминокислоты можно получить из белков путем ферментативного расщепления или кислотного гидролиза. В 1902 г. Эмиль Фишер и Франц Гофмейстер предположили, что белки являются результатом связи между аминогруппой одной аминокислоты с карбоксильной группой другой, образующих линейную структуру, которую Фишер назвал пептидом.
Общая структура аминокислот
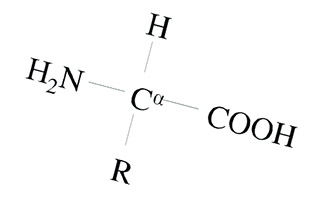
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот. У альфа-аминокислот, за исключением глицина, альфа-углерод является хиральным атомом углерода. У аминокислот, углеродные цепи которых присоединяются к альфа-углероду (как, например, лизин), углероды обозначаются как альфа, бета, гамма, дельта, и так далее. У некоторых аминокислот аминогруппа прикреплена к бета или гамма-углероду, и поэтому они называются бета- или гамма- аминокислоты.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
Термин «аминокислота с разветвленной цепью» относится к аминокислотам, имеющим алифатические нелинейные боковые цепи, это лейцин, изолейцин и валин. Пролин – единственная протеиногенная аминокислота, боковая группа которой прикреплена к альфа-аминогруппе и, таким образом, также является единственной протеиногенной аминокислотой, содержащей на этом положении вторичный амин. С химической точки зрения, пролин, таким образом, является имино кислотой, поскольку в нем отсутствует первичная аминогруппа, хотя в текущей биохимической номенклатуре он все еще классифицируется как аминокислота, а также «N-алкилированная альфа-аминокислота».
Изомерия
Все стандартные альфа-аминокислоты, кроме глицина, могут существовать в форме одной из двух энантиомеров, называемых L или D аминокислоты, представляющих собой зеркальные отображения друг друга. L-аминокислоты представляют собой все аминокислоты, которые находятся в белках при переносе в рибосому, D-аминокислоты находятся в некоторых белках, получаемых путем ферментативных посттрансляционных модификаций после переноса и транслокации в эндоплазматический ретикулум, как, например, у таких экзотических морских организмов, как улитки-конус. Кроме того, они в большом количестве представлены на пептидогликанных клеточных стенках бактерий, а D-серин может выступать в качестве нейротрансмиттера в мозге. Конфигурация аминокислот L и D относится а не к оптической активности самой аминокислоты, а скорее к оптической активности изомера глицеральдегида, из которого, теоретически, можно синтезировать аминокислоту (D-глицеральдегид является правосторонней аминокислотой; L-глицеральдегид – лево). По альтернативной модели, в стереохимии используются буквы (S) и (R). Почти все аминокислоты в белках - (S) при альфа углероде, цистеин - (R), глицин не хирален. Цистеин необычен тем, что в его боковой цепи атом серы находится во втором положении, и имеет большую атомную массу, чем группы, присоединенные к первому углероду, который присоединен к альфа-углероду в других стандартных аминокислотах, при этом аминокислота обозначается как (R).
Стандартные аминокислоты
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам. Процесс построения белка называется трансляцией и включает в себя пошаговое добавление аминокислот к растущей цепи белка через рибозимы, осуществляемый рибосомой. Порядок, в котором добавляются аминокислоты, считывается в генетическом коде с помощью шаблона мРНК, который представляет собой копию РНК одного из генов организма.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода. Оставшиеся 2, селеноцистеин и пирролизин, включаются в белки при помощи уникального синтетического механизма. Селеноцистеин образуется, когда транслируемый мРНК включает SECIS элемент, вызывающий кодон UGA вместо стоп-кодона. Пирролизин используется некоторыми метаногенными археями в составе ферментов, необходимых для производства метана. Он кодируется с кодоном UAG, который в других организмах обычно играет роль стоп-кодона. За кодоном UAG следует PYLIS последовательность.
Нестандартные аминокислоты
Не-протеиногенные аминокислоты
Помимо 22 стандартных аминокислот существует множество других аминокислот, которые называются не-протеиногенными или нестандартными. Такие аминокислоты либо не встречаются в белках (например, карнитин, ГАМК), либо не производятся непосредственно в изоляции при помощи стандартных клеточных механизмов (например, оксипролин и селенометионин).
Нестандартные аминокислоты, находящиеся в белках, образуются путем пост-трансляционной модификации, то есть модификацией после трансляции в процессе синтеза белка. Эти модификации часто необходимы для функционирования или регуляции белка; например, карбоксилирование глутамата позволяет улучшить связывание ионов кальция, а гидроксилирование пролина важно для поддержания соединительной ткани. Другой пример – формирование гипузина в фактор инициации трансляции EIF5A посредством модификации остатка лизина. Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипидной мембраной.
Некоторые нестандартные аминокислоты не встречаются в белках. Это лантионин, 2-аминоизомасляная кислота, дегидроаланин и гамма-аминомасляная кислота. Нестандартные аминокислоты часто встречаются в качестве промежуточных метаболических путей для стандартных аминокислот - например, орнитин и цитруллин встречаются в орнитиновом цикле как часть катаболизма кислоты. Редкое исключение доминированию альфа-аминокислоты в биологии - бета-аминокислота бета-аланин (3-аминопропановая кислота), которая используется для синтеза пантотеновой кислоты (витамина B5), компонента коэнзима А у растений и микроорганизмов.
Классификация аминокислот
Хотя существует множество способов классификации аминокислот, на основе их структуры и общих химических характеристик их R групп их можно разделить на шесть основных групп:
Алифатические: глицин, аланин, валин, лейцин, изолейцин
Гидроксильные или серосодержащие: серин, цистеин, треонин, метионин
Циклические: пролин
Ароматические: фенилаланин, тирозин, триптофан
Основные: гистидин, лизин, аргинин
Кислотные и их амиды: аспартат, глутамат, аспарагин, глутамин
Небелковые функции аминокислот
Нейромедиатор аминокислоты
В организме человека небелковые аминокислоты также играют важную роль в качестве промежуточных продуктов метаболизма, например, в биосинтезе нейромедиатора гамма-аминомасляной кислоты. Многие аминокислоты используются для синтеза других молекул, например:
Триптофан является предшественником нейромедиатора серотонина.
Тирозин и его предшественник фенилаланин являются предшественниками нейромедиаторов дофамина катехоламинов, адреналина и норадреналина.
Глицин является предшественником порфиринов, таких как гем.
Аргинин является предшественником оксида азота.
Орнитин и S-аденозилметионин являются предшественниками полиаминов.
Аспартат, глицин и глутамин являются предшественниками нуклеотидов.
Фенилаланин является предшественником различных фенилпропаноидов, которые играют важную роль в метаболизме растений.
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот.
Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей. Небелковая аминокислота мимозин содержится в других видах бобовых, особенно в Leucaena leucocephala. Это соединение является аналогом тирозина и может вызвать отравление у животных, пасущихся в местах произрастания этих растений.
Использование аминокислот
В промышленности
Аминокислоты используются для различных целей в промышленности, в основном - в качестве добавок в корма для животных. Такие добавки являются чрезвычайно необходимыми, так как во многих основных компонентах таких кормов, например, соевых бобах, очень мало или вовсе нет некоторых незаменимых аминокислот. Лизин, метионин, треонин, триптофан являются наиболее важными в производстве подобных кормов. В этой области аминокислоты также используются в хелатных катионах металла, чтобы улучшить поглощение минералов из пищевых добавок, что важно для улучшения здоровья или производительности этих животных.
В пищевой промышленности аминокислоты также широко используются, в частности, глутаминовую кислоту используют в качестве усилителя вкуса, а аспартам (аспартил-фенилаланин-1-метиловый эфир) – в качестве низкокалорийного искусственного подсластителя. Технологии, использующиеся в промышленности, связанной с кормлением животных, часто используются и в пищевой промышленности для снижения дефицита минеральных веществ (например, при анемии), за счет улучшения усвоения минеральных веществ из неорганических минеральных добавок.
Хелатообразующая способность аминокислот используется в сельскохозяйственных удобрениях для облегчения доставки минеральных веществ в растения при минеральной недостаточности (например, дефиците железа). Эти удобрения также используются для предотвращения возникновения болезней и улучшения общего состояния здоровья растений.
Помимо этого, аминокислоты используются в синтезе лекарств и при изготовлении косметики.
В медицине
Следующие аминокислотные производные имеют фармацевтическое применение:
5-HTP (5-гидрокситриптофан) используется в экспериментальном лечении депрессии.
L-ДОФА (L-дигидроксифенилаланин) используется в лечении паркинсонизма.
Эфлорнитин - препарат, ингибирующий орнитиндекарбоксилазу. Используется для лечения сонной болезни.
Расширенный генетический код
С 2001 года 40 неприродных аминокислот были добавлены в белки путем создания уникального кодона (перекодировки) и соответствующего РНК-переносчика: аминоацил - тРНК-синтетазная пара для кодирования его с различными физико-химическими и биологическими свойствами для использования в качестве инструмента для изучения структуры и функции белков или для создания новых или усовершенствования известных белков.
Аминокислоты и создание биоразлагаемых пластмасс и биополимеров
Аминокислоты в настоящее время исследуются в качестве компонентов биоразлагаемых полимеров. Эти соединения будут использоваться для создания экологически чистых упаковочных материалов и в медицине для доставки лекарственных средств и создания протезных имплантатов. Эти полимеры включают полипептиды, полиамиды, полиэфиры, полисульфиды и полиуретаны с аминокислотами, входящими в состав их основной цепи, либо связанными, как боковые цепи. Эти модификации изменяют физические свойства и реакционную способность полимеров. Интересным примером таких материалов выступает полиаспартат, водорастворимый биоразлагаемый полимер, который может найти применение в одноразовых подгузниках и сельском хозяйстве. В связи с его растворимостью и способностью образовывать хелатные соединения ионов металлов, полиаспартат также используется в качестве биоразлагаемого средства от накипи и ингибитора коррозии. Кроме того, в настоящее время разрабатывается ароматическая аминокислота тирозин в качестве возможной замены для токсичных фенолов, таких, как бисфенол А, в производстве поликарбонатов.
Химические реакции аминокислот
Так как аминокислоты имеют как первичную аминогруппу, так и первичную карбоксильную группу, эти химические вещества могут включаться в большинство реакций, связанных с этими функциональными группами, такие как: нуклеофильное присоединение, образования амидной связи и имина для аминогруппы и этерификации, образования амидной связи и декарбоксилирование группы карбоновой кислоты. Сочетание этих функциональных групп позволяет аминокислотам быть эффективными полидентатными лигандами металл-амино кислотных хелатов. Многочисленные боковые цепи аминокислот могут также вступать в химические реакции. Типы этих реакций определяются группами на их боковых цепях и, таким образом, отличаются в различных типах аминокислот.
Синтез аминокислот
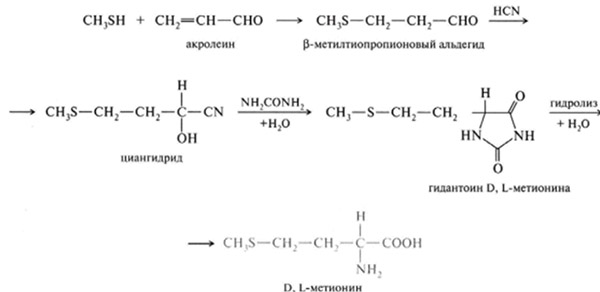
Химический синтез аминокислот
Синтез пептида
Существует несколько способов синтеза аминокислот. Один из старейших методов начинается с бромирования на альфа-углероде карбоновой кислоты. Нуклеофильное замещение аммиаком преобразует алкилбромид в аминокислоту. В качестве альтернативы, синтез аминокислот Стрекера включает обработку альдегида цианидом калия и аммиаком, что выводит альфа-амино нитрил в качестве промежуточного соединения. В результате гидролиза нитрила в кислоте получается альфа-аминокислота. Использование в данной реакции аммиака или аммониевых солей дает незамещенную аминокислоту, а замена первичных и вторичных аминов дает замещенную аминокислоту. Кроме того, использование кетонов вместо альдегидов дает альфа, альфа-дизамещенные аминокислоты. В результате классического синтеза получаются рацемические смеси альфа-аминокислот, однако были разработаны некоторые альтернативные процедуры с использованием асимметричных катализаторов.
В настоящее время наиболее принятый метод автоматизированного синтеза на твердой подложке (например, полистирол) с использованием защитных групп (например, Fmoc-и t-Вос) и активирующей группы (например, DCC и DIC).
Образование пептидной связи
Как амино-, так и карбоксильные группы аминокислот могут в результате реакций образовывать амидные связи, одна молекула аминокислоты может взаимодействовать с другой и соединяться через амидную связь. Это полимеризации аминокислот является именно тем механизмом, который создает белки. Эта реакция конденсации приводит к вновь формируемой пептидной связи и образованию молекулы воды. В клетках эта реакция происходит не напрямую, вместо этого аминокислоту сначала активируют путем присоединения к молекуле транспортной РНК посредством сложноэфирной связи. Аминоацил-тРНК производится в АТФ-зависимой реакции на аминоацил тРНК синтетазе. Эта аминоацил-тРНК затем служит субстратом для рибосомы, который катализирует атаку аминогруппы удлиненной белковой цепи на сложноэфирной связи. В результате этого механизма, все белки синтезируются, начиная с N-конца в направлении С-конца.
Однако не все пептидные связи формируются таким образом. В некоторых случаях пептиды синтезируются специфическими ферментами. Например, трипептид глутатион играет важную роль в защите клеток от окислительного стресса. Этот пептид синтезируется из свободных аминокислот в две стадии. На первой стадии гамма-глутамилцистеин синтетаза конденсирует цистеин и глутаминовую кислоту посредством пептидной связи, образованной между карбоксильной боковой цепью глутамата (гамма углерод этой побочной цепи) и аминогруппой цистеина. Этот дипептид затем конденсируется глицином через синтетазу глутатиона с образованием глутатиона.
В химии пептиды синтезируют при помощи различных реакций. В твердофазном синтезе пептидов в качестве активированных единиц чаще всего используются ароматические производные оксимы аминокислот. Их последовательно добавляют к растущей пептидной цепи, которая присоединена к твердой подложке из смолы. Возможность легко синтезировать огромное количество различных пептидов путем изменения типа и порядка аминокислот (с использованием комбинаторной химии) делает синтез пептидов особенно важным в создании библиотек пептидов для использования в создании лекарственных препаратов путем высокопроизводительного скрининга.
Биосинтез аминокислот
В растениях азот впервые был ассимилирован в органическое соединение в виде глутамата, формируемого из альфа-кетоглутарата и аммиака в митохондрии. Для формирования других аминокислот растения используют трансаминазу, чтобы переместить аминогруппу в другую альфа-кето-карбоновую кислоту. Например, аспартатаминотрансфераза преобразует глутамат и оксалоацетат в альфакетоглютарат и аспартат. Другие организмы также используют трансаминазы для синтеза аминокислот.
Нестандартные аминокислоты, как правило, формируются путем модификации стандартных аминокислот. Например, гомоцистеин образуется в результате транссульфирования или деметилирования метионина через промежуточный метаболит S-аденозилметионин, а гидроксипролин производится путем посттрансляционной модификации пролина.
Микроорганизмы и растения могут синтезировать многие необычные аминокислоты. Например, некоторые микроорганизмы могут производить 2-аминоизомасляную кислоту и лантионин, сульфидное производное аланина. Обе эти аминокислоты можно найти в пептидных лантибиотиках, таких как аламетицин. У растений 1-аминоциклопропан-1-карбоновая кислота представляет собой небольшую дизамещенную циклическую аминокислоту, которая является ключевым промежуточным продуктом в производстве этилена у растений.
Катаболизм протеиногенных аминокислот
Аминокислоты могут быть классифицированы в соответствии со свойствами их основных продуктов, как, например:
* Глюкогенные, продукты которых обладают способностью к образованию глюкозы путем глюконеогенеза
* Кетогенные, продукты которых имеют свойство образовывать глюкозу. Эти продукты могут быть использованы для кетогенеза или синтеза липидов.
* Аминокислоты, катаболизируемые как в глюкогенные, так и кетогенные продукты.
Деградация аминокислот часто включает дезаминирование, перемещая аминогруппу в альфакетоглютарат с образованием глутамата. Этот процесс включает трансаминазы, часто такие же, как и использующиеся в аминировании в процессе синтеза. У многих позвоночных аминогруппа затем удаляется через цикл мочевины и выделяется в виде мочевины. Однако, процесс деградации аминокислот может приводить к образованию мочевой кислоты или аммиака. Например, серин дегидратаза преобразует серин в пируват и аммиак. После удаления одной или более аминогрупп, остальная часть молекулы может иногда быть использована для синтеза новых аминокислот или для энергии путем ввода в гликолиз или цикл лимонной кислоты.
Физико-химические свойства аминокислот
20 аминокислот, кодируемых непосредственно генетическим кодом, можно разделить на несколько групп в зависимости от их свойств. Важными факторами являются заряд, гидрофильность или гидрофобность, размер и функциональные группы. Эти свойства важны для структуры белков и белок-белковых взаимодействий. Водорастворимые белки, как правило, имеют гидрофобные остатки (Leu, Ile, Val, Phe и Trp), хранящиеся в середине белка, тогда как гидрофильные боковые цепи подвергаются растворению в воде. Интегральные мембранные белки, как правило, имеют наружные кольца гидрофобных аминокислот, которые закрепляют их в липидный бислой. В случае срединного положения между этими двумя крайностями, некоторые периферические мембранные белки имеют на своей поверхности ряд гидрофобных аминокислот, блокирующихся на мембране. Аналогичным образом, белки, которые связываются с положительно заряженными молекулами, в верхнем слое имеют отрицательно заряженные аминокислоты, такие как глутамат и аспартат, а белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности с положительно заряженными цепями, такие как лизин и аргинин. Существуют различные масштабы гидрофобности аминокислотных остатков.
Некоторые аминокислоты обладают особыми свойствами, например цистеин, который может образовывать ковалентные дисульфидные связи с другими остатками цистеина; пролин, который образует цикл с полипептидной основой, и глицин, более гибкий, чем другие аминокислоты.
Многие белки при наличии дополнительных химических групп на аминокислотах претерпевают ряд посттрансляционных модификаций. Некоторые модификации могут производить гидрофобные липопротеины или гидрофильные гликопротеины. Эти модификации позволяют обращать направленность белка к мембране. Например, добавление и удаление жирных кислот пальмитиновой кислоты в остатки цистеина у некоторых сигнальных белков приводит к тому, что белки сначала присоединяются, а затем отделяются от клеточных мембран.
Аминокислоты и рост мышц

Аминокислоты - строительные элементы, из которых состоят все белки организма. В бодибилдинге аминокислотам уделяется особое значение, потому что мышцы практически полностью состоят из белка, то есть аминокислот. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов. От них зависит не только рост силы и «массы» мышц, но и восстановление физического и психического тонуса после тренировки, катаболизм подкожного жира и даже интеллектуальная деятельность мозга - источник мотивационных стимулов. Ученые установили, что аминокислоты чрезвычайно важны для восстановления мышц после тренировок, сохранения мышц во время цикла сушки или похудения, а также роста мышц.
Доступность:
Аминокислоты – это важные строительные элементы организма. Аминокислоты не имеют побочных эффектов, так как являются естественными пищевыми компонентами. Продолжительность приема аминокислот не ограничена, перерывы и циклирование не требуются. Аминокислоты можно приобрести в аптеке, где они находятся в свободном доступе и отпускаются без рецепта.
:Tags
Читать еще: Депакин/Конвулекс (Вальпроевая кислота) , Мегаколон , Рецепторы , Сенна , Хлорталидон ,










