Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
GDF11
 Фактор дифференциации роста-11 (GDF11), также известный как костный морфогенетический белок 11 (BMP-11), представляет собой белок, который у человека кодируется геном фактора дифференциации роста 11. 1)
GDF11 действует как цитокин, и его молекулярная структура идентична у людей, мышей и крыс. Группа морфогенетических белков костей характеризуется многоосновным протеолитическим процессинговым участком, который расщепляется с образованием белка, содержащего семь консервативных остатков цистеина.
Фактор дифференциации роста-11 (GDF11), также известный как костный морфогенетический белок 11 (BMP-11), представляет собой белок, который у человека кодируется геном фактора дифференциации роста 11. 1)
GDF11 действует как цитокин, и его молекулярная структура идентична у людей, мышей и крыс. Группа морфогенетических белков костей характеризуется многоосновным протеолитическим процессинговым участком, который расщепляется с образованием белка, содержащего семь консервативных остатков цистеина.
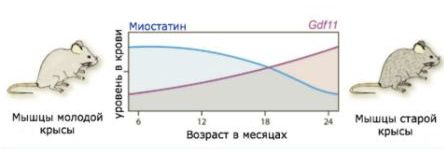
Системное применение GDF11 улучшает сосудистую сеть в гиппокампе и коре у старых мышей, что приводит к усилению нейрогенеза. 2) Кроме того, систематическая добавка GDF11 улучшила выживание и морфологию β-клеток и улучшила метаболизм глюкозы как на негенетических, так и на генетических моделях мышей с диабетом типа 2. GDF11 является регулятором биологии кожи и оказывает существенное влияние на выработку проколлагена I и гиалуроновой кислоты. GDF11 также активирует путь фосфорилирования Smad2/3 в эндотелиальных клетках кожи и улучшает сосудистую сеть кожи. Дополнение системных уровней GDF11, которые обычно снижаются с возрастом, посредством гетерохронного парабиоза или системной доставки рекомбинантного белка, обращает функциональные нарушения и восстанавливает целостность генома в старых мышечных стволовых клетках (сателлитных клетках). Повышенный уровень GDF11 у старых мышей также улучшал мышечные структурные и функциональные характеристики и увеличивал силу и выносливость. 3) Лечение старых мышей с целью восстановления GDF11 до уровня молодости суммировало эффекты парабиоза и обратимой возрастной гипертрофии, открывая терапевтическую возможность для лечения стареющего сердца. Обнаружено, что GDF11 снижает окислительный стресс и способен снижать уровни AGE, окисления белков и перекисного окисления липидов, а также замедлять накопление возрастных гистологических маркеров. GDF11 значительно предотвращал снижение активности CAT, GPX и SOD. Повышенная экспрессия GDF11 способствовала апоптозу и подавленная экспрессия GDF11 ингибировала апоптоз в клеточных линиях рака поджелудочной железы. Эти данные свидетельствуют о том, что GDF11 действует как супрессор опухолей при раке поджелудочной железы. 4) В 2014 году GDF11 был описан как фактор продления жизни в двух публикациях, основанных на результатах экспериментов с парабиозом на мышах, что журнал Science назвал в качестве научного прорыва года. Более поздние исследования поставили под сомнение эти выводы. 5) Исследователи расходятся во мнениях о селективности тестов, используемых для измерения GDF11, и об активности GDF11 из различных коммерчески доступных источников. Полная связь GDF11 со старением и любые возможные различия в действии GDF11 у мышей, крыс и людей – неясны и продолжают изучаться.
Влияние на рост и дифференцировку клеток
GDF11 принадлежит к суперсемейству трансформирующего фактора роста бета, который контролирует передне-задний паттерн путем регуляции экспрессии Hox генов. Он определяет домены экспрессии генов Hox и рострокаудальную идентичность в хвостовом отделе спинного мозга. 6) Во время развития мышей экспрессия GDF11 начинается в области хвостовой почки и хвостовой нервной пластинки. Мыши, нокаутированные по GDF, показывают дефекты скелета в результате проблем формирования паттерна с передне-задним позиционированием. В центральной нервной системе взрослых мышей, только GDF11 может улучшать сосудистую сеть головного мозга и усиливать нейрогенез. Этот цитокин также ингибирует пролиферацию нейронов-предшественников обонятельных рецепторов, регулируя количество нейронов обонятельных рецепторов, встречающихся в обонятельном эпителии, и контролирует способность клеток-предшественников регулировать количество ганглиозных клеток сетчатки, развивающихся в сетчатке. 7) Другие исследования на мышах предполагают, что GDF11 участвует в мезодермальном образовании и нейрогенезе во время эмбрионального развития. Члены этого суперсемейства TGF-β участвуют в регуляции роста и дифференцировки клеток не только в эмбриональных тканях, но и в тканях взрослых. GDF11 может связывать рецепторы суперсемейства TGF-бета типа I ACVR1B (ALK4), TGFBR1 (ALK5) и ACVR1C (ALK7), но преимущественно использует ALK4 и ALK5 для передачи сигнала. GDF11 тесно связан с миостатином, негативным регулятором роста мышц. 8) И миостатин, и GDF11 участвуют в регуляции пролиферации кардиомиоцитов. GDF11 является регулятором органогенеза почек, развития поджелудочной железы, ростро-каудального паттерна в развитии спинного мозга и хондрогенеза. Из-за сходства между миостатином и GDF11, действия GDF11, вероятно, регулируются WFIKKN2, большим внеклеточным мультидоменным белком, состоящим из фоллистатина, иммуноглобулина, ингибитора протеазы и доменов NTR. WFIKKN2 обладает высокой аффинностью к GDF11, и ранее было обнаружено, что он ингибирует биологическую активность миостатина. 9)
Влияние на старение сердца и скелетных мышц
GDF11 был идентифицирован как фактор кровообращения, способный обратить вспять возрастную гипертрофию сердца у мышей. Экспрессия гена GDF11 и содержание белка уменьшается с возрастом, и это показывает разную распространенность между молодыми и старыми мышами при процедурах парабиоза, что вызывает юношескую регенерацию кардиомиоцитов, уменьшение количества мозгового натрийуретического пептида (BNP) и в предсердного натрийуретического пептида (ANP). GDF11 также вызывает увеличение экспрессии SERCA-2, фермента, необходимого для релаксации во время диастолических функций. GDF11 активирует путь TGF-β в кардиомиоцитах, полученных из плюрипотентных гемопоэтических стволовых клеток, и подавляет фосфорилирование факторов транскрипции Forkhead (белков FOX). Это предполагает «антигипертрофический эффект», способствующий восстановлению возрастной гипертрофии, на кардиомиоцитах. В 2014 году было показано, что периферические добавки белка GDF11 (у мышей) улучшают возрастную дисфункцию скелетных мышц, восстанавливая функцию старых мышечных стволовых клеток. Что касается людей, пожилые мужчины, активные в течение своей жизни, демонстрируют более высокие концентрации GDF11, чем неактивные пожилые мужчины, а концентрация циркулирующего GDF11 коррелирует с выходной мощностью ног при езде на велосипеде. 10) Эти результаты привели к утверждению, что GDF11 может быть омолаживающим фактором. Эти результаты были оспорены, так как другая публикация продемонстрировала обратное, заключив, что GDF11 увеличивается с возрастом и оказывает вредное воздействие на регенерацию скелетных мышц, являясь фактором старения, с очень высокими уровнями у некоторых пожилых людей. Однако, в октябре 2015 года исследование в Гарварде показало, что эти противоположные результаты связаны с ошибочным анализом, в котором обнаруживался иммуноглобулин, а не GDF11. Гарвардское исследование показало, что GDF11 действительно устраняет возрастную гипертрофию сердца. Однако, исследование Гарварда проигнорировало разработанный GDF11-специфический анализ, установив, что GDF11 у мышей не обнаруживается, а измеренный фактор фактически является миостатином. Кроме того, исследование Гарварда объединило измерение GDF11 и GDF8 (миостатин), используя неспецифическое антитело, еще больше запутывая вопрос. В 2016 году были опубликованы противоречивые обзоры от разных исследовательских групп, касающиеся влияния GDF11 на скелетную и сердечную мышцу. 11) В одном из обзоров сообщалось об антигипертрофическом эффекте у стареющих мышей, но другая команда отрицала, что гипертрофия сердца возникает у старых мышей, утверждая, что GDF11 вызывает истощение мышц. Обе команды согласились, что не было установлено, увеличивается или уменьшается GDF11 с возрастом. Исследование, проведенное в 2017 году, показало, что суперфизиологические уровни GDF11 вызывают истощение скелетных мышц мышей.










