Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Миостатин
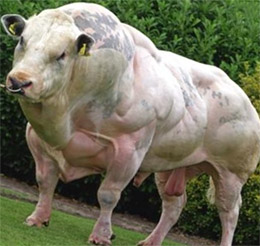 Стопорный рычаг в отношении синтеза мышечного белка без других известных ролей в организме, удаление миостатина из организма ведет к чрезмерному мышечному росту и снижению жировой массы; заветная цель бодибилдинга в связи с его силой действия, но добавки, нацеленные на миостатин, неэффективны.
Стопорный рычаг в отношении синтеза мышечного белка без других известных ролей в организме, удаление миостатина из организма ведет к чрезмерному мышечному росту и снижению жировой массы; заветная цель бодибилдинга в связи с его силой действия, но добавки, нацеленные на миостатин, неэффективны.
Взаимодействие со скелетной мышечной массой
Согласно многим исследованиям, миостатин представляет собой наиболее сильнодействующий отрицательный регулятор скелетной мышечной массы, известный на сегодняшний день.1) Он выражен практически исключительно в мышечной ткани (с некоторым количеством в сердечной ткани). Миостатин также может быть обнаружен в клетках кожи.
Миостатин может быть снижен различными средствами:
- Генетическое разрушение (изъятие или подавление гена, который кодирует миостатин)
- Генетическая повышенная регуляция антагонистов (повышение активности гена, который ингибирует активность миостатина)
- Прием антагонистов субъектом
Конечный результат заключается в том, что, когда миостатин неспособен действовать на свой активин-II рецептор, мышечная масса резко повышается.2) Белковая структура миостатина достаточно фиксированная (одинаковая) среди видов, аналогичное действие подавления миостатина наблюдалось у овец, крупного рогатого скота, собак, рыб, приматов, также имеется предметное исследование в отношении здорового человека с мутацией миостатина.3) Вероятно, что результаты на животных моделях будут распространяться на людей в равной степени.
Взаимодействие с телесным жиром
У животных моделей дефицита миостатина постоянно наблюдается меньшее количество телесного жира наряду с повышением мышечной массы. Это непосредственно связано с тем, что процесс роста мышечной массы является в высокой степени эндотермическим и для его выполнения требуется энергия. Действие миостатина на мышечную ткань косвенно вызывает расходование жировых клеток в целях обеспечения энергии для синтеза белка. Дефицит миостатина связан с повышенной выработкой бурого жира у мышиных моделей, хотя могут наблюдаться некоторые межвидовые различия в отношении человека.4)
Взаимодействие с обменом глюкозы
Миостатин способен повышать активность АМФ-зависимой киназы, которая повышает потребление глюкозы мышечными клетками. Тем не менее, исследования в естественных условиях демонстрируют сниженную инсулиновую резистентность в периоды дефицита миостатина. Вовлеченность активности АМФ-зависимой киназы повышается в этом случае в равной степени,5) в то время как другие исследования свидетельствуют, что потребление энергии мышечной тканью повышается, таким образом, лишая жировую ткань анаболизма, что вызывает повышение инсулиночувствительности. Это наблюдалось при дефиците миостатина в мышцах, но не жировой ткани, что вызвало повышение инсулиночувствительности у мышей. Причинно-следственная связь объясняется высоким уровнем взаимосвязи между пониженным уровнем миостатина (за счет аэробных упражнений), вызывающим дозозависимое снижение инсулиновой резистентности, и вызовом инсулиновой резистентности с помощью инъекций миостатина. В дополнение к повышению чувствительности к глюкозе, повышение потребления мышцами энергии оказывает защитное действие против атеросклероза.
Ингибирование миостатина
Выработка миостатина может ингибироваться, он может связываться и блокироваться в крови до его воздействия на активин-II рецептор, либо может ингибироваться пострецепторный каскад. Доступно множество методов ингибирования действия миостатина на клеточное ядро, хотя многие представляют по существу лекарственные средства и недоступны для широкой публики.
Миостатин пропептид
Миостатин пропептид представляет собой часть первоначально синтезируемой цепи миостатина, активный компонент, который должен разрушиться для выполнения функции. По существу, миостатин пропептид является одним из способов, с помощью которого можно регулировать активность миостатина в сыворотке. Повышенная выраженность миостатин пропептида у животных приводит к росту мышечной массы и другим действиям, приведенным в предыдущих разделах.6) Другие исследования свидетельствуют, что он несет в себе множество полезных воздействий, наблюдаемых пи дефиците миостатина, таких как повышение скорости заживления травм. Возможно введение мутантного пропептидного гена, который обеспечивает долговременное подавление миостатина.
Фоллистатин и родственные пептиды
Фоллистатин представляет собой естественно возникающий и вырабатываемый гепатокин (цитокин, вырабатываемый большей частью в печени, хотя вырабатывается в ограниченных количествах в других клетках), который может связываться с миостатином и деактивировать его в сыворотке. И манипулирование генетической выраженностью выработки фоллистатина, и введение фоллистатина дают действие, сходное с дефицитом миостатина. Фоллистатин также обладает способностью связываться с другими факторами в сыворотке, одним из которых является активин. Поскольку активин также частично ингибирует синтез белков, подавление как миостатина, так и активина может вызывать в дальнейшем повышение мышечного роста. Это было продемонстрировано в одном исследовании, где прием фоллистатина у мышей с дефицитом миостатина вызвал дальнейший мышечный рост.7) Тем не менее, активины также обусловливают рост и пролиферацию других клеток, а не только скелетных мышц.[42] По этой причине миостатин-специфичный пептид, полученный из фоллистатина и получивший название «выделенный из фоллистатина пептид II», является многообещающим в ингибировании миостатина без влияния на другие факторы в сыворотке.
Декорин
Декорин представляет собой сравнительно небольшой белок, состоящий из дерматиновой/хондроитиновой сульфатной цепи. Он способен модулировать действие миостатина на мышцы посредством связывания с ним в сыворотке. В жизненном цикле декорин и миостатин достаточно взаимосвязаны в отношении их выраженности.8) Декорин также способен повышать уровень фоллистатина.
Вакцинация
«Вакцинация» миостатином получила развитие из культуры дрожжей, где пероральный прием и внутривенное введение миостатина мышам вызывали образование миостатин-специфичных антител и повышали в результате мышечный фенотип.
Возможные побочные эффекты ингибирования миостатина
Действие миостатина в отношении отрицательной регуляции (и, таким образом, ускорение синтеза белка за счет ингибирования) локализовано в скелетных мышцах и сердечной ткани. Тем не менее, у животной модели, изучавшей сердечный рост у стареющих мышей, побочные эффекты не наблюдались, хотя было выявлено полезное метаболическое действие миостатина. Так как миостатин расположен в клетках кожи, у мышей с отсутствующим миостатином наблюдается рост уровня белка декорина, который замедляет заживление кожи за счет подавления белков TGF-b.
Миостатин и образ жизни
Физическая нагрузка
 Кратковременные упражнения с сопротивлением, в среднем, снижают содержание миостатина в сыворотке. Нагрузки на протяжении долгого времени повышают мРНК миостатина и содержание белка в среднем. Одно исследование отметило снижение уровня миостатина,9) но упоминало, что это может быть связано с тем, как они анализировали содержание миостатина. Повышение уровня миостатина на протяжении долгого времени представляет собой побочный результат повышенной рибосомальной плотности и повышения способности синтезировать белок в целом (так как миостатин является белком).
У мышей периоды отсутствия нагрузки не повышают содержание миостатина, хотя нагружение мышц с помощью механической нагрузки после времени отдыха вызывает снижение уровня миостатина. Эти результаты могут быть связаны с тем, что исследование началось с отсутствия нагрузки, так как исследования на людях свидетельствуют, что отсутствие нагрузки после тренировки вызывает повышение содержания миостатина. Аналогичный протокол отсутствия нагрузки у людей дает аналогичный рост уровня миостатина, при этом рост может наблюдаться до трех дней.10)
Аэробные упражнения также могут быть причастны к снижению содержания миостатина в сыворотке.
Исследование на мышах свидетельствует, что ингибирование миостатина в отдельности не оказывает влияния на повышение силы, в то время как повышает мышечную массу, но ингибирование NF-kB наряду с ингибированием миостатином ослабляет это.
Даже с учетом всего вышеуказанного, обусловленные нагрузкой изменения уровня миостатина не связаны с фактическим мышечным ростом. Миогенные факторы, которые миостатин подавляет, имеют отношение, но не к миостатину по существу.
Кратковременные упражнения с сопротивлением, в среднем, снижают содержание миостатина в сыворотке. Нагрузки на протяжении долгого времени повышают мРНК миостатина и содержание белка в среднем. Одно исследование отметило снижение уровня миостатина,9) но упоминало, что это может быть связано с тем, как они анализировали содержание миостатина. Повышение уровня миостатина на протяжении долгого времени представляет собой побочный результат повышенной рибосомальной плотности и повышения способности синтезировать белок в целом (так как миостатин является белком).
У мышей периоды отсутствия нагрузки не повышают содержание миостатина, хотя нагружение мышц с помощью механической нагрузки после времени отдыха вызывает снижение уровня миостатина. Эти результаты могут быть связаны с тем, что исследование началось с отсутствия нагрузки, так как исследования на людях свидетельствуют, что отсутствие нагрузки после тренировки вызывает повышение содержания миостатина. Аналогичный протокол отсутствия нагрузки у людей дает аналогичный рост уровня миостатина, при этом рост может наблюдаться до трех дней.10)
Аэробные упражнения также могут быть причастны к снижению содержания миостатина в сыворотке.
Исследование на мышах свидетельствует, что ингибирование миостатина в отдельности не оказывает влияния на повышение силы, в то время как повышает мышечную массу, но ингибирование NF-kB наряду с ингибированием миостатином ослабляет это.
Даже с учетом всего вышеуказанного, обусловленные нагрузкой изменения уровня миостатина не связаны с фактическим мышечным ростом. Миогенные факторы, которые миостатин подавляет, имеют отношение, но не к миостатину по существу.
Пища
Обработка мышечных трубок витамином D подавляет уровень миостатина, возможно за счет повышения уровня фоллистатина.
Температура
У животных наблюдается феномен, когда воздействие холода повышает мышечный вес у вьюрков, уток, цыплят и синиц. По меньшей мере одно исследование (на цыплятах), использовавшее воздействие холодом в 4°C (по сравнению с контрольными условиями в 30°C) в течение 24 часов, сообщает о снижении уровня мРНК миостатина, хотя более длительное воздействие в течение восьми дней не связывалось с изменениями содержания мРНК миостатина. Воздействие холодом связано с повышением уровня миостатина, но странно, что все соответствующие исследования проводились на птицах. Применимость этой информации к млекопитающим не известна и носит предварительный характер.
Старение
У мышей миостатин медленно растет по прошествии молодости, но затем перестает подниматься. Данное повышение может быть причастно к потере возможности набирать мышечную массу с легкостью по прошествии молодости, но не оказывает значительного влияния на саркопению. У людей данное повышения содержания миостатина у стареющих субъектов сопровождается более сильным подавлением миостатина за счет нагрузки.
:Tags
Читать еще: Кэмпас (Алемтузумаб) , Рамелтеон (Розерем) , Множественный (рассеянный) склероз , Тутовое дерево (шелковица белая), Флороглюцин ,










