Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Нефрогенный несахарный диабет
Для поддержания нормального баланса жидкости в организме, требуется система, обеспечивающая ежедневное введение жидкости в организм в условиях ежедневной её потери. 1)
Как питьё, так и потеря воды, могут значительно различаться ежедневно, например, из-за ограниченного доступа к воде, потере жидкости при дыхании и потении во время физических упражнений. Регулируемое выделение воды почками является одним из ключевых факторов способности организма приспосабливаться к этим проблемам и сохранять баланс жидкости в организме. Увеличение осмоляльности плазмы или уменьшение объема крови отражают потребность организма в сохранении воды. Даже очень незначительные изменения, менее 1%, в осмоляльности плазмы, стимулируют осморецепторы в гипоталамусе, что приводит к секреции антидиуретического гормона аргинина вазопрессина (АВП) из гипофиза 2). Подобный ответ вызывается через баро-рецепторы из-за уменьшения объема крови, хотя в этом случае такие изменения объема крови должны достигать 5-10%.
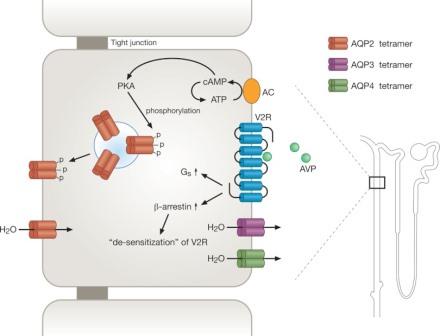
Водосберегающий эффект АВП опосредуется преимущественно связыванием АВП с рецептором вазопрессина типа 2 (АВПR2), классом рецепторов, связанных с G-белком, локализованных на базолатеральной стороне основной клетки собирающего протока почки. (рис. 1). Связывание АВП с АВПR2 приводит к активации рецептора и взаимодействию АВПR2 с цитозольным G-белком GαS, что, в свою очередь, активирует аденилатциклазу. Это приводит к увеличению уровней цАМФ и вызывает каскад внутриклеточных событий, среди которых активация протеинкиназы А (PKA) и движение транспортных везикул, содержащих аквапорин-2 (AQP2), из внутриклеточных отсеков, на апикальную поверхность основных клеток.
На апикальной плазматической мембране, AQP2 функционально существуют как гомотетрамеры 3) и являются ограничивающим скорость местом входа для реабсорбции воды вдоль осмотического градиента. Осмотический градиент обусловлен реабсорбцией растворенного вещества в толстой части восходящей конечностиа (TAL) медуллярного типа, также регулируемой АВП. Вода, входящая в основную клетку через AQP2, выходит через AQP3 и AQP4 в базолатеральной плазматической мембране. При восстановлении водного баланса, снижаются уровни АВП в плазме и уровни AQP2 в апикальной плазматической мембране. У человека, присутствие АВП может увеличить осмоляльность мочи до приблизительно 1200 мольмоль / кг и уменьшить выход мочи до 0,5 мл / мин. Напротив, при отсутствии АВП, осмоляность мочи может составлять 50 моль / кг, и скорость потока мочи 20 мл / мин. В нормальных условиях, АВП-опосредованная активация АВПR2 приводит к СООН-терминальному фосфорилированию АВПR2, β-ацепина и интернализации АВПR2. Этот процесс отрицательно регулирует эффекты АВПR2 и предотвращает длительную и чрезмерную реабсорбцию воды.
Патофизиология несахарного диабета
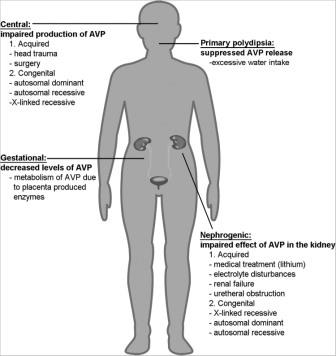
НД является клиническим синдромом, характеризующимся полиурией (из-за дефекта в мочевом концентрационном механизме) и компенсаторной полидипсией. В общей популяции, распространенность НД составляет приблизительно 1 на 25000-30000 случаев 4). При ограниченном / недостаточном употреблении жидкости, чтобы компенсировать потерю воды в моче, эти пациенты подвергаются риску сильного обезвоживания. Существует четыре основных типа НД (рис.2) Существуют две врожденные формы ДИ, а именно, семейный несахарный нейрогипофизарный диабет (FННД) и врожденный нефрогенный НД (ННД). Вместе, эти заболевания составляют менее 10% всех случаев НД в клинике (11). СННД происходит на основе снижения или дефектной секреции АВП из гипофиза. ВНД обусловлен, прежде всего, уменьшенным или дефектным действием АВП в основной клетке собирающего протока, хотя отсутствие ответа АВП в TAL также может способствовать этому состоянию. Следует подчеркнуть, что дефект концентрации мочевого пузыря как при СННД, так и при ВНД может значительно различаться по степени тяжести. И центральный НД, и ВНД также могут быть приобретенными. В отличие от врожденных форм, приобретенные формы, особенно нефрогенные формы, являются более распространенными условиями в клинике. Другие формы НД, которые не являются предметом настоящего обзора, включают гестационный диабет, вызванный дефицитом АВП из-за увеличения метаболизма АВП в плаценте и первичной полидипсии (дипсогенной и психогенной), формы НД, вызванной подавлением АВП из-за чрезмерного приёма воды 5). Дефицит АВП может быть исправлен путем лечения десмопрессином, который является аналогом АВП, специфичным для АВПR2 (торговые названия: десмопрессин (dDАВП), DesmoMelt, Stimate и Minirin). Однако, дефекты в действии АВП на уровне почек в настоящее время редко могут быть исправлены. Лечение в этих случаях направлено на использование других терапевтических стратегий для улучшения симптомов.
Диагностика
Эффективное лечения НД требует точной дифференциации основной причины заболевания. НД имеет значительные различия в осмоляльности мочи и выходе мочи. НД чаще всего определяется как объем мочи более чем 3-3,5 литра за 24 часа у взрослых (или> 50 мл / кг массы тела / 24 часа) с осмоляцией мочи менее 300 мосмоль / кг 6). Поэтому объем мочи и осмоляльность являются важными показателями при диагностике. История болезни имеет важное значение для дифференциации НД от других причин полиурии и определения причины заболевания. В некоторых случаях, история болезни (например, гестационное начало или болезнь после операции на головном мозге) и представление симптомов (например, полный НД) делают дифференциальный диагноз менее сложным. Однако, в случае сомнений существуют некоторые альтернативные диагностические подходы, такие как тест на лишение воды с или без гипертонической физиологической инфузии, вызов десмопрессина и магнитно-резонансная томография (МРТ) головного мозга.
Тест на лишение воды и вызов десмопрессина
Тест на депривацию воды и десмопрессин могут быть полезны при дифференциации между тяжелыми центральными НД и ВНД. Из-за риска выраженной дегидратации и гиповолемии, этот тест должен проводиться под строгим контролем. Принцип этого теста заключается в том, чтобы пациент не употреблял жидкости, после чего ежечасно измеряется его масса тела, осмоляльность мочи и осмоляльность плазмы, чтобы определить его состояние обезвоживания. При достаточном обезвоживании, то есть, при уменьшении массы тела более чем на 5%, или когда осмоляльность плазмы повышается от исходного уровня, вводят десмопрессин с последующим определением осмоляльности мочи в течение, по меньшей мере, 2 часов. Обычно используемые дозы составляют 2 мкг внутривенно, 20 мкг интраназального или 120 мкг сублингвально. Здоровые люди и лица с первичной полидипсией будут иметь осмоляльность мочи, превышающую плазменную осмоляльность, после лишения воды, а осмоляльность мочи будет далее возрастать минимально после введения десмопрессина. При центральном НД, осмоляльность мочи будет оставаться ниже плазменной осмоляльности после лишения воды, но введение десмопрессина приводит к увеличению осмоляльности мочи (> 50%). При ВНД, осмоляльность мочи остается ниже плазменной осмоляльности, а введение dDАВП увеличивает осмоляльность мочи менее чем на 50%. Одна диагностическая ловушка в этом подходе заключается в том, что все состояния с полиурией приводят к уменьшению антидиуретического ответа на десмопрессин, в основном, из-за вымывания градиента концентрации мозгового вещества. Кроме того, в ответ на лишение жидкости и введение десмопрессина, умеренное увеличение осмоляльности мочи делает диагноз первичной полидипсии, частичного нейрогипофизарного НД и частичного ВНД неразличимым 7).
Измерение уровней АВП в плазме
При осмотической стимуляции, измерение уровней АВП в плазме может способствовать дискриминации между различными формами НД, особенно, частичными формами. Измерения проводятся в базисных условиях (неограниченное потребление жидкости), во время лишения жидкости и / или во время инфузии гипертонического солевого раствора. Уровни АВП плазмы сравнивались с осмоляльностью плазмы и мочи. Повышенные базальные плазменные уровни АВП говорят о ВНД. Если уровни АВП в плазме во время осмотической стимуляции являются нормальными или повышенными по отношению к соответствию к соответствующей осмолярности плазмы, нейрогипофизарный НД может быть исключен, а уровень осмоляльности мочи относительно АВП плазмы будет отличать ВНД от первичной полидипсии.
МРТ-сканирование
В случаях низкого уровня АВП в плазме, МРТ-сканирование мозга может помочь дифференцировать первичную полидипсию и НД. При нормальных условиях (или первичной полидипсии) в нейрогипофизе обнаруживается интенсивный сигнал с использованием T1-взвешенной визуализации. При нейрогипофизарном НД или ВНД, этот интенсивный сигнал отсутствует 8).
Анализы копептина
АВП и копептин имеют один и тот же пептидный предшественник длиной 164 аминокислоты, и состоят из сигнального пептида, АВП, нейрофизина II (NPII) и копептина (рис.3). Таким образом, копептин высвобождается вместе с АВП во время обработки предшественника. В отличие от АВП, копептин очень стабилен в плазме при комнатной температуре и легко измеряется. Однако, значение уровней копептина в плазме в дифференциальной диагностике НД еще не полностью определено.

Типы несахарного диабета
Несахарный нейрогипофизарный диабет
При несахарном нейрогипофизарном диабете, производство и высвобождение АВП из задней доли гипофиза нарушено. АВП продуцируется магноцеллюлярными нейронами, расположенными в надоптических и паравентрикулярных ядрах гипоталамуса, и переносится в заднюю долю гипофиза путем аксонального транспорта вдоль длинных расширений. Как правило, центральный НД является приобретенным состоянием из-за новообразования, инфекции, травмы головы или хирургии, которая поражает гипофиз. Альтернативно, центральный НД может возникнуть из-за врожденных дефектов.
Наследственный нейрогипофизарный НД
Во всех случаях, изученных на сегодняшний день, НННД обусловлен вариациями (мутациями) в гене АВП (18). Ген АВП содержит три экзона, кодирующих сигнальный пептид, АВП, NPII и копептин (рис.3) 9). По состоянию на октябрь 2012 года, было зарегистрировано 67 мутаций в гене АВП, которые приводят к НННД. Из них, большинство мутаций (> 50 мутаций) находятся в домене NPII, который представляет собой белок-носитель, который способствует переносу АВП из гипоталамуса в заднюю долю гипофиза. У всех, кроме трех родственников, болезнь передавалась в аутосомно-доминантном режиме (adFННД). У двух родственников с НННД, была идентифицирована рецессивная форма, и сообщалось об одном случае ретрансляционной передачи с X-соединением. Хотя члены семьи с adFННД имеют нормальный водный баланс при рождении и в раннем детстве, симптомы компульсивного употребления жидкости постепенно развиваются в детстве, а полиурия и полидипсия продолжаются на протяжении всей жизни. Существуют две преобладающие гипотезы относительно основного механизма доминантного и прогрессивного характера заболевания мутантные белки аберрантно сгибаются и накапливаются в эндоплазматическом ретикулуме (ER), что приводит к агрегации белка и прогрессирующей потере магноцеллюлярных нейронов; и 2) доминирующий отрицательный эффект мутантного гормона на секрецию АВР «дикого типа» (WT) 10). Эти две общие гипотезы не исключают друг друга, но могут происходить параллельно. Различные модели животных были разработаны для изучения основного механизма НННД. Модель крысы, содержащая индуцибельную вариацию Cys67stop, известную как вызывающую adFННД у людей, предполагала остановку WT АВП-продуктов в ER, за чем следует лизосомальная деградациZ. Однако, в этой модели клеточная смерть не наблюдалась, а особенности СД проявлялись только после повторного обезвоживания. Альтернативная мышиная модель с укороченным предшественником АВП (C67X) показала симптомы прогрессирующего СД, потерю АВП-продуцирующих нейронов и возможное удержание как WT, так и мутантных предшественников АВП в телах нейронов. Другая модель мыши, экспрессирующая мутантный NPII (Cys98stop), вызывающий adFННД у людей 11), показала, что агрегаты прогормона, накопленные в ER, в конечном итоге, вызывали гибель клеток, но эта полиурия прогрессировала до и в отсутствие гибели клеток, поддерживая доминирующий негативный эффект мутанта. Эти результаты in vivo показывают, что как клеточная токсичность, так и доминантный отрицательный эффект мутанта, вероятно, объясняют клеточные эффекты мутаций. В соответствии с этим, было предложено, что adFННД тесно связан с другими нейродегенеративными заболеваниями, такими как болезнь Альцгеймера и болезнь Паркинсона. Вероятно, что различные мутации вызывают adFННД с помощью различных механизмов. Например, активация мутации в сигнальном пептиде, вызывающая мягкий фенотип у людей, не выявила явного фенотипа у мышей, что указывает на то, что разные мутации имеют различные клеточные патологические причины. Крыса Бриттлборо, модель нейрогипофизического СД, является результатом единственной нуклеотидной делеции (гуанозина) в области NPII гена АВП, приводящей к сдвигу рамки и потере нормального стоп-кодона. Этот дефект приводит к аномальной обработке гормона прекурсора и сбою в производстве, хранении и секреции АВП. Рецессивный признак предполагает абсолютный дефицит, и действительно, у этих крыс наблюдается полное отсутствие секреции АВП. Модель крысы Brattleboro доказала свою ценность в понимании последствий отсутствия АВП, в частности, для концентрации почечной мочи. Исследования крыс Brattleboro показали, что отсутствие АВП препятствует миграции AQP2 и приводит к снижению уровней экспрессии AQP2, условиям, которые могут быть отменены при длительной инфузии АВП. В дополнение к регуляции экспрессии AQP2, АВП также регулирует другие белки, участвующие в концентрации мочи, такие как AQP3, Na-K-Cl котранспортер-2 (NKCC2) и транспортеры мочевины. Исследования нокаутных мышей с дефицитом в этих белках, подчеркивают важность их концентрации в моче 12).
Нефрогенный СД
Основная характеристика НСД – нарушенная реабсорбция воды, вызванная АВП. Чаще всего, НСД приобретается и встречается как осложнение многих распространенных клинических состояний, таких как аномалии электролитов (например, гипокалиемия и гиперкальциемия) или лечение (например, терапия литием и цисплатином). НСД также может быть вызвана первичными генетическими заболеваниями, вызванными мутациями в гене АВПR2 или AQP2, или быть вторичным по отношению к другим генетическим заболеваниям почек.
Врожденный ННД
Врожденный ННД вызван мутациями в АВПR2 или AQP2-гене. Дистальный нефрон в этих случаях нечувствителен к АВП (аргинин вазопрессину), что приводит к реабсорбции дефосфорилированной воды в собирающих протоках. Дефицит концентрации мочи присутствует с момента рождения, и симптомы возникают в первые недели жизни. Младенцы часто страдают от гипернатримного обезвоживания, проявляя такие симптомы, как раздражительность, плохой аппетит и увеличение веса 13). Клинические признаки обезвоживания – сухость кожи, потеря нормального тургора кожи (напряженность и эластичность ткани, изменяющиеся в зависимости от ее физиологического состояния), утопленные глазные яблоки, увеличенная периорбитальная складчатость и подавление переднего родничка. Иногда можно наблюдать прерывистую высокую температуру из-за обезвоживания и запоров. Кроме того, могут наблюдаться судороги. В так называемых частичных формах ННД, у пациентов сохраняется определенная способность концентрировать мочу, снижая риск развития тяжелой дегидратации. При отсутствии лечения, большинство пациентов не могут нормально расти, но с началом лечения большинство из них восстанавливает первоначальную потерю веса. Умственная отсталость, предположительно, являющаяся результатом повторных эпизодов дегидратации мозга и отека мозга (вызванных попытками слишком быстро восстановиться), может быть серьезным осложнением ННД. Такие осложнения, в основном, вызваны мутациями de novo, при которых может произойти отсроченный клинический диагноз. Напротив, дети, подверженные риску наследования гена болезни, то есть, известные родственники с заболеванием, часто диагностируются и лечатся намного раньше. Психологическое развитие этих пациентов отрицательно затрагивается постоянной потребностью в питье и частых мочеиспусканиях. Постоянная полиурия может вызывать развитие мегацистита, трабекуляции мочевого пузыря, гидроресурса и гидронефроза.
Дефекты в АВПR2
Ген АВПR2 был впервые описан в 1992 году. АВПR2 содержит семь мембранно-охватывающих спиралей (рис.4). При связывании АВП, инициируется активация рецептора и происходят аллостерические структурные перестройки. АВП связывается с АВПR2 в трансмембранных спиралях II-IV (остатки 88-96, 119-127, 284-291 и 311-317) 14).
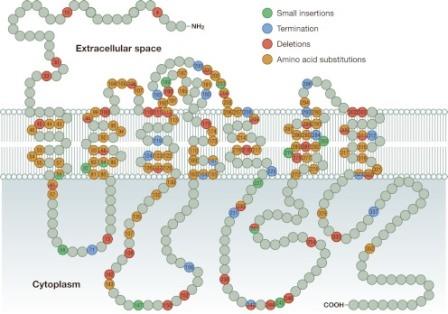 Мутации в гене АВПR2 приводят к X-связанному ННД (X-ННД). Это причина 90% всех диагностированных врожденных случаев ННД. В X-ННД, симптомы (полиурия, жажда и полидипсия) часто присутствуют с рождения. В случае недостаточного обеспечения водой, полиурия может быстро вызывать тяжелую гипернатриемию и обезвоживание. Новорожденные, страдающие этим заболеванием, часто имеют такие симптомы, как рвота и увеличение веса из-за повышенного потребления воды. Мужчины, страдающие этим заболеванием, не концентрируют мочу даже после введения экзогенного АВП, тогда как из-за искаженной инактивации Х-хромосом некоторые гетерозиготные женщины имеют переменную степень полиурии и полидипсии. Значительная изменчивость была описана в местоположении мутаций и тяжести заболевания. Таким образом, некоторые пациенты могут концентрировать свою мочу в ответ на лишение жидкости или на введение АВП / dDАВП, что приводит к так называемому частичному или неполному ННД. По состоянию на октябрь 2012 года были идентифицированы 222 мутации, приводящие к X-ННД (рис.4), и число постоянно увеличивается. В дополнение к мутациям в АВПR2, валовые фрагменты гена или сложная перегруппировка гена L1CAM, которая находится рядом с АВПR2, может привести к ННД 15). Однако, только делеции генов L1CAM, которые также охватывают АВПR2, связаны с ННД, а изолированные точечные мутации в L1CAM гене никогда не ассоциируются с полиурическим фенотипом. Мутации в АВПR2, приводящие к ННД, могут быть классифицированы как мутации «потери функции». Кроме того, на АВПR2 также могут влиять мутации «усиления функции», например, аргинин-137-цистеин и аргинин-137-лейцин. Эти мутации вызывают конститутивную активацию рецептора, что приводит к нефрогенному синдрому неуместного антидиуреза. Клинические проявления нефрогенного синдрома несоответствующего антидиуза варьируются от полностью бессимптомного, при этом дефектное разведение мочи проявляется только при загрузке воды, при тяжелых неврологических симптомах. Еще один прирост функциональной мутации (G12E) в АВПR2 связан с увеличением уровней фактора фон Виллебранда и уровня плазмы фактора VIII 16). Мутации АВПR2 делятся на пять классов. Мутации класса I приводят к неправильной обработке / нестабильной мРНК, сдвигу кадров или бессмысленным мутациям, приводящим к усечению рецептора. Мутации класса II (наиболее распространенный тип мутаций) приводят к неправильной постановке рецептора и сохранению в ER. Мутации класса III также вызывают диспропорцию АВПR2, но, хотя АВПR2 достигает плазматической мембраны и взаимодействует с АВП, он полностью не взаимодействует с белками G, что приводит к нарушению производства цАМФ. Мутации класса IV также приводят к неправильной работе АВПR2. В этом случае, хотя АВПR2 способен достигать плазматической мембраны, он не взаимодействует должным образом с АВП. Мутации класса V передаются в неправильный клеточный отсек. Модели in vivo для X-ННД полезны с точки зрения 1) выяснения возможных компенсаторных или адаптивных изменений в почках и 2) изучения новых стратегий лечения для конкретных мутаций АВПR2. АВПR2-дефицитные самцы мыши с мутацией, приводящие к преждевременному введению стоп-кодона (E242X), которые, как известно, вызывают дефектную функцию АВПR2 и X-ННД (66), являются полиурическими при рождении. У трехлетних самцов щенков (с E242X) повышенная экспрессия в различных генах, включая AQP1, карбоангидразы, Na-K-АТФазу и транспорты NaCl и HCO3, что говорит о компенсационных изменениях. Мыши E242X также имеют повышенную регуляцию экспрессии циклооксигеназы 2 как в почках, так и в гипоталамусе. Несмотря на эти компенсационные изменения, мыши E242X умирают в течение 1 недели, что делает их непригодной моделью для изучения X-ННД у взрослых мышей. Недавно была создана жизнеспособная модель мыши X-ННД, которая имеет условное удаление АВПR2 при лечении тамоксифеном. После тамоксифена, у взрослых мышей наблюдается полиурия, полидипсия и отсутствие ответа на АВП. Эта модель мыши была использована для изучения потенциального благоприятного эффекта селективного агониста рецептора простанового EP4 для лечения X-ННД. Вполне вероятно, что такие модели окажутся полезными для дальнейших исследований для определения новых стратегий лечения X-ННД.
Мутации в гене АВПR2 приводят к X-связанному ННД (X-ННД). Это причина 90% всех диагностированных врожденных случаев ННД. В X-ННД, симптомы (полиурия, жажда и полидипсия) часто присутствуют с рождения. В случае недостаточного обеспечения водой, полиурия может быстро вызывать тяжелую гипернатриемию и обезвоживание. Новорожденные, страдающие этим заболеванием, часто имеют такие симптомы, как рвота и увеличение веса из-за повышенного потребления воды. Мужчины, страдающие этим заболеванием, не концентрируют мочу даже после введения экзогенного АВП, тогда как из-за искаженной инактивации Х-хромосом некоторые гетерозиготные женщины имеют переменную степень полиурии и полидипсии. Значительная изменчивость была описана в местоположении мутаций и тяжести заболевания. Таким образом, некоторые пациенты могут концентрировать свою мочу в ответ на лишение жидкости или на введение АВП / dDАВП, что приводит к так называемому частичному или неполному ННД. По состоянию на октябрь 2012 года были идентифицированы 222 мутации, приводящие к X-ННД (рис.4), и число постоянно увеличивается. В дополнение к мутациям в АВПR2, валовые фрагменты гена или сложная перегруппировка гена L1CAM, которая находится рядом с АВПR2, может привести к ННД 15). Однако, только делеции генов L1CAM, которые также охватывают АВПR2, связаны с ННД, а изолированные точечные мутации в L1CAM гене никогда не ассоциируются с полиурическим фенотипом. Мутации в АВПR2, приводящие к ННД, могут быть классифицированы как мутации «потери функции». Кроме того, на АВПR2 также могут влиять мутации «усиления функции», например, аргинин-137-цистеин и аргинин-137-лейцин. Эти мутации вызывают конститутивную активацию рецептора, что приводит к нефрогенному синдрому неуместного антидиуреза. Клинические проявления нефрогенного синдрома несоответствующего антидиуза варьируются от полностью бессимптомного, при этом дефектное разведение мочи проявляется только при загрузке воды, при тяжелых неврологических симптомах. Еще один прирост функциональной мутации (G12E) в АВПR2 связан с увеличением уровней фактора фон Виллебранда и уровня плазмы фактора VIII 16). Мутации АВПR2 делятся на пять классов. Мутации класса I приводят к неправильной обработке / нестабильной мРНК, сдвигу кадров или бессмысленным мутациям, приводящим к усечению рецептора. Мутации класса II (наиболее распространенный тип мутаций) приводят к неправильной постановке рецептора и сохранению в ER. Мутации класса III также вызывают диспропорцию АВПR2, но, хотя АВПR2 достигает плазматической мембраны и взаимодействует с АВП, он полностью не взаимодействует с белками G, что приводит к нарушению производства цАМФ. Мутации класса IV также приводят к неправильной работе АВПR2. В этом случае, хотя АВПR2 способен достигать плазматической мембраны, он не взаимодействует должным образом с АВП. Мутации класса V передаются в неправильный клеточный отсек. Модели in vivo для X-ННД полезны с точки зрения 1) выяснения возможных компенсаторных или адаптивных изменений в почках и 2) изучения новых стратегий лечения для конкретных мутаций АВПR2. АВПR2-дефицитные самцы мыши с мутацией, приводящие к преждевременному введению стоп-кодона (E242X), которые, как известно, вызывают дефектную функцию АВПR2 и X-ННД (66), являются полиурическими при рождении. У трехлетних самцов щенков (с E242X) повышенная экспрессия в различных генах, включая AQP1, карбоангидразы, Na-K-АТФазу и транспорты NaCl и HCO3, что говорит о компенсационных изменениях. Мыши E242X также имеют повышенную регуляцию экспрессии циклооксигеназы 2 как в почках, так и в гипоталамусе. Несмотря на эти компенсационные изменения, мыши E242X умирают в течение 1 недели, что делает их непригодной моделью для изучения X-ННД у взрослых мышей. Недавно была создана жизнеспособная модель мыши X-ННД, которая имеет условное удаление АВПR2 при лечении тамоксифеном. После тамоксифена, у взрослых мышей наблюдается полиурия, полидипсия и отсутствие ответа на АВП. Эта модель мыши была использована для изучения потенциального благоприятного эффекта селективного агониста рецептора простанового EP4 для лечения X-ННД. Вполне вероятно, что такие модели окажутся полезными для дальнейших исследований для определения новых стратегий лечения X-ННД.
Частичный ННД
Хотя почти все мутации ННД, связанные с тяжелым фенотипом, характеризуются как полный несахарный диабет (НД), в последних отчетах выявлено множество мутаций, вызывающих умеренные фенотипы с частичным НД (69-77). Функциональные исследования подчеркнули, что некоторые (egpArg104Cys) уменьшают связывание аффинности АВПR2 с минимальными эффектами на экспрессию поверхности рецептора, тогда как другие (например, pSer329Arg) уменьшают экспрессию поверхности клеток АВПR2 из-за накопления рецептора в ER. Аналогичным образом, частичные клинические фенотипы ННД описаны у пациентов, несущих мутации в гене AQP2 17). Клиническая и молекулярная характеристика частичного подтипа ННД подчеркивали, что измененное связывание лиганда и трансдукция сигнала зависят от локализации измененной аминокислоты в АВПR2. Поразительные расхождения на уровне функциональности АВПR2 могут лежать в основе подобных клинических фенотипов в ННД. Большинство частичных случаев ННД были обнаружены после генетического тестирования пациентов с предыдущим неправильным клиническим диагнозом, например, первичная полидипсия (из-за сохранения концентрации концентрации мочи во время лишения жидкости). Таким образом, исследования частичного ННД подчеркивали ценность молекулярного тестирования при определении фактической причины и потенциальной стратегии лечения различных форм ННД.C.
Дефекты в гене AQP2
У людей ген AQP2 расположен на хромосоме 12q13 и кодирует белок 271 аминокислоты. Обычно AQP2 состоит из четырех идентичных субъединиц белка, которые образуют стабильный тетрамер в плазматической мембране. Каждый мономер состоит из шести трансмембранных областей с концом СООН, расположенным внутри цитозоля (рис.5). Подобно большинству других аквапоринов, AQP2 содержит два высококонсервативных мотива NPA (мотив Asn-Pro-Ala), которые, как считается, «погружаются» в мембрану, перекрываются и образуют поры воды каналов (3, 9). Структура AQP2 была выяснена при разрешении 4,9 Å, но структура внутриклеточных доменов отсутствует. Движение AQP2 регулируется различными клеточными процессами, включая сложную обработку AQP2 через посттрансляционные модификации. АВП опосредует повышенное полифосфорилирование AQP2 у карбоксиконцевого хвоста у сериновых остатков S2ЗД56, S264 и S269 и снижение фосфорилирования на S261. Хорошо известно, что фосфорилирование, вызванное АВП S256, имеет решающее значение для накопления AQP2 в апикальной мембране. Недавно было продемонстрировано, что S269 фосфорилированный AQP2 присутствует только в апикальной плазматической мембране. Наряду с фосфорилированием S256, S269, вероятно, участвует в накоплении мембран AQP2, уменьшая скорость интернализации AQP2 после отмены АВП, в результате снижения зависимых от фосфорилирования белковых взаимодействий 18).
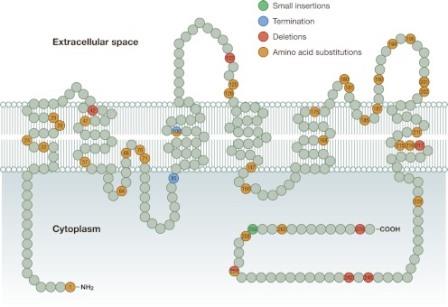 В настоящее время описано, что 51 мутация в гене AQP2 вызывает ННД (рис.5). Эти мутации приводят к двум различным молекулярным исходам. Во-первых, мутация в AQP2 может влиять на сигнал сортировки и ингибировать маршрутизацию функционального AQP2 на мембрану. Во-вторых, мутация может привести к дефекту в образовании порообразующей структуры AQP2, что приводит к отсутствию функции в качестве водного канала. Поскольку роль AQP2 в ННД была впервые описана, несколько мутаций AQP2, приводящих к ННД, были исследованы и изучены в различных модельных системах. Исследования клеточных линий млекопитающих предоставили информацию о трафике и нацеливании на белок мутанта AQP2, тогда как экспрессия AQP2 в системе ооцитов Xenopus laevis обеспечила понимание функции, то есть, способность мутаций изменять AQP2-опосредованный поток воды через мембраны.
В настоящее время описано, что 51 мутация в гене AQP2 вызывает ННД (рис.5). Эти мутации приводят к двум различным молекулярным исходам. Во-первых, мутация в AQP2 может влиять на сигнал сортировки и ингибировать маршрутизацию функционального AQP2 на мембрану. Во-вторых, мутация может привести к дефекту в образовании порообразующей структуры AQP2, что приводит к отсутствию функции в качестве водного канала. Поскольку роль AQP2 в ННД была впервые описана, несколько мутаций AQP2, приводящих к ННД, были исследованы и изучены в различных модельных системах. Исследования клеточных линий млекопитающих предоставили информацию о трафике и нацеливании на белок мутанта AQP2, тогда как экспрессия AQP2 в системе ооцитов Xenopus laevis обеспечила понимание функции, то есть, способность мутаций изменять AQP2-опосредованный поток воды через мембраны.
Аутосомно-рецессивный ННД
Аутосомный ННД является результатом рецессивного признака более чем в 90% случаев. Пациенты гомозиготные или сложные гетерозиготные для мутаций в AQP2. Преимущественно, мутации находятся в порообразующей области AQP2, то есть, в области ядра (трансмембранные домены и соединительные петли). Эти мутации приводят к несоответствию AQP2, сохранению в ER и быстрой деградации AQP2. Аутосомно-рецессивный ННД обычно проявляется при рождении и одинаково влияет на мужчин и женщин. Хотя большинство случаев являются тяжелыми, сообщалось о нескольких случаях аутосомно-рецессивного частичного НДИ.










