Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Бетулин (экстракт коры берёзы)
 Кожа, главным образом, действует как защитный барьер против окружающей среды. Поэтому потеря её целостности сразу же приводит к запуску сложных процессов по восстановлению функции эпидермального барьера. Восстановление повреждений представляет собой чрезвычайно сложный биологический процесс, в основном, разделенный на три перекрывающиеся фазы: воспаление, образование новых тканей и ремоделирование 1). Первая стадия характеризуется гемостазом и инициированием контролируемой воспалительной реакции. Высвобождение различных провоспалительных цитокинов, в том числе, хемокинов и факторов роста, способствует привлечению макрофагов и гранулоцитов в область раны для удаления омертвевших тканей и профилактики бактериальной инфекции. Вторая стадия включает миграцию и пролиферацию кератиноцитов (=реэпителизация) и фибробластов (= формирование грануляционной ткани и внеклеточного матрикса), а также ангиогенез. На третьем этапе происходит замена старого коллагена, апоптоз и образование рубца. Следовательно, процесс излечивания ран требует интеграции множества сложных клетчатых и молекулярных событий, которые могут происходить различными способами, приводя к ускоренному или сдержанному излечиванию, при этом последнее может привести к хроническим ранам 2).
Кожа, главным образом, действует как защитный барьер против окружающей среды. Поэтому потеря её целостности сразу же приводит к запуску сложных процессов по восстановлению функции эпидермального барьера. Восстановление повреждений представляет собой чрезвычайно сложный биологический процесс, в основном, разделенный на три перекрывающиеся фазы: воспаление, образование новых тканей и ремоделирование 1). Первая стадия характеризуется гемостазом и инициированием контролируемой воспалительной реакции. Высвобождение различных провоспалительных цитокинов, в том числе, хемокинов и факторов роста, способствует привлечению макрофагов и гранулоцитов в область раны для удаления омертвевших тканей и профилактики бактериальной инфекции. Вторая стадия включает миграцию и пролиферацию кератиноцитов (=реэпителизация) и фибробластов (= формирование грануляционной ткани и внеклеточного матрикса), а также ангиогенез. На третьем этапе происходит замена старого коллагена, апоптоз и образование рубца. Следовательно, процесс излечивания ран требует интеграции множества сложных клетчатых и молекулярных событий, которые могут происходить различными способами, приводя к ускоренному или сдержанному излечиванию, при этом последнее может привести к хроническим ранам 2).
Помимо традиционных средств, фитомедицина оказывается интересной альтернативой или дополнением, благотворно влияющим на различные стадии заживления ран. В этом контексте, экстракты бересты (Betula alba, syn. B. pendula, семейство Betulaceae) получают все больше и больше внимания. Береста имеет длительную историю использования в качестве традиционного лекарственного средства, известного уже индейцам Северной Америки, которые применялось для ускорения заживления ран. В последнее время, клинически доказана эффективность препаратов бересты. В одном клиническом случае было описано успешное лечение некротизирующего опоясывающего лишая при использовании эмульсии бересты. Кроме того, установлено, что экстракт бересты был эффективен при лечении двух пациентов, страдающих ожогами второй степени тяжести. В частности, открытое, слепое, контролируемое, проспективное рандомизированное клиническое исследование II фазы, включавшее 24 пациента, показало, что препарат бересты значительно ускорил реэпителизацию в донорских участках кожного трансплантата с расщеплением 3). Все эти исследования проводились с препаратом, содержащим N-гептановый сухой экстракт из наружной коры березы (TE: triterpene extract). Около 97% экстракта состоит из пентациклических тритерпенов с приблизительно 87% бетулина в качестве основного соединения, с незначительным количеством лупеола, бетулиновой кислоты, олеаноловой кислоты и эритродиола (их структуры см. рис.). Следовательно, эти пентациклические тритерпены считаются, в основном, эффективными компонентами бересты. Отдельные тритерпены еще не были оценены относительно их эффективности по заживлению ран. Учитывая положительный эффект TE на заживление ран in vivo, мы хотели выяснить молекулярные механизмы, лежащие в основе его ранозаживляющих свойств, а также механизмы изолированных тритерпенов (бетулин, лупеол, бетулиновая кислота, олеаноловая кислота и эритродиол). Было показано, что TE и бетулин влияют на воспалительную фазу заживления ран за счет регуляции провоспалительных цитокинов, хемокинов и циклооксигеназы-2 (COX-2) в первичных кератиноцитах человека. Например, была подтверждена повышенная регуляция в модели заживления ран свиньи ex-vivo для IL-6 и COX-2. Приведены доказательства для COX-2 и IL-6, что их увеличение в мРНК связано со стабилизирующим эффектом мРНК, процессом, в котором принимают участие P38 MAPK и HuR (человеческий антиген R). Было продемонстровано, что TE, бетулин, лупеол и эритродиол увеличивают образование актина филоподии, ламеллоподии и стресс-волокон, процессы, которые зависят от активации Rho ГТФазы. Наконец, было показано в модели ex-vivo свиньи, что TE улучшает регенерацию эпидермиса и ускоряет восстановление функции эпидермального барьера.
Результаты
TE и бетулин проявляют ранозаживляющие эффекты в свиной ex-vivo модели заживления ран (WHM). Эффективность препарата из бересты (TE-олеогель) у человека уже была доказана, но отдельно не изучалось влияние контрольного препарата или основного компонента – тритерпенового бетулина. Поэтому, систематически исследовался прогресс заживления ран модели ранозаживления у свиней ex-vivo (WHM), с использованием олеогеля с тем же составом, который использовался в работе (10% TE, 90% подсолнечного масла) по сравнению с подсолнечным маслом в отдельности и подсолнечным маслом в этилцеллюлозе, имитируя более высокую вязкость олеогеля по сравнению с маслом. Было обнаружено значительное ускорение реэпителиализации с ТE-олеогелем по сравнению с контролем через 48 ч (рис. 1A). Существует также значительное улучшение по сравнению с вазелином (данные не показаны). Кроме того, мы проанализировали, приводит ли использование ТЕ, растворенного в PBS, к благотворному влиянию на заживление ран в WHM. Такой подход позволил нам иметь рациональную основу для наших дальнейших экспериментов по выяснению основных молекулярных механизмов ранозаживляющих свойств ТЕ, поскольку эти исследования проводились с первичными кератиноцитами человека в культуре, где олеогели или масла не могут быть использованы. Действительно, мы могли бы показать значительно ускоренное заживление раны с 10 мкг/мл TE в PBS по сравнению с PBS в отдельности через 48 ч после ранения (рис. 1B). Мы также наблюдали положительный эффект с бетулином (8,69 мкг / мл), который изучали в концентрации, при 10 мкг/мл те, но эффект был меньше, чем у ТЕ и статистически не является значимым. Таким образом, можно предположить, что бетулин, основное составляющее ТЕ, не является исключительно ответственным за этот эффект (рис. 1B).
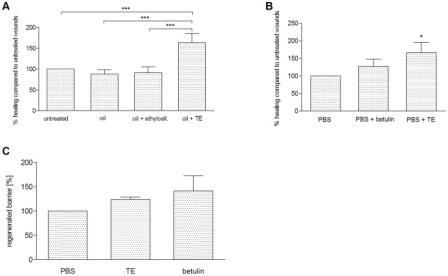
TE способствует образованию кожного барьера
Основной целью заживления ран является восстановление кожного барьера для защиты организма от болезнетворных микроорганизмов. Поэтому мы исследовали, улучшают ли 10 мкг/мл те и 8,69 мкг/мл бетулина, соответственно, барьерную функцию кожи, используя анализ проникновения красителя в ex-vivo WHM (рис. 1С). Применение TE и бетулина через 72 ч после ранения в течение 24 ч приводило к улучшению барьерной функции кожи. То же самое наблюдалось, когда TE использовался непосредственно после ранения в течение 4 дней (данные не показаны).
TE и бетулин увеличивают мРНК провоспалительных медиаторов в первичных кератиноцитах человека
Нарушение эпидермального барьера вызывает выделение различных провоспалительных медиаторов, таких как цитокины, ферменты или факторы роста кератиноцитов и тромбоцитов 4). Оба события способствуют рекрутингу гранулоцитов и макрофагов к месту травмы. Эти клетки усиливают фазу воспаления индукцией дальнейших провоспалительных медиаторов. В этом контексте показано, что ЦОГ-2, ИЛ-6 и ИЛ-8 являются регуляторами и играют решающую роль в реэпителизации и ангиогенезе. Для оценки возможности ускорения этой начальной фазы за счет увеличения количества этих провоспалительных медиаторов проводили обработку первичных кератиноцитов человека двумя различными концентрациями ТЕ (1 и 5 мкг/мл) и его основными тритерпенами – бетулином, лупеолом и бетулиновой кислотой, соответственно, и оценивали их влияние на экспрессию мРНК в разные моменты времени. Тритерпены изучали в концентрациях, в которых они встречаются в 5 мкг/мл исследуемого экстракта. мРНК ЦОГ-2 достоверно увеличивалась после 8 ч использования 5 мкг/мл ТЕ (6,3-кратное увеличение ± 1,2) и 4,34 мкг/мл (= 9,81 мкм) бетулина (Bet, 3,5-кратное увеличение ±0,4) (Рис. 2A). Обработка с 1 мкм / мл ТЕ привела к более низким уровням ЦОГ-2 и была значительна после 24 ч (увеличение в 3,4 раза ± 0.3). Влияние на экспрессию ИЛ-6 мРНК было значительно более выраженным при кратном увеличении 172,4 ± 83,3 для ТЕ (5 мкг / мл) и 84,3 ± 29,9 для бетулина (4,34 мкг/мл) через 8 ч (рис. 2B). Опять же, эффект был дозозависимым, т. е. ТЕ в концентрации 1 мкг/мл привело к снижению эффектов (в 12.7 раз ± 4.9 после 8 ч), что зависело от времени (в 82.1 раз ±26.8 в течение 12 ч, 181.9 раз ± 22.9 в течение 24 ч) и после 24 часов. Исследования влияния Ил-8 на экспрессию мРНК показали увеличение в 57.1 ± 8.3 раза при концентрации 5 мкг ТЕ/мл и в 37.6±12.6 при 4.34 мкг/мл бетулина через 8 часов. Более низкая концентрация ТЕ 1 мкг/мл дала менее высокие уровни Ил-8 мРНК со значительным уровнем через 24 ч (кратное увеличение на 33,7±8.6) (рис. 2). Тритерпены лупеол и бетулиновая кислота не оказывали никакого влияния на мРНК этих трех медиаторов.
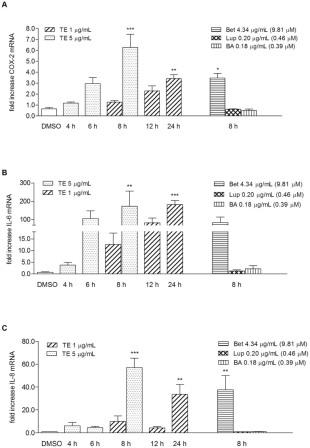
ТЕ и бетулин по-разному влияют на мРНК дальнейших медиаторов в первичных кератиноцитах человека
Впоследствии изучалось влияние ТЕ на дальнейшие молекулы, участвующие в процессе заживления ран. При этом, уровень мРНК IL-1β оставался неизменным при обработке первичных кератиноцитов 1 мкг / мл ТЕ в течение 4, 6, 8, 12 и 24 ч (рис. S2a), уровни TNF-α мРНК достоверно увеличивались через 12 ч и вновь снижались через 24 ч (рис. S2B). Как уже упоминалось выше, эти цитокины важны для начала процесса заживления ран. Трансформирующий фактор роста-β (TGF-β) существенно влиял на TE, что приводило к увеличению примерно в 2,6 раза ±0,4 при 8 ч (рис. S2C). Этот медиатор регулирует рекрутирование воспалительных клеток и макрофагов и образование грануляционной ткани за счет увеличения экспрессии генов, связанных с формированием межклеточного матрикса. Влияние ТЕ и бетулина на мРНК транскрипционного фактора NF-E2-родственного фактора 2 (Nrf2), антимикробного пептида бета-дефензина 3 (hBD3) человека, а также матриксных металлопротеиназ (ММП) ММП-2 и ММП-9 не было достоверным (Рис. S2).
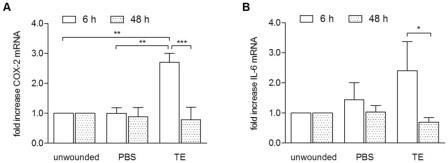
TE увеличивает уровни мРНК IL-6 и ЦОГ-2 в WHM
Для контроля возможности демонстрации регуляции провоспалительных медиаторов, обнаруженных в первичных кератиноцитах, в 3D модели раны, мы на примере определили влияние TE на уровень мРНК IL-6 и ЦОГ-2 в модели заживления ран ex-vivo у свиней. После применения 10 мкг/мл ТЕ в течение 6 и 48 ч, мРНК выделяли и количественно определяли методом количественной ПЦР. Использовалась в 10 раз увеличенная концентрация, чтобы рассмотреть различные условия, касающиеся биодоступности в ex-vivo модели, а также в соответствии с ранозаживляющими экспериментами (рис. 1Б). Через 6 ч после ранения наблюдалось увеличение мРНК Ил-6 и ЦОГ-2, которое достоверно уменьшалось через 48 ч (рис. 3).
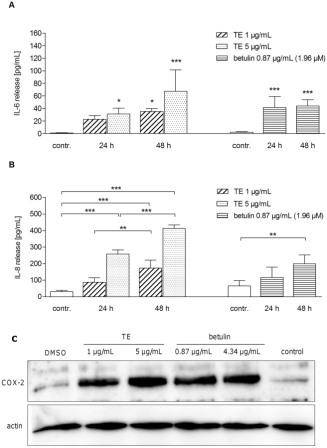
TE и бетулин повышают уровень протеинов различных провоспалительных медиаторов
Для подтверждения повышенного уровня провоспалительных медиаторов, индуцированного ТЕ и бетулином также на уровне белка, впервые было изучено влияние на высвобождение IL-6 и IL-8 в первичных кератиноцитах человека при помощи ELISA. Супернатанты собирали через 24 ч и 48 ч инкубации либо ТЕ (1 и 5 мкг / мл), либо бетулином (0,87 мкг/мл). В обоих случаях измеряли повышенные уровни IL-6 и IL-8 по сравнению с контролем. Для ИЛ-6 наиболее высокие уровни были получены при 5 мкг/мл ТЕ через 48 ч (67±34 пг / мл) и 0,87 мкг/мл бетулина (51±27 пг/мл) через 24 ч (рис. 4A). Высвобождение IL-8 зависело от концентрации TE (максимальный уровень 350±128 пг / мл при 5 мкг / мл и 48 ч). Лупеол не влиял на уровень ИЛ-6 или ИЛ-8 (данные не приведены). Уровни белка ЦОГ-2 после введения ТЕ и бетулина определяли Вестерн-Блот анализом (рис. 4C). ТЕ и бетулин приводили к увеличению белка ЦОГ-2 через 24 ч в обеих исследуемых концентрациях (1 и 5 мкг/мл ТЕ и 0,87 и 4,34 мкг/мл бетулина соответственно).
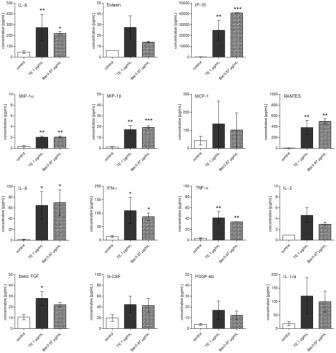
Для подтверждения вышеуказанных данных другим методом и получения более полного представления о дальнейших медиаторах, важных в фазе заживления воспалительной раны, был проведен Bio-Plex® Cytokine анализ. Этот анализ позволяет осуществлять одновременное измерение выпускаемых провоспалительных цитокинов и факторов роста. Лишь одна концентрация ТЕ (1 мкг/мл), бетулина (0,87 мкг/мл = 1,96 мкм) и лупеола (0,04 мкг/мл = 0,09 мкм) была испытана в течение 24 ч, что было доказано на основе предыдущих экспериментов. В целом, оценивали эффект на 27 различных медиаторов, включая провоспалительные [Ил-1β, ИЛ-6, интерферон-γ (ИФН-γ), фактор некроза опухоли-α (ФНО-α)] и противовоспалительные [антагонист рецептора интерлейкина-1 (Ил-1ra), Ил-4, Ил-10, Ил-13] цитокины, цитокины с различными функциями (Ил-2, Ил-5, Ил-7, Ил-9, Ил-12, Ил-15, ИЛ-17), хемокины [ИЛ-8, эотаксин, ИФН-γ- индуцированный белок-10 (ИС-10), моноцитарный хемотаксический белок-1 (МСР-1), макрофагальный воспалительный белок-1α (MIP-1α), MIP-1β, регулируемый при активации, нормальных Т-клеток, и секретируемый (RANTES)] и факторы роста [основной фактор роста фибробластов (basic FGF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцит-макрофаг колониестимулирующий фактор (GM-CSF), тромбоцитарный фактор роста-bb (PDGF-bb), сосудистый эндотелиальный фактор роста (VEGF)] (рис. 5 и S3). Можно подтвердить увеличение ИЛ-6 и ИЛ-8, уже описанное выше. Значительное усиление, индуцированное ТЕ и бетулином, также наблюдались для TNF-α, IP-10, MIP-1α и β, RANTES, и основной FGF с IP-10, высвобождаемым в максимальной величине (рис. 5). Влияние на производство других цитокинов и факторов роста было незначительным (рис. 5) или вовсе малым (рис. S3). Лупеол, изученный в концентрации 0,04 мкг / мл (как это происходит в 1 мкг/мл ТЕ), не оказал влияния на производство этих медиаторов (данные не приведены).
ТЕ и бетулин не влияют на связывание ДНК NF-kB, но влияют на стабильность мРНК
Было показано, что фактор транскрипции ядерный фактор kB (NF-kB) участвует в транскрипционной регуляции многих воспалительных цитокинов и хемокинов. Для выяснения предполагаемого механизма повышенного содержания медиаторов на уровне гена и белка TE и его основного ингредиента бетулина, впервые было изучено влияние на связывание NF-kB-ДНК в методе сдвига электрофоретической подвижности (EMSA). Однако, при инкубации первичных кератиноцитов человека либо с 1 мкг/мл те, либо с 0,87 мкг/мл бетулина (= 1,96 мкм) в разные моменты времени не наблюдалось повышения активности связывания ДНК NF-КБ, в отличие от TNF-α, которое служило положительным контролем (рис. S4). Бетулиновая кислота (0,04 мкг / мл = 0,08 мкм) и лупеол (0,04 мкг/мл = 0,09 мкм) также неактивны в этих условиях (данные не показаны).
Повышение уровня мРНК цитокинов, хемокинов и других провоспалительных медиаторов также может быть связано с повышением стабильности мРНК, как это было показано для IL-6, COX-2 и IL-8 5). Поэтому на примере было изучено влияние ТЕ и бетулина на стабилизацию мРНК IL-6 и ЦОГ-2. Сначала было измерено время полураспада мРНК IL-6 и ЦОГ-2 в присутствии актиномицина D (ActD). Рис. 6 показывает распад ЦОГ-2 (А) и ИЛ-6 мРНК (с) с течением времени, и время полувыведения 74.4 мин для ЦОГ-2 и 66.0 мин для ИЛ-6 рассчитано на одну фазу распада нелинейной регрессии (рис. 6E).
При обработке кератиноцитов человека ТЕ (1 мкг/мл) и бетулином (0,87 мкг/мл) в течение 24 ч наблюдалось увеличение периода полувыведения мРНК ЦОГ-2 до 226,9 мин ТЕ и 196,5 мин бетулином (Рис. 6A и B). мРНК ИЛ-6 также стабилизировалась и составила T1 / 2 157,7 мин для ТЕ и 260,3 мин для бетулина (Рис. 6C, D и E).
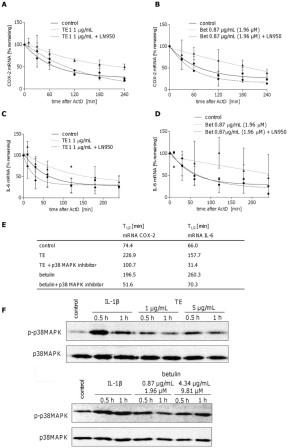
Р38 MAPK и HuR участвуют в стабилизирующем эффекте мРНК ТЕ и бетулина
Поскольку известно, что Р38 MAPK, в основном, участвует в стабильности мРНК ЦОГ-2 и ИЛ-6, было изучено потенциальное участие Р38 MAPK в повышенной устойчивости мРНК при помощи ТЕ и бетулина. Таким образом, первичные кератиноциты человека обрабатывали ТЕ или бетулином, а затем ингибитором P38 MAPK LN950 и ActD и определяли время полураспада мРНК ЦОГ-2 и IL-6, соответственно. Комбинированное применение ингибитора Р38 MAPK и ТЕ существенно снизило T1 / 2 мРНК ЦОГ-2 до 100,7 мин, хотя и не до уровня контроля. Сочетание ингибитора Р38 MAPK с бетулином приводило даже к более низкому T1/2 по сравнению с контролем (51,6 мин). Что касается ИЛ-6, то после добавления ингибитора Р38 MAPK время полураспада мРНК в присутствии ТЕ и бетулина сильно сократилось. Для ТЕ это приводило к более низкому периоду полураспада по сравнению с контролем (31,4 мин по сравнению с 66,0 мин), тогда как комбинация с бетулином приводила к несколько более высокому T1/2 из 70,3 (рис. 6A-E).
В целом, эти результаты ясно показывают, что p38 MAPK участвует в TE и бетулин-индуцированной устойчивости мРНК ЦОГ-2 и Ил-6. Эти данные подтверждаются повышением клеточных уровней активированного p38 MAPK (= p-p38) (рис. 6F) после использования ТЕ (1 и 5 мкг / мл) и бетулина (0,87 и 4,34 мкг/мл).
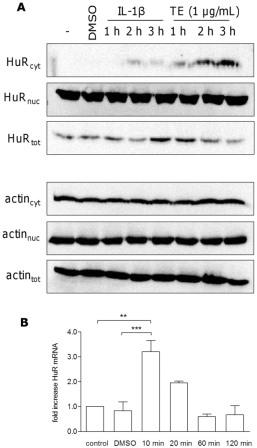
В дальнейшем изучалось влияние на HuR, стабилизирующий фактор мРНК, который, как известно, участвует в посттранскрипционной регуляции генов с AU-богатыми элементами (ARE), присутствующими в их 3' - нетранслированных областях 6). Гены ЦОГ-2 и Ил-6 также обладают этой особенностью, и ранее было продемонстрировано участие HuR в стабилизации мРНК ЦОГ-2. Поэтому влияние на транслокацию HuR из ядра в цитозоль, где он проявляет стабилизирующее действие, оценивали на примере TE методом вестерн-блот. На рис. 7А показано, что 1 мкг/мл ТЕ увеличивает цитозольную локализацию HuR. В качестве контроля использовали IL-1β (20 нг/мл), что обусловлено его влиянием на цитоплазматическую HuR. В то время как уровни ядерного HuR, по-видимому, остаются неизменными, общий HuR был слегка повышен после обработки IL-1β (3 ч) и TE (1 ч). Чтобы объяснить недостающее снижение уровня ядерной HuR, был применен количественный ПЦР для изучения того, активирует ли ТЕ экспрессию генов HuR. Действительно, мРНК HuR быстро усиливается через 10 мин, а через 20 мин быстро уменьшается (рис. 7B). Однако, кратный рост был низкий, так что сомнительно, что отсутствующие изменение уровня ядерной HuR можно объяснить только новым синтезом HuR. Следует учитывать, что изменение уровня цитозольной HuR может быть слишком незначительным, чтобы оказывать влияние на ядерный уровень.
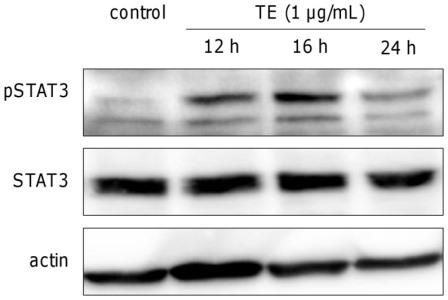
TE активирует фактор транскрипции STAT3
Как упоминалось выше, обработка первичных кератиноцитов человека ТЕ увеличивает производство IL-6 (рис. 4 и 5). Этот цитокин является важным активатором сигнального преобразователя сигнала фактора транскрипции и активатором транскрипции (STAT3), играющим существенную роль в пролиферации и миграции кератиноцитов 7). Для изучения влияния TE-индуцированного IL-6 на активацию STAT3 через разные промежутки времени выполняли вестерн-блот анализ. Увеличение фосфорилирования STAT3 наблюдалось через 12 ч и 16 ч (рис. 8).
TE и бетулин не увеличивают пролиферацию в первичных кератиноцитах человека и в WHM
В связи с предполагаемым влиянием STAT3 на пролиферацию, было исследовано влияние 1 мкг / мл и 5 мкг/мл ТЕ, а также соответствующих концентраций бетулина на пролиферацию первичных кератиноцитов человека. Не наблюдалось каких-либо пролиферативных эффектов при применении ТЕ, бетулина или лупеола и бетулиновой кислоты, которые также были включены в исследование (рис. S5A). Это также было подтверждено в WHM (рис. S5B). Несмотря на тенденцию к снижению количества пролиферативных клеток после применения 10 мкг/мл ТЕ и бетулина (8,69 мкг/мл), существенного влияния на пролиферацию во всех отделах ВМ не было.
TE усиливает миграцию первичных кератиноцитов человека в анализе методом зарастания царапины
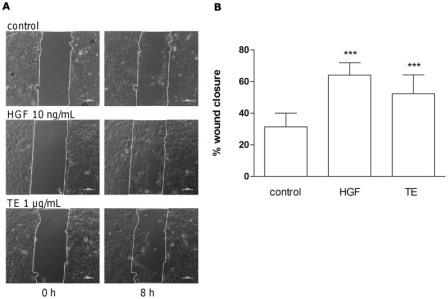
Реэпителиализация включает пролиферацию и миграцию. Наблюдалась повышенная реэпителизация в ТЕ-обработанной WHM (рис. 1), но без пролиферативных эффектов (рис. S5). Было изучено влияние на миграцию в анализе методом зарастания царапины первичных кератиноцитов человека с использованием ibidi® культур. Клетки обрабатывали 1 мкг/мл ТЕ и 10 нг/мл фактора роста гепатоцитов (HGF) в качестве положительного контроля, а микроскопические изображения получали сразу после ранения (t = 0 ч) и в течение времени инкубации до 24 ч. Оба стимула показали значительное увеличение закрытия царапины (64% ±15 для HGF и 52% ±24 для TE) по сравнению с необработанными клетками (31%±17) через 8 ч после ранения (рис.9А и Б).
ТЕ и его тритерпены влияют на актиновый цитоскелет
Реорганизация актинового цитоскелета в условиях контролируемой полимеризации и деполимеризации участвует в подвижности клеток. Это обеспечивает движущую силу миграции клеток, таких как кератиноциты, по краю раны, что необходимо для закрытия раны. Филоподия, ламеллиподия и стресс-волокна – это разные виды актиновых структур, которые способствуют миграции клетки.
Для изучения влияния ТЕ и его основных тритерпенов на актиновый цитоскелет, первичные кератиноциты человека обрабатывали различными концентрациями ТЕ и соответствующих изолированных тритерпенов в течение двух часов и окрашивали флуорофором, меченным фаллоидином. Использовали субконфлюентные клетки, фенотипически и биохимически напоминающие активные кератиноциты из базального слоя на краю раны, мигрирующие по новообразованной грануляционной ткани до восстановления поврежденной кожи 8). Обработка ТЕ в концентрациях 0,5 и 1 мкг / мл индуцировала образование стрессовых волокон, филоподий и ламеллиподий (F) (рис. S6). Интересно, что даже более низкие концентрации ТЕ (0,51, 5,1 и 51 нг / мл), в большей степени по сравнению с более высокими концентрациями, индуцировали образование филоподий и ламеллиподий (F), а также стресс-волокон (S) (рис. 10). Длинные, тонкие и колючие филоподии и очень плотная, полосчатая актиновая сетка (ламеллиподия) наблюдались на переднем крае клетки по сравнению с контролем (растворитель DMSO), где было видно лишь несколько коротких филоподий. В качестве положительного контроля для образования филоподий и ламеллиподий, использовали цитотоксический некротизирующий фактор 1 из Escherichia coli (CNF1), который непосредственно активирует Rac и Cdc42. Для индукции стресс-волокон применяли CNFY (цитотоксический некротизирующий фактор из Yersinia pseudertuberculosis), избирательно активирующий RhoA.
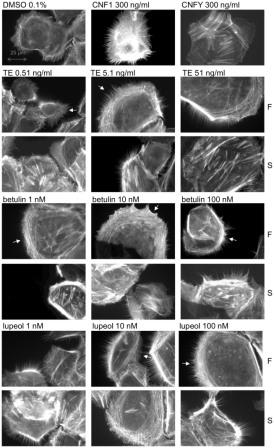
Отдельные тритерпены экстракта бересты вели себя по-разному. Бетулин испытывали в концентрациях 1, 10 и 100 нм, соответствующих количеству этого тритерпена в 0,51, 5,1 и 51 нг / мл ТЕ. Лупеол, бетулиновая кислота, олеаноловая кислота и эритродиол тестировали в концентрациях 1, 10 и 100 нм по причинам сопоставимости с бетулином. Бетулин и лупеол сильно поляризовали клетки, образуя широкие ламеллиподии и остроконечные филоподии на переднем крае (обозначены белыми стрелками) даже при самой низкой наномолярной концентрации (Рис. 10). Стресс-волокна внутри тела клетки, в частности, в самой низкой концентрации (1 пм), также увеличивались обоими тритерпенами. Никакого эффекта относительно бетулиновой и олеаноловой кислот при испытанных концентрациях не наблюдалось, в то время как эритродиол (1-100 нм) увеличивал образование стресс-волокон, филоподий и ламеллиподий по сравнению с контрольным растворителем DMSO (см. рис. S6).
ТЕ, бетулин и лупеол активируют выставочных центров Rho ГТФазы, участвующие в регуляции актинового цитоскелета
Члены семейства Rho ГТФаз, особенно RhoA, Rac1 и Cdc42, существенно вовлечены в регуляцию актинового цитоскелета 9). Активация Cdc42 поляризует клетки 10), приводя к образованию филоподии, а также влияя на ламеллоподии, тогда как активация Rac приводит к расширению ламеллоподий, что является движущей силой миграции клеток. Образование стресс-волокон, содержащих актин-миозин, что сужает тело клетки, а также фокальные спайки, связанные со стресс-волокнами, точка крепления к основанию, опосредуется RhoA.
Из-за сильного влияния ТЕ, бетулина и лупеола на различных цитоскелетных структурах актина (рис. 10 и S6), было изучено их влияние на вышеупомянутые Rho ГТФазы на примере 5,1 нг / мл TE, 10 нм бетулина (соответствующая концентрация в 5,1 нг / мл TE) и 10 нм лупеола. На рис. 11А показано влияние ТЕ, бетулина и лупеола на RhoA в первичных кератиноцитах человека, оцениваемое в экспериментах и последующем анализе вестерн-блот. Через 3 ч инкубации с соответствующими соединениями, активная форма RhoA – GTP-RhoA – осаждалась гранулами, загруженными ретекином. ТЕ, бетулин и лупеол были способны слегка активировать RhoA. В качестве положительного контроля, использовали цитотоксический некротизирующий фактор из Escherichia coli (CNFY) (300 нм), который конститутивно активирует RhoA путем дезаминирования глутамина 63, задерживающего RhoA в активном, связанном с ГТФ состоянии. Незначительное воздействие на Cdc42 наблюдалось только при десятикратном увеличении концентрации ТЕ (51 нг / мл) и бетулина (100 нм), но не лупеола (100 нм) (рис. 11B). В качестве положительного контроля использовали CNF1 (300 нм), который также дезаминирует Cdc42 и Rac1 на глютамине. Четкой активации Rac1 с TE и тритерпенами не наблюдалось (рис. 11C).
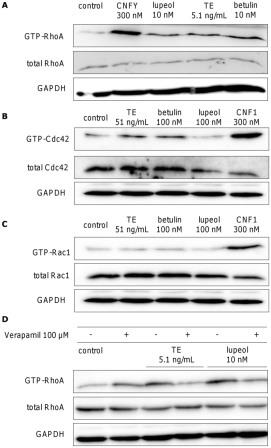
Кальций является многогранным вторым мессенджером, соединяющим активацию рецепторов с последующими сигнальными путями, а также участвующим в регуляции Rho ГТФаз 11). Поскольку ТЕ вызывает повышение внутриклеточного уровня кальция в первичных кератиноцитах человека, на примере верапамила –блокатора потенциал-зависимых кальциевых каналов – была изучена роль кальция в активации RhoA при помощи ТЕ и лупеола. Первичные кератиноциты человека предварительно обрабатывали 100 мкм верапамила за 10 минут до инкубации либо ТЕ (5,1 нг / мл), либо лупеола (10 нм) (см. рис. 11). Снижение активации RhoA при использовании ТЕ и лупеола, при использовании ингибитора, показывает, что кальций, вероятно, участвует в активации RhoA.
Обсуждение
Целью данного исследования являлось выяснение лежащего в основе молекулярного механизма клинически доказанного ранозаживляющего действия экстракта бересты (ТЕ), состоящего, в основном, из различных пентациклических тритерпенов. В качестве модели мы использовали первичные кератиноциты человека, так как они являются основной клеточной популяции эпидермиса и необходимы для быстрого покрытия раны нео-эпидермисом. Показано, что ТЕ влияло как на воспалительную фазу, так и на фазу образования новой ткани. В отношении провоспалительных эффектов было показано, что ответственность несет только бетулин, основной компонент ТЕ, тогда как влияние на миграцию клеток, измеряемое перестройкой актинового цитоскелета, может дополнительно наблюдаться относительно лупеола и эритродиола. Эти процессы могут способствовать улучшению регенерации эпидермиса и ускорению восстановления барьерной функции эпидермиса с помощью ТЕ, что было доказано в модели ex-vivo у свиней. Кинетика заживления ран еще не оценена в модели ex-vivo, но является интересной задачей для будущих экспериментов. Связанные с воспалительной фазой, ТЕ и бетулин приводили к временному и концентрационно-зависимому увеличению мРНК ЦОГ-2 и ИЛ-6 в первичных кератиноцитах человека. Этот результат был подтвержден в модели заживления ран у свиней ex-vivo и на уровне белка первичных кератиноцитов человека. Важность ЦОГ-2 в ранозаживляющем процессе была показана Futagami et al., кто показал отсроченную реэпителизацию кожных ран у крыс после применения специфического ингибитора ЦОГ-2. У мышей с «выбитым» геном ЦОГ-2, предел прочности после кожного ранения уменьшился, по сравнению с мышами дикого типа. Однако, роль ЦОГ-2 в излечивании раны пока не была точно подтверждена. Ряд исследований показал, что ингибирование ЦОГ-2 не оказывает или оказывает незначительное негативное влияние на заживление ран 12). Учитывая, что экстракт бересты уже показал перспективные ранозаживляющие свойства у пациентов, наблюдаемое незначительное увеличение экспрессии ЦОГ-2 после использования ТЕ может быть полезным в заживлении ран. Роль IL-6 в заживлении ран была продемонстрирована в экспериментах с мышами с «выбитым геном» IL-6, которые демонстрировали нарушение заживления ран, приводящее к замедленной реэпителизации, снижению ангиогенеза, отложению коллагена и инфильтрации лейкоцитов. ИЛ-6 также вовлечен в восстановление эпидермального барьера, а местное применение ИЛ-6 усиливает восстановление эпидермального барьера у мышей дикого типа, в то время как ингибирование рецепторного комплексп агониста ИЛ-6/ sIL-6, задерживается барьер ремонт в диких мышей 13). Также наблюдалось улучшение барьерной функции кожи после применения ТЕ и бетулина, что может быть связано с повышенным уровнем IL-6. Пантотенат, распространенное средство для самолечения при ранениях, также показал повышенную регуляцию IL-6 в культивированных фибробластах человека [57]. Это считается важным в ранозаживляющем действии пантотената. ИЛ-6 также является известным активатором сигнального каскада JAK/STAT. Активация STAT3 обычно приводит к экспрессии генов, связанных как с миграцией, так и с пролиферацией. Однако в случае экстракта бересты, по-видимому, затрагивается только миграция клеток, так как не было обнаружено увеличения числа пролиферативных клеток. Помимо IL-6, Rho ГТФазы RhoA, который был слегка активирован TE, может дополнительно способствовать наблюдаемой активации STAT3, как это было ранее показано Reipschläger et al. 14). Были проведены дальнейшие исследования для выяснения механизма повышения уровня мРНК ЦОГ-2 и ИЛ-6 при использовании ТЕ и бетулина. Фактор транскрипции NF-kB, являющийся мощным индуктором многих провоспалительных генов, не был задействован. Вместо этого, был обнаружен длительный период полураспада мРНК. Было показано, что p38 MAPK участвует в экспрессии мРНК и стабильности многих провоспалительных медиаторов, включая ЦОГ-2 и IL-6. Была продемонстрирована его вовлеченность с помощью специфического ингибитора p38 MAPK, который сокращал длительный период полураспада. Соответственно, TE и бетулин несколько увеличили количество фосфорилированного p38 MAPK, как показал вестерн-блот анализ в первичных кератиноцитах человека. p38 MAPK действует путем активации или ингибирования стабильности мРНК или факторов дестабилизации, как HuR и ТТП 15). HuR проявляет свою стабилизирующую функцию только при локализации в цитозоле. Наши данные свидетельствуют о том, что ТЕ приводило к увеличению цитозольной фракции HuR. Поскольку известно, что p38 MAPK индуцирует ядерный экспорт этого фактора 16), наблюдаемое накопление HuR может быть результатом активации p38 MAPК. Нуклео-цитоплазматическое курсирование HuR обычно подразумевает снижение уровня ядерной HuR, что мы не наблюдали. Недостающее сокращение ядерного HuR может быть объяснено быстрым синтезом de novo, поскольку мы измерили увеличение уровня мРНК HuR. Однако нельзя исключать, что различия в уровне белка слишком малы, чтобы их можно было обнаружить с помощью анализа вестерн-блот. В дополнение к ЦОГ-2 и IL-6, IL-8 и TNF-α увеличивались на уровне гена и белка при помощи TE и бетулина в первичных кератиноцитах человека. Путем одновременного измерения различных провоспалительных цитокинов, хемокинов и факторов роста с помощью био-Плекс цитокинового анализа, был получен более полный обзор других пораженных медиаторов. Примечательно, что среди медиаторов, увеличивалось количество тестируемых хемокинов (IL-8, IP-10, MIP-1β, RANTES) после обработки ТЕ и бетулином в кератиноцитах. Известно, что хемокин ИЛ-8 значительно активируется в заживающих ранах кожи и содержится в раневой жидкости, где он действует как мощный хемоаттрактант, рекрутирующий и активирующий воспалительные клетки. Показано, что местное применение IL-8 способствует заживлению ран за счет ускоренной реэпителизации. Таким образом, результаты показывают, что ТЕ и бетулин активируют различные медиаторы, участвующие в воспалительной фазе раневого процесса. Провоспалительные эффекты некоторых исследованных тритерпенов уже сообщалось ранее. Аналогично этим результатам, Zdzisinska et al. продемонстрировали умеренную индукцию TNF-α бетулином в культурах первичных цельных клеток крови человека [69]. Было показано, что бетулиновая кислота индуцирует производство TNF-α в макрофагах мыши. Однако, также было продемонстрировано, что бетулин, лупеол и бетулиновая кислота оказывают мощное противовоспалительное действие in vivo и in vitro 17). Таким образом, это, по-видимому, сильно зависит от концентрации, времени инкубации, типа исследуемой клетки или ткани (первичные или раковые клетки), и экспериментальной установки (стимулированные или нестимулированные клеточные системы), проявляют ли эти тритерпены воспалительные или противовоспалительные эффекты. Тогда как временное воспаление необходимо для процесса заживления ран, чрезмерная и увеличенная воспалительная фаза вредна для правильного излечения ран и приводит к хроническим ранам. Следовательно, необходимо прекращение воспалительной реакции 18). В WHM было продемонстрировано, что увеличение мРНК ЦОГ-2 и IL-6 было лишь временным. Кроме того, ЦОГ-2 не только участвует в провоспалительных эффектах, на более поздних стадиях заживления ран этот фермент способствует образованию противовоспалительных простагландинов, например, производных PGD2 и PGJ2, которые способствуют снижению воспаления. Кроме того, TGF-β, который был слегка активирован TE, может способствовать прекращению фазы воспаления путем индукции IL-1ra и снижению TNF-α, IL-8, MCP-1 и MIP-1α. В совокупности, предполагается, что ТЕ и бетулин усиливают начало воспалительной фазы заживления раны за счет транзиторной регуляции провоспалительных медиаторов, что не приводит к длительному воспалению. Кроме того, исследования показывают, что экстракт бересты влияет на вторую стадию заживления ран, новую фазу формирования тканей, увеличивая миграцию клеток первичных кератиноцитов человека, показанных в эксперименте по анализу зарастания царапины. Миграция сильно зависит от морфологической поляризации клеток и включает в себя мембранные выступы на переднем крае клетки с образованием новых прикреплений к субстрату, сжатием тела клетки и, наконец, высвобождением хвостовой части клетки. Эти процессы требуют скоординированного взаимодействия элементов цитоскелета, особенно сборки и разборки актиновых филаментов, что приводит к формированию четких клеточных структур, таких как фитоподии, ламеллиподии и стресс-волокна 19). Соединения, которые прямо или косвенно влияют на эти структуры актина, интересны в контексте поддержки и усиления ранозаживляющих процессов. Было наглядно показано, что ТЕ в микромолярных и даже в наномолярных концентрациях оказывает сильное влияние на актиновый цитоскелет, приводя к поляризации клеток, образованию ламеллиподий и филоподий на переднем крае и стресс-волокон в клеточном теле. Формирование стабилизированных филоподий и стресс-волокон дополнительно подтверждено визуализацией винкулина с флуоресцентно-мечеными антителами (данные не приведены). Этот белок накапливается в новообразованных фокальных комплексах при филоподиях и в фокальных спайках во всем теле клетки. Влияние на актиновый цитоскелет в наномолярных концентрациях может быть подтверждено выделенными тритерпенами бетулином, лупеолом и эритродиолом. В частности, в клетках меланомы мышей Hata et al. наблюдали прямо противоположный эффект, то есть, разъединение стресс-волокон при обработке лупеолом, который подавлял миграцию клеток в концентрациях от 1 до 20 мкм. Martin et al. также показали разъединение стресс-волокон для эритродиола (25-50 мкм) в клеточной линии астроцитомы человека 20). Эти контрастные результаты можно объяснить тем, что эти группы ученых использовали линии раковых клеток. В соответствии с этим выводом, Martin et al. наблюдали нарушение стресс-волокон в клеточной линии астроцитомы человека после обработки олеаноловой кислотой, тогда как в первичных фибробластах кожи человека это же соединение не проявляло изменения цитоскелетных структур, что подтверждает результаты в первичных кератиноцитах. Формирование стресс-волокон регулируется активацией Rho ГТФазы RhoA. Следовательно, можно продемонстрировать увеличение ГТФ- RhoA на TE, бетулин и лупеол, что указывает на то, что активация RhoA может способствовать наблюдаемому образованию стресс-волокон. Известно, что кальций участвует в регуляции Rho ГТФаз и других последующих игроков, таких как актин-связывающие белки, которые непосредственно контролируют полимеризацию и деполимеризацию актина 21). Соответственно, можно было также продемонстрировать вовлеченность кальция в TE- и люпеол-опосредованной активации RhoA с использованием верапрамила, блокатора потенциалзависимых кальциевых каналов L-типа, по мере того как наблюдалось значительно уменьшение GTP-связанного RhoA при обработке верапамилом. Увеличение внутриклеточного кальция с использованием сопоставимого экстракта бересты также ранее сообщалось Woelfle. Эта группа ученых дополнительно продемонстрировала повышенную экспрессию TRPC6 (суперсемейство переходного рецепторного потенциала катионных каналов) после стимуляции экстрактом бересты. Возможно, этот эффект может быть вызван наблюдаемым притоком кальция. Рассматривая оба результата на приток Ca2+, можно заключить, что TRPC6 не может быть исключительно и полностью ответственен за приток кальция, а активация L-типа каналов кальция может быть осуществлена TRPC6 опосредованной деполяризацией мембраны, как сообщалось Soboloff et al. Изменения актинового цитоскелета и активация ГТФазы тесно связаны с путями митогенактивированной протеинкиназы 22). Таким образом, Rho ГТФазы могут приводить к фосфорилированию p38 MAPK путем воздействия на восходящие киназы. Поэтому активация Р38 ТЕ и бетулином может не только влиять на стабилизацию мРНК, но и участвовать в наблюдаемой сборке и разборке актиновых нитей. ТЕ и бетулин также активировали Rho ГТФазы Cdc42, который, как известно, стимулирует образование филоподий, но здесь требовались более высокие концентрации по сравнению с активацией RhoA. Интересно, что лупеол, который также увеличивал количество филоподий, не активировал Cdc42. Кроме того, не наблюдалось активации Rac1 TE, бетулином или лупеолом, несмотря на повышенное образование ламеллиподий. Эти наблюдения могут быть объяснены пространственной или временной активацией или вовлечением других Rho ГТФаз, таких как Rif. Таким образом, наши результаты способствуют пониманию молекулярного механизма клинически доказанного ранозаживляющего эффекта бересты. Эти результаты, вкупе с доказанной эффективностью, определяют бересту как первое медицинское растение с высоким потенциалом для улучшения заживления ран, области, которая срочно нуждается в эффективных лекарственных средствах. Кроме того, береста является удачным примером того, что традиционные лекарственные растения могут стать рациональными лекарственными средствами.










