Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Гиперфорин
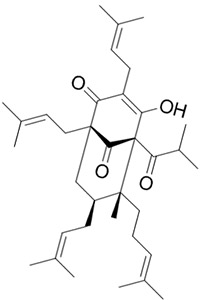
Традиционная китайская медицина славится изобилием лекарственных источников. Тем не менее, традиционная медицина не имеет привязки к какой-либо конкретной географической зоне; природные средства, используемые в других областях земного шара, с не меньшей вероятностью содержат мощные химические вещества. Одним из наиболее известных природных средств является зверобой (Hypericum perforatum), издавна используемый для лечения легкой депрессии (которая в настоящее время считается наиболее распространенным заболеванием в мировом масштабе).
В ходе исследований было показано, что зверобой содержит некоторое количество биологически активных веществ, первичным из которых является гиперфорин, мощный ингибитор нескольких нейротрансмиттеров. Химически гиперфорин является полициклическим полипренилированным ацилфлороглюцинолом, и, что характерно для этой семьи веществ, состоит из бицикло [3.3.1] нонана с несколькими изопреноидными боковыми цепями. Хотя эта структура дает гиперфорину потенцию, она привносит и значительные недостатки, в частности, низкую растворимость в воде и высокую чувствительность к окислению.
Задача медицинской химии достаточно ясна – создать аналоги гиперфорина, поддерживающие эффективность натурального продукта, но являющиеся при этом более стабильными и водорастворимыми. Однако, чтобы обеспечить это, требуется эффективный маршрут к цели, обеспечивающий возможности для селективного и гибкого вывода. Эти возможности предоставила команда Гарвардского университета, США, во главе с Мэттом Шэр.
Столкнувшись с сутью проблемы, команда ученых из США начала работу в направлении двух фрагментов, которые предоставляли бы комплекс системы бицикло[3.3.1]нонана. Получение гераниола обеспечило исходный материал и асимметрию, при этом в начале синтеза использовался довольно спорный реагент – ацетат ртути. Хотя далеко не такой токсичный, как другие ртутьорганические соединения, побочные продукты реакции оксимеркурирования могут быть довольно неприятными, но мягкость протокола и полезность реакции все же сохраняют ее актуальность.
Для увеличения селективности реакции пренилирования второй фрагмент также требует наличия потенциально токсичного реагента в виде йодистого бария. При депротонировании необработанного диена формируется пентадиенил анион, который может вступать в реакцию с хлоридом пренила на различных участках, но с использованием свежего йодистого бария реакция протекает на нужном участке. Второе депротонирование в этом же центре способствует благополучному образованию связи с первым фрагментом, напрямую возвращая циклизацию субстрата.
Циклизация сама по себе представляет собой более эффективную реакцию, с использованием обычной кислоты Льюиса для активации эпоксида, что вызывает реакцию перегруппировки с образованием в процессе двух колец, с отличной стереоселективностью и общей эффективностью реакции.
Красота стратегии состоит в том, что, в то время как цель находилась только в 11 шагах от этого промежуточного соединения, большая часть декорирования терпеноида была еще впереди, что создает множество возможностей для различных разработок. Однако, прежде чем украшать ядро, команда должна была удалить посторонние вещества, привносящие в него кислород. Применение несколько необычного диметил бромида бора первоначально позволило расщепить кеталь, а затем малая база (литий тетраметилпиперидид) удалила молекулу метанола.
Затем команда выполнила преобразование освобожденного гидроксила в тионокарбонат. Эта группа действует в качестве большого радикального предшественника - добавление триэтилбора в аэробных условиях генерирует радикал на углеродном кольце, который взаимодействует с аллилтрибултином, создавая более практичную функциональную основу алкена. За этим следует простое пренилирование с использованием общего катализатора обмена олефинов (второе поколение Ховейда - Граббс) и 2-метил-2-бутен – селективные для олефинов нового терминала.
Для завершения цели требуется осуществление двух последних реакций алкилирования, индуцированных депротонированием бицикло[3.3.1]нонатового ядра и добавлением подходящих субстратов для замены. Для завершения создания гиперфорина необходимо осуществить пять дальнейших шагов, что существенно превосходит предыдущий метод синтеза (требующий более 50 шагов). Однако, данный синтез выделяет из прочих не только быстрота работы, но и потенциальная возможность разработки новых методов лечения.
Распространенность
Гиперфорин в значительных количествах содержится в растении Hypericum perforatum (зверобой продырявленный), при этом другие виды зверобоя, такие как Hypericum calycinum (зверобой чашечный), содержат более низкие уровни этого фитохимического вещества. Гиперфорин считается ингибитором обратного захвата. Он накапливается в сальных железах, пестиках и фруктах, вероятно, для защиты растения от поедания. В других видах зверобоя содержится низкое количество гиперфорина.
Химия
Гиперфорин является пренилированным производным флороглюцина. Химическая структура гиперфорина была открыта исследовательской группой Шемякинского Института биоорганической химии (Академия наук СССР в Москве), а данные об этом были опубликованы в 1975 году. Полный синтез ненатурального энантиомера гиперфорина был осуществлен в 2010 году, а полный синтез натурального энантиомера – в 2012 году. Гиперфорин нестабилен в присутствии света и кислорода.
Фармакология
Гиперфорин считается первичным активным компонентом, ответственным за антидепрессивные и анксиолитические свойства экстрактов зверобоя. Он действует как ингибитор обратного захвата моноаминов, включая серотонин, норадреналин, дофамин, а также является ингибитором обратного захвата ГАМК и глутамата. Его значения половины ингибирующей концентрации (ИК50) составляют 0,05-0,10 мкг/мл для всех соединений, за исключением глутамата (0,5 мкг/мл). Гиперфорин также ингибирует обратный захват глицина и холина. Похоже на то, что он действует, активируя переходный рецепторный потенциал ионного канала TRPC6. Активация TRPC6 способствует вступлению натрия и кальция в клетку, что вызывает ингибирование обратного захвата моноаминов.
Гиперфорин также считается ответственным за индукцию ферментов цитохрома P450 CYP3A4 и CYP2C9 путем связывания и активации рецепторов прегнана X (PXR).
Имеются данные о фармакокинетике гиперфорина, основанные на информации об экстракте, содержащем 5% гиперфорин. Максимальные уровни в плазме (Cmax) у добровольцев достигались через 3,5 ч после приема экстракта, содержащего 14,8 мг гиперфорина. Биологический период полувыведения (Т ½) и среднее время удержания препарата в организме составили 9 и 12 часов соответственно, при этом устойчивая концентрация в плазме в состоянии покоя составляла 100 нг/мл (около 180 нм/л), при 3 дозах/сут. Линейные концентрации в плазме наблюдались в пределах нормального диапазона дозирования. Накопления препарата в организме не наблюдалось.
Гиперфорин является сильным ингибитором СОХ-1 и 5-LO со значениями ИК50 300 нМ и 90 нм соответственно, что делает его приблизительно в 3-18 раз более мощным противовоспалительным средством, чем аспирин.
Гиперфорин обладает свойствами местного антибиотика и активен против метициллин-резистентных штаммов золотистого стафилококка (MRSA) со значением минимальной подавляющей концентрации (МПК) 1,0 мкг/мл (1.86μM), а также активен против других грамположительных бактерий.
:Tags
Читать еще: Норвалин , Трилостан , Ункария клюволистная , Ципротерон (ципротерона ацетат), Чеснок ,










