Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Лейцин
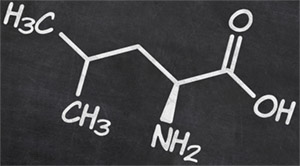
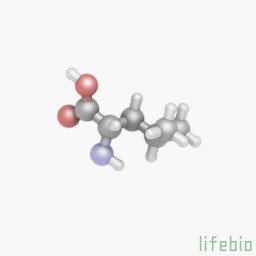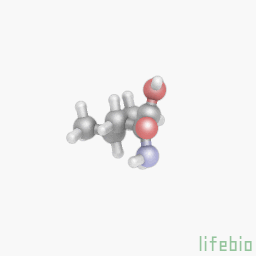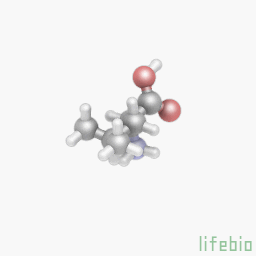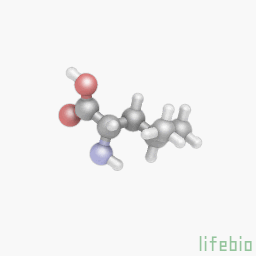
Лейцин (сокращенно Leu или L) – альфа-аминокислота с разветвленной цепью с химической формулой HO2CCH (NH2) CH 2 CH (CH 3)2. Из-за своей алифатической изобутиловой боковой цепи лейцин классифицируется как гидрофобная аминокислота. Лейцин кодируется шестью кодонами (UUA, UUG, CUU, CUC, CUA и CUG) и является основным компонентом субъединиц ферритина, астацинов и других «буферных» белков. Лейцин является незаменимой аминокислотой, то есть не может синтезироваться в организме человека, и поэтому она должна поступать в организм с пищей. Лейцин является наиболее полезной основной аминокислотой с разветвленной цепью (АРЦ). Восполнение организма лейцином отдельно от смеси аминокислот с разветвленными цепями не только полезно, но и может обойтись дешевле; все АРЦ имеют горьковатый вкус.
Фармакологическая группа: аминокислоты; незаменимые аминокислоты
Краткая информация
Лейцин является одной из трех аминокислот с разветвленной цепью. Иногда ее называют «главной» аминокислотой, поскольку она обладает самым популярным полезным свойством АРЦ – способствует наращиванию мышечной массы. Лейцин является активатором белка, известного как «мишень рапамицина в клетках» (МРК), который затем индуцирует синтез мышечного белка с помощью киназы рибосомного белка S6; две другие АРЦ могут также активировать МРК, но значительно слабее, чем лейцин, таким образом, 5 г лейцина будут иметь больший эффект, чем 5 г смеси АРЦ. Метаболит лейцина, гидроксиметилбутират моногидрат, также слабее индуцирует синтез мышечного белка, чем лейцин, но, несмотря на это, лучше предохраняет от потери безжировую (сухую) мышечную массу. Лейцин не сильно отличается от двух других АРЦ – изолейцина и валина. Две другие АРЦ, изолейцин и валин, требуют более подробного изучения. В исследованиях лейцин в основном оценивают по синтезу мышечного белка, когда дополнительное количество лейцина добавляют к обычному или тестовому рациону. Исследования тестового рациона показали, что лейцин значительно увеличивает синтез белка. Несмотря на то, что это, возможно, приводит к образованию более сухой массы в течение некоторого периода времени, лейцин также демонстрирует эффективность в увеличении мышечной массы у людей с низким потреблением белка и у пожилых людей (у которых, как правило, нарушен синтез мышечного белка в результате лечебной диеты). Воздействие лейцина на глюкозу до конца не выяснено. Лейцин обладает свойством снижать уровень сахара в крови (может выделять инсулин из поджелудочной железы, а также непосредственно стимулировать поглощение глюкозы клеткой без инсулина), но также имеет и противоположные свойства (ингибирует стимулируемое инсулином усвоение глюкозы, с помощью стимуляции киназы рибосомного белка S6). В культуре клеток лейцин стимулирует поглощение глюкозы до 45 минут. В живых системах воздействие небольших доз лейцина незначительно (по предварительным данным, лейцин обладает реабилитационными свойствами при сахарном диабете). Изолейцин является более мощным гипогликемическим препаратом, но с меньшим ингибированием собственного воздействия. Другие названия: L-лейцин Не путать с: АРЦ, лейциновая кислота (метаболит) Чем примечателен:
- Лейцин не является стимулирующим препаратом
- Порошок лейцина имеет горьковатый вкус, который можно ослабить посредством снижения температуры или добавления кислого ароматизатора.
Является:
- средством для стимуляции роста мышц
- аминокислотной добавкой
Хорошо сочетается с
- ресвератролом (митохондриальный биогенез) 1)
Не сочетается с:
- ароматическими аминокислотами (триптофан и L-тирозин)
Лейцин: инструкция по применению 2,000-5,000 мг лейцина принимают кратковременно натощак, либо во время приёма пищи с изначально низким содержанием белка (или источников белка с низким содержанием лейцина).
Биосинтез
Так как лейцин – незаменимая аминокислота, она не может быть синтезирована в организме животных. Следовательно, она должна поступать в организм, как правило, в качестве компонента белков. У растений и микроорганизмов лейцин синтезируется из пировиноградной кислоты с помощью ряда ферментов:
Ацетолактатсинтазы\\ Ацетогидроксикислотной изомероредуктазы\\ Дигидроксиацидной дегидратазы\\ Альфа- изопропилмалатной синтазы\\ Альфа-изопропилмалатной изомеразы\\ Лейциновой аминотрансферазы\\
Синтез небольшой гидрофобной аминокислоты валина также включает в себя начальную часть этого пути.
Биология
Лейцин перерабатывается в печени, в жировой и мышечной ткани. В жировой и мышечной ткани лейцин участвует в формировании стеринов, и в общем в этих двух тканях стерин задействован в семь раз больше, чем в печени. Лейцин является единственной диетической [[аминокислоты|аминокислотой]], способной стимулировать синтез белка (протеина). В качестве пищевой добавки лейцин способен замедлять деградацию мышечной ткани за счет увеличения синтеза мышечных белков у старых крыс. Хотя ранее лейцин включали в состав спортивных добавок, сейчас его применяют в качестве катализатора для роста мышц и для их страховки от повреждений. Компании, ранее выпускающие на рынок добавки для спортивного питания, рекомендовали «идеальное» соотношение лейцина, изолейцина и валина, равное 2:1:1. Однако в дальнейшем появились доказательства того, что лейцин является наиболее важной для наращивания мышечной массы аминокислотой, и с этих пор его популярность в качестве основного ингредиента биологически активных добавок существенно возросла. Лейцин мощно активирует рапамицин киназу у млекопитающих, которая, в свою очередь, регулирует рост клеток. После инфузии лейцина в головной мозг крыс благодаря активации пути МТор (мишени рапамицина в клетках) у них снижалось потребление пищи и вес тела. Токсичность Лейцина, заметная при валинолейцинурии, вызывает бред и неврологические нарушения и может быть опасна для жизни. В генах дрожжей, мутанты с дефектным геном, отвечающим за синтез лейцина (leu2), трансформируются плазмидой, содержащей рабочий ген синтеза лейцина (LEU2) и выращиваются на минимальной среде. Синтез лейцина является полезным селективным маркером.
В каких продуктах содержится лейцин
К пищевым источникам лейцина относятся (г/100 г):
Концентрат соевого белка 4,917
Соевые бобы, зрелые семена, сырые 2,97
Говядина, 1,76
Арахис 1,672
Салями, итальянская, свинина 1,63
Рыба, лосось, розовая, сырая 1,62
Зародыши пшеницы 1,571
Миндаль 1,488
Курица, бройлеры или цыплята, бедра, только мясо, сырые 1,48
Куриное яйцо, желток, сырой, свежий 1,40
Овес 1,284
Фасоль, бобы Пинто, приготовленные 0,765
Чечевица, приготовленная 0,654
Нут, приготовленный 0,631
Кукуруза, желтая 0,348
Молоко коровье, цельное, 3,25% молочного жира 0,27
Рис, коричневый, среднезерновой, приготовленный 0,191
Молоко человеческое 0.10
Химические свойства
Лейцин является аминокислотой с разветвленной цепью, поскольку имеет алифатическую боковую цепь, которая не является линейной. Для того, чтобы лучше понять происхождение биомолекулярной асимметрии, рацемический лейцин подвергался циркулярно поляризованному синхротронному излучению. Наблюдалось энантиомерное повышение на 2,6%, что указывает на возможное фотохимическое происхождение биомолекулярной гомохиральности.
Источники и структура
Источники
Лейцин (также известный как 2-амино-4-метилпентановая кислота) – важная аминокислота класса АРЦ (наряду с изолейцином и валином). Из этих трех аминокислот, лейцин является наиболее мощным активатором белка, известного как «мишень рапамицина в клетках» (его активация может положительно влиять на синтез протеина). Также лейцин - это исключительно кетогенная аминокислота 2), которая является катализатором кетоновых тел после процесса диссимиляции, тогда как валин – глюкогенная (катализатор глюкозы) аминокислота. Изолейцин, в свою очередь, имеет свойства обеих аминокислот. Лейцин иногда называют главной АРЦ. Это наиболее мощный стимулятор синтеза мышечного белка на молекулярном уровне, и также является кетогенным веществом (производит кетоны в процессе метаболизма).
Метаболизм
Лейцин обратимо метаболизируется в организме в первую очередь с помощью фермента аминотрансферазы разветвленной цепи (АТРЦ) в промежуточный продукт, известный как альфа-кетоизокапроат (КИК). КИК может метаболизироваться в несколько промежуточных продуктов, например, в β-гидроксиизовалерат (с помощью митохондриального фермента диоксигеназы КИК [3]), в изовалерил кофермент А (через дегидрогеназу альфа-кетокислот с разветвленной цепью (РЦKДГ), либо в гидроксиметилбутират моногидрат ( с помощью цитозольного фермента диоксигеназы КИК 3)). Последний этап метаболизма в гидроксиметилбутират моногидрат составляет примерно 5% потребляемого лейцина 4) и является единственным источником гидроксиметилбутират моногидрата в организме. Первый этап, который преобразовывает альфа-кетоизокапроат (КИК), в β- гидроксиизовалерат, также может трансформировать КИК в метаболит, известный как альфа-гидроксикапроновая кислота (лейциновая кислота или HICA). Лейцин метаболизируется в один из нескольких метаболитов, которые способствуют эффективному воздействию лейцина. Двое из них являются самостоятельными добавками (HMB (гидроксиметилбутират моногидрат) и HICA).
Фармакология
Механизм действия
Основной механизм действия лейцина – это активация мишени рапамицина (TOR), которая упоминается как «мишень рапамицина в клетках млекопитающих» (в частности, лейцин активизирует mTORC1, - одну из подгрупп комплекса 5)). Первый внутриклеточный мультимолекулярный сигнальный комплекс (mTORC1) состоит из нескольких белков: сам TOR, наряду с raptor (англ. regulatory-associated protein of TOR), белка GβL и PRAS40 (англ. proline-rich PKB/AKT substrate 40 kDa) 6). Этот комплекс активируется добавкой лейцина. Второй комплекс, содержащий такие белки, как rictor (англ. rapamycin-insensitive companion of TOR), protor (англ. protein observed with rictor), GβL, и белок, известный как mSin1 - от англ. mammalian stress-activated protein kinase (SAPK)-interacting protein 1, не активируется лейцином. TOR или mTOR - это белковый комплекс, который играет ключевую роль в регулировании клеточной связи. Лейцин способен активировать один из двух комплексов, в составе которых состоит, известного как mTORC1 (c1 понимают как «первый комплекс»). Сокращение «mTORC1» используется при упоминании mTOR, если не указано иное. Несмотря на то, что связь с помощью инсулинового рецептора может стимулировать mTOR (через 1 класс фосфоинозитол-3-киназы (PI3K) и серин-треониновой протеинкиназы Akt / РКВ, которые активируют Rheb (от англ. Ras homolog enriched in brain) и mTOR [8]), mTOR из лейцина возникает из-за белка, официально известного как белок вакуоли человека сортировки 34 (hVPS34), но иногда неофициально его называют PI3K класса 3 7). Деплеция hVPS34, как известно, снижает лейцин-индуцированную активацию mTOR, не препятствуя инсулин-индуцированной активации протеинкиназы В. Инкубация клетки с помощью лейцина активирует mTOR без активации протеинкиназы В 8), и это воздействие идентично общему увеличению содержания внутриклеточного кальция 9). Интересно, что лейцин, видимо, индуцирует активность mTOR посредством увеличения внутриклеточного кальция, так как увеличение кальция и связывание кальмодулина (белка, участвующего в гомеостазе кальция) с hVPS34 принципиально важно для лейцин-индуцированной активации mTOR. 10) Белок SHP-2 (тирозин фосфатазы) имеет решающее значение для синтеза мышечного белка 11) и, как известно, ограничивает рост мышц в периоды питательной депривации [18]. Он подает сигнал киназе рибосомного белка S6 (S6K1) посредством мобилизации внутриклеточного кальция в наивысшей точке фосфолипазы C гамма-4 и работает с помощью белка Rheb, который стимулирует mTOR. Белки Rheb, как известно, являются положительными модуляторами функций mTOR. 12) Лейцин и/или его метаболиты увеличивают внутриклеточный кальций, что похоже на мышечные сокращения. Увеличение кальция, в свою очередь, активирует белки типа mTOR, которые затем индуцируют синтез протеина в мышцах. В отличие от мышечных сокращений, данный процесс происходит во всех клетках и не только в скелетных мышцах. Другими словами, процесс происходит таким образом: SHP-2 (в настоящее время – самый дальний белок в цепи) → мобилизация кальция → связывание hVPS34 с кальмодулином → активация mTORC1 (возможно, с помощью Rheb) → активация S6K1 → синтез мышечного белка
Гипераминоацидемия
«Гипераминоацидемия» - это термин, используемый для обозначения избытка (гипер) аминокислот в крови (-emia), аналогично этому гиперлейцинемия означает избыток лейцина. Исследования показали, что у пожилых людей лейцин увеличивает синтез мышечного белка независимо от гипераминоацидемии, учитывая тот факт, что она сама по себе является независимым фактором синтеза мышечного белка. 13)
Продолжительность жизни
Сиртуин
 Белок сиртуин (от англ. Silent Information Regulator Transcript (SIRT) – это NAD+ зависимые ферменты, чувствительные к клеточному коэффициенту NAD + / NADH и, таким образом, к энергетическому статусу клетки. 14) Из них SIRT1 является гистондеацетилазой, которая может изменять сигнализацию ядерных белков p53 (транскрипционный фактор, регулирующий клеточный цикл), NF-kB (ядерный фактор «каппа-би») и FOXO (транскрипционный факторы семейства forkhead box класса О) 15) и может вызвать митохондриальный фактор биогенеза PGC-1α. 16) Считается, что активация SIRT1 (чаще всего ресвератрол) положительно влияет на продолжительность жизни.
Исследования на крысах показали, что лейцин обусловливает полезные свойства молочных белков, и это положительно сказывается на продолжительности жизни, укреплении здоровья и снижает риск преждевременной смерти 17). Результаты данных сыворотки крови пациентов, которые потребляли большое количество молочных продуктов, показали, что такая диета повышает активность SIRT1 на 13% (жировая ткань) и 43% (мышечная ткань).
Оба метаболита лейцина (альфа-кетоизокапроновая кислота и гидроксиметилбутират моногидрат (HMB) являются активаторами SIRT1 в диапазоне 30-100%, что сравнимо с эффективностью ресвератрола (2-10мкM), но требует более высокой концентрации (0,5 мМ). Было отмечено, что митохондриальный биогенез и инкубация лейцина происходит в жировых и мышечных клетках, а разрушение SIRT1 уменьшает (но не устраняет) лейцин-индуцированный митохондриальный биогенез.
Метаболиты лейцина способны стимулировать активность SIRT1, и этот механизм лежит в основе митохондриального биогенеза. Данный механизм имеет умеренную силу действия.
Белок сиртуин (от англ. Silent Information Regulator Transcript (SIRT) – это NAD+ зависимые ферменты, чувствительные к клеточному коэффициенту NAD + / NADH и, таким образом, к энергетическому статусу клетки. 14) Из них SIRT1 является гистондеацетилазой, которая может изменять сигнализацию ядерных белков p53 (транскрипционный фактор, регулирующий клеточный цикл), NF-kB (ядерный фактор «каппа-би») и FOXO (транскрипционный факторы семейства forkhead box класса О) 15) и может вызвать митохондриальный фактор биогенеза PGC-1α. 16) Считается, что активация SIRT1 (чаще всего ресвератрол) положительно влияет на продолжительность жизни.
Исследования на крысах показали, что лейцин обусловливает полезные свойства молочных белков, и это положительно сказывается на продолжительности жизни, укреплении здоровья и снижает риск преждевременной смерти 17). Результаты данных сыворотки крови пациентов, которые потребляли большое количество молочных продуктов, показали, что такая диета повышает активность SIRT1 на 13% (жировая ткань) и 43% (мышечная ткань).
Оба метаболита лейцина (альфа-кетоизокапроновая кислота и гидроксиметилбутират моногидрат (HMB) являются активаторами SIRT1 в диапазоне 30-100%, что сравнимо с эффективностью ресвератрола (2-10мкM), но требует более высокой концентрации (0,5 мМ). Было отмечено, что митохондриальный биогенез и инкубация лейцина происходит в жировых и мышечных клетках, а разрушение SIRT1 уменьшает (но не устраняет) лейцин-индуцированный митохондриальный биогенез.
Метаболиты лейцина способны стимулировать активность SIRT1, и этот механизм лежит в основе митохондриального биогенеза. Данный механизм имеет умеренную силу действия.
Взаимодействие с метаболизмом глюкозы
Усвоение глюкозы
Лейцин может способствовать активации инсулин-индуцированной протеинкиназы В (Akt), но для того чтобы сначала ослабить и ингибировать ее, необходима фосфоинозитол-3-киназа PI3K. Только так лейцин сохраняет инсулин-индуцированную активацию Akt). 18) Так как лейцин также стимулирует секрецию инсулина из поджелудочной железы (инсулин затем активирует PI3K), в сущности это не имеет практического значения. В условиях, когда инсулин отсутствует, 2 мМ лейцина и (в меньшей степени) его метаболит α-Кетоизокапроат, видимо, способствуют поглощению глюкозы через PI3K / aPKC (атипичная протеинкиназа С 19)) и независимо от mTOR (блокирование MTOR не влияет на производимый эффект). В этом исследовании стимуляция составляет лишь 2-2.5мМ для 15-45 минут (сопротивление вырабатывается при 60 мин) и по силе сопоставима с физиологическими концентрациями базального инсулина, но на 50% меньшей силой (100 нМ инсулина). Этот механизм действия аналогичен механизму действия изолейцина и имеет похожую силу. Тем не менее, лейцин также может помешать клеточному всасыванию глюкозы, что, как полагают, связано с активацией передачи сигнала mTOR, который подавляет сигнализацию АМФ-зависимой киназы (AMPK) 20) (сигнализация AMPK опосредует поглощение глюкозы в периоды низкой клеточной энергии и физических упражнений 21)) и действует вместе с сигнализацией mTOR, влияющей на киназу рибосомного белка S6 (S6K). Передача сигнала с помощью MTOR / S6K вызывает деградацию IRS-1 (первый белок, который несет «сигнал» инсулин-индуцированного эффекта), посредством активации протеасомной деградации IRS-1 или непосредственным связыванием с IRS-1. Это формирует негативную замкнутую систему управления с обратной связью сигнализации инсулина. 22) Минимизирование негативных последствий для IRS-1 способствует лейцин-индуцированному всасыванию глюкозы, и эта отрицательная обратная связь объясняет, почему глюкоза всасывается в течение 45-60 минут, а затем внезапно ингибируется. Так как изолейцин не так сильно влияет на активацию mTOR и, таким образом, это путь отрицательной обратной связи, именно изолейцин обеспечивает существенное всасывание глюкозы в мышечных клетках. Изначально лейцин способствует поглощению глюкозы в мышечных клетках в течение приблизительно 45 минут, а затем процесс резко прекращается, что несколько снижает общий эффект. Это внезапное прекращение является отрицательной обратной связью, что обычно происходит после активации MTOR. Изолейцин лучше, чем лейцин, содействует поглощению глюкозы из-за меньшей активации mTOR.
Секреция инсулина
Лейцин способен индуцировать секрецию инсулина из поджелудочной железы с помощью своего метаболита КИК. Это выделение инсулина подавляется другими АРЦ и двумя подобными аминокислотами: норвалином и норлейцином. Лейцин участвует в индукции секреции инсулина либо как добавка, либо в комбинации с глюкозой (например, при приеме лейцина и глюкозы соответственно наблюдается увеличение на 170% и на 240%, а при приеме комбинации наблюдается увеличение до 450%). Несмотря на сопоставимый потенциал лейцина и йохимбина, они не сочетаются из-за их параллельных механизмов действия. 23) Лейцин, как известно, стимулируют секрецию инсулина из поджелудочной железы и поэтому является самой сильной АРЦ. На эквимолярной основе (такой же концентрации молекулы внутри клетки), лейцин имеет примерно такую же силу, как йохимбин, и две трети потенциала глюкозы. Лейцин является положительным аллостерическим регулятором глутаматдегидрогеназы (GDH), 24) – фермента, который может преобразовать некоторые аминокислоты в кетоглутарат (α-кетоглутарат). Это увеличивает клеточную концентрацию АТФ (по отношению к АДФ). Увеличение уровня концентрации АТФ вызывает увеличение секреции инсулина посредством механизмов, которые не зависят от активации mTOR. 25) Метаболит KIC может подавлять KATФ каналы и вызывать колебания кальция 26) в панкреатических бета-клетках. Выделение кальция может также воздействовать на mTOR (стандартная цель лейцина), а активация mTOR может подавлять экспрессию α2A рецепторов. Так как α2A рецепторы подавляют секрецию инсулина при активации 27), а избыточная экспрессия индуцирует диабет, 28) меньшая экспрессия этих рецепторов вызывает относительное увеличение секреции инсулина. Такой путь, вероятно, наиболее важный с практической точки зрения, так как mTOR антагонист рапамицина может отменить лейцин-индуцированную секрецию инсулина и подавить саму секрецию инсулина. 29) Чтобы стимулировать секрецию инсулина из панкреатических бета-клеток, лейцин работает двумя путями, основным из которых является уменьшение влияния негативного регулятора (2а-рецепторов). Снижение влияния отрицательного регулятора вызывает не поддающееся лечению увеличение активности.
Лейцин в бодибилдинге
Синтез белка
Основной механизм действия лейцина – это стимуляция активности mTOR 30), а затем – стимуляция активности киназы p70S6 через PDK1 31). Киназа p70S6 затем положительно регулирует синтез протеина. Кроме того, лейцин способен индуцировать активность эукариотического фактора инициации (eIF, в частности, eIF4E) и подавляет его ингибирующий связывающий белок (4E-BP1), который повышает трансляцию белка 32), что было подтверждено после перорального приема лейцина. Модуляция eIF, таким образом, усиливает синтез белка мышц, вызванный киназой p70S6. Активация mTOR – это общеизвестный анаболический путь, действие которого связанно с выполнением физических упражнений (активация с 1-2 часовой задержкой по времени), 33) инсулином 34) и избытком калорий. 35) Как и другие АРЦ, но в отличие от инсулина, лейцин не стимулирует активность протеинкиназы В (Akt / РКВ), которая происходит между рецептором инсулина и mTOR, (Akt и протеинкиназа B / PKB являются взаимозаменяемыми терминами). 36) Akt способен усиливать eIF2B, что также положительно способствует синтезу белка в мышцах, вызванному киназой p70S6 и, судя по недостаточной активации Akt с помощью лейцина, является теоретически не такой сильной, как если бы сигнализация Akt активировалась так же, как инсулин. Активация mTOR с помощью лейцина в организме человека была подтверждена после перорального приема добавок, а также активации киназы p70S6K. Исследования активации Akt не смогли выявить каких-либо изменений в функциональности человеческих мышц, и это подразумевает, что высвобождение инсулина из поджелудочной железы, вызванное лейцином (данный процесс происходит в организме человека 37), а активация Akt происходит с помощью инсулина), не могут быть актуальны. Лейцин способен стимулировать активность mTOR и его последующую сигнализацию синтеза белка. Хотя Akt / PKB положительно влияет на активность mTOR (поэтому, когда активирована Akt, она активизирует mTOR), лейцин может воздействовать другим путем и активизирует mTOR, не влияя на Akt. Несмотря на это, все, что активизирует mTOR, будет также влиять на киназу p70S6, а затем и на синтез белка в мышцах. Этот анаболический эффект лейцина имеет большее влияние на скелетные мышцы, чем на ткань печени 38); физические упражнения (мышечные сокращения) дополняют его полезное воздействие. Согласно некоторым исследованиям, прием лейцина перед тренировкой является более эффективным, чем прием в другое время (для резкого увеличения синтеза белка). 39) Лейцин – наиболее сильная из всех аминокислот в стимулировании синтеза мышечного белка.
Атрофия / Катаболизм
Лейцин, как известно, способствуют синтезу белка мышц при низких концентрациях в лабораторных условиях, при приеме в более высоких концентрациях лейцин может ослабить атрофию мышц, даже несмотря на остановку скорости синтеза. Этот эффект сохраняется в мышцах и был отмечен при болезнях, оказывающих негативное влияние на мышцы, таких как рак, а также сепсис, ожоги и травмы. В этих случаях преимущества приема зависят от дозы.40)
Гипераминоацидемия
Гипераминоацидемия – это термин, используемый для обозначения избытка (гипер) аминокислот в крови (-emia), аналогично этому, гиперлейцинемия означает избыток лейцина. Исследования показали, что у пожилых людей лейцин увеличивает синтез мышечного белка независимо от гипераминоацидемии.
Саркопения
Саркопения характеризуется снижением содержания белка и увеличением содержания жира в скелетных мышцах, которое происходит с возрастом. Одной из причин возникновения саркопении является уменьшение метаболической реакции на сохранение мышечного эффекта L-лейцина, что возникает с клеточным старением. Негативное воздействие этого эффекта можно минимизировать путем добавления L-лейцина к продуктам, содержащим белок. 41)
Взаимодействие с питательными веществами
Карбогидрат (углевод)
Когда рецептор инсулина активирован, он может активировать mTOR косвенно через Akt. 42) В то время как Akt положительно влияет на синтез белка, вызванный киназой S6K1 (которая активируется во время активации mTOR), добавка лейцина напрямую не влияет на активацию Akt, как это делает инсулин в лабораторных условиях. Было отмечено, что инфузия лейцина у людей существенно не влияет на активацию Akt в скелетных мышцах, т.е., секреция инсулина, индуцированная лейцином, недостаточна для стимулирования Akt. Лейцин взаимодействует с усвоенной глюкозой и снижает уровень глюкозы в крови и затем влияет на секрецию инсулина из поджелудочной железы. 43) Интересно, что лейцин не сочетается с йохимбином в индукции секреции инсулина из-за параллельных механизмов действия. Лейцин взаимодействует с пищевыми углеводами и влияет на активность секреции инсулина из поджелудочной железы, а также взаимодействует с инсулином, что влияет на синтез мышечного белка.
Ресвератрол
 Ресвератрол – фенольное вещество, которое, как известно, взаимодействует с сиртуином (главным образом с SIRT1), который идентичен лейцину. Метаболиты KIC и НМВ массой в 0,5 мМ могут индуцировать SIRT1 в 30-100% от исходного уровня, который сопоставим с активностью ресвератрола в 2-10 мкм. Это несмотря на то, что комбинация лейцина (0,5 мМ) или HMB (0,5 мкм) и ресвератрола (200 нм) способна синергически индуцировать активность SIRT1 и SIRT3 в адипоцитах (жировых клетках) и скелетных мышечных клетках 44). KIC - это более мощный стимулятор, чем HMB, и лучше взаимодействует с лейцином, чем с HMB (возможно, это указывает на метаболизм KIC).
Когда крысам дают смесь лейцина (24 г / кг, до 200% главной диеты) или HMB (2 или 10 г / кг) с ресвератролом (12,5 или 225 мг / кг), а затем умерщвляют натощак, наблюдается уменьшение жировой массы и веса тела, также синергично.
Было отмечено, что инкубация ресвератрола с лейцином или HMB фактически увеличивает активность АМФ-зависимой киназы (42-55%, соответственно) и способствует небольшому (18%) увеличению окисления жиров, несмотря на инкубацию 5 мкм глюкозы.
Взаимодействие ресвератрола и лейцина (в состоянии инкубации или при приеме внутрь) посредством активации SIRT1 положительно влияет на митохондриальный биогенез.
Ресвератрол – фенольное вещество, которое, как известно, взаимодействует с сиртуином (главным образом с SIRT1), который идентичен лейцину. Метаболиты KIC и НМВ массой в 0,5 мМ могут индуцировать SIRT1 в 30-100% от исходного уровня, который сопоставим с активностью ресвератрола в 2-10 мкм. Это несмотря на то, что комбинация лейцина (0,5 мМ) или HMB (0,5 мкм) и ресвератрола (200 нм) способна синергически индуцировать активность SIRT1 и SIRT3 в адипоцитах (жировых клетках) и скелетных мышечных клетках 44). KIC - это более мощный стимулятор, чем HMB, и лучше взаимодействует с лейцином, чем с HMB (возможно, это указывает на метаболизм KIC).
Когда крысам дают смесь лейцина (24 г / кг, до 200% главной диеты) или HMB (2 или 10 г / кг) с ресвератролом (12,5 или 225 мг / кг), а затем умерщвляют натощак, наблюдается уменьшение жировой массы и веса тела, также синергично.
Было отмечено, что инкубация ресвератрола с лейцином или HMB фактически увеличивает активность АМФ-зависимой киназы (42-55%, соответственно) и способствует небольшому (18%) увеличению окисления жиров, несмотря на инкубацию 5 мкм глюкозы.
Взаимодействие ресвератрола и лейцина (в состоянии инкубации или при приеме внутрь) посредством активации SIRT1 положительно влияет на митохондриальный биогенез.
Цитруллин
Цитруллин может восстанавливать скорость синтеза мышечного белка 45) и мышечную функцию 46) в процессе старения и плохого питания у крыс, что опосредуется через путь mTORC1 и разрушается ингибитором mTORC1, известным как рапамицин). 47) Не удалось значительно изменить скорость окисления лейцина или синтеза белка организма человека с помощью добавки 0,18 г / кг цитруллина в течение недели, но в других случаях та же доза улучшает баланс азота в организме человека в сытом состоянии. 48) Причина такого расхождения неизвестна. Существует не так уж много доказательств прямого активирующего воздействия цитруллина на mTOR, но он слабо индуцирует белки после активации mTOR (в том числе 4E-BP1) до уровня ниже лейцина. Клинически пока не доказано то, что цитруллин повышает сигнализацию mTOR, поскольку его преимущество зависит от mTOR, и в этом случае цитруллин должен быть синергичен с лейцином. Цитруллин может передавать сигналы лейцина через mTOR, что даёт основания предположить, что они синергичны. Еще не исследован эффект от применения этой смеси тяжелоатлетами, так что синергизм в настоящее время – это только неподтвержденная гипотеза.
Безопасность и токсичность
В небольшом исследовании, в котором 5 здоровых человек ступенчато принимали до 1,250 мг/кг лейцина (что в 25 раз превышает ожидаемую среднюю потребность организма в лейцине), было отмечено, что пероральный прием дозы в 500-1,250 мг вызывал увеличение в сыворотке аммиака, из-за чего верхний ограничительный порог был установлен на уровне в 500 мг / кг (для человека весом в 150 фунтов (68 кг) - 34 г) [93].
Пищевая добавка
Как пищевая добавка, L-лейцин имеет Е номер E641 и классифицируется как усилитель вкуса.
Доступность:
L-лейцин является аминокислотой для парентерального питания. Отпускается из аптек по рецепту врача.
:Tags
Читать еще: Булимия , Гистамин , Моринга масличная , ДСИП (DSIP) - пептид дельта-сна , Японский горец ,










