Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Халостачин
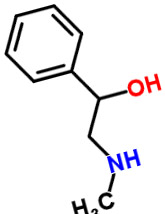 Халостачин (также известный как N-метилфенилэтаноламин) является натуральным алкалоидом, впервые выделенным из азиатского кустарника Halostachys caspica (синоним Halostachys belangeriana). Структурно вещество является β-гидрокси-фенилэтиламином (фенилэтаноламином), связанным со своим более известным «родственником» биогенным амином фенилэтаноламином, с адренергическим препаратом синефрином, а также с алкалоидом эфедрином. По фармакологическим свойствам Халостачин имеет некоторое сходство со структурно родственными соединениями, а экстракты Halostachys caspica входят в состав некоторых безрецептурных пищевых добавок, однако сам Халостачин никогда не был разработан в качестве лекарственного средства. Хотя вещество встречается в природе в виде отдельного стереоизомера, в виде синтетического продукта Халостачин обычно доступен в виде его рацемата. По внешнему виду халостачин представляет собой бесцветное твердое вещество.
Халостачин (также известный как N-метилфенилэтаноламин) является натуральным алкалоидом, впервые выделенным из азиатского кустарника Halostachys caspica (синоним Halostachys belangeriana). Структурно вещество является β-гидрокси-фенилэтиламином (фенилэтаноламином), связанным со своим более известным «родственником» биогенным амином фенилэтаноламином, с адренергическим препаратом синефрином, а также с алкалоидом эфедрином. По фармакологическим свойствам Халостачин имеет некоторое сходство со структурно родственными соединениями, а экстракты Halostachys caspica входят в состав некоторых безрецептурных пищевых добавок, однако сам Халостачин никогда не был разработан в качестве лекарственного средства. Хотя вещество встречается в природе в виде отдельного стереоизомера, в виде синтетического продукта Халостачин обычно доступен в виде его рацемата. По внешнему виду халостачин представляет собой бесцветное твердое вещество.
Происхождение
Естественно встречающийся Халостачин был впервые обнаружен Syrneva в солончаковом растении соляноколосник, или Halostachys caspica (переклассифицированный в Halostachys belangeriana) (семейство Amaranthaceae). Ошибочная информация о структуре соединения была впоследствии переработана и исправлена Меншиковым и Рубинштейном. Халостачин также содержится в таких растениях, как пастбищный райграс, плевел многолетний и овсяница тростниковая, Festuca arundinacea. Наличие N-метилфенилэтаноламина в головном мозге крыс предполагалось в экспериментах, описанных Сааведром и Аксельродом.
Химия
Синтез
Известно о нескольких способах синтеза рацемического N-метилфенилэтаноламина. О синтезе с использованием «классической» методологии с ацетофеноном написал Дерден и его сотрудники. Метильную группу ацетофенона бромировали бромом, в результате чего создавался α-бромацетофенон, который затем подвергали взаимодействию с N-метилбензиламином, создавая амино-кетон. Амино-кетон восстанавливали алюмогидридом лития в соответствующий амино-спирт. N-бензильную группу, наконец, удаляли каталитическим гидрированием с использованием палладия на угле в качестве катализатора. Другой синтез, описанный Нордландером и сотрудниками, начинается с ацилирования Фриделя-Крафтса бензола при помощи N-(трифторацетил) глицил хлорида в присутствии хлорида алюминия. Полученный N-(трифторацетил)-α-аминоацетофенон затем подвергался N-метилированию с метилиодидом и карбонатом калия, и полученный продукт наконец преобразовывался в рацемический N-метилфенилэтаноламин с помощью боргидрида натрия в этаноле. Эффективный, стереоспецифический синтез Халостачина описывают Zandbergen и сотрудники: (R)-(+)-α-гидроксибензенацетонитрил вначале O-защищали с использованием 2-метоксипропена. Продукт затем обрабатывали с помощью DIBAL, и неизолированный имин затем последовательно обрабатывали бромидом аммония и метиламином, чтобы осуществить «трансаминирование». Полученный N-метиламин превращался в (R)- (-)- α - [(метиламино) метил] бензолметанол.
Свойства
Химически, N-метилфениэтаноламин является ароматическим соединением, амином и спиртом. Наличие аминогруппы делает это соединение слабым основанием, способным вступать в реакции с кислотами с образованием солей. Одной из распространенных солей N-метилфениэтаноламина является (рацемический) гидрохлорид, C9H13NO.HCl, пл. 103-104 ° С. Значение РКа гидрохлорида N-метилфениэтаноламина, при 25 ° С и при концентрации 10 мМ, равно 9,29. Наличие гидрокси-группы на бензильном C молекулы N-метилфениэтаноламина создает хиральный центр, таким образом, соединение существует в виде двух энантиомеров, d- и l-N- метилфениэтаноламина, или в виде рацемической смеси, d, l - N- метилфениэтаноламина. Правовращающий изомер соответствует S-конфигурации, а левовращающий изомер – R-конфигурации. N-метилфениэтаноламин, выделенный из растения Halostachys caspica (халостачин), является левовращающим энантиомером. «Естественный» халостачин имеет т.пл. 43-45°C, и [α] D = -47.03°; гидрохлорид этого энантиомера имеет т.пл. 113-114 ° C, и [α] D = -52,21°. Разделение синтетического рацемического N- метилфениэтаноламина с помощью его тартрат солей, создает энантиомеры со специфическими вращениями [α] D = - 52,46° и + 52,78°.
Фармакологическая группа: алкалоиды; фенилэтаноламины
ИЮПАК наименование: (R) - (-)- α -[(метиламино) метил] - бензолметанол
Другие названия: N-метилфенилетаноламид; 1-гидрокси-1-фенил-2- метиламиноэтан; α-(метиламинометил) бензиловый спирт; 2-метиламино-1- фенилэтанол
Молекулярная формула: C9H13NO
Молярная масса: 151,21 г моль-1
Внешний вид: бесцветное твердое вещество
Температура плавления: 43-45 ° С (R - или S- энантиомер); 75-76 ° C (рацемат)
Фармакология
Первое фармакологическое исследование синтетического рацемического N- метилфениэтаноламина (метилфениэтаноламина) было проведено Баргером и Дейлом, которые выяснили, что соединение является прессорным амином, с потенциалом, близким к фениэтаноламину и β-фенилэтиламину у кошек. Впоследствии это соединение (также в виде его рацемата) изучалось более тщательно Ченом и сотрудниками, которые подтвердил его прессорную активность, но заметили, что соединение обладает только половиной активности фениэтаноламина, после внутривенного введения кошкам. Общая доза 5 х 10-6 М (или ~ 1 мг соли HCl) вызывала максимальное повышение кровяного давления до 26 мм рт. Дополнительные эксперименты этих исследователей показали, что рацемический N- метилфениэтаноламин также вызывает расширение зрачка в глазу у кролика (инстилляция капли 0,05 М/л раствора производила приблизительно в 5 раз большее расширение, чем такая же доза фениэтаноламина), ингибирование изолированных полос кишечника кролика и сокращение изолированной матки морской свинки. Препарат также оказывал вяжущее действие на слизистую оболочку носа. У человека прием пероральной дозы 50 мг не оказывает никакого влияния на кровяное давление. Более поздние исследования воздействия рацемического N-метилфениэтаноламина на кровяное давление у интактных собак, проведенные Лэндсон и Грантом, показали аналогичные результаты с результатами, полученными Чэнь и др. 0,41 мг / кг препарата, при внутривенном применении, вызвали повышение артериального давления на 38 мм РТ. в течение 3-10 минут. Этот эффект был равен ~ 1/200 х от такой же дозы адреналина (или ~ 1/250 х при сравнении на молярной основе). У овец халостачин вызывает лишь небольшое расширение зрачка в дозе 30 мг / кг, внутривенно, и «возбуждение» в дозе 100 мг / кг; у морских свинок дозы 30 мг / кг внутрибоюшинно вызывали беспокойство, длящееся в течение 1/2 часа; а дозы 100 мг / кг внутрибрюшинно вызвали волнение, мидриаз, слюноотделение, пилоэрекцию, мышечное дрожание и увеличение сердечных сокращений и скорость дыхания. Состояние нормализовалось после 1/2-2 часов. Более поздние исследования N-метилфениэтаноламина (предположительно в виде рацемата), проведенные Шенноном и сотрудниками, подтвердили и дополнили результаты более ранних исследований. Внутривенное введение препарата собакам в дозах ~ 6 - 18 мг / кг вызывало значительное расширение зрачка (100%-е увеличение диаметра зрачка при дозе 17,5 мг / кг); эффект был более выражен (~ 1,3 х), чем при приеме тех же доз фениэтаноламина. N-метилфениэтаноламин также вызывает уменьшение частоты сердечных сокращений в обратной зависимости от дозы (т.е. более высокие дозы вызывают меньшую степень брадикардии), меньшее, чем при тех же дозах фениэтаноламина. Препарат вызывает снижение температуры тела, что также отрицательно коррелирует с дозой, и выражено меньше, чем при применении тех же доз фениэтаноламина. Дополнительные симптомы включают обильное слюноотделение и пилоэрекцию (образование «гусиной кожи»), хотя, в отличие от фениэтаноламина, N-метилфениэтаноламин не вызывает никаких стереотипных или быстрых движений глаз. Эти результаты привели авторов к предположению, что N-метилфениэтаноламин действует как на α, так и на β-адренорецепторы. Использование β2 адренергических рецепторов, полученных из трансфицированной клетки НЕК 293, Liappakis и коллеги установили, что в рецепторах дикого типа, рацемический N-метилфениэтаноламин (названный этими авторами как «халостачин») имел ~ 1/120 х от сродства адреналина в конкурентных экспериментах с 3 [H]- CGP-12177, и был поэтому приблизительно в 3 раза более мощным, чем сам фениэтаноламин. Измерения накопления цАМФ в неповрежденных трансфектированных клетках НЕК 293, после обработки ЭЭДХ для инактивации 98 -99% рецепторов, показало, что «халостачин» был на ~ 19% столь же эффективным, как эпинефрин в максимальном стимулировании накопления цАМФ в рецепторах дикого типа. «Халостачин», таким образом, рассматривался как вещество, имеющее свойства частичного агониста на β2-рецепторах.
Фармакодинамика
Фармакокинетика N-метилфениэтаноламина, после внутривенного применения у собак, изучалась Шенноном и коллегами, которые обнаружили, что препарат следовал «двухкамерной модели», с Т1 / 2 (α) ≃ 9.7 минуты и T1 / 2 (β) ≃ 56,4 минут; «полураспад в плазме» N-метилфениэтаноламина составлял около 1 часа.
Биохимия
 В животной ткани N-метилфениэтаноламин формируется под действием фермента фениэтаноламин N-метилтрансферазы (PNMT), впервые выделенным из надпочечников обезьян Юлием Аксельродом.
Действие моноаминоксидаз МАО-А и МАО-В из митохондрий головного мозга крыс на N-метилфениэтаноламин было описано Осаму и коллегами, которые обнаружили, что при концентрации 10 мкМ, это соединение (стереохимическая идентичность не указана) было специфическим субстратом для МАО-В, но при 100 мкМ и 1000 мкм – как для МАО-А, так и для МАО-В. Кинетическими константами, представленными этими исследователями, были: Км = 27,7 мкМ; Vmax = 3,67 нМ / мг белок/30 минут (с высоким сродством), и Кт = 143 мкм; Vmax = 7,87 нМ / мг белок/30 минут (низкое сродство).
В животной ткани N-метилфениэтаноламин формируется под действием фермента фениэтаноламин N-метилтрансферазы (PNMT), впервые выделенным из надпочечников обезьян Юлием Аксельродом.
Действие моноаминоксидаз МАО-А и МАО-В из митохондрий головного мозга крыс на N-метилфениэтаноламин было описано Осаму и коллегами, которые обнаружили, что при концентрации 10 мкМ, это соединение (стереохимическая идентичность не указана) было специфическим субстратом для МАО-В, но при 100 мкМ и 1000 мкм – как для МАО-А, так и для МАО-В. Кинетическими константами, представленными этими исследователями, были: Км = 27,7 мкМ; Vmax = 3,67 нМ / мг белок/30 минут (с высоким сродством), и Кт = 143 мкм; Vmax = 7,87 нМ / мг белок/30 минут (низкое сродство).
Токсичность
Полулетальная доза N-метилфениэтаноламина у мышей, как сообщается, была равна 44 мг / кг внутривенно, и ~ 140 мг / кг внутрибрюшинно (рацемический; гидрохлорид). В более ранней работе того же года, Лэндс отмечает, что полулетальная доза вещества равнялась 490 мг / кг (мыши, внутрибрюшинно). Минимальная летальная доза рацемата у кроликов внутривенно равнялась 100 мг / кг. Были проведены исследования того, может ли халостачин отвечать за «райграссовые шатания» (нейромышечное заболевание пастбищных сельскохозяйственных животных, возбудителем которой являются алкалоиды, образующиеся при определенных погодных условиях в райграсе) в Австралии при приеме в дозах до 100 мг / кг, внутривенно у овец и 100 мг / кг, внутрибрюшинно, у морских свинок, без указания летальности. Хотя у морских свинок проявлялись адренергические эффекты, исследователи пришли к выводу, что маловероятно, что халостачин вызывает «райграссовые шатания».
:Tags
Читать еще: Гамма-валеролактон , Гиалуроновая кислота , Предменструальное дисфорическое расстройство , Хинаголид , Целебрекс (Целекоксиб) ,










