Содержание
7,8-дигидроксифлавон (7,8-ДГФ)
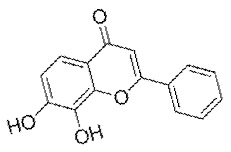 7,8-ДГФ представляет собой синтетический флавоноид, который может достигать мозга и активировать рецептор (TrkB), который способствует росту нейронов. Некоторые данные исследований на животных свидетельствуют о том, что 7,8-ДГФ может оказывать положительное воздействие на когнитивные и моторные функции и может быть ноотропом, однако на сегодняшний день не существует доказательств его воздействия на человека.
7,8-ДГФ представляет собой синтетический флавоноид, который может достигать мозга и активировать рецептор (TrkB), который способствует росту нейронов. Некоторые данные исследований на животных свидетельствуют о том, что 7,8-ДГФ может оказывать положительное воздействие на когнитивные и моторные функции и может быть ноотропом, однако на сегодняшний день не существует доказательств его воздействия на человека.
Резюме
7,8-дигидроксифлавон (7,8-ДГФ) является синтетическим флавоноидом, который первоначально был обнаружен в ходе поиска небольших молекул, которые могут активировать конкретный рецептор, известный как тропомиозин-связанная киназа В (TrkB), поскольку пептид, производимый в организме человека, который действует на этот рецептор, называемый нейротрофическим фактором головного мозга (BDNF), не может использоваться из-за плохого всасывания в мозг. 7,8-ДГФ воздействует на TrkB аналогичным образом. Это означает, что 7,8-ДГФ теоретически может вызывать подобные BDNF эффекты в мозгу, и в теории является более терапевтически полезным из-за его лучшей абсорбции и способности проникать через гематоэнцефалический барьер. Активация рецептора TrkB, как правило, способствует росту нейронов и увеличивает их способность к защите. Как правило, увеличиваются дендриты нейрона, которые достигают синапса и связываются с другими нейронами. 7,8-ДГФ способен стимулировать рост этих дендритов и обеспечивать их попадание в синапс, что способствует восстановлению связь между нейронами в животных модели когнитивных нарушений (исследовались болезнь Альцгеймера и старение). Некоторые другие добавки, такие как Бакопа Монье и истод тонколистный, как правило, активируют этот рецептор, высвобождая BDNF в головном мозге. Существует возможный ноотропный потенциал при использовании этого флавоноида у в остальном здоровых испытуемых, однако данные о когнитивных преимуществах у когнитивно нездоровых грызунов могут плохо коррелировать с данными, которые могут быть получены при изучении здоровых субъектов. Доказательства, подтверждающие пользу ДГФ касательно улучшения когнитивных функций у здоровых грызунов, являются смешанными, а исследований на человеке проведено не было. Благодаря тому, что 7,8-ДГФ является простым и эффективным активатором TrkB, который может пересекать гематоэнцефалический барьер, вероятно, будут продолжаться исследования его ноотропного потенциала.
ДГФ: инструкция по применению
На сегодняшний день, не было проведено исследований 7,8-ДГФ на людях, поэтому неизвестно, в каких дозах это вещество следует принимать. Все оценочные данные были математически приближены к данным из исследований на грызунах. Однако, в большинстве исследований на грызунах использовались внутривенные инъекции, и имеется ограниченное количество исследований с использованием данного вещества перорально. При пероральном применении также наблюдались определенные эффекты. Исследования на крысах показали, что: * Доза 5 мг / кг является эффективной при приеме у когнитивно нездоровых мышей (длительное применение) * Доза 10 мг / кг является эффективной у когнитивно здоровых крыс (средняя продолжительность использования) * Доза 30 мг / кг у мышей является эффективной при кратковременном применении Эти дозировки приблизительно соотносятся с дозами 1 мг / кг при средней или длительной продолжительности использования у человека, при этом при краткосрочном приеме дозировка должна составлять приблизительно 2,5 мг / кг.
Источники и состав
Источники и структура
7,8-дигидроксифлавон (7,8-ДГФ) является флавоноидом, который не так давно привлек внимание научного сообщества, в основном, благодаря результатам исследования по поиску небольших молекул с нейротрофическими свойствами, аналогичными свойствам нейротрофического фактора головного мозга (BDNF). 1) В этом исследовании было показано, что 7,8-ДГФ является сильным активатором сигнального пути BDNF, предотвращающим апоптоз нейрональных клеток in vitro и демонстрирующим сильное нейропротекторное действие на мышиных моделях. Нейротрофические свойства 7,8-ДГФ сильно зависят от 7,8-катехинового сегмент молекулы.
Молекулярные мишени
TrkB
7,8-ДГФ наиболее хорошо известен как прямой лиганд рецептора тропомиозин-связанной киназы В (TrkB) и был первоначально обнаружен в ходе скринингового исследования подходящих малых молекул, которые активируют этот рецептор. В последующих исследованиях это соединение использовалось в ряде исследований, демонстрирующих воздействие соединения на различные когнитивные показатели в животных моделях. 2) TrkB обычно активируется пептидом, известным как мозговой нейротрофический фактор (BDNF), и после активации способствует выживанию и росту нейронов. 3) 7,8-ДГФ может имитировать эти действия с высокой эффективностью (Кд 1 нМ для ДНФ в сравнении с 320 нМ для 7,8-ДГФ), а также посредством связывания и активации TrkB. Следует отметить, что 7,8-ДГФ также способен пересекать гематоэнцефалический барьер при введении в периферию на животных моделях, что не способен делать сам BDNF. Воздействие 7,8-ДГФ на рецептор TrkB зависят от 7,8-катехиновой части молекулы. Добавление гидроксильной группы в положении 3' потенциирует связывание с TrkB, так как 7,3'-дигидроксифлавон и 7,8,3'-тригидроксифлавон оказываются более мощными in vitro.
PI3K/Akt
Было отмечено, что 7,8-ДГФ увеличивает экспрессию антиоксидантного белка Nrf2, что ниже по потоку передачи сигналов PI3K/Akt. 4) Nrf2 связывается и активирует элемент антиоксидантного ответа (ARE), последовательность ДНК, которая воздействует на антиоксидантные гены, в том числе антиоксидантный белок гемоксигеназы 1 (HO-1). Было показано, что 7,8-ДГФ индуцирует экспрессию HO-1 в некоторых клетках, а также индуцирует 8-оксогуанин ДНК гликозилазу-1 (OGG1) в манере, зависимой от PI3K/Akt. 5) Точный механизм, посредством которого 7,8-ДГФ активирует сигнализацию PI3K/Akt, пока не известен; в то время как PI3K/Akt может быть активирован в нейронах вторично по отношению к TrkB, 7,8-ДГФ также продемонстрировал антиоксидантный эффект в клетках, которые не экспрессируют этот рецептор (клетки PC12 и HT-22). 6) Предполагается, что 7,8-ДГФ может активировать сигнализацию Akt с помощью TrkB зависимых и независимых механизмов.
Фармакология
Абсорбция
Некоторые исследования, в ходе которых делались попытки оптимизировать эффекты 7,8-ДГФ через структурные изменения, отметили, что, в то время как 7,8-ДГФ является перорально биодоступным у мышей, он подвержен значительному метаболизму первого прохода. 7) В то время как плохое усвоение является свойством, присущим флавоноидам, исследования, измеряющие конкретные пероральные фармакокинетические параметры 7,8-ДГФ, по-видимому, не были проведены.
Неврологическое распределение
Периферийные инъекции 7,8-ДГФ (5мг/кг) у мышей могут активировать TrkB в головном мозге. Предположительно, вещество способно пересекать гематоэнцефалический барьер.
Фаза II метаболизма
Было отмечено, что 7,8-ДГФ оказывает ингибирующее действие на эстроген сульфотрансферазу in vitro с Ки 1-3 мкм, то есть, с незначительно более слабым потенцилом, чем некоторые другие тестируемые флавоноиды. 8) 7,8-ДГФ проявляет ингибирующие действие на альдегиддегидрогеназе 2 с Ки от 35 мкм.
Неврология
Нейрогенез
Тропомиозин связанная киназа В (TrkB) представляет собой рецептор, который реагирует на фактор роста нервов, известный как мозговой нейротрофический фактор (BDNF), который способствует росту и защите нейронов после активации. TrkA является аналогичным рецептором, который реагирует на нейронный фактор роста (NGF). 9) Флавоноиды в целом, как известно, взаимодействуют с нейронами, стимулируя их рост. 7,8-ДГФ, в частности, продемонстрировал защитное действие против апоптоза, с полумаксимальной эффективной концентрацией 35 нм, что более эффективно по отношению к флавоноидам катехин (100 нМ), пиноцембрин (100 нМ) и диосмерин (500 нМ). Это было вторичным по отношению к активации TrkB. Вещество не активирует TrkA и не требует наличия BDNF. Степень активации была сравнима с BDNF при испытании в лабораторных условиях. Данные о влиянии 7,8-ДГФ на экспрессию рецептора TrkB являются смешанными. В одном исследовании было показано, что 7,8-ДГФ не влияет на экспрессию рецептора TrkB, несмотря на то, что он вызывал активацию этого рецептора в мышиной модели болезни Альцгеймера при пероральном приеме в дозе 5 мг / кг в течение более четырех месяцев. С другой стороны, еще одно исследование с использованием этой же мышиной модели болезни Альцгеймера (5XFAD) показало увеличение общего количества рецепторов TrkB через 10 дней (инъекции в дозе 5 мг / кг), в то время как у диких мышей, которым давали 7,8-ДГФ, наблюдалась статистически незначительная тенденция к снижению общего содержания TrkB. 10) Снижение общего количества TrkB, наблюдаемое у диких мышей, связано с увеличением активного (фосфорилированного) TrkB без существенных изменений в концентрациях BDNF. При испытании в лабораторных условиях, доза 500 нм 7,8-ДГФ при приеме в течение трех дней способствовала дендритному разветвлению и формированию синапса, увеличению длины дендритов, размера синапса и плотности примерно на 50%. 11) BDNF (путем активации TrkB), как известно, способствует росту дендритов позвоночника, что наблюдалось в естественных условиях у больных мышей. В ответ на воздействие 7,8-ДГФ увеличивается только плотность дендритов, а не общее количество аксонов. При испытании на модели болезни Альцгеймера, индуцированной воздействием скополамина, инъекции 7,8-ДГФ (1 мг / кг) восстанавливали возбудительный постсинаптический потенциал (fEPSP) до контрольного уровня, что указывает на восстановление синаптической передачи. В трансгенной модели болезни Альцгеймера, когда селективно уничтожаются клетки гиппокампа (CaM/Tet-DTA мыши), 7,8-ДГФ продемонстрировал восстановительное действие на синаптическую плотность при введении инъекций в дозе 5 мг/кг, затрагивающее только поврежденные нейроны. В то время как 7,8-ДГФ проявил восстановительное действие у 19% этих мышей, авторы не заметили какого-либо влияния на синаптическую плотность у здоровых контрольных мышей. 7,8-ДГФ способствуют регенерации поврежденных периферических нервов и двигательных нейронов in vitro (500 нМ) вторично по отношению к воздействию на TrkB.
Нейроокисление
Инкубация 7,8-ДГФ в клетках РС12 связана с защитными эффектами против окислительного стресса (6-OHDA), несмотря на то, что эти клетки, как правило, не экспрессируют рецептор TrkB (хотя они могут быть трансфицированы для того, чтобы стабильно экспрессировать его), защитный эффект был воспроизведен против окисления, индуцированного глутаматом, в другой клеточной линии без TrkB рецептора (HT-22). Нейротоксичность, индуцированная воздействием метамфетамина, была уменьшена при предварительном введении 7,8-ДГФ перорально (30 мг/кг у мышей 12)), при этом более низкая доза 10 мг/кг была эффективной при средней продолжительности использования метамфетамина. Эти защитные эффекты связаны с меньшим снижением переносчика дофамина и меньшим количеством поведенческих отклонений, что зависило от рецептора TrkB. 13)
Нейровоспаление
Было отмечено, что 7,8-ДГФ проявляет противовоспалительные эффекты в клетках микроглии, что связано с ослаблением активации NF-kB в ответ на LPS, и что приводит к снижению активации белков МАРК, таких как р38, JNK и ERK; 14) эти действия также наблюдаются в макрофагах и в обеих клеточных линиях это приводит к меньшему высвобождению цитокинов, опосредованному воспалением – TNF-альфа и IL-1бета. 15)
Наркомания
Акивация TrkB – это механизм, который потенциально может применяться в лечении наркотических зависимостей, что было доказано в ходе лечения кокаиновой зависимости у крыс. Этот механизм связан с эндогенным лигандом BDNF, однако такой эффект был также воспроизведен при введении инъекций 7,8-ДГФ. 16) Активация TrkB усиливает сигнализацию через субъединицу NMDA, известную как GluN2B, которая имеет решающее значение для этих эффектов.
Инсульт и травма головного мозга
Применение 7,8-ДГФ вскоре после гипоксии-ишемии (модель инсульта у грызунов), с последующим введением инъекций в дозе 5 мг/кг на последующей неделе, было связано с защитным действием только у новорожденных самок мышей, у которых наблюдался меньший когнитивный дефицит и повреждения белого вещества по сравнению с гипоксической контрольной группой. 17) Подобные эффекты наблюдались в других исследованиях при непосредственном введении BDNF. 18) Аналогичный защитный эффект после случаев когнитивных поражений также наблюдался у взрослых мышей после окклюзии средней мозговой артерии при введении инъекций 7,8-ДГФ в дозе 5 мг/кг и ишемического/реперфузионного повреждения, 19) у обоих полов. Защита клеток гиппокампа у грызунов наблюдалась также при предварительном введении 7,8-ДГФ до повреждения средней степени тяжести. Защитный эффект наблюдался через 24 часа после повреждения. 20)
Беспокойство и стресс
У крыс, подверженных стрессу иммобилизации, подкожное введение 5 мг/кг 7,8-ДГФ за два часа до воздействия стрессора, помогло предотвратить изменения памяти через день по сравнению с контрольной группой; однако, воздействие 7,8-ДГФ не вызвало повышения производительности у крыс, не подвергавшихся воздействию стресса. 21) Положительное воздействие преимущество с 7,8-ДГФ до иммобилизации отмечалось и в другом исследовании на мышах, а также, когда вещество давали мышам через 15 дней после иммобилизации (для оценки угасания страха, которое, как известно, связано с BDNF), таким образом, вещество способствует исчезновению чувства страха. 22) Однократное введение вещества в дозе 5 мг/кг у крыс без какого-либо стрессора не влияет на тревожное поведение.
Депрессия
Мышиная модель депрессии с участием социального поражения смягчалась при введении внутрибрюшинных инъекций 7,8-ДГФ в дозе 10 мг/кг. В частности, показатели теста принудительного плавания и теста подвешивания за хвост улучшились при введении 7,8-ДГФ до такой же степени, как и при введении инъекции кетамина в дозе 10 мг/кг. Показатели предпочтения сахарозы также улучшились, хотя и в меньшей степени, чем при введении кетамина. Кроме того, эффект от инъекции 7,8-ДГФ исчезал через 6 дней после инъекции, в то время как у мышей, которым вводили кетамин, наблюдалось поддержание показателей улучшения. 23)
Память и обучение
При испытании в случаях стресса иммобилизации, инъекции 7,8-ДГФ в дозе 5мг/кг (внутрибрюшинно или подкожно), были связаны с анти-амнестическими эффектами у крыс, будучи эффективными как при однократном введении до стрессора или в виде ежедневных инъекций в течение четырех недель. 24) Cообщается о когнитивных преимуществах у в остальном здоровых пожилых грызунов при введении инъекций 5 мг/кг 7,8-ДГФ относительно страха обучения, что, предположительно, связано с тем, как сигнализация BDNF (через TrkB) сама по себе помогает сохранить познавательные функции в процессе старения с помощью восстановления дефектов синаптической пластичности 25). Однократное введение 5 мг / кг 7,8-ДГФ у здоровых крыс не вызвало улучшения пространственной памяти при измерении на следующий день. 26) Инъекции 7,8-ДГФ у крыс (0,3-3 мг/кг, доза 0,1 мг/кг была неэффективной) сразу или через три часа после теста на обучение улучшили показатели распознавания объекта при испытании на день позже, при этом доза 0,3-1 мг/кг показала одинаковую эффективность, а доза 3 мг/кг оказалась немного более эффективной; этот эффект был воспроизведен у здоровых мышей и у мышей с трансгенной болезнью Альцгеймера при приеме в дозе 0,1 мг/кг. Тем не менее, другое исследование мышиной модели болезни Альцгеймера показало, что инъекции 7,8-ДГФ в дозе 5 мг/кг ежедневно в течение четырех недель не вызвалb улучшения когнитивных нарушений и изменений в уровнях белка-предшественника амилоида или процессинге, или в отложении бляшек. 27)
Здоровье сердечно-сосудистой системы
Кровяное давление
7,8-ДГФ, по-видимому, повышает передачу сигнала оксида азота вне зависимости от TrkB и калиевых каналов. В этом механизме участвует снижение внеклеточного притока кальция и внутриклеточное высвобождение запасов кальция. В одном исследовании было отмечено снижение кровяного давления у спонтанно гипертензивных крыс при введении 7,8-ДГФ (2,5 мг/кг), и наблюдалось лишь слабое изменение диастолического артериального давления только у нормальных крыс, которым также вводилось вещество в той же дозе. В этом исследовании 7,8-ДГФ вызывал снижение АД в течение примерно одного часа. 7,8-ДГФ также оказал небольшое влияние на диастолическое артериальное давление при пероральном введении (10 мг/кг) у гипертензивных крыс, при отсутствии эффекта у здоровых крыс. 28)
Ожирение и жировая масса
Скорость метаболизма
Прямые вливания в мозг нейротрофического фактора мозга (BDNF), как было показано, подавляют потребление пищи у крыс 29) с помощью механизма, скорее всего, связанного со связыванием BDNF с его рецептором, известным как TrkB. Тем не менее, короткий период полураспада и плохое проникновение через гематоэнцефалический барьер делает сам BDNF плохим кандидатом для потери веса. 30) Так как 7,8-ДГФ также действует на TrkB и имеет лучшую биологическую доступность, он может оказаться более многообещающим средством. Эта гипотеза была проверена путем введения 0,16 мг/мл 7,8-ДГФ в питьевую воду мышей с ожирением, в течение 20 недель, которых кормили пищей с высоким содержанием жиров. Было установлено, что у самок, но не у самцов мышей, увеличение веса, вызванное диетой, ослаблялось при введении 7,8-ДГФ через TrkB-зависимый механизм мышц, так как 7,8-ДГФ не оказал такого эффекта на мышей, которые специфически испытывали недостаток этого рецептора в мышцах. Самки мышей, получавшие 7,8-ДГФ, также имели повышенный расход энергии. Предположительно, это может быть механизмом, с помощью которого ослаблялось увеличение веса. 31)
Скелетно-мышечная и физическая работоспособность
Мышечная выносливость
Нейротрофины (такие как BDNF и NT-4), как известно, участвуют в мышечных сокращениях, где лиганд-активированный TrkB взаимодействует с пресинаптическими мускариновыми рецепторами, способствуя высвобождению ацетилхолина в двигательных нейронах. 32) Нервно-мышечная передача в мышцы (диафрагма) в изолированных клетках мышей повышается (32%) при введении 10 мкм 7,8-ДГФ 33) в связи с усилением скорости нервно-мышечной передачи. 7,8-ДГФ, однако, не влияет на изометрические сократительные и усталостные свойства мембраны мышц.
Метаболизм рака
Молекулярные мишени
Белок, известный как Sp1, является фактором транскрипции, обнаруженным у всех млекопитающих, который регулирует широкий спектр процессов, участвующих в дифференцировке клеток и клеточном цикле. Существует несколько типов рака, при которых наблюдается гиперэкспрессия Sp1. Таким образом, это может быть важной молекулярной мишенью при терапии рака. 7,8-ДГФ непосредственно связывается с Sp1 и влияет на низлежащие мишени этого белка, что, в конечном счете, может индуцировать апоптоз в клеточной линии рака in vitro. 34)
Полость рта и горло
Одно исследование показало, что 10-40 мкм 7,8-ДГФ может вызвать остановку клеточного цикла и апоптоз в двух клетках плоскоклеточной карциномы полости рта in vitro в зависимости от дозы.
Система периферических органов
Кишечник
Воздействие нейротрофического фактора мозга (BDNF) на его рецептор TrkB увеличивают холинергическую передачу. 35) Это действие имитируется 7,8-ДГФ в мышцах диафрагмы и в клетках мышц кишечника. При активации TrkB при помощи 7,8-ДГФ в кишечных мышечных клетках, холинергическое агонист-индуцированное сокращение усиливается PLC-зависимым образом. Активация TrkB в клетках мышц кишечника усиливает сокращения, индуцированные холинергическими агонистами. Теоретически это может лежать в основе синдрома раздраженного кишечника (что наблюдалось при исследовании других добавок, связанных с BDNF, таких как Бакопа Монье, хотя нет данных исследований на человеке, подтверждающих это).
Заболевания
Болезнь Альцгеймера
 При инкубации с первичными нейронами in vitro, 7,8-ДГФ (500 нМ) значительно снижает токсичность, индуцированную Aβ, зависимо от TrkB.
В мышиной модели болезни Альцгеймера, длительный пероральный прием 7,8-ДГФ в течение четырех недель (по оценкам, в дозе 5 мг/кг) предотвращает отложение Aβ, не затрагивая уровни Aβ. Предположительно, активация TrkB может специфически антагонизировать образование амилоидных бляшек. Кроме того, введение 7,8-ДГФ до введения скополамина крысам снижает отложение Aβ, окислительный стресс и синаптическую дисфункцию при сохранении когнитивной функции. Как и в последнем исследовании мышей, 7,8-ДГФ предотвращает развитие патологических нарушений при болезни Альцгеймера, в зависимости от активации TrkB.
Однократное введение 7,8-ДГФ в трансгенной мышиной модели болезни Альцгеймера дает кратковременные результаты касательно распознавания объектов в дозе 0,1 мг / кг, и подобное явление наблюдалось у здоровых мышей, получавших такую же внутрибрюшинную дозу.
Применение 7,8-ДГФ, растворенного в питьевой воде (22 мг/л, по оценкам, 5 мг/кг перорально) у 5XFAD мышей с болезнью Альцгеймера почти в два раза увеличивает фосфорилирование TrkB (а также МАРК и Akt) через четыре месяца применения без изменения содержания белка TrkB. Считалось, что это лежит в основе снижения синаптической потери по сравнению с контрольными мышами 5XFAD. Следует отметить, что увеличение фосфорилирования TrkB происходило на фоне восстановления дефицита памяти. Эксперименты в другой трансгенной модели болезни Альцгеймера (CaM/Tet- DTA) отметили положительные эффекты на дендритнуюх плотность и пространственную память при введении инъекций 7,8-ДГФ.
Было показано, что 7,8-ДГФ уменьшает окислительный стресс и амилоидогенез, сохраняя когнитивные функции в нескольких моделях болезни Альцгеймера у грызунов. Эффективность была установлена как при введении инъекций, так и при пероральном приеме.
При инкубации с первичными нейронами in vitro, 7,8-ДГФ (500 нМ) значительно снижает токсичность, индуцированную Aβ, зависимо от TrkB.
В мышиной модели болезни Альцгеймера, длительный пероральный прием 7,8-ДГФ в течение четырех недель (по оценкам, в дозе 5 мг/кг) предотвращает отложение Aβ, не затрагивая уровни Aβ. Предположительно, активация TrkB может специфически антагонизировать образование амилоидных бляшек. Кроме того, введение 7,8-ДГФ до введения скополамина крысам снижает отложение Aβ, окислительный стресс и синаптическую дисфункцию при сохранении когнитивной функции. Как и в последнем исследовании мышей, 7,8-ДГФ предотвращает развитие патологических нарушений при болезни Альцгеймера, в зависимости от активации TrkB.
Однократное введение 7,8-ДГФ в трансгенной мышиной модели болезни Альцгеймера дает кратковременные результаты касательно распознавания объектов в дозе 0,1 мг / кг, и подобное явление наблюдалось у здоровых мышей, получавших такую же внутрибрюшинную дозу.
Применение 7,8-ДГФ, растворенного в питьевой воде (22 мг/л, по оценкам, 5 мг/кг перорально) у 5XFAD мышей с болезнью Альцгеймера почти в два раза увеличивает фосфорилирование TrkB (а также МАРК и Akt) через четыре месяца применения без изменения содержания белка TrkB. Считалось, что это лежит в основе снижения синаптической потери по сравнению с контрольными мышами 5XFAD. Следует отметить, что увеличение фосфорилирования TrkB происходило на фоне восстановления дефицита памяти. Эксперименты в другой трансгенной модели болезни Альцгеймера (CaM/Tet- DTA) отметили положительные эффекты на дендритнуюх плотность и пространственную память при введении инъекций 7,8-ДГФ.
Было показано, что 7,8-ДГФ уменьшает окислительный стресс и амилоидогенез, сохраняя когнитивные функции в нескольких моделях болезни Альцгеймера у грызунов. Эффективность была установлена как при введении инъекций, так и при пероральном приеме.
Болезнь Паркинсона
Мышиная модель болезни Паркинсона генерируется путем введения инъекций возрастающих доз химического вещества, известного как МРТР, в течение четырех недель. Болезнь была частично смягчена путем введения внутрибрюшинных инъекций 5 мг / кг 7,8-ДГФ. 36) В частности, была улучшена двигательная функция у мышей, и была сохранена функция тирозин гидроксилазы в дорсолатеральном полосатом теле, даже тогда, когда лечение началось через две недели после введения MPTP, предполагая, что лечение 7,8-ДГФ может не только ослабить симптомы, но и модифицировать заболевание в этой модели болезни Паркинсона. Тирозингидроксилаза является ферментом, который преобразует тирозин в L-ДОФА, и уменьшение количества этого фермента является важным шагом в развитии болезни Паркинсона. 37)
Боковой амиотрофический склероз
Внутрибрюшинное введение 7,8-ДГФ при животной модели бокового амиотрофического склероза (БАС), по-видимому, связано с двигательными улучшениями, что, как полагают, связано с сохранением дендритных шипов нейронов спинного мозга. 38) Наблюдается увеличение нервно-мышечной передачи при инкубации 7,8-ДГФ (10 мкм) в диафрагменных мышцах мышей, что может быть связано с БАС, когда основной причиной смерти является дыхательная недостаточность. 39) Предварительные данные исследований на животных показывают, что 7,8-ДГФ может иметь терапевтический потенциал для лечения БАС, хотя до сих пор отсутствуют данные исследований на человеке.
Шизофрения
Внутрибрюшинное введение 5 мг / кг 7,8-ДГФ в день в течение двух недель у шизофренических крыс, по-видимому, дает когнитивные преимущества, включая повышение пространственного обучения. Это происходит за счет активации TrkB, также способствуя увеличению синаптической пластичности гиппокампа.
Синдром Ретта
В трансгенной мышиной модели синдрома Ретта (MeCP2-нулевые мыши), которая привела к снижению экспрессии BDNF у относительно здоровых мышей, нормализация концентраций BDNF 40) и пероральный прием 7,8-ДГФ (80 мг/л питьевой воды, по оценкам, 8-12 мг/кг от 2-3 мл воды ежедневно) 41), по всей видимости, частично улучшает физические (бег и дыхание) и нейронные (размер гиппокампа) признаки этого состояния. Пероральный прием 7,8-ДГФ смягчает некоторые из признаков синдрома Ретта в мышиной модели.










