Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Как плацебо изменяет мозг пациента
 На сегодняшний день эффект плацебо активно и продуктивно исследуют. Из-за того, что в эффекте плацебо задействовано множество механизмов, этот эффект на самом деле можно рассматривать как смесь понятий и идей для нейробиологии. В действительности, существует не один, а множество эффектов плацебо, имеющих различные механизмы и действующие в различных системах, при различных медицинских условиях и терапевтических вмешательствах. Например, в механизме плацебо участвуют процессы, связанные с ожиданием, тревогой и вознаграждением, а также целый ряд явлений обучения, таких как Павловской условный рефлекс, когнитивное и социальное обучение. Существуют также некоторые экспериментальные данные о различных генетических вариантах, влияющих на отзывчивость на плацебо. Наиболее эффективными моделями для лучшего понимания нейробиологии эффекта плацебо являются боль и болезнь Паркинсона. Были идентифицированы нейронные сети, вовлеченные в эти медицинские условия: опиоидэргическая-холецистокинергическая-дофаминергическая модуляторная сеть при боли и часть системы базальных ганглиев при болезни Паркинсона. В области исследования плацебо, из этих последних достижений можно сделать вывод о важных клинических последствиях. Во-первых, поскольку эффект плацебо – это, в основном, эффект психосоциального контекста, эти данные указывают на то, что различные социальные стимулы, такие как слова и ритуалы терапевтического акта, могут изменить химические процессы в мозгу пациента. Во-вторых, механизмы, которые активируются плацебо – это те же механизмы, которые активируются препаратами, что предполагает когнитивное / аффективное вмешательство в действие препарата. В-третьих, если ослабляется функционирование префронтальной коры, ответы плацебо уменьшаются или полностью отсутствуют, как, например, при деменции типа Альцгеймера 1).
На сегодняшний день эффект плацебо активно и продуктивно исследуют. Из-за того, что в эффекте плацебо задействовано множество механизмов, этот эффект на самом деле можно рассматривать как смесь понятий и идей для нейробиологии. В действительности, существует не один, а множество эффектов плацебо, имеющих различные механизмы и действующие в различных системах, при различных медицинских условиях и терапевтических вмешательствах. Например, в механизме плацебо участвуют процессы, связанные с ожиданием, тревогой и вознаграждением, а также целый ряд явлений обучения, таких как Павловской условный рефлекс, когнитивное и социальное обучение. Существуют также некоторые экспериментальные данные о различных генетических вариантах, влияющих на отзывчивость на плацебо. Наиболее эффективными моделями для лучшего понимания нейробиологии эффекта плацебо являются боль и болезнь Паркинсона. Были идентифицированы нейронные сети, вовлеченные в эти медицинские условия: опиоидэргическая-холецистокинергическая-дофаминергическая модуляторная сеть при боли и часть системы базальных ганглиев при болезни Паркинсона. В области исследования плацебо, из этих последних достижений можно сделать вывод о важных клинических последствиях. Во-первых, поскольку эффект плацебо – это, в основном, эффект психосоциального контекста, эти данные указывают на то, что различные социальные стимулы, такие как слова и ритуалы терапевтического акта, могут изменить химические процессы в мозгу пациента. Во-вторых, механизмы, которые активируются плацебо – это те же механизмы, которые активируются препаратами, что предполагает когнитивное / аффективное вмешательство в действие препарата. В-третьих, если ослабляется функционирование префронтальной коры, ответы плацебо уменьшаются или полностью отсутствуют, как, например, при деменции типа Альцгеймера 1).
ВВЕДЕНИЕ
Плацебо не являются инертными веществами, как считалось до сих пор. Плацебо состоят из слов и ритуалов, символов и смыслов, и все эти элементы активно воздействуют на мозг пациента. Инертные вещества, такие как солевой раствор, уже давно используются в клинических испытаниях и двойных слепых рандомизированных протоколах для оценки эффективности новых методов лечения, например, новых фармакологических препаратов. Хотя инертные вещества имеют применимость в условиях клинических испытаний, ученые всегда обращают внимание на само инертное вещество, а не на реальный смысл плацебо 2). Плацебо – это не просто инертное вещество, это вещество, которое вводится вкупе с сенсорными и социальными стимулами, благодаря которым пациент получает уверенность в том, что его лечат. Если считать плацебо инертным веществом правильно в прагматических целях клинических испытаний, в которых единственной целью является определить, являются ли препараты более эффективными, чем плацебо, это, конечно, не помогает нам понять, что же такое плацебо 3).
Реальный эффект плацебо – это психобиологическое явление, происходящее в головном мозге пациента после введения инертного вещества, или фиктивной физической обработки, такой как ложная хирургия, наряду со словесными предположениями (или любыми другими стимулами) о его клинической пользе 4). Таким образом, эффект, который следует за введением плацебо, не может быть обусловлен одним только инертным веществом, поскольку солевые растворы или сахарные таблетки не имеют лечебных свойств. Вместо этого, эффект плацебо связан с психосоциальным контекстом, в котором находится инертное вещество и пациент. В этом смысле, для исследователя и для нейробиолога термин «эффект плацебо» будет иметь разное значение. В то время как исследователи заинтересованы в любых улучшениях, которые могут возникнуть в группе пациентов, принимающих инертное вещество, независимо от его происхождения, нейробиологи заинтересованы лишь в улучшении, связанном с активными процессами, происходящими в головном мозге пациента. В действительности, улучшение, наблюдаемое у пациентов, которые получили плацебо, можно приписать множеству факторов, таких как спонтанная ремиссия заболевания (так называемое естественное течение болезни), регрессия к среднему значению (статистическое явление из-за ошибки выборки), пристрастное отношение пациента и врача, а также неидентифицированные эффекты дополнительных вмешательств. В прагматических клинических исследованиях, ученые заинтересованы в улучшении независимо от его причины, потому что им нужно установить, будет ли фармакологическое (или иное) лечение лучше, чем плацебо. Такой прагматичный подход дает плодотворные результаты в клинических испытаниях. Однако, если мы заинтересованы в понимании того, что такое реальный эффект плацебо и как он работает, мы должны отделить его от спонтанных ремиссий, регрессии к среднему, ошибок, и так далее.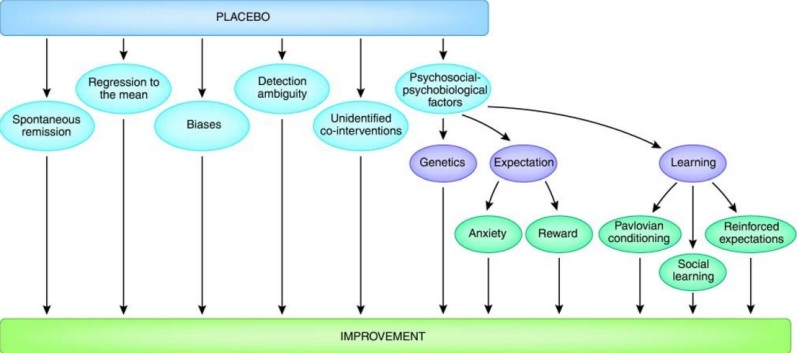 Принимая во внимание все эти соображения, этот обзор имеет дело только с частью улучшений, которые могут иметь место в группе плацебо клинических испытаний, то есть, улучшениями, связанными с активными процессами в головном мозге пациента. Можно исключить другие явления, используя соответствующий методологический подход. Например, чтобы исключить спонтанную ремиссию, пациентов из группы плацебо следует сравнить с группой, которой не дают лечения, что даст нам информацию о естественном течении болезни. Аналогичным образом, чтобы исключить предвзятость, например, субъективные симптомы, такие как боль, следует иметь дело с объективными критериями оценки. С точки зрения этой методологии, исследование плацебо не так легко выполнить, потому что оно потребует строгих экспериментальных протоколов и множество контрольных групп.
Реальная реакция на плацебо, то есть, реальное психобиологическое явление, не имеет значения. Важным является его вклад в клиническое улучшение. Например, в клинических испытаниях антидепрессантов было показано, что естественное течение болезни (то есть, спонтанная ремиссия) составляет 23,87% от общего эффекта, реальный эффект плацебо (то есть, ожидание пользы от лечения) – 50,97%, и эффект препарата – только 25.16%. Таким образом, в клинических испытаниях клинической депрессии, одна четверть пользы обусловлена специфическим действием активного лекарства, четверть связана с другими факторами, такими как спонтанная ремиссия, а половина – это реальный эффект плацебо, то есть, реальное психобиологическое явление.
Сегодня этот экспериментальный подход к эффекту плацебо служит хорошим подспорьем для будущих исследований 5). Как подчеркивается в этом обзоре, теперь мы знаем, что существует не один, а множество эффектов плацебо, с различными механизмами и действующими при различных заболеваниях, системах и терапевтических вмешательствах 6). Другими словами, в головном мозге пациента могут происходить различные процессы в различных условиях. Иногда модулируется беспокойство, в некоторых других случаях участвуют механизмы вознаграждения, а в некоторых других случаях присутствуют различные виды обучения, или даже генетические варианты, которые могут отвечать за отзывчивость на плацебо. В этом смысле, эффект плацебо является «плавильным котлом» нейрологических концепций и идей, начиная от тревоги и механизмов вознаграждения и заканчивая павловским условным рефлексом и социальным обучением, от нейрогенетики и нейрофизиологии до клинической практики и нейроэтики.
Принимая во внимание все эти соображения, этот обзор имеет дело только с частью улучшений, которые могут иметь место в группе плацебо клинических испытаний, то есть, улучшениями, связанными с активными процессами в головном мозге пациента. Можно исключить другие явления, используя соответствующий методологический подход. Например, чтобы исключить спонтанную ремиссию, пациентов из группы плацебо следует сравнить с группой, которой не дают лечения, что даст нам информацию о естественном течении болезни. Аналогичным образом, чтобы исключить предвзятость, например, субъективные симптомы, такие как боль, следует иметь дело с объективными критериями оценки. С точки зрения этой методологии, исследование плацебо не так легко выполнить, потому что оно потребует строгих экспериментальных протоколов и множество контрольных групп.
Реальная реакция на плацебо, то есть, реальное психобиологическое явление, не имеет значения. Важным является его вклад в клиническое улучшение. Например, в клинических испытаниях антидепрессантов было показано, что естественное течение болезни (то есть, спонтанная ремиссия) составляет 23,87% от общего эффекта, реальный эффект плацебо (то есть, ожидание пользы от лечения) – 50,97%, и эффект препарата – только 25.16%. Таким образом, в клинических испытаниях клинической депрессии, одна четверть пользы обусловлена специфическим действием активного лекарства, четверть связана с другими факторами, такими как спонтанная ремиссия, а половина – это реальный эффект плацебо, то есть, реальное психобиологическое явление.
Сегодня этот экспериментальный подход к эффекту плацебо служит хорошим подспорьем для будущих исследований 5). Как подчеркивается в этом обзоре, теперь мы знаем, что существует не один, а множество эффектов плацебо, с различными механизмами и действующими при различных заболеваниях, системах и терапевтических вмешательствах 6). Другими словами, в головном мозге пациента могут происходить различные процессы в различных условиях. Иногда модулируется беспокойство, в некоторых других случаях участвуют механизмы вознаграждения, а в некоторых других случаях присутствуют различные виды обучения, или даже генетические варианты, которые могут отвечать за отзывчивость на плацебо. В этом смысле, эффект плацебо является «плавильным котлом» нейрологических концепций и идей, начиная от тревоги и механизмов вознаграждения и заканчивая павловским условным рефлексом и социальным обучением, от нейрогенетики и нейрофизиологии до клинической практики и нейроэтики.
ОЖИДАНИЕ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ
Термины «эффект плацебо» и «реакция на плацебо» часто используются как синонимы, и, таким образом, в данном исследовании будут использоваться оба термина. Большинство исследований плацебо было сосредоточено на ожиданиях в качестве основного фактора, участвующего в отзывчивости на плацебо. Во многих исследованиях, описанных в литературе, в которых анализируются ожидания, термины «эффект плацебо» и «эффект ожиданий» часто используются как синонимы. В целом, ожидания направлены на подготовку организма к тому, чтобы предвидеть событие, чтобы лучше справляться с ним, и этот механизм имеет четко выраженное эволюционное преимущество. Например, человек может иметь ожидания будущего результата и будущей реакции касательно его собственных эмоциональных и физиологических реакций, таких как боль, тревога и сексуальное возбуждение 7). Это может привести к когнитивной переоценке соответствующего поведения: позитивные ожидания приведут к принятию определенной модели поведения, например, возобновлению нормального режима дня, а негативные ожидания приведут к торможению определенного действия 8). Однако, в этом механизме задействованы не только ожидания, а также ряд других факторов, таких как память и мотивация 9). Эффекты ожидания могут также модулироваться изменением других познавательных процессов, таких как уменьшение самодеструктивных мыслей 10). Кроме того, Франк 11) проанализировал процесс выздоровления в контексте ожиданий пациента, и предположил, что надежда является основным механизмом изменения в психотерапии. Действительно, надежда может быть определена как желание и ожидание того, что будущее будет лучше настоящего. Ожидания могут также играть определенную роль в Хоторнском эффекте, то есть, клиническое улучшение в группе пациентов в клинических испытаниях может быть связано с самим фактом участия в испытании 12). Другими словами, пациент, который знает, что находится под пристальным вниманием, может ожидать лучшего терапевтического эффекта из-за многочисленных тестов, которые он или она проходит, особого внимания со стороны медицинского персонала, а также доверия к новой терапии. Таким образом, ожидание – это общий термин, который может быть описан с различных точек зрения. Существует несколько механизмов, с помощью которых ожидание будущего события может повлиять на различные физиологические функции. Например, ожидание отрицательного результата направлено на предвидение возможной угрозы, тем самым увеличивая беспокойство, в то время как ожидание предстоящего положительного результата может уменьшить беспокойство и / или активировать механизмы вознаграждения нейронных сетей. В действительности, существует достаточная поддержка роли механизмов тревоги и вознаграждения в отзывчивости на плацебо, некоторые из которых приводятся ниже.
Модуляция тревоги ожиданиями
В некоторых исследованиях было установлено, что после приема плацебо снижается беспокойство. Если человек ожидает, что огорчающий его симптом ослабеет в ближайшее время, имеется тенденция к снижению тревоги. Например, в ранних исследованиях, проведенных McGlashan и соавторами 13) и Эвансом 14), исследовалась экспериментальная боль при личностной и ситуативной тревожности. Личностная тревожность представляет собой черту личности и, таким образом, может проявляться на протяжении всей жизни, в то время как ситуативная тревога может присутствовать в определенных стрессовых ситуациях и представляет собой адаптивный и преходящий ответ на стресс. Эти исследователи давали пациентам плацебо, которое пациенты считали болеутоляющим. В то время как не было обнаружено никакой корреляции между тревожностью и терпимостью к боли после приема плацебо, наблюдалась корреляция между ситуативной тревожностью и терпимостью к боли во время приема плацебо. Аналогичные результаты были получены в еще более новом исследовании, проведенном Vase и соавторами 15), который обнаружил снижение уровня тревоги у больных с синдромом раздраженной толстой кишки, которые получали плацебо. В исследованиях визуализации головного мозга может наблюдаться снижение активации областей, связанных с тревогой, во время реакции на плацебо. В одном исследовании функциональной магнитно-резонансной томографии (фМРТ) было установлено, что прием плацебо может модулировать эмоции 16). В первый день эксперимента испытуемым давали либо бензодиазепин мидазолам, либо антагонист бензодиазепиновых рецепторов флумазенил, а потом показывали им снимки, вызывающие неприятные эмоции. Как и ожидалось, в то время как мидазолам уменьшал восприятие неприятных эмоций, флумазенил отменял этот эффект. Таким образом, в первый день вызывались сильные ожидания эффекта лечения. На второй день, испытуемым сказали, что их будут лечить либо тем же успокоительным лекарственным средством, либо анксиолитическом блокатором, как и в предыдущий день. Тем не менее, вместо того чтобы получать реальное лекарство, они получали плацебо. Существенный и явный ответ плацебо (снижение неприятных ощущений) был обнаружен, когда испытуемые думали, что они принимали анксиолитический препарат, и никакого ответа не наблюдалось, если пациенты думали, что они получали анксиолитический блокатор. фМРТ показало, что региональный кровоток изменился как в передней части поясной извилины коры головного мозга, так и в боковой орбитофронтальной коре, которые являются теми же самыми областями, которые участвуют в плацебо аналгезии 17). Это говорит о том, что подобные механизмы могут быть задействованы в ответе на плацебо эмоциональных стимулов и плацебо аналгезии. Лучшее доказательство того, что тревога принимает участие в ответах плацебо, проявляется в эффекте ноцебо, который противоположен эффекту плацебо. Для того, чтобы вызвать эффект ноцебо, инертное вещество вводят наряду с отрицательными словесными предположениями о клиническом ухудшении, например, об увеличении боли. В исследовании, проведенном Colloca и соавторами, 18) использовалась процедура ноцебо, в которой здоровым добровольцам говорили о болезненной стимуляции перед использованием тактильных стимулов или болевых электрических стимулов низкой интенсивности. Это исследование показало, что эти анксиогенные словесные предложения были способны превратить тактильные раздражители в боль, а также болевые стимулы низкой интенсивности – в боль высокой интенсивности. Поэтому, определяя гипералгезию как повышение болевой чувствительности и аллодинию как восприятие боли в ответ на безобидную стимуляцию, предположение ноцебо об отрицательном результате может производить как гипералгезический (повышенная чувствительность организма к болевым раздражителям), так и аллодинический (боль вследствие воздействия раздражителей, обычно её не вызывающих) болевой эффект. В различных исследованиях было обнаружено, что на усиление боли могут влиять несколько областей головного мозга, такие как передняя часть поясной извилины, префронтальная кора и гиппокамп, активирующиеся во время ожидания боли 19) 20) 21). Эти эффекты противоположны эффектам, вызываемым позитивными ожиданиями, при которых испытуемые ожидают уменьшение боли. В некоторых исследованиях, в которых были исследованы как положительные, так и отрицательные результаты с тем же экспериментальным подходом, была обнаружена модуляция субъективного опыта и активация мозга. Например, в исследовании Koyama и соавторов 22), при увеличении величины ожидаемой боли, увеличивалась активация в таламусе, островке головного мозга, префронтальной коре и передней части поясной извилины. В отличие от этого, ожидания уменьшения боли снижали активацию связанных с болью областей мозга, таких как первичная соматосенсорная кора, островная кора и передняя поясная кора. В другом исследовании, проведенном Кельтнером и соавт. 23), было установлено, что уровень ожидаемой интенсивности боли изменяет воспринимаемую интенсивность боли наряду с активацией различных областей головного мозга. Используя два визуальных сигнала, каждый с выработанными рефлексами к одному из двух вредных термических раздражителей (высоких и низких), исследователи показали, что испытуемые сообщали об увеличении боли, когда вредный раздражитель предшествовал визуальному сигналу высокой интенсивности. Сравнивая активацию мозга, произведенную двумя визуальными сигналами, исследователи обнаружили существенные различия в ипсилатеральной хвостовой передней поясной коре, главе хвостатого ядра, мозжечке и контралатеральной кунеиформном ядре. Kong и др. 24) также повысили негативные ожидания по поводу восприятия боли после ложного иглоукалывания, в протоколе с участием фМРТ, и субъективной боли и измерений ожидания. При сравнении ответов на тепловые болевые стимулы одинаковой интенсивности на контрольных участках или на участках вдоль предлагаемого курса меридианы акупунктуры (ноцебо), наблюдалось учащение сообщений о боли на участках ноцебо, а также повышенная активность в нескольких областях медиальной матрицы боли (среди которых двусторонняя спинная передняя часть поясной извилины коры головного мозга, островковая кора, левая лобная и теменная покрышки, орбитальная префронтальная кора головного мозга и гиппокамп). Левый гиппокамп (не была доказана до сих пор его вовлеченность в плацебо аналгезию) может играть определенную роль в ноцебо гипералгезии, при поддержке корреляции своей деятельности левой орбитальной префронтальной извилиной и передней поясной корой, которая, как известно, играет ключевую роль в когнитивной модуляции эмоциональной составляющей боли. Интересно отметить, что гиппокамп также напрямую связан с беспокойством, поскольку его активность возрастает при вызывающих беспокойство раздражителях 25). Ноцебо гипералгезия также была изучена с фармакологической точки зрения, с целью определить возможные нейромедиаторы, участвующие в усилении боли, вызванной тревожностью. Используя анксиогенную процедуру ноцебо, при которой инертное лечение давалось наряду со словесными предположениями об ухудшении боли, Бенедетти и др. 26) использовали проглумид, неспецифический холецистокининовый (ССК) антагонист для обоих ССК-А и ССК-B-рецепторов, или CCK-1 и ССК-2 в соответствии с новой классификацией 27), для пациентов в послеоперационном периоде во время послеоперационного манипуляций. Было обнаружено, что гипералгезия, индуцированная тревожностью (ноцебо) предотвращалась при введении проглумида в зависимости от дозы, таким образом, предполагается посредничество CCK. Этот эффект не антагонизировался налоксоном, что указывает на то, что он не был опосредован опиоидами. Чтобы преодолеть некоторые этические ограничения, которые присутствовали в этом клиническом исследовании, подобный экспериментальный подход был использован у здоровых испытуемых. Исследуя экспериментальную ишемическую боль в руке, Бенедетти и др. 28) провели детальное нейрофармакологическое исследование гипералгезии, индуцированной тревожностью (ноцебо). Было установлено, что пероральное введение инертного вещества, наряду со словесными предположениями о гипералгезии, индуцировало гипералгезию и гиперактивность гипоталамо-гипофизарно-надпочечниковой оси, что оценивалось с использованием адренокортикотропного гормона (АКТГ) и концентрации кортизола в плазме крови. И ноцебо-индуцированная гипералгезия, и гипоталамо-гипофизарно-надпочечниковая гиперактивность блокировались бензодиазепином диазепам, тем самым предполагая влияние тревоги на боль. В противоположность этому, введение смешанного антагониста рецептора CCK типа A / B, проглумида, полностью блокировало ноцебо гипералгезию, но не оказывало никакого влияния на гипоталамно-гипофизарно-надпочечниковую гиперактивность. Это наводит на мысль о конкретном участии ССК в повышенной болевой чувствительности, но не в компоненте тревоги эффекта ноцебо. Ни диазепам, ни проглумид не продемонстрировали болеутоляющего действия на исходную боль, так как они действовали только на увеличение боли, вызванной тревогой. Аналогичные механизмы присутствуют у животных, из-за чего возникают вопросы о возможном использовании животных моделей для изучения эффектов плацебо и ноцебо. Например, в модели тревожности у крыс, связанной с социальным поражением, было показано, что CI-988, селективный антагонист рецептора ССК-В, предотвращает гипералгезию, индуцированную беспокойством, причем его эффект аналогичен анксиолитическому препарату хлордиазепоксид 29). Другие исследования, в которых используются селективные антагонисты рецепторов ССК-А и CCK-B у животных и человека, показали важную роль систем CCK в модуляции тревоги и в связи между тревогой и гипералгезией 30). Про-ноцицептивное и анти-опиоидное действие CCK были зарегистрированы в стволе головного мозга у животных 31), и в ростровентромедиальном мозговом веществе крыс существуют нейроны, экспрессирующие как мю-опиоидные рецепторы, так и ССК-2 (или CCK-B) рецепторы. Более 80% этих клеток одновременно экспрессируют оба рецептора, в то время как около 15% экспрессируют только ССК-2, и очень немногие клетки экспрессируют только мю-опиоидные рецепторы. Выборочные поражения ССК-2 и клеток, экспрессирующих μ-опиоиды, не изменяют базального сенсорного порога, но упраздняют гипералгезию, вызванную микроинъекцией ССК в ростровентромедиальное мозговое вещество, что говорит о том, что эти совместно экспрессируемые ССК-2 / μ-опиоидные ростровентромедиальные нейроны облегчают боль и могут быть непосредственно активированы путем введения CCK в ростровентромедиальное мозговое вещество 32). Стоит отметить, что, хотя в гипералгезии, вызванной тревогой, тревога влияет на саму боль, в случае аналгезии, индуцированной стрессом, тревога связана со стрессором, который смещает внимание от самой боли, например, угрожающий раздражитель в окружающей среде. Поэтому, направленное внимание играет ключевую роль 33). В случае гипералгезии, вызванной тревогой, при которой внимание сосредоточено на предстоящей боли, биохимическая связь между этой упреждающей тревогой и увеличением боли представлена системами CCK. И наоборот, в стресс-индуцированной анальгезии общее состояние возбуждения проистекает из стрессовой ситуации в окружающей среде, так что внимание в этом случае сосредоточено на экологическом стрессоре. В этом случае существуют экспериментальные доказательства того, что обезболивание вызывается активацией эндогенных опиоидных систем 34) 35).
Ожидание вознаграждения
Ожидания будущих событий могут не только модулировать тревогу, но также они могут вызывать физиологические изменения через механизмы вознаграждения. Эти механизмы опосредованы специфическими нейрональными цепями, связывающими когнитивные, эмоциональные и моторные ответы, и традиционно изучаются в контексте естественных вознаграждений (например, еды), денежных вознаграждений, а также приятных ощущений при приеме наркотика 36). У животных, дофаминергические клетки в вентральной области покрышки ствола головного мозга, выступающие в прилежащем ядре вентральных базальных ганглиев, реагируют как на величину ожидаемых выгод, так и на отклонения от прогнозируемых результатов, таким образом представляя собой адаптивную систему, модулирующую поведенческие реакции 37) 38). Прилежащее ядро играет центральную роль в механизмах вознаграждения, опосредованных дофамином, вместе с вентральной областью покрышки. Тем не менее, следует отметить, что другие регионы также принимают участие в этом процессе, такие как миндалевидное тело, периакведуктальное серое вещество, а также другие области в таламусе, гипоталамусе и гипоталамических (спирохета) областях.
Существуют убедительные экспериментальные доказательства того, что мезолимбическая дофаминергическая система может быть в некоторых случаях активирована, когда человек ожидает клинического улучшения после приема плацебо. В 2001 году de la Fuente–Fernandez и его коллеги 39) оценивали высвобождение эндогенного дофамина с использованием позитронно-эмиссионной томографии (ПЭТ) с раклопридом, радиотрейсером, который связывается с дофаминовыми D2 и D3 рецепторами, конкурируя с эндогенным дофамином. В этом исследовании, пациенты с паркинсонизмом знали, что они будут получать инъекции либо активного лекарственного средства (апоморфин, агонист дофаминового рецептора), или плацебо, в соответствии с классической методикой клинического испытания. После введения плацебо, было установлено, что дофамин высвобождался в полосатом теле, что соответствует изменению концентрации внеклеточного дофамина на 200% и сравнимо с ответом на амфетамин у субъектов с интактной системой дофамина. Выпуск дофамина в двигательном стриатуме (скорлупа и хвостатое ядро) был выше у пациентов, которые сообщили о клиническом улучшении. Хотя в исследованиях de la Fuente–Fernandez и др. 40) все пациенты показали дофаминовые ответы на плацебо, только половина пациентов сообщили о сопутствующих двигательных улучшениях. У этих пациентов также наблюдался повышенный выпуск дофамина в дорсальном двигательном стриатуме, что предполагает взаимосвязь между количеством дофамина, высвобождаемого в дорсальном стриатуме, и клиническими преимуществами. Эта связь не наблюдалась в вентральном стриатуме, то есть, в прилежащем ядре, при этом у всех пациентов наблюдалось здесь повышенное высвобождение дофамина, независимо от того, воспринимали ли они какие-либо улучшения. Соответственно, исследователи предположили, что выпуск дофамина в прилежащем ядре связан с ожиданием улучшения симптомов у пациентов, что может, в свою очередь, считаться формой вознаграждения.
В 2002 году было проведено еще одно исследование визуализации головного мозга 41). Изменения в метаболизме глюкозы в мозгу были измерены с использованием ПЭТ у больных с униполярной депрессией, которым давали плацебо или флуоксетин в течение 6 недель. Были описаны общие и уникальные ответы. В действительности, прием и плацебо, и флуоксетина индуцировал региональное увеличение обмена веществ в префронтальной, передней части поясной извилины, премоторной, теменной, задней островковой и задней части поясной извилины и замедление метаболизма в субгенуальной области, пара-гиппокампе и таламусе. Величина региональных изменений при приеме флуоксетина в целом была больше, чем при приеме плацебо. Тем не менее, ответы на флуоксетин были связаны с дополнительными подкорковыми и лимбическими изменениями в стволе головного мозга, стриатуме, передней островковой доле мозга и гиппокампе. Не наблюдалось никаких региональных изменений, уникальных для плацебо, в течение 6 недель. Интересно отметить, что уникальные изменения в вентральном стриатуме (прилежащее ядро) и орбитальных лобных участках присутствовали как при введении плацебо, так и при приеме активного препарата, на 1 неделе лечения, то есть, задолго до начала клинической пользы. Таким образом, эти изменения не были связаны с клиническим ответом, а, скорее, они были связаны с ожиданием клинической пользы. Кроме того, такие изменения не могли наблюдаться у возможных нереспондентов на препарат через 1 неделю или у людей, реагирующих на препарат через 6 недель, когда антидепрессивный ответ был хорошо отлажен, в соответствии с ожиданием ответа 42).
В другом исследовании визуализации головного мозга, в котором были использованы как ПЭТ, так и фМРТ, Скотт и др. 43) проверили корреляцию между отзывчивостью на плацебо и на денежное вознаграждение. Используя модель экспериментальной боли у здоровых испытуемых, они обнаружили, что отзывчивость на плацебо была связана с активацией дофамина в прилежащем ядре, что оценивалось с использованием ПЭТ связывания рецептора с раклопридом in vivo. Те же пациенты были затем протестированы с использованием фМРТ относительно реакции на денежное вознаграждение в прилежащем ядре. Была обнаружена корреляция между ответами на плацебо и деньги: чем больше были ответы прилежащего ядра на денежное вознаграждение, тем сильнее были и ответы на плацебо. Та же группа 44) изучала эндогенные опиоидные и дофаминергические системы в различных областях мозга, в том числе, в прилежащем ядре. Пациенты проходили болевое испытание два раза, в отсутствие и в присутствии плацебо с ожидаемыми обезболивающим действием. Используя ПЭТ с 11С-меченым раклопридом для анализа дофамина и 11C-карфентанила для изучения опиоидов, было установлено, что плацебо индуцировало активацию опиоидной нейротрансмиссии в передней части поясной извилины, орбитофронтальной и островной коре головного мозга, прилежащем ядре, миндалевидном теле, и центральном сером веществе головного мозга. Дофаминергическая активация наблюдалась в вентральных базальных ганглиях, в том числе, прилежащем ядре. И дофаминергическая, и опиоидная активность были связаны как с ожиданием, так и с воспринимаемой эффективностью плацебо. Более выраженные ответы на плацебо были связаны с большей дофаминовой и опиоидной активностью в прилежащем ядре. С другой стороны, реакции ноцебо, связанные с увеличением боли, были связаны с дезактивацией дофамина и опиоидов. Таким образом, эффекты плацебо и ноцебо, как представляется, связаны с противоположными ответами дофамина и эндогенных опиоидов в распределенной сети регионов, входящих в систему вознаграждения и мотивации. Аналогичные результаты были получены в более позднем исследовании 45).
Нейронная сеть плацебо аналгезии
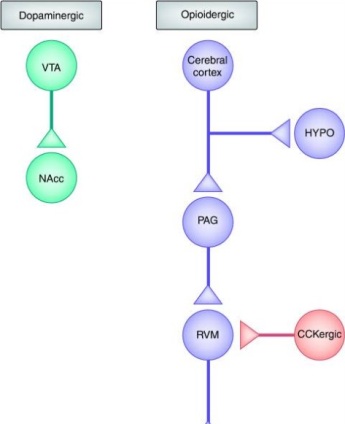
В нескольких нейрофармакологических и нейровизуализационных исследованиях не изучались ни механизмы тревоги, ни механизмы вознаграждения, что делало невозможным конкретное определение того, были ли связаны наблюдаемые ответы плацебо с уменьшением тревожности или с активацией системы вознаграждения. По всей вероятности, здесь также играют определенную роль тревога и / или механизмы вознаграждения, в зависимости от условия эксперимента. В любом случае, эти исследования предоставили доказательства того, что комплексная нейронная сеть участвует в анальгетической реакции на плацебо и в повышенной болевой реакции на ноцебо. Предложенная схема изображена на рисунке 1. Передача боли блокируется нисходящей системой модулирования боли, которая берет свое начало в коре головного мозга. В действительности, было установлено, что при введении плацебо активируются несколько кортикальных областей, таких как передняя часть поясной извилины и дорсолатеральная префронтальная кора 46). Эта активация затем распространяется на всю нисходящую систему модулирования боли, включая гипоталамус, центральное серое вещество и ростральный вентромедиальный отдел продолговатого мозга
47), и достигает спинного мозга, где, вероятно, будет наблюдаться торможение нейронов спинного рога. Нейрофармакологические исследования показали, что эта система является опиоидергической, поскольку опиоидные антагонисты блокируют плацебо обезболивание 48), а также in vivo связывание с рецептором показало активацию μ-опиоидных рецепторов во время плацебо аналгезии 49). Дофаминергическая система вознаграждения, в которой дофаминергические нейроны в вентральной области покрышки проецируются к прилежащему ядру, также участвует 50). Этим опиоидергическим и дофаминергическим сетям противодействует, по меньшей мере, два механизма, которые лежат в основе ноцебо гипералгезии. С одной стороны, предполагалось, что система CCK антагонизирует опиоидергическую систему на разных уровнях, например, в ростральном вентромедиальном отделе продолговатого мозга 51). С другой стороны, дезактивация μ-опиоидных и D2-D3 дофаминовых рецепторов происходит в прилежащем ядре во время ноцебо гипералгезии 52).
ОБУЧЕНИЕ ОТВЕТУ НА ПЛАЦЕБО
Обучение является еще одним механизмом, который имеет центральное значение для отклика на плацебо. Пациенты, которые страдают от болей, например, головных болей, регулярно употребляющие аспирин, могут ассоциировать форму, цвет и вкус таблетки с уменьшением боли. После многократного употребления, если им дадут сахарную пилюлю, напоминающую аспирин, у пациентов будет наблюдаться уменьшение боли. Не только форма, цвет и вкус таблетки могут быть связаны с клиническим улучшением, но и бесчисленное множество других стимулов, такие как больница, диагностическое и терапевтическое оборудование, а также качества медицинского персонала. Механизм, лежащий в основе этого эффекта – выработка условного рефлекса, при котором условный (нейтральный) раздражитель, например, цвет и форма таблетки, может стать эффективным в стимулировании снижения симптома, если он будет несколько раз связан с безусловным раздражителем, то есть, активным веществом, содержащимся в таблетке. Этот тип ассоциативного обучения может представлять собой основу многих эффектов плацебо, в которых плацебо сам по себе является условным (нейтральным) стимулом. В 1960-е годы Herrnstein (Herrnstein RJ. Placebo effect in the rat. Science. 1962;138:677–678) обнаружил, что инъекция скополамина вызывала двигательные изменения у крыс, и что такие же двигательные изменения наблюдались после инъекции физиологического раствора (плацебо) после инъекции скополамина. Аналогичный эффект также присутствует в организме человека. Например, уже давно известно, что применение плацебо после введения препаратов более эффективно, чем когда оно используется в первый раз 53). Если плацебо дается в первый раз, то реакция на плацебо может быть, однако она будет небольшой. Если плацебо вводят после двух предыдущих приемов эффективного болеутоляющего средства, обезболивающий эффект плацебо гораздо сильнее 54), что свидетельствует о том, что эффект плацебо является обучающим явлением. В действительности, величина плацебо аналгезии зависит от предыдущего опыта обезболивающих эффектов 55). В начале 1930-х годов, Tolman 56) не согласился с точкой зрения о том, что условный рефлекс – это автоматическое бессознательное явление, которое происходит из-за временной близости между условным и безусловным раздражителями. В последующие годы, условный рефлекс был переосмыслен в познавательном плане на основании того, что условный рефлекс зависит не только от сочетания условных и безусловных раздражителей, но и от информации, которая содержится в условном раздражителе 57). Другими словами, условный рефлекс приведет к ожиданию того, что за данным событием последует еще одно событие, и это происходит на основе информации о том, что условный раздражитель связан с безусловным раздражителем 58). Действительно, в настоящее время имеются убедительные доказательства того, что эффект плацебо представляет собой явление, связанное с обучением, которое может быть основано на различных механизмах, от бессознательного условного рефлекса до когнитивного обучения, такого как создание и усиление ожиданий.
Павловский условный рефлекс
Поведенческий условный рефлекс можно во всех отношениях представить себе как эффект плацебо. В действительности, нейтральный стимул, например, физиологический раствор или сахар, может вызывать физиологическую реакцию после процедуры ассоциативного обучения. Это было экспериментально показано, по меньшей мере, в рамках двух систем: иммунной и эндокринной системах. Некоторые из первых убедительных доказательств того, что иммунологические ответы могут быть поведенчески обусловлены, были получены в длинной серии экспериментов, проведенных в 1970-х и 1980-х годах. Используя парадигму создания условного рефлекса отвращения вкуса у крыс, Ader и Cohen 59) соединили ароматизированный питьевой раствор (сахарин) с иммуносупрессивным лекарством циклофосфамид. Затем крыс иммунизировали эритроцитами барана. Через 6 дней тем крысам вновь дали сахарин во время антигенной стимуляции. У них были обнаружены более низкие титры гемагглютинирующих антител по сравнению с обученными животными, которым повторно не давали сахарин, необученными животными, получавшими сахарин, и группой плацебо. Таким образом, сахарин был способен имитировать иммунодепрессивное действие циклофосфамида. Эти эффекты были подтверждены другими исследованиями на животных 60). Условные иммунные реакции могут также наблюдаться у человека. Например, Goebel и др. 61) представили убедительные доказательства того, что в организме человека возможна поведенческая обусловленность иммуносупрессии. Повторные ассоциации между циклоспорином А и ароматизированным напитком индуцировали кондиционированную иммуносупрессию у здоровых добровольцев мужского пола, у которых ароматизированный напиток вызывал подавление иммунных функций, что оценивалось с помощью мРНК экспрессии интерлейкина-2 (IL-2) и интерферона-гамма (IFN-gamma), экстракорпорального высвобождения IL-2 и IFN-gamma, а также пролиферации лимфоцитов. Интересно отметить, что эффекты условного раздражителя были такими же, как специфические эффекты циклоспорина А. В действительности, циклоспорин А связывается с циклофилинами, что приводит к ингибированию внутриклеточной фосфатазы кальциневрина, которая затем селективно уменьшает экспрессию некоторых цитокинов, таких как IL-2 и IFN-gamma, и, в конечном итоге, приводит к подавлению функции Т-клеток. Последующее исследование той же группы ученых предположило, что для развития иммунных условных эффектов будет необходимо проведение более одного ассоциативного обучения 62), подчеркивая тем самым важную роль обучения в плацебо отзывчивости. В другом клиническом исследовании, Goebel и др. 63) исследовали, индуцируются ли эффекты антагониста гистаминового рецептора 1 (H1) у пациентов, страдающих от аллергии на пылевого клеща, используя процедуру создания поведенческого условного рефлекса. На протяжении всей фазы ассоциации, пациенты с аллергическим ринитом, вызываемым пылевым клещом, получали один раз в день напиток с новым вкусом, а затем – стандартную дозу антагониста рецептора H1 дезлоратадина, пять дней подряд. Во время этой фазы, дезлоратадин уменьшил общие субъективные оценки симптомов, ослабил показатели испытания уколом на гистамин, а также снизил активацию базофилов ex vivo во всех группах. Через 9 дней после вымывания препарата, началось ответное испытание. Первая группа пациентов получала воду вместе с идентично выглядящими таблетками плацебо. Вторая группа вновь подвергалась воздействию напитка с новым вкусом и получала таблетку плацебо. Третья группа получала воду и дезлоратадин. Во время этого ответного испытания, в первой группе, которая повторно не подвергалась воздействию вкусового стимула, наблюдалось снижение общей оценки субъективных симптомов и результаты теста укола кожи, но не ингибирование активации базофилов. Во второй группе, повторное воздействие напитка с новым вкусом снизило активацию базофилов, результат теста укола кожи, а также субъективной симптоматики, до степени, похожей на эффекты дезлоратадина в третьей группе. Таким образом, поведенчески условные эффекты в организме человека не только могут облегчить субъективные симптомы ринита, но также могут облегчить аллергические кожные реакции и вызвать изменения иммунных функций. В попытке идентифицировать нейронный субстрат, участвующий в поведенчески кондиционированной / плацебо иммуносупрессии у крыс, использовалась связь между сахарином как условным раздражителем и циклоспорином А в качестве безусловного раздражителя, чтобы показать, что экситотоксикационные поражения специфических и дискретных областей мозга влияют на обусловленное снижение отзывчивости спленоцитов и обусловленное снижение производства цитокинов, таких как IL-2 и IFN-gamma 64). Островная кора головного мозга имеет важное значение как для приобретения, так и для вызова этих условных реакций плацебо, в то время как миндалевидное тело, вероятно, опосредует поступление висцеральной информации, необходимой в момент приобретения рефлекса. В противоположность этому, вентромедиальное ядро гипоталамуса, кажется, участвует в выходном пути к иммунной системе, который необходим для того, чтобы вызвать поведенчески условный иммунный ответ 65). В эндокринной системе также можно обнаружить подобные эффекты. Гипогликемические эффекты инсулина могут быть обусловлены сопряжением инсулина с условным раздражителем у животных 66). В организме человека может быть выработан условный рефлекс на гипогликемию. Первые исследования на человеке проводились с шизофреническими пациентами, перенесшими инсулиновую шоковую терапию, при которой в организм вводят высокие дозы инсулина. Когда инсулин был заменен на плацебо, стали наблюдаться симптомы гипогликемии, такие как изменения в потливости, усталости и частоте сердечных сокращений и артериальном давлении 67). Stockhorst и др. 68) представили доказательства того, что выработанная гипогликемия может наблюдаться в организме человека. Хотя в этих исследованиях условная реакция плацебо не была большой, образец ответ был последовательным, кроме того, могла наблюдаться тенденция к увеличению уровня инсулина. В одном исследовании была поставлена цель: выяснить, что влияет на секрецию гормона – выработка условного рефлекса, или ожидание. Исследование было направлено на дифференцирование воздействия условного рефлекса и ожидания на плазменные уровни гормона роста и кортизола 69). В первом экспериментальном условии, словесные предложения о повышении уровня гормона роста и снижении уровня кортизола были сообщены здоровым добровольцам, с тем, чтобы заставить их ожидать гормональные изменения. Эти устные указания не имеют никакого влияния на гормоны, и в действительности не было обнаружено никаких изменений их концентраций в плазме. Во втором экспериментальном условии, пациентам вводили агонист серотониновых 5-HT1B / 1D рецепторов суматриптан, который стимулирует гормон роста и ингибирует секрецию кортизола, в течение двух дней подряд, а затем на третий день заменили его на плацебо. После введения плацебо было обнаружено значительное увеличение уровня гормона роста и снижение концентрации кортизола в плазме крови. Эти выработанные эффекты наблюдались независимо от словесных предложений. Другими словами, плацебо имитировал суматриптан-индуцированное увеличение гормона роста, даже когда испытуемые ожидали снижение уровня гормона роста. Точно так же, плацебо имитировал индуцированное суматриптаном снижение уровня кортизола, даже когда пациенты ожидали повышение уровня кортизола. Можно предположить, что в данном случае условный раздражитель был представлен актом введения фармакологического агента (то есть, контекст, связанный с лечением). Эксперимент Бенедетти и др. 70) ясно показывает, что иногда не стоит ожидать ответа плацебо. Эти гормональные реакции представляют лучшие образцы бессознательных эффектов плацебо, то есть, эффект плацебо, которые имеет место в отсутствие сознательных когнитивных процессов, таких как ожидания и убеждения.
Подкрепленные ожидания
Было установлено, что в некоторых условиях, включающих процедуру выработки условного рефлекса, ответы плацебо были опосредованы ожиданием. Таким образом, предполагается, что процедура выработки условного рефлекса действует путем усиления ожиданий, а не создания бессознательного павловского ответа. Например, в классическом эксперименте, демонстрирующем роль выработки условного рефлекса в эффекте плацебо, Voudouris и др. 71) применили нейтральный неанестезирующий крем (плацебо) к одной группе испытуемых, которые были уверены, что им дают местный анестетик. Неудивительно, что некоторые из этих испытуемых продемонстрировали реакции на плацебо после болезненной электрической стимуляции. Во второй группе, при применении того же крема плацебо ученые неоднократно, без уведомления пациентов, снижали интенсивность стимуляции, с тем, чтобы заставить пациентов думать, что крем является мощным обезболивающим. Испытуемые, которые испытали «истинный обезболивающий эффект», стали охотнее отвечать на плацебо. Voudouris и др. пришли к выводу, что выработка условного рефлекса является основным механизмом, участвующим в эффекте плацебо.
Тем не менее, в эксперименте с несколько иной конструкцией было обнаружено, что когнитивный компонент вносит свой вклад в реакции на плацебо, индуцированные условным рефлексом. Монтгомери и Кирш 72) применили протокол, в котором испытуемые ощущали кожную боль благодаря ионофорезному раздражителю. Как и в исследованиях Voudouris и соавторов, втайне от испытуемых была сокращена интенсивность стимулов в присутствии крема плацебо (процедура выработки условного рефлекса), но затем испытуемых разделили на две группы. Первая группа не знала о снижении стимуляции, в то время как вторую проинформировали об изменении стимуляции и сообщили им, что крем был инертен. В этой второй группе не наблюдалось обезболивающего эффекта плацебо, что наводит на мысль, что для плацебо аналгезии необходимо сознательное ожидание. Это представляет собой очень важный момент, поскольку указывает на то, что ожидание играет главную роль, даже в присутствии процедуры выработки условного рефлекса.
Используя подобную парадигму, Price и др. 73) применили тот же крем плацебо наряду с градуированными уровнями тепловой стимуляции на трех соседних кожных областях предплечья испытуемых, чтобы добиться ожидания того, что крем А является сильным анальгетиком, крем B – слабым анальгетиком, а крем C – контрольным агентом. Сразу же после этих испытаний выработки условного рефлекса, испытуемые оценили свои ожидаемые уровни боли во время тестовых испытаний плацебо, в которых интенсивность стимула была одинаковой для всех трех областей. Испытания выработки условного рефлекса привели к ступенчатым уровням ожидаемой боли (C> B> A) для трех кремов, а также в испытаниях плацебо были зарегистрированы ступенчатые уровни фактической боли (C> B> A). Таким образом, уровень плацебо аналгезии может классифицироваться по трем смежным участкам кожи, показывая высокую степень соматотопической специфичности по отношению к плацебо аналгезии.
Эти два механизма выработки условного рефлекса и ожидания также могут работать друг против друга. Например, Бенедетти и др. 74), в течение двух дней подряд проводили в одной группе испытуемых фармакологическое предобусловливание с использованием кеторолака, неопиоидного анальгетика, а затем, на третий день, заменили активное лекарственное средство на плацебо, наряду со словесными предложениями об обезболивании. Эта процедура вызывала сильную ответную реакцию на плацебо анальгетик. Чтобы определить, была ли эта реакция на плацебо связана с фармакологическим предобусловливанием, во второй группе испытуемых была проведена та же процедура предобусловливания с кеторолаком, но на этот раз, когда пациентам давали на третий день плацебо, это сопровождалось словесными предложениями о том, что препарат повышает болевую чувствительность. Эти устные указания не только полностью блокировали обезболивание плацебо, но также могли вызывать гипералгезию (повышенную чувствительности к боли). Эти данные ясно показывают, что плацебо аналгезия зависит от ожиданий уменьшения боли, причем при отсутствии такового ожидания даже анальгетическая процедура предобусловливания становится неэффективной.
Хотя большинство исследований плацебо, по крайней мере, изначально, были ориентированы на плацебо аналгезию, важный вклад в понимание механизмов плацебо связан с болезнью Паркинсона (БП). Как и в испытаниях с болью и обезболиванием, эффект плацебо при БП обычно достигается путем введения инертного вещества, которое пациент считает эффективным противопаркинсоническим средством. Оценка улучшения двигательных характеристик является несколько более объективным показателем, чем субъективная оценка изменения боли, так как она может быть проведена экзаменатором, не знающим, что принял пациент, с использованием Единой шкалы оценки болезни Паркинсона (UPDRS). Было обнаружено, что ожидания влияют на ответы плацебо при БП, что указывает на то, что ожидания играют важную роль не только в плацебо-эффектах, влияющих на сенсорный вход, но и влияют на двигательную реакцию 75). Например, в исследовании Бенедетти и др., пациентам внушили, что им проведут глубокую стимуляцию мозга, весьма эффективное хирургическое лечение БП. В рамках двойного слепого эксперимента, в котором ни пациент, ни экспериментатор не знали, был ли стимулятор выключен, была протестирована скорость движения правой руки. Скорость движения руки оценивали с помощью анализатора движения. Стимулятор несколько раз выключали (на 4-й и 2-й неделях) до начала тестовой сессии. Каждый раз, скорость движения измерялась непосредственно перед тем, как стимулятор был выключен, и через 30 минут после этого. В день эксперимента, стимулятор поддерживали во включенном состоянии, но пациентам сказали, что он был выключен, с тем, чтобы вызвать негативные ожидания о двигательной активности (процедура ноцебо). Хотя стимулятор был включен, скорость движения уменьшилась. Такую ноцебо брадикинезию можно было полностью предотвратить путем словесных предложений о хорошей двигательной активности (процедура плацебо). Таким образом, как и при боли, скорость движения пациента с БП может быть модулирована в двух противоположных направлениях (ноцебо и плацебо), и эта модуляция происходит на основе положительных и отрицательных ожиданий пациента в отношении двигательной активности.
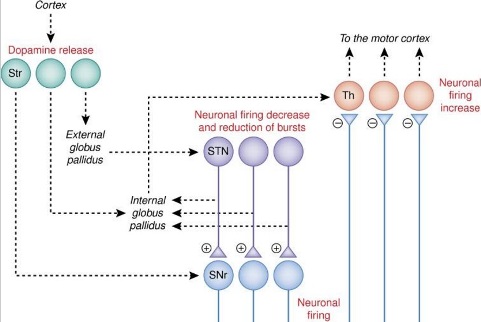
Для того, чтобы вызвать устойчивые реакции на плацебо у пациентов с болезнью Паркинсона, обычно необходимо фармакологическое предобусловливание, например, с использованием противопаркинического препарата апоморфина. В исследовании ПЭТ, с использованием агониста дофаминового рецептора D2-D3 [11C] раклоприда в качестве радиофармацевтического средства, де-ла Фуэнте-Фернандес и др. 76) получили первое доказательство того, что после введения плацебо в полосатом теле высвобождается эндогенный дофамин (см выше в раздел о механизмах вознаграждения и рисунок 2). Позже их вывод был подтвержден с аналогичными результатами, полученными с использованием фиктивной транскраниальной магнитной стимуляции в качестве плацебо 77). Подобные сильные ответы на плацебо были получены с помощью предобусловливания с апоморфином непосредственно перед интраоперационной записью одной нейронной активности в субталамическом ядре. Эти пациенты показали значительное снижение скорости выстреливания нейронов 78). Было установлено, что эти изменения в гипоталамическом ядре должны быть связаны с изменениями в активности нейронов в вентральном сетчатом слое черной субстанции и в таламусе, что предполагает, что плацебо влияет на часть базальных ганглиев и цепь таламуса, как показано на рисунке 2 79). Кроме того, было обнаружено, что эти нейрофизиологические изменения связаны как со снижением ригидности мышц, так и с субъективными сообщениями о хорошем самочувствии. Рассматривая важную роль ожиданий в ответе на плацебо у пациентов с болезнью Паркинсона и надежные ответы, полученные с помощью предыдущей выработки условного рефлекса на апоморфин, эти данные свидетельствуют о том, что в плацебо ответе участвует усиление ожиданий, то есть, когнитивное обучение.
 Актуальность двигательных ответов на плацебо не ограничивается поврежденными системами, как при БП, но может охватывать и неповрежденные двигательные системы. В недавнем исследовании были изучены эффекты эргогенных плацебо на четырехглавую мышцу, которая отвечает за вытяжение ноги относительно бедра 80). Плацебо, которым, как предполагали испытуемые, был кофеин в больших дозах, вводили дважды во время двух сеансов, и каждый раз вес, который необходимо было поднять при помощи квадрицепса, снижался, чтобы пациенты считали, что «эргогенный агент» был эффективным. После этой процедуры создания условного рефлекса, нагрузка была восстановлена до первоначального веса, и после введения плацебо оценивали как работу мышц, так и усталость. Наблюдался четкий эффект плацебо, со значительным увеличением мышечной работы и снижением мышечной усталости. Эти данные свидетельствуют о возможной модуляции при помощи плацебо механизма, отвечающего за усталость в центральной нервной системе, который обычно действует путем стимуляции мышц и устанавливает предел, чтобы уберечь их от полного истощения. Этот центральный регулятор компенсировался плацебо, что позволило увеличить мышечную производительность.
Актуальность двигательных ответов на плацебо не ограничивается поврежденными системами, как при БП, но может охватывать и неповрежденные двигательные системы. В недавнем исследовании были изучены эффекты эргогенных плацебо на четырехглавую мышцу, которая отвечает за вытяжение ноги относительно бедра 80). Плацебо, которым, как предполагали испытуемые, был кофеин в больших дозах, вводили дважды во время двух сеансов, и каждый раз вес, который необходимо было поднять при помощи квадрицепса, снижался, чтобы пациенты считали, что «эргогенный агент» был эффективным. После этой процедуры создания условного рефлекса, нагрузка была восстановлена до первоначального веса, и после введения плацебо оценивали как работу мышц, так и усталость. Наблюдался четкий эффект плацебо, со значительным увеличением мышечной работы и снижением мышечной усталости. Эти данные свидетельствуют о возможной модуляции при помощи плацебо механизма, отвечающего за усталость в центральной нервной системе, который обычно действует путем стимуляции мышц и устанавливает предел, чтобы уберечь их от полного истощения. Этот центральный регулятор компенсировался плацебо, что позволило увеличить мышечную производительность.
Социальное обучение
Социальное обучение является одной из форм обучения, при которой люди, находящиеся в обществе, учатся друг у друга путем наблюдения и имитации. Плацебо эффекты могут включать в себя также социальное обучение 81), и ожидания будущих результатов могут оказать существенное влияние на социальное обучение. Colloca и Benedetti 82) сравнили плацебо обезболивание, индуцированное социальным наблюдением, с опытом «из первых рук» через типичную процедуру выработки условного рефлекса и с одним только словесным внушением. В условиях социального наблюдения, пациенты испытывали болевые стимулы и введение плацебо после того, как они наблюдали за поведением демонстратора (в действительности симулятора), демонстрирующего обезболивающий эффект, когда болевые стимулы проявлялись одновременно с зеленым светом. Испытуемые прошли классическую процедуру выработки условного рефлекса, при которой зеленый свет был связан с незаметным уменьшением интенсивности стимула, таким образом, чтобы заставить пациентов поверить, что лечение является эффективным. Пациенты получали болезненные стимулы, после чего их устно проинструктировали, что им следует ожидать пользы от зеленого света. Было установлено, что наблюдение благотворного воздействия на демонстратора обезболивающих ответов плацебо положительно коррелировало с эмпатией. Кроме того, социальное обучение вызвало ответы плацебо, которые были аналогичны ответам, индуцируемым непосредственно через процедуру выработки условного рефлекса, в то время как одни только словесные предложения обеспечивали значительно меньший эффект. Таким образом, социальное наблюдение является мощным фактором в выработке условного рефлекса и производстве существенных ответов плацебо.
Генетические варианты отзывчивости на плацебо
Центральным вопросом в исследованиях плацебо является вопрос о том, обладает ли человек, отвечающий на плацебо, какими-либо специфическими характеристиками, которые могут надежно идентифицировать его априори в качестве «плацебо ответчика». Ответ на этот вопрос важен как для дизайна клинических испытаний, так и для персонализированной оптимизации терапии. Результаты до сих пор были весьма неубедительными. Было показано, что демографические, социально-психологические, личностные и поведенческие переменные играют определенную роль в ответе на плацебо, но все эти факторы непоследовательно присутствует в различных испытаниях 83). Тем не менее, недавно были обнаружены некоторые генетические варианты, демонстрирующие особенную чувствительность к плацебо, что подчеркивает возможную роль генетических факторов. Стоит отметить, однако, что в настоящий момент было проведено только два генетических исследования, и, таким образом, необходимо их подтверждение и дальнейшие исследования.
Генетические варианты при социальной тревожности
Существуют некоторые экспериментальные доказательства того, что некоторые генетические варианты, связанные с серотонином, влияют на ответы на плацебо при психиатрических расстройствах 84) 85). Например, Furmark и др. использовали функциональную нейровизуализацию для изучения нейронных коррелятов снижении уровня тревоги в результате введения плацебо у пациентов с социальным тревожным расстройством. Активность мозга оценивали во время стрессовой задачи публичного выступления с использованием ПЭТ до и после 8-недельного периода лечения. Пациенты прошли генотипирование по отношению к полиморфной области, связанной с переносчиком серотонина (5-HTTLPR) и полиморфизму G-703T в промоторе гена триптофангидроксилазы-2 (TPH2). Было установлено, что сниженная активность в миндалине, связанная со стрессом, сопровождаемая реакцией на плацебо, может наблюдаться только у пациентов, гомозиготных по длинной аллели 5-HTTLPR или с вариантом G полиморфизма TPH2 G-703T, но не у носителей коротких или Т-аллелей. Кроме того, полиморфизм TPH2 был значимым предиктором клинического ответа на плацебо, при этом гомозиготность для G аллеля ассоциировалась с большим улучшением симптомов тревожности.
Генетические варианты при депрессии
Основываясь на действии плацебо на моноамины в системе вознаграждения и том, что моноаминергическая сигнализация находится под сильным генетическим контролем, Leuchter и др. 86) исследовали взаимосвязь между ответами плацебо и полиморфизмом в генах, кодирующих катаболические ферментов катехол-O-метилтрансферазы и моноаминоксидазы А у пациентов с большим депрессивным расстройством. Пациенты с полиморфизмом моноаминоксидазы A G / T (rs6323), связанной с высшей формой активности фермента (G или G / G), имели значительно более низкую величину реакции на плацебо, чем пациенты с другими генотипами. Пациенты с полиморфизмом ValMet катехол-O-метилтрансферазы, кодирующим форму низкой активности фермента (2 Met аллели) продемонстрировали статистическую тенденцию к более низкой величине реакции на плацебо. Эти данные подтверждают возможную роль генов в некоторых типах реакций плацебо; например, генетически контролируемая серотонинэргическая модуляция активности миндалины, которая связана с плацебо-индуцированным облегчением тревоги, и генетически контролируемый моноаминергический тон, который связан со степенью отзывчивости на плацебо при большом депрессивном расстройстве.
ПРЕФРОНТАЛЬНЫЙ КОНТРОЛЬ И ОТВЕТ НА ПЛАЦЕБО
Префронтальная дегенерация при болезни Альцгеймера
Одной из особенностей болезни Альцгеймера (БА) является нарушение префронтального исполнительного контроля. Конкретные аспекты этого исполнительного контроля можно проследить вплоть до определенных префронтальных областей, например, абстрактные рассуждения связаны с дорзолатеральными лобными областями, а ингибиторный контроль – с орбитальной и медиальной лобной областями 87) 88). Интересно отметить, что было обнаружено, что те же самые области мозга активируются с помощью плацебо-индуцированного ожидания пользы, например, уменьшения боли 89). При БА, серьезно страдают лобные доли, с выраженной дегенерацией нейронов в дорсолатеральной префронтальной коре, орбитофронтальной коре и передней поясной коре 90). Поэтому разумно ожидать у этих пациентов потерю отзывчивости на плацебо. Бенедетти и др. 91) изучали пациентов с болезнью Альцгеймера в начальной стадии болезни и после 1 года болезни, с целью узнать, влияет ли болезнь на компонент плацебо терапии (плацебо всегда представляет собой часть эффекта лекарственного средства, из-за чего общий результат получается более выраженным, чем эффект основного вещества, содержащегося в препарате). В этом исследовании, компонент плацебо в обезболивающей терапии коррелировал как с когнитивным статусом, определяемым с помощью тестирования батареи лобной дисфункции (FAB), так и с функциональными связями между различными областями мозга, что оценивалось с использованием электроэнцефалографического анализа связности. Было установлено, что у пациентов с болезнью Альцгеймера с уменьшенными показателями FAB наблюдалось снижение компонента плацебо в анальгезирующем лечении. Кроме того, разрушение компонента плацебо происходило, только если присутствовало сниженное соединение префронтальной доли с остальной частью мозга. Потеря этих механизмов, связанных с плацебо, снизило общую эффективность лечения, и, чтобы компенсировать эту потерю, требовалось повышение дозы для адекватного обезболивания. Это было первое исследование, показывающее, что при клиническом состоянии, которое влияет на мозг, в частности, при повреждении префронтальных долей, может произойти нарушение плацебо-психологического компонента лечения, а также, что повреждение этих префронтальных механизмов ожидания снижает эффективность анальгезирующего лечения. Согласно этой точке зрения, нарушение префронтальной связи позволит сократить связь между префронтальной долей и остальной частью мозга, поэтому механизмы плацебо и механизмы ожидания не будут работать. Существует, по крайней мере, два важных аспекта, возникающие из-за нарушения механизмов плацебо и механизмов ожидания при БА. Во-первых, снижение эффективности оперативной обезболивающей терапии подчеркивает необходимость возможного пересмотра некоторых видов терапии у пациентов с болезнью Альцгеймера, чтобы компенсировать потерю механизмов, связанных с плацебо и ожиданиями. Во-вторых, нейроанатомическая локализация механизмов, связанных с ожиданием и плацебо, говорит нам о потенциальном нарушении механизмов плацебо во всех состояниях, при которых повреждены префронтальные доли мозга, например, другие формы деменции, такие как сосудистые и лобно-височные деменции, или любое повреждение префронтальной коры.
Блокада префронтальной опиоидной нейротрансмиссии
Как уже обсуждалось в предыдущем разделе, функциональное отделение передних долей мозга от остальной части головного мозга связано с потерей отзывчивости на плацебо. Интересно, что в последние годы эта точка зрения была поддержана дезактивацией префронтальной коры в экспериментальных условиях. На основании предыдущих экспериментов по блокаде плацебо аналгезии с помощью опиоидного антагониста налоксона 92), Eippert и др 93) провели исследование с целью изучить расположение действия налоксона в головном мозге. При помощи налоксона и МР-томографии, исследователи обнаружили, что налоксон уменьшал поведенческие эффекты плацебо, а также плацебо-индуцированные реакции в корковых структурах, модулирующих боль, таких как дорсолатеральная префронтальная кора и ростральная передняя часть поясной извилины. При анализе ствола головного мозга, была также обнаружена подобная налоксону модуляция плацебо-индуцированных реакций в ключевых структурах нисходящей системы контроля боли, включая гипоталамус, центральное серое вещество и ростральный вентрамедиальный отдел мозга. Самое главное, налоксон ликвидировал увеличение связи между ростральной передней частью поясной извилины и центральным серым веществом, которое индуцировало плацебо. Поэтому, как и при префронтальной дегенерации в случае БА, обезболивающие ответы на плацебо разрушались фармакологической блокадой префронтальной опиоидергической функции в экспериментальных условиях.
Префронтальная инактивация при помощи транскраниальной магнитной стимуляции
Префронтальная дегенерация при болезни Альцгеймера и фармакологическая блокада префронтальной опиоидергической передачи не являются единственными условиями, при которых нарушаются ответы плацебо. Недавно была использована повторяющаяся транскраниальная магнитная стимуляция (пТМС) для инактивации префронтальной коры головного мозга, в частности, дорсолатеральной префронтальной коры головного мозга, во время реакции на болеутоляющее плацебо 94). Известно, что пТМС угнетает корковую возбудимость целевой области коры головного мозга; таким образом, она представляет собой отличный экспериментальный подход для исследования того, как потеря префронтального контроля может повлиять на сложные когнитивные функции, такие как реакции на плацебо, индуцированные ожиданием. В парадигме тепловой боли, Krummenacher и др. использовали неинвазивную, низкочастотную пТМС для того, чтобы быстро остановить левую и правую дорсолатеральную функции префронтальной коры, или использовали транскраниальное стимулирующее устройство как плацебо, перед применением процедуры плацебо обезболивания, индуцированной ожиданием. Было установлено, что, в то время как плацебо значительно повышало болевой порог, пТМС полностью блокировало плацебо аналгезию. Таким образом, инактивация префронтальных областей с помощью транскраниальной магнитной стимуляции имеет те же эффекты, какие индуцируются фармакологической блокадой или префронтальной дегенерацией при болезни Альцгеймера. На основании всех этих исследований, нормальное функционирование префронтальных областей, а также нисходящей сети, модулирующей боль, с которой они связаны 95), по-видимому, является критическим для плацебо отзывчивости. При потере префронтального контроля, также наблюдается потеря реакции на плацебо 96).
Клиническое значение
На основании нейробиологических выводов, представленных в этом обзоре, становится ясно, что каждый раз, когда используется медицинское лечение, активируется сложный каскад биохимических событий при помощи нескольких социальных стимулов. Эти события неизбежно будут способствовать ответам, наблюдаемым при введении лекарственного средства. Другими словами, препараты вводятся не в вакуум, а в сложную биохимическую среду, которая варьируется в зависимости от когнитивного / аффективного состояния пациента и предыдущего воздействия других фармакологических агентов. Например, как показано на рисунке 3a, когда представлен шприц (или любой другой стимул, связанный с терапевтическим действием), пациент начинает ожидать терапевтического эффекта, и его мозг начинает активацию различных биохимических путей, таких как опиаты, ССК и дофамин (стадия 1). На стадии 2, препарат вводят через шприц, и его действие, например, обезболивание, может быть связано с фармакодинамическим действием самого препарата и / или вмешательством в какой-либо из этих биохимических механизмов, активированных ожиданием (шаг 3). Обусловлен ли этот обезболивающий эффект фармакодинамическим действием препарата? Или же он опосредуется взаимодействием с механизмами ожидания / плацебо? Вопрос звучит парадоксально и, на самом деле, ответ на него не так прост. Поскольку у нас нет априорного знания того, какие фармакологические агенты действуют на механизмы ожидания / плацебо (да и вообще почти все лекарства могут действовать благодаря этим механизмам), мы никогда не узнаем, как именно будет происходить наблюдаемый эффект. Он может быть связан с действием препарата при механизмах плацебо или, в качестве альтернативы, он может быть связан с конкретным фармакодинамическим действием препарата. Это было названо «принципом неопределенности» 97). Согласно этому принципу, невозможно с уверенностью оценить происхождение действия фармакологического агента, так как его фармакодинамическое действие сопровождается актом его введения. Другими словами, когда лекарство дается пациенту, сам акт введения (т.е. психосоциальный контекст) может влиять на систему и изменять ответ на препарат.
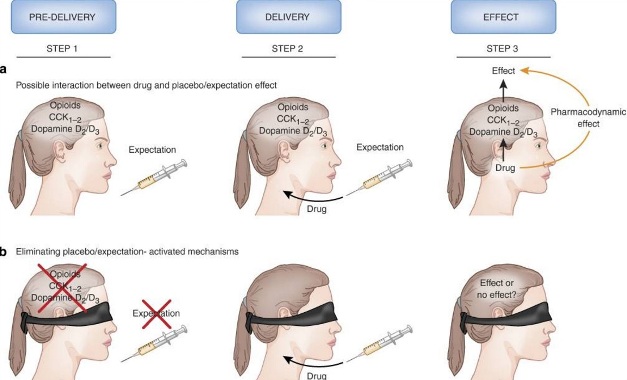 Существует способ преодолеть связь между действием препаратов и эффектами плацебо / ожидания. Это может быть сделано путем, так сказать «глушения» механизмов ожидания, например, за счет устранения плацебо (психосоциального) компонента, например, в случае, когда пациент не знает, что проводится медицинская терапия (4б), и последующего анализа фармакодинамического эффекта лечения, без каких-либо психологических составляющих 98). С этой целью, лекарства доставляются через скрытые инфузии при помощи машин. Такие инфузии можно вводить с помощью управляемых компьютером инфузионных насосов, которые заранее запрограммированы для того, чтобы выдавать лекарства в нужное время. Решающим фактором является то, что пациенты не знают, что им впрыскивается препарат, поэтому они не имеют никаких ожиданий о его терапевтическом эффекте. Это отличается от открытого введения, используемого в повседневной медицинской практике, когда препараты даются открыто и пациенты ожидают положительного клинического эффекта. Таким образом, открытые инъекции препарата обеспечивают ожидаемое лечение, в то время как скрытая инъекция представляет неожиданную терапию.
Если препарат на рис. 3а действительно эффективен и имеет только специфическое фармакодинамическое действие, не должно быть никакой разницы между его открытым (рис 4а) и скрытым (4б) введением, поскольку он не действует на нейротрансмиттеры, активируемые ожиданием. В противоположность этому, если препарат на рис.4А не имеет каких-либо конкретных фармакодинамических действий и его действие обусловлено только активированием нейротрансмиттеров, связанных с ожиданием, его скрытое введение (4б) полностью ликвидирует наблюдаемый эффект. Действительно, исследование, проведенное Бенедетти и соавт. 99), показало, что антагонист ССК индуцировал более сильное обезболивание, чем плацебо, что предполагает, что этот препарат является хорошим анальгетиком. Однако, этот вывод оказался ошибочным, так как скрытая инъекция того же антагониста CCK была совершенно неэффективной, что говорило о том, что препарат не имел никакого фармакодинамического анальгезирующего действия, и что он способствовал увеличению плацебо-активированного высвобождения эндогенных опиоидов. Таким образом, анальгетик, испытываемый в соответствии с классической методологией клинических испытаний, потенциально может иметь лучший отклик, чем плацебо, даже если он не обладает обезболивающим действием. Задачей на будущее является лучшее понимание и ответ на вопрос: должны ли мы рассматривать препарат, который действует на механизмы ожидания, эффективным, или нет? Или, другими словами, в этом исследовании 100), должны ли мы считать антагонист ССК болеутоляющим средством или нет?
Существует способ преодолеть связь между действием препаратов и эффектами плацебо / ожидания. Это может быть сделано путем, так сказать «глушения» механизмов ожидания, например, за счет устранения плацебо (психосоциального) компонента, например, в случае, когда пациент не знает, что проводится медицинская терапия (4б), и последующего анализа фармакодинамического эффекта лечения, без каких-либо психологических составляющих 98). С этой целью, лекарства доставляются через скрытые инфузии при помощи машин. Такие инфузии можно вводить с помощью управляемых компьютером инфузионных насосов, которые заранее запрограммированы для того, чтобы выдавать лекарства в нужное время. Решающим фактором является то, что пациенты не знают, что им впрыскивается препарат, поэтому они не имеют никаких ожиданий о его терапевтическом эффекте. Это отличается от открытого введения, используемого в повседневной медицинской практике, когда препараты даются открыто и пациенты ожидают положительного клинического эффекта. Таким образом, открытые инъекции препарата обеспечивают ожидаемое лечение, в то время как скрытая инъекция представляет неожиданную терапию.
Если препарат на рис. 3а действительно эффективен и имеет только специфическое фармакодинамическое действие, не должно быть никакой разницы между его открытым (рис 4а) и скрытым (4б) введением, поскольку он не действует на нейротрансмиттеры, активируемые ожиданием. В противоположность этому, если препарат на рис.4А не имеет каких-либо конкретных фармакодинамических действий и его действие обусловлено только активированием нейротрансмиттеров, связанных с ожиданием, его скрытое введение (4б) полностью ликвидирует наблюдаемый эффект. Действительно, исследование, проведенное Бенедетти и соавт. 99), показало, что антагонист ССК индуцировал более сильное обезболивание, чем плацебо, что предполагает, что этот препарат является хорошим анальгетиком. Однако, этот вывод оказался ошибочным, так как скрытая инъекция того же антагониста CCK была совершенно неэффективной, что говорило о том, что препарат не имел никакого фармакодинамического анальгезирующего действия, и что он способствовал увеличению плацебо-активированного высвобождения эндогенных опиоидов. Таким образом, анальгетик, испытываемый в соответствии с классической методологией клинических испытаний, потенциально может иметь лучший отклик, чем плацебо, даже если он не обладает обезболивающим действием. Задачей на будущее является лучшее понимание и ответ на вопрос: должны ли мы рассматривать препарат, который действует на механизмы ожидания, эффективным, или нет? Или, другими словами, в этом исследовании 100), должны ли мы считать антагонист ССК болеутоляющим средством или нет?
БУДУЩИЕ НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ
Несмотря на недавнее увеличение нейробиологических исследований плацебо и недавних выводов, которые помогут нам лучше понять биологию человека и клиническую практику, некоторые вопросы требуют дальнейшего уточнения и многие вопросы до сих пор остаются без ответа. Прежде всего, нам нужно знать, где, когда и как действуют плацебо при различных заболеваниях и терапевтических вмешательствах, а также было бы интересно проверить влияние фармакологического условного рефлекса для различных классов лекарственных средств, таких как иммуносупрессивные препараты и гормонально-стимулирующие агенты. Кроме того, требуется более глубокое понимание влияния ожидания и условного рефлекса в различных типах реакций на плацебо, и это, безусловно, поможет выявить социальные, психологические и нейробиологические детерминанты различных эффектов плацебо. Последний неразрешенный вопрос: почему некоторые испытуемые реагируют на плацебо, в то время как другие не реагируют на него? Этот вопрос является критической точкой, и он может быть выяснен путем проведения дальнейших исследований условного рефлекса и генетических механизмов.










