Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Софора (Софора желтоватая)
 Растение софора желтоватая представляет собой средство традиционной китайской медицины, которое используется против опухолей, при вирусном гепатите, энтерите, вирусном миокардите, аритмии и заболеваниях кожи. Иногда упоминается как Кушэнь или Ку Шэнь, и в рамках традиционной китайской медицины обладает «охлаждающими» и противовоспалительными свойствами.1)
Растение софора желтоватая представляет собой средство традиционной китайской медицины, которое используется против опухолей, при вирусном гепатите, энтерите, вирусном миокардите, аритмии и заболеваниях кожи. Иногда упоминается как Кушэнь или Ку Шэнь, и в рамках традиционной китайской медицины обладает «охлаждающими» и противовоспалительными свойствами.1)
Также известна как: Ку Шэнь, Кушэнь, Ку-Шэнь. Является средством для роста и улучшения качества волос.
Строение
В целом, софора желтоватая содержит 3.3% алкалоидов и 1.5% флавоноидов. Специфичные компоненты включают:
- Матрин в количестве 0.21-1.12 мг/г (считается основным соединением) и оксиматрин в количестве 1.94-8.77 мг/г, а также родственные по строению софоридин (0.13-0.62 мг/г) и оксисофоридин2)
- Изокураринон и норкураринон, оба являются модификациями кураринона3)
- Кураринол (а также неокураринол и норкураринол)
- Кураидин, кураридин и кушенол H,K (пренилированные флавоноиды) и X
- Кушекарпины A-C и кушинол A-O
- Леахианон G
- L-Маакиаин
- Трифолирхизин4)
- Софофлавесценол (пренилированный флавоноид; 5-метокси-7,4‘-дигидрокси-8-(3,3-диметилаллил)флавонол), при этом в одном исследовании получили 27 мг из спиртового экстракта 9 кг свежих плодов, а в другом получили 600 мг из 10 кг в виде метиленхлоридного экстракта;5) точное количество не определено
- Синапиевую кислоту
Фрагмент полисахаридов состоит из:
- SFPW1 в количестве 0.32% сухого веса6)
Содержит множество биологически активных веществ, но матрин и две родственные структуры наиболее широко упоминаются в качестве «активных» составляющих софоры желтоватой, хотя некоторые другие соединения (пренилированные флавоноиды) могут быть биологически активными. Матрин также был обнаружен в других видах софоры, включающих С. полураспростертую (Шаньдоугэнь), С. тонкиненсис и С. лисохвостную (Кудоуцзы). Матрин в некоторых случаях используется в качестве основного биомаркера качества растения семейства софора в связи с тем, что встречается во всех видах этого растения.7)
Фармакология
Абсорбция
Чистый матрин (компонент софоры) обладает приблизительной пероральной биологической усвояемостью в 44% у крыс.8)
Сыворотка
У крыс, принимавших концентрированный экстракт софоры желтоватой (0.56г/ кг), был измерен уровень матрина, оксиматрина и оксисофокарпина в плазме, в результате чего были определены фармакокинетические параметры; Матрин обладает значением Cmax в 2529+/-1029мкг/л при Tmax 2.08+/-0.49 с периодом полувыведения в 9.75+/-2.76ч, дающим значение средней концентрации в моче в 22,688+/-8493мкг/ч/л, для оксиматрина значение Cmax составляет 408+/-156.7мкг/л при Tmax в 1.58+/-0.20ч с периодом полувыведения в 3.44+/-2.51ч, дающим среднюю концентрацию в моче в 908.7+/-215.8мкг/ч/л, оксисофокарпин имеет значение Cmax в 207.2+/-161.6мкг/л при Tmax в 1.42+/-0.86ч с периодом полувыведения в 2.68+/-0.96ч, дающим среднюю концентрацию в моче 453.7+/-134.8мкг/ч/л.
Метаболизм
Экстрагирование матрина в печени достаточно низкое, при этом 0.27% пероральной дозы были обнаружены в желчных кислотах после перорального приема.9) Матрин (и родственные по строению соединения) не подвергаются в значительной степени метаболизму после перорального приема10), за исключением возможного преобразования оксиматрина в матрин в желудочно-кишечном тракте до поглощения. При внутривенном введении оксиматрин в незначительной степени метаболизируется в матрин (приблизительно 19.1+/-5.4%, если судить по средней концентрации в моче матрина по сравнению с оксиматрином). Большей частью матрин не метаболизируется.
Неврология
Ацетилхолин
Один из флавоноидов софоры желтоватой, софорафлавесценол, ингибирует и ацетилхолинэстеразу, и сывороточную бутирилхолинэстеразу со значениями ИК50 в 8.37+/-0.28 и 8.21+/-0.37 микромоль, при этом оба значения уступают активному контролю галантамину (0.13 микромоль, 0.96+/-0.05 микромоль). Софофлавесценол также ингибирует фермент бета-секретазы (BACE) с ИК50 в 10.98+/-1.18 микромоль (незначительно менее эффективна, чем кверцетин со значением ИК50 в 7.23+/-0.55 микромоль).
Отек
У крысиных моделей ишемии головного мозга, софора желтоватая оказывает защитное действие против отека при предварительном приеме (свидетельствует о том, что это является результатом ингибирования протеинкиназы C).
Травма
В моделях очаговой ишемии, ингибирование NF-kB является источником защитного действия.11) Масштаб инфаркта вследствие ишемии был ослаблен в дозозависимой манере введением 25-50 мг/ кг матрина, при этом степень уменьшения масштаба инфаркта соотносится со степенью ингибирования NF-kB, наблюдаемой в естественных условиях,[21] и, предположительно, происходит за счет сохранения цитоплазматического IκBα. Аналогичное защитное действие наблюдается относительно оксиматрина, что связано с противовоспалительными механизмами, которые снова связаны с NF-kB, и может также охватывать понижающую регуляцию TLR4, который был повышен в результате ишемического повреждения и подавлен инъекциями 120 мг/ кг оксиматрина.12) Обладает защитным действием против повреждения мозга (в некоторой степени предотвращая воспаление), но с маленькой магнитудой, при этом в исследованиях на животных использовались инъекции выделенного матрина в высоких дозах; возможно, это не слишком применимо к пероральному приему софоры желтоватой.
Глутаминергическая передача сигнала
Оксиматрин причастен к ослаблению повышения субэлемента NMDA-рецептора (NR2B) в ответ на возбуждение с последующим ослаблением токсичности в глутаминергических нейронах с высоким уровнем стимула.13)
Продолжительность жизни
Теломераза
Софора желтоватая ингибирует выраженность в мРНК человеческой обратной транскриптазы теломеразы (hTERT) и последующую активацию фермента теломеразы. Это было отмечено в раковых клетках толстого кишечника (HT-29 и SW1116) и двух линиях клеток карциномы печени (HepG2, QGY).14) Ингибирует теломеразу, но на сегодняшний день все свидетельства касаются линий раковых клеток (в которых теломераза иногда дисрегулирована); на данный момент отсутствуют свидетельства относительно ингибирования теломеразы в здоровых клетках, и точка зрения, что софора обладает способствующими продолжительности жизни свойствами, не может быть поддержана.
Взаимодействие с обменом глюкозы
Альдозоредуктаза
Ингибирование альдозоредуктазы может стать терапевтическим средством при диабете за счет предотвращения связанных с диабетом побочных эффектов, таких как ретинопатия. В лабораторных условиях, флавоноид софорафлавесценол может ингибировать ферменты рекомбинантной альдозоредуктазы в крысиных кристалликах и у человека со значениями ИК50 в 0.3+/-0.06 и 0.17+/-0.03 микромоль, при этом последнее равно активному контролю эпалрестату. Способность препятствовать конечным продуктам гликации была более эффективна, чем у аминогуанидина (пимагедин, препарат, когда-то использовавшийся при диабетической ретинопатии). Пренилированная боковая цепь софорафлавесценола может объяснить, почему он более эффективен в качестве ингибитора альдозоредуктазы, чем его базовая структура, кемпферол.15)
Воспаление и иммунология
Механизмы
Матрин16) и оксиматрин, получаемые из софоры желтоватой, способны снижать активацию NF-kB в результате травмы, не оказывая влияния на уровень ядерного NF-kB без воспалительного стимула. Другие соединения ингибируют вызванную ФНО-α активацию NF-kB (в клетках HepG2), что может быть возможным механизмом, объясняющим действие NF-kB. Пренилированные флавоноиды из софоры (кураринон) причастны к ингибированию ERK/RSK2, что прерывает воспалительную передачу сигнала из цитокинов, таких как ИЛ-6. Различные некалорийные биологически активные вещества оказывают общее противовоспалительное действие.
Макрофаги
Одно исследование, использовавшее очищенные полисахариды (0.32% сухого веса; носят название SFPW1), отметило, что эти полисахариды были способны повышать цитотоксичность макрофагов (фагоцитоз) в отношении исследуемой линии опухолевых клеток; клеток H22. Это сопровождалось иммуностимулирующим влиянием на макрофаги с повышением уровня окиси азота и индуцибельной NO-синтетазы.
Взаимодействие с раком
Рак молочной железы
Одно исследование в лабораторных условиях нечувствительных к эстрогену клеток рака молочной железы отметило, что дисрегуляция провоспалительной передачи сигнала может лежать в основе антипролиферативного действия софоры желтоватой; связывается с флавоноидом курариноном. Аналогичное действие наблюдалось относительно матрина, когда в клетках рака молочной железы MBA-MB-231 матрин подавлял вызванное ЭФР/ФРЭС возбуждение протеинкиназой B/фосфоинозитол-3-киназой NF-kB; все эти провоспалительные механизмы лежат в основе метастаза рака молочной железы. Протеинкиназа B может не активироваться за счет повышения уровня протеинтирозинфосфатазы, которое усиливается в связи со снижением mIR-21 (предположительно представляет собой другой механизм действия матрина).17) Одно исследование продемонстрировало синергизм с трихостатином A (ингибитор гистондеацетилазы), который также был отмечен в клетках рака легких по отношению к ФРЭС, также синергична с выборочным ингибитором ЦОГ-2 целекоксибом. Растение обладает антипролиферативными свойствами и синергично с трихостатином A и целекоксибом, ингибиторами гистондеацетилазы и ЦОГ-2 соответственно. Отсутствуют исследования относительно человека и животных. Нутрицевтики, способные ингибировать гистондеацеталазу (сульфорафан) и ЦОГ-2 (спирулин), могут быть синергичны, но это не было наглядно продемонстрировано.
Рак желудка
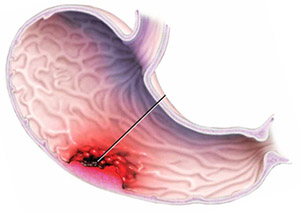 Выделенный матрин дефосфорилирует 4E-BP1, который, в свою очередь, ингибирует фактор роста eIF4E; оба эти явления были обнаружены в клетках рака желудка MKN45, что, предположительно, связано с ингибированием ERK1/2. Возбуждение аутофагии и апоптоза было выявлено в равной степени в клетках рака желудка SGC-7901, при этом последний был связан с повышением каспазы-3; этот механизм (в лейкемических клетках) вызвал митохондриальную дестабилизацию.18)
Выделенный матрин дефосфорилирует 4E-BP1, который, в свою очередь, ингибирует фактор роста eIF4E; оба эти явления были обнаружены в клетках рака желудка MKN45, что, предположительно, связано с ингибированием ERK1/2. Возбуждение аутофагии и апоптоза было выявлено в равной степени в клетках рака желудка SGC-7901, при этом последний был связан с повышением каспазы-3; этот механизм (в лейкемических клетках) вызвал митохондриальную дестабилизацию.18)
Рак печени
Апоптоз достигал 28.91% (0.5 мг/мл), 34.36% (1 мг/мл) и 38.80% (1 мг/мл) в клетках HepG2 наряду с повышенной выраженностью аутофагических белков Bax и беклина-1, при этом данные значения апоптоза были значительно ослаблены при инкубации с ингибитором аутофагии 3-MA.19) Апоптоз наблюдался в фазе G1 клеточного цикла.
Рак предстательной железы
Матрин обладает ингибирующим потенциалом в отношении нечувствительных к андрогену клеток рака предстательной железы (PC-3)20), а также в отношении андроген-чувствительных раковых клеток (LNCaP).21) В последнем исследовании, концентрации 0.5-2.0 г/л выделенного матрина в течение 36 часов продемонстрировали дозо- и времязависимое ингибирование роста до 56.8% в максимальной дозе и с в сочетании с временным фактором (2 г/л в течение 36 часов), хотя наблюдалось наиболее значительное снижение уровня андрогенного рецептора, который был снижен до более чем 50% в минимальной дозе спустя 24 часа. Это снижение уровня андрогенного рецептора было отмечено и в других исследованиях. Матрин может оказывать терапевтическое действие против рака предстательной железы, на сегодняшний день исследования на животных отсутствуют; может использоваться с целью нормализации чрезмерного роста андрогенного рецептора, но также обладает и некоторыми другими механизмами действия.
Лейкемия
Матрин из софоры желтоватой вызывает апоптоз в линиях клеток экспериментальной острой миелоидной лейкемии (HL-60, NB4, K562 и U937)22), а также в клетках, взятых у пациентов с острой миелоидной лейкемией, с варьирующимися значениями ИК50 в 0.56-0.99 г/л и вызывает апоптоз в 33-41.1% в зависимости от типа клеток (максимальные значения). Лежащий в основе этого действия механизм связан с дестабилизацией митохондрии и частично блокируется ингибитором каспазы-3 и активатором фосфоинозитол-3-киназы/протеинкиназы B. Введение мышам 50 или 100 мг/ кг матрина через 5 ней после введения раковых клеток в течение 17 дней привело к снижению до 87.0-89.6% размера лейкемической опухоли; действие было незначительно менее эффективным, чем у 20 мг/ кг циклофосфамида. Инъекции матрина достаточно эффективны в вызывании смерти лейкемических клеток, что незначительно отличается от циклофосфамида (стандартное лечение). Существует, по меньшей мере, одно исследование относительно лейкемии у грызунов.
Рак легких
В клетках рака легких A375, инкубированных с 0.25, 0.5, 1 или 2 мг/мл матрина, максимальная концентрация (1+) была способна повышать процент апоптотических клеток (19.66+/-0.77% при 1 мг/мл; меньше, чем в других исследованиях матрина в отношении рака), а также в значительной степени ингибировала рост клеток, как было определено на основе MTT-теста.23) Данное ингибирование роста было дозо- и времязависимым, и спустя 6 дней доза 2 мг/мл устранила (100% ингибирование) рост клеток, что было определено MTT-тестом. Данное снижение роста было отмечено в равной степени в клетках карциномы легкого A549, где 25-100 мкг/мл снизили рост до 30-48%; для вызова апоптоза необходимы более низкие концентрации. Пониженный миграционный потенциал может быть связан с понижающей регуляцией секреции ФРЭС-A из раковых клеток приблизительно до 20% от контроля при 500 мкг/мл, ФРЭС-A является сигнальной молекулой, которая способствует миграции клеток рака легкого за счет фосфоинозитол-3-киназы/протеинкиназы B. Апоптоз был отмечен в другом исследовании в клетках A549, где 50-500 мкг/мл снизили жизнеспособность клеток в дозо- и времязависимой манере (жизнеспособность клеток приблизительно до 60%, снижение до 40% при 500 мкг/мл спустя 72 часа). Данное исследование отметило, что матрин снижает соотношение Bcl-2/Bax (посредством возбуждения Bax и понижающей регуляции Bcl-2) и был синергичен с ингибитором гистондеацетилазы трихостатином A в изменении соотношения Bcl-2/Bax и вызывании апоптоза. Вызывает апоптоз (регулируемую клеточную смерть) в клетках рака легкого, но в меньшей степени, чем в других раковых клетках; Матрин обладает антипролиферативным потенциалом. Исследования на животных с раком легкого отсутствуют.
Взаимодействие с гормонами
В клетках крысиной предстательной железы типа II, активность фермента 5-альфа-редуктазы была полностью устранена при инкубации с 0.1% софоры желтоватой и ингибировалась до 50% при 0.001%.24) Что касается молекул, по своему характеру ингибирующих рецептор 5-AR, наиболее сильнодействующими являются норкураринон и изокураринон со степенью ингибирования в 51.4-94.2% при 50-200 мкг/мл и 54.4-97.1% при 50-200 мг/мл, хотя большая часть флавоноидных соединений также является ингибирующими, особенно в дозе 200 мкг/мл. Обладает значительным ингибирующим действием на фермент 5-альфа редуктазы; взаимодействие с андрогенным рецептором и сывороточным тестостероном не известно.
Воздействие на половую сферу
Эректильные свойства
Софофлавесценол является выборочным ингибитором PDE5 подобно икариину из горянки крупноцветковой, при этом было обнаружено, что метанольный экстракт сам по себе обладает значением ИК50 в отношении PDE5 в 4.77 мкг/мл, в то время как выделенный софофлавесценол имеет значение ИК50 в 0.013 микромоль (при этом другие флавоноиды из софоры желтоватой имеют значения ИК50 до 10.6 микромоль) и классифицируется скорее как смешанный ингибитор (Ki в 0.005 микромоль), чем конкурентный ингибитор типа Виагры, которая имеет ИК50 в 0.003 микромоль. Выборочность софофлавесценола в отношении PDE5 была в 31.5 раз выше, чем в отношении PDE3 и в 196.2 раз выше, чем относительно PDE4. На сегодняшний день известно, что софофлавесценол обнаруживается только в софоре желтоватой и альбиции ленкоранской (Хэ Хуань Хуа в традиционной китайской медицине). В лабораторных условиях является сильным эректогенным веществом; на сегодняшний день отсутствуют исследования, использующие пероральный прием софоры желтоватой, чтобы определить практическую ценность софофлавесценола.
Софора: применение
Волосы
В клетках дермального гребня, 50% спиртовой экстракт софоры желтоватой был способен возбуждать ИФР-1 и фактор роста кераноцитов при нанесении на спину мышей в количестве 0.2 мл 1% софоры желтоватой в течение 30 дней и связывался с более ранней фазой телогена по отношению к анагену.25) В этом исследовании фактор роста гепатоцитов и ФРЭС не были подвержены влиянию. Обладает способствующими росту волос свойствами при местном нанесении.
Кожа
 Софорафлавесценол (пренилированный флавонол) из софоры желтоватой является ингибитором тирозиназы, как и соединения куранидина, кураринон и норкураринол, со значениями ИК50 в 0.6-1.1 микромоль, 1.3-6.2 микромоль и 2.1 микромоль соответственно26), а также как кураринол и кураридинол со значениями ИК50 в 8.60+/-0.51 и 0.88+/-0.06 микромоль и софорафлаванон G с ИК50 в 6.6 микромоль. Трифолирхизин достаточно слаб (506.77+/-4.94 микромоль) в ингибировании тирозиназы, но при культивировании в клетках меланомы, B16 (а также кураринол и кураридинол) был эффективен в подавлении более чем 50% синтеза меланина (свидетельствует об активности тирозиназы) при 50 микромоль.27) Кураринол и кураридинол являются неконкурентными ингибиторами, при этом последний был в 10 раз более сильнодействующим, чем активный контроль койевая кислота.
При тестировании действия против грибной тирозиназы, ингибирующий потенциал софоры желтоватой был выше, чем у арбутина и витамина C (использовались в качестве положительных контролей), но, хотя софора превосходит 96 из 99 протестированных в этом исследовании растений, она значительно уступает атласной шелковице и дубильным орешкам сумаха яванского при сравнении значений ИК50.
Некоторые молекулы, обычно представленные в спиртовых экстрактах, являются умеренно сильнодействующими ингибиторами тирозиназы в лабораторных условиях; этот механизм действия изучается для использования в косметике в связи с потенциальным действием на осветление кожи. На сегодняшний день отсутствуют опубликованные данные о вмешательствах, чтобы определить практически актуальную силу действия.
Софорафлавесценол (пренилированный флавонол) из софоры желтоватой является ингибитором тирозиназы, как и соединения куранидина, кураринон и норкураринол, со значениями ИК50 в 0.6-1.1 микромоль, 1.3-6.2 микромоль и 2.1 микромоль соответственно26), а также как кураринол и кураридинол со значениями ИК50 в 8.60+/-0.51 и 0.88+/-0.06 микромоль и софорафлаванон G с ИК50 в 6.6 микромоль. Трифолирхизин достаточно слаб (506.77+/-4.94 микромоль) в ингибировании тирозиназы, но при культивировании в клетках меланомы, B16 (а также кураринол и кураридинол) был эффективен в подавлении более чем 50% синтеза меланина (свидетельствует об активности тирозиназы) при 50 микромоль.27) Кураринол и кураридинол являются неконкурентными ингибиторами, при этом последний был в 10 раз более сильнодействующим, чем активный контроль койевая кислота.
При тестировании действия против грибной тирозиназы, ингибирующий потенциал софоры желтоватой был выше, чем у арбутина и витамина C (использовались в качестве положительных контролей), но, хотя софора превосходит 96 из 99 протестированных в этом исследовании растений, она значительно уступает атласной шелковице и дубильным орешкам сумаха яванского при сравнении значений ИК50.
Некоторые молекулы, обычно представленные в спиртовых экстрактах, являются умеренно сильнодействующими ингибиторами тирозиназы в лабораторных условиях; этот механизм действия изучается для использования в косметике в связи с потенциальным действием на осветление кожи. На сегодняшний день отсутствуют опубликованные данные о вмешательствах, чтобы определить практически актуальную силу действия.
Взаимодействие с другими веществами
ACAPHA
ACAPHA (противораковое средство A) – это растительная микстура из софоры тонкиненсис (2% матрина или более в расчете на вес), горца змеиного, черноголовки обыкновенной, осота короткоушкового, ясенца мохнатоплодного и диоскореи клубненосной; это сочетание способно снижать желудочную дисплазию почти до 50% после 3-5 лет ежедневного приема по сравнению с плацебо. Данный состав сам по себе связан также со снижением опухолевой нагрузки (70%) и множественности опухолей (40%) у мышей (p53, трансгенный отсутствующий опухолевый супрессорный ген), принимавших состав.28) После перорального приема ACAPHA было обнаружено, что матрин был единственной молекулой, фактически обнаруженной в плазме; свидетельствует о том, что другие растения всего лишь повышают степень поглощения. При исследовании абсорбции, 3.8 г/ кг ACAPHA (0.4% матрина) сравнивались с 15 мг/ кг матрина (одинаковые пероральные дозы матрина между группами), при этом никаких значительных различий в биологической усвояемости не было выявлено; имеет место всего лишь замедление скорости абсорбции в случае ACAPHA.
:Tags
Читать еще: Кеппра (Леветирацетам) , Лист дамианы , Массулярия заостренная , Триптеригиум Вильфорда (Tripterygium wilfordii) , Халостачин ,










