Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Тандоспирон (Седиел)
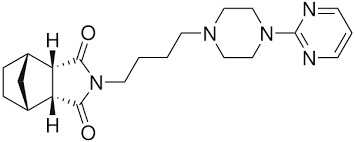
Тандоспирон (Sediel), также известный как метанопирон, является анксиолитическим и антидепрессантным препаратом, используемым в Китае и Японии, где его продает компания Dainippon Sumitomo Pharma. Он является членом класса азапироновых препаратов и тесно связан с другими азапиронами, такими как буспирон и гепирон.
- Применение: перорально
- Легальный статус: отпускается только по рецепту
- Биологический период полувыведения: 2-3 часа (3-5 часов для активного метаболита, пиримидинилпиперазина)
- Выведение: моча (70%, 0,1% в неизмененном виде)
- Формула: C21H29N5O2
- Молярная масса: 383,487 г / моль
Применение в медицине
Тандоспирон чаще всего используется для лечения тревожных и депрессивных расстройств, таких как генерализованное тревожное расстройство и дистимия. Лечение обоих состояний требует нескольких недель для начала проявления эффеков, 1) хотя при более высоких дозах наблюдались более быстрые анксиолитические реакции. Препарат также успешно использовался для лечения бруксизма 2). Тандоспирон также успешно применялся в качестве дополнительного средства для лечения когнитивных симптомов у лиц с шизофренией 3).
Побочные эффекты
К общим побочным эффектам препарата относятся:
- Головокружение
- Сонливость
- Бессонница
- Головная боль
- Желудочно-кишечные расстройства
- Сухость во рту
Побочные эффекты с неизвестной частотой включают:
- Гипотония (низкое кровяное давление)
- Дисфория
- Тахикардия
- Недомогание
- Психомоторные нарушения
Считается, что препарат не вызывает привыкания, однако известно, что он вызывает умеренные эффекты отмены (например, анорексия) после резкого прекращения приема.
Фармакология
Тандоспирон действует как мощный и избирательный частичный агонист 5-НТ1А рецептора, с величиной сродства Ki 27 ± 5 нМ 4) и собственной активностью приблизительно 55-85%. Он обладает слабым и клинически незначимым сродством к 5-HT2A (1300 ± 200), 5-HT2C (2 600 ± 60), α1-адренергическим (1600 ± 80), α2-адренергическим (1900 ± 400), D1 (41000 ± 10 000) и D2 (1700-300) рецепторам и практически неактивен в отношении к 5-HT1B, 5-HT1D, β-адренергическим и мускариновым ацетилхолиновым рецепторам, транспортеру серотонина и бензодиазепиновуму аллостерическому участку ГАМКА-рецептора. Тем не менее, имеются доказательства того, что тандоспирон обладает низкой, но значительной антагонистической активностью в отношении α2-адренергического рецептора через его активный метаболит 1-(2-пиримидинил) пиперазина (1-ПП) 5)
Тандоспирон и алкогольная абстиненция
Повторные эпизоды употребления алкоголя (запой) вызывают тревожность, депрессию и различные побочные эффекты, включая изменения в нейрогенезе. 1) Хотя участие серотонинового 1A рецептора (5-HT1A) в регуляции тревожного поведения и нейрогенеза хорошо задокументировано, его эффект на вызванную алкоголем тревогу и дефицит нейрогенеза, вызванный алкоголем, менее документирован. Используя парадигму «употребление алкоголя в темноте» (Drinking-In-the-Dark, DID) для моделирования хронического долгосрочного (12 недель) потребления алкоголя, подобного употреблению алкоголя у мышей, было показано, что селективная частичная активация 5-HT1A-рецепторов тандоспироном (3 мг/кг) предотвращает вызванное алкоголем беспокойство в ряде поведенческих тестов (закапывание мраморных шариков, приподнятый крестообразный лабиринт, открытое поле), что сопровождалось устойчивым снижением запойного потребления (1 и 3 мг / кг). Кроме того, используя тройное иммуномечение пролиферации и маркеры дифференцировки нейронов, было показано, что долгосрочное DID вызывает глубокие дефициты в нейрогенезе и спецификации участия нейронов в дорсальном гиппокампе, которые полностью меняются через 2 недели лечения с помощью 5-HT1A-частичного агониста тандоспирона (3 мг / кг / день). Результаты подтверждают предыдущие наблюдения, что 5-HT1A-рецепторы играют решающую роль в поведении, связанном с алкоголем, и связанными с ним эмоциональными и нейрогенными нарушениями. Предположительно, 5-HT1A-частичные агонисты представляют собой перспективную стратегию лечения алкоголизма.
Введение
Алкоголизм рассматривается как хроническое рецидивирующее расстройство, а развитие алкогольной зависимости – как прогрессивный цикл, включающий длительные периоды употребления тяжелых алкогольных напитков, с повторными эпизодами потребления и абстиненции, наблюдаемые при запоях.2) В обществе, злоупотребление алкоголем широко распространено, со значительно более высокими показателями совместного возникновения с эмоциональными расстройствами и расстройствами настроения, включая тревожность и депрессию 3). В свою очередь, повышенная тревожность после отмены алкоголя является ключевым фактором, способствующим тяге к алкоголю и рецидивам 4). Исследования на животных с использованием неконтингентного / принудительного введения алкоголя (например, вдыхание паров, инъекция, зонд), или контингентные модели, основанные на непрерывном доступе к алкоголю (выбор из 2 бутылок), также показали, что прекращение хронического алкогольного воздействия увеличивает стресс-реакцию 5) и депрессивное поведение, и изменяет нейрогенез гиппокампа 6). Тем не менее, ни одно исследование на сегодняшний день не изучало последствия длительных периодов (12 недель) добровольного употребления алкоголя (запой) и воздержания при тревожном поведении и распространении или дифференциации нейронов гиппокампа. Парадигма «выпивки в темноте» (DID) представляет собой модель добровольного алкогольного употребления, при котором животные имеют ежедневный ограниченный доступ к этанолу в течение двух часов, после чего следует 24-часовой период абстиненции. Используя эту процедуру, штамм мыши, употребляющий большое количество алкоголя C57Bl / 6 J, употреблял фармакологически соответствующие уровни этанола (концентрация этанола в крови ≥1,0 г / л) и демонстрировал признаки поведенческой интоксикации 7). Было показано, что у взрослых мышей, хронически подвергающихся воздействию алкоголя в течение коротких периодов (6 недель), эта процедура вызывает поведение, связанное с беспокойством и депрессией, в течение 24 часов после последней выпивки, и до 21 дня при длительной отмене 8). Система серотонина (5-гидрокситриптамина, 5-НТ) широко участвует в регуляции эмоций, импульсивности, настроении, системе вознаграждения и возбуждения. Таким образом, дисрегуляция гомеостаза серотонина участвует в развитии расстройств, связанных с тревожностью и депрессией. В соответствии с этим, глубокие функциональные изменения в передаче сигналов 5-HT наблюдались в лимбической системе после кратковременного и хронического употребления алкоголя 9). Поскольку антидепрессанты группы селективных ингибиторов обратного захвата серотонина (СИОЗС) повышают доступность 5-HT и способствуют нейрогенезу гиппокампа, который необходим для антидепрессивных эффектов 10), была установлена положительная связь между сигналом 5-HT и нейрогенезом гиппокампа с ролью рецептора 5-HT1A как в тревоге / депрессии, так и в нейрогенезе 11). Хроническое употребление алкоголя снижает регуляцию экспрессии 5-HT1A-рецептора в гиппокампе, но усиливает экспрессию и функцию рецептора 5-HT1A в ядрах шва 12). Интересно отметить, что активация 5-HT1A-рецепторов неселективным частичным агонистом буспироном уменьшала употребление алкоголя и тревогу, вызванную потреблением алкоголя 13) у грызунов. Однако, в этих конкретных исследованиях использовался протокол, при котором животные были вынуждены потреблять алкоголь, включая этанол, в жидкой диете, в качестве единственного источника питательных веществ, что делает сомнительной их мотивацию пить этанол по отношению к эмоциональным дефицитам. Кроме того, теперь признано, что буспирон не является селективным для рецепторов 5-HT1A, но также проявляет антагонистическую активность в дофаминовых D2-подобных рецепторах 14). Действительно, влияние буспирона на употребление алкоголя, а также некоторое поведение, связанное с тревожностью, опосредуется блокадой D2-подобных рецепторов 15). Более того, было продемонстрировано, что буспирон обладает комплексным действием, проявляя как анксиолитические, так и анксиогенные или моторные эффекты, у грызунов 16), что может объяснить непоследовательные результаты о пользе буспирона, зарегистрированные у алкоголиков. Вместе, эти данные позволяют предположить, что необходима дальнейшая работа для уточнения специфического вклада рецепторов 5-НТ1А как при употреблении алкоголя, так и в вызванной алкоголем тревожности. Тандоспирон является частичным агонистом 5-HT1A, который, в отличие от буспирона, представляет собой высокую селективность, в 2-3 раза выше, на дофаминовых, адренергических и других рецепторах, чем 5-НТ32. Тандоспирон – эффективный анксиолитический препарат, продаваемый как Sediel в Китае и Японии, который хорошо переносится и имеет ограниченные побочные эффекты и низкий риск злоупотребления 17). Исследования на животных также показали, что длительное лечение тандспопироном улучшает нейрогенез гиппокампа 18) и ингибирует стресс-индуцированную тревожность и нейрогенный дефицит 19). Тем не менее, способность тандоспирона уменьшать тревожное поведение и нейрогенный дефицит после длительного употребления алкоголя, не была описана. Для решения этого вопроса, мы использовали долгосрочную модель DID (от 12 до 15 недель) для исследования влияния тандспопирона относительно (1) тревоги, вызванной алкоголем, в батарее поведенческих тестов (закапывание мраморных шариков, приподнятый крестообразный лабиринт, открытое поле), (2) поддержание запойного пьянства, а также (3) дефицит алкоголя в гиппокампальном нейрогенезе. Селективная частичная активация 5-НТ1А-рецепторов тандоспироном отменяет вызванное алкоголем тревожноподобное поведение после 12 недель воздействия, что сопровождается устойчивым снижением потребления алкоголя. Кроме того, было показано, что двухнедельное лечение тандоспироном является достаточным для полного устранения нарушений в нейрогенезе гиппокампа и дефиците нейронов, вызванными 15-недельным потреблением алкоголя. В совокупности, результаты дополняют предыдущие исследования, демонстрируя интегральную роль рецепторов 5-НТ1А в эмоционально обусловленном алкогольном поведении и поведении при неврологических нарушениях, вызванных длительным употреблением алкоголя.
Результаты
Частичная активация рецепторов 5-НТ1А тандоспироном отменяет тревожноподобное поведение, вызванное отменой после 12 недель употребления алкоголя.
Чтобы оценить влияние 5-HT1A-рецепторов на тревожное поведение после отмены долговременного запоя, наблюдались эффекты 5-HT1A-частичного агониста тандоспирона (3 мг / кг) на мышах, которых подвергали 24-часовой отмене алкоголя в батарее поведенческих тестов (закапывание мраморных шариков, тест с приподнятым крестообразным лабиринтом, открытое поле) (рис.1A).
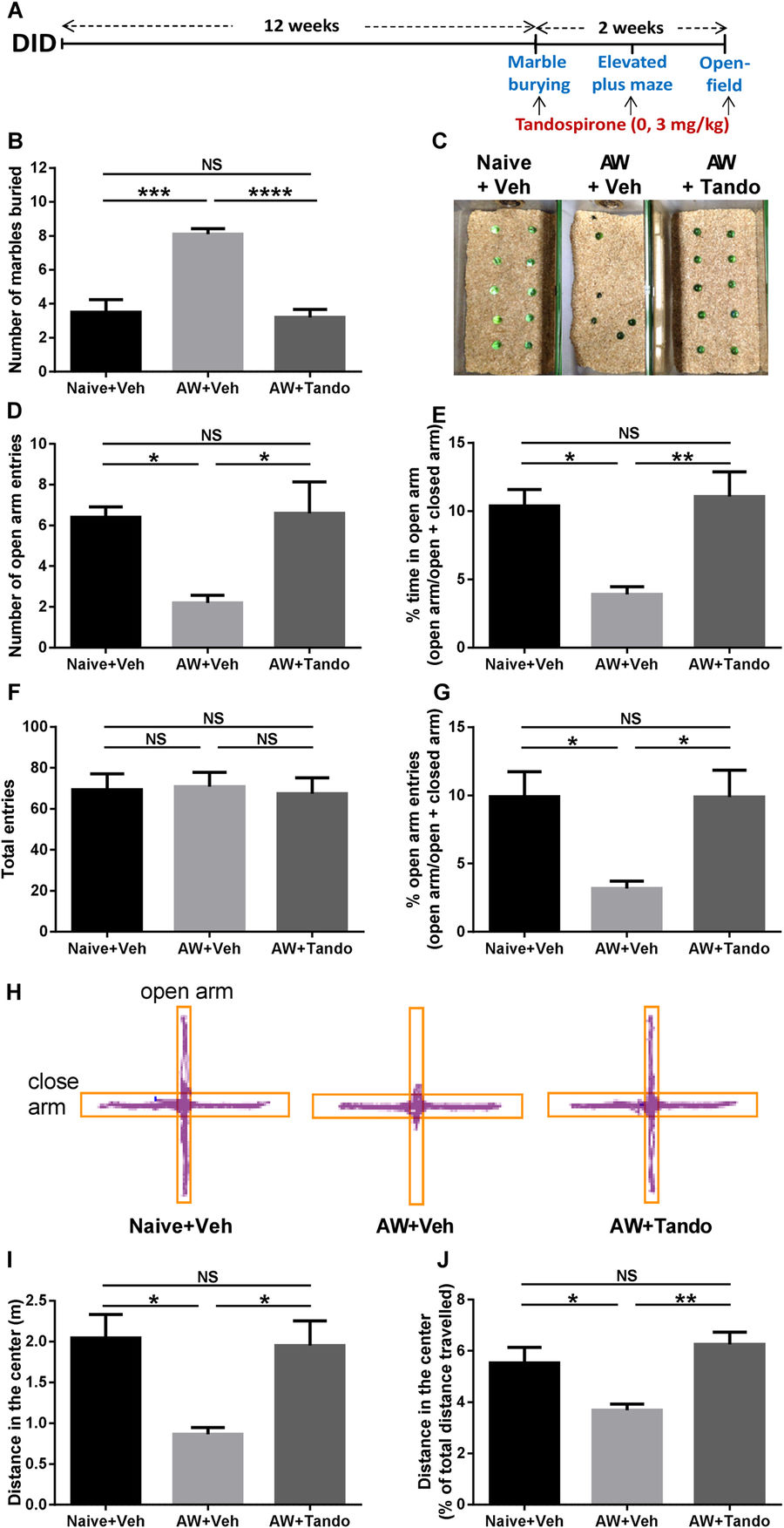 В испытании с закапыванием мраморных шариков, наблюдалось значительное увеличение поведения, связанного с тревожностью, у мышей, у которых отняли спирт, по сравнению с «наивными» мышами (которые никогда не употребляли алкоголь), и это увеличение было предотвращено предварительной обработкой тандоспироном (рис.1B). Показан репрезентативный образец теста закапывания мраморных шариков для трех групп (рис.1C). В тесте с приподнятым крестообразным лабиринтом, количество записей и процент времени, проведенного в открытой руке, были значительно уменьшены у животных, у которых отобрали этанол, по сравнению с животными, никогда не употреблявшими алкоголь, и это предотвращение опасностей, связанных с опасностью / открытым пространством, было устранено путем предварительной обработки тандопироном (рис.1D, E). Поскольку общее количество записей не отличалось от мышей, которые никогда не употребляли алкоголь, мышей, у которых отобрали алкоголь и мышей, обработанных тандсопироном (рис.1F), записи с открытой рукой, выраженные как процент от общего количества записей, также были значительно уменьшены у обработанных плацебо лишенных алкоголя мышей, по сравнению с мышами, которые никогда не употребляли алкоголь, при этом лечение тандоспироном также предотвращало это снижение (рис.1G). Это демонстрирует, что противотревожный эффект тандоспирона после отмены алкоголя не опосредуется изменениями двигательной активности. Для трех групп показано типичное изображение амбулаторного поведения в приподнятом крестообразном лабиринте (рис.1Н). Аналогично, в тесте на открытом поле, расстояние, пройденное в центре, было уменьшено у мышей, у которых отобрали алкоголь, по сравнению с животными, которые никогда не употребляли алкоголь, и это уменьшение отсутствовало у животных, получавших тандоспирон (рис.1I). Общее пройденное расстояние не значительно различалось между группами (рис. S1a), и поэтому расстояние, пройденное в центре, выраженное в процентах от общего пройденного расстояния, было значительно уменьшено у мышей, у которых отобрали алкоголь и давали плацебо, но не у мышей, у которых отобрали алкоголь и давали тандспиронон (рис.1J). Опять же, это показывает, что анксиолитический эффект тандоспирона не опосредуется изменениями двигательной активности. В совокупности, эти результаты показывают, что анксиогенные эффекты отмены алкоголя после 12 недель потребления, подобного употреблению в модели DID, полностью изменяются путем селективной частичной активации 5-HT1A-рецепторов тандоспироном.
В испытании с закапыванием мраморных шариков, наблюдалось значительное увеличение поведения, связанного с тревожностью, у мышей, у которых отняли спирт, по сравнению с «наивными» мышами (которые никогда не употребляли алкоголь), и это увеличение было предотвращено предварительной обработкой тандоспироном (рис.1B). Показан репрезентативный образец теста закапывания мраморных шариков для трех групп (рис.1C). В тесте с приподнятым крестообразным лабиринтом, количество записей и процент времени, проведенного в открытой руке, были значительно уменьшены у животных, у которых отобрали этанол, по сравнению с животными, никогда не употреблявшими алкоголь, и это предотвращение опасностей, связанных с опасностью / открытым пространством, было устранено путем предварительной обработки тандопироном (рис.1D, E). Поскольку общее количество записей не отличалось от мышей, которые никогда не употребляли алкоголь, мышей, у которых отобрали алкоголь и мышей, обработанных тандсопироном (рис.1F), записи с открытой рукой, выраженные как процент от общего количества записей, также были значительно уменьшены у обработанных плацебо лишенных алкоголя мышей, по сравнению с мышами, которые никогда не употребляли алкоголь, при этом лечение тандоспироном также предотвращало это снижение (рис.1G). Это демонстрирует, что противотревожный эффект тандоспирона после отмены алкоголя не опосредуется изменениями двигательной активности. Для трех групп показано типичное изображение амбулаторного поведения в приподнятом крестообразном лабиринте (рис.1Н). Аналогично, в тесте на открытом поле, расстояние, пройденное в центре, было уменьшено у мышей, у которых отобрали алкоголь, по сравнению с животными, которые никогда не употребляли алкоголь, и это уменьшение отсутствовало у животных, получавших тандоспирон (рис.1I). Общее пройденное расстояние не значительно различалось между группами (рис. S1a), и поэтому расстояние, пройденное в центре, выраженное в процентах от общего пройденного расстояния, было значительно уменьшено у мышей, у которых отобрали алкоголь и давали плацебо, но не у мышей, у которых отобрали алкоголь и давали тандспиронон (рис.1J). Опять же, это показывает, что анксиолитический эффект тандоспирона не опосредуется изменениями двигательной активности. В совокупности, эти результаты показывают, что анксиогенные эффекты отмены алкоголя после 12 недель потребления, подобного употреблению в модели DID, полностью изменяются путем селективной частичной активации 5-HT1A-рецепторов тандоспироном.
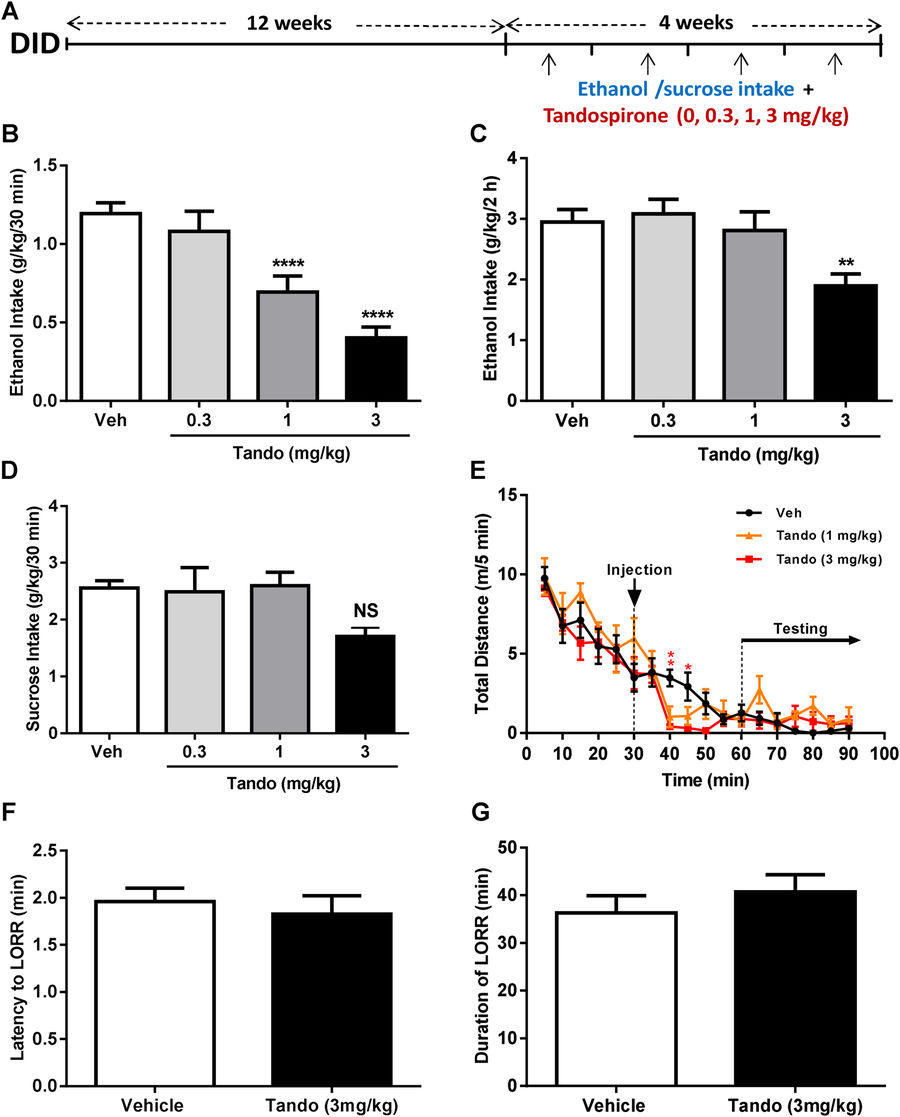 Было оценено, влияет ли противотревожный эффект частичной активации 5-HT1A-рецепторов при ежедневной отмене алкоголя при DID на уровень потребления алкоголя. Был протестирован эффект предварительного введения тандоспирона на уровни потребления алкоголя (рис. 2А). По сравнению с плацебо, тандоспирон значительно уменьшал потребление алкоголя через 30 мин (рис.2В) и через 2 часа (рис.2С). Чтобы оценить влияние любых неспецифических эффектов на действие тандоспирона на снижение потребления алкоголя, было дополнительно протестировано действие тандоспирона на потребление сахарозы, общую локомоторную активность и алкогольный метаболизм. Не наблюдалось никаких изменений в потреблении сахарозы через 30 мин (или 2 ч, рис. S1b) при любой дозе вводимого тандспопирона (0, 0,3, 1 и 3 мг / кг) (рис. 2D). Кроме того, хотя небольшое снижение двигательной активности наблюдалось через 10 и 15 минут после инъекции тандоспирона, амбулаторное поведение не было существенно изменено тандоспироном через 30 минут после инъекции, то есть, в течение периода, соответствующего тестированию влияния потребления алкоголя / сахарозы на тревожность (рис.2Е). Наконец, оценка неспецифичности тандоспирона в отношении алкогольного метаболизма не выявила влияния на латентность (рис.2F) и продолжительность (рис. 2G) выпрямляющего рефлекса туловища мыши, по сравнению с плацебо. Вместе, эти результаты демонстрируют, что тандоспирон специфически снижает поддержание поведения, связанного с употреблением алкоголя, после длительного воздействия при DID.
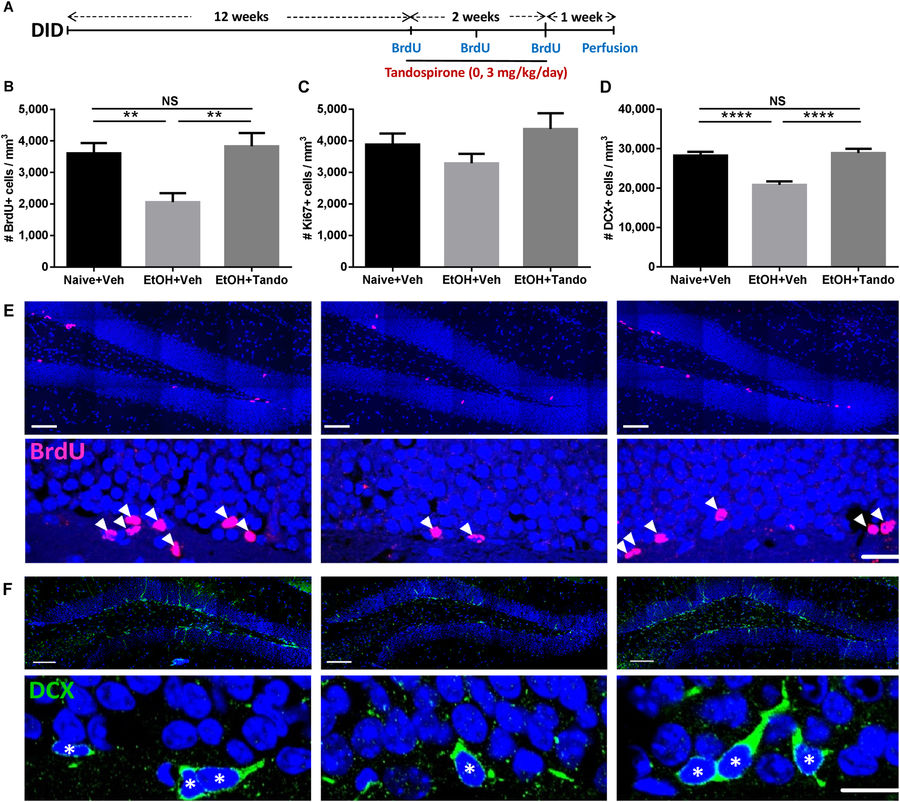
Поскольку ранее было показано, что хроническое лечение тандоспироном увеличивает нейрогенез гиппокампа и предотвращает стресс-индуцированные дефициты нейрогенеза у крыс 20), было исследовано влияние 2-недельного введения (3 мг / кг / день) на включение BrdU, экспрессия маркера пролиферации, Ki67 и маркера незрелых нейронов, doublecortin (DCX), в зубчатой извилине у мышей, которые долгое время подвергались употреблению алкоголя при DID (рис.3A). Наблюдалось, что длительное потребление алкоголя значительно уменьшало плотность иммунореактивных (BrdU+) клеток BrdU в зубчатой извилине у мышей, у которых изъяли алкоголь, по сравнению с мышами, не пробовавшими алкоголь, и это снижение было предотвращено длительным введением тандоспирона (рис.3В). Количественная оценка иммунореактивных клеток Ki67 (Ki67+) Ki67 не выявила влияния воздействия алкоголя или лечения тандоспироном на плотность пролиферирующих клеток по сравнению с «наивными» животными (не пробовавшими алкоголя), обработанными плацебо (рис.3C). Однако, длительное употребление алкоголя значительно уменьшало плотность иммунореактивных (DCX +) DCX нейронов по сравнению с «наивными» животными, а длительное введение тандоспирона значительно меняла это снижение (рис. 3D). Показаны типичные микрофотографии влияния длительного употребления алкоголя и / или влияния длительного введения тандоспирона, на плотность иммунореактивных клеток BrdU и DCX в зубчатой извилине (рис. 3Е, F соответственно).
Было оценено, влияет ли противотревожный эффект частичной активации 5-HT1A-рецепторов при ежедневной отмене алкоголя при DID на уровень потребления алкоголя. Был протестирован эффект предварительного введения тандоспирона на уровни потребления алкоголя (рис. 2А). По сравнению с плацебо, тандоспирон значительно уменьшал потребление алкоголя через 30 мин (рис.2В) и через 2 часа (рис.2С). Чтобы оценить влияние любых неспецифических эффектов на действие тандоспирона на снижение потребления алкоголя, было дополнительно протестировано действие тандоспирона на потребление сахарозы, общую локомоторную активность и алкогольный метаболизм. Не наблюдалось никаких изменений в потреблении сахарозы через 30 мин (или 2 ч, рис. S1b) при любой дозе вводимого тандспопирона (0, 0,3, 1 и 3 мг / кг) (рис. 2D). Кроме того, хотя небольшое снижение двигательной активности наблюдалось через 10 и 15 минут после инъекции тандоспирона, амбулаторное поведение не было существенно изменено тандоспироном через 30 минут после инъекции, то есть, в течение периода, соответствующего тестированию влияния потребления алкоголя / сахарозы на тревожность (рис.2Е). Наконец, оценка неспецифичности тандоспирона в отношении алкогольного метаболизма не выявила влияния на латентность (рис.2F) и продолжительность (рис. 2G) выпрямляющего рефлекса туловища мыши, по сравнению с плацебо. Вместе, эти результаты демонстрируют, что тандоспирон специфически снижает поддержание поведения, связанного с употреблением алкоголя, после длительного воздействия при DID.
Поскольку ранее было показано, что хроническое лечение тандоспироном увеличивает нейрогенез гиппокампа и предотвращает стресс-индуцированные дефициты нейрогенеза у крыс 20), было исследовано влияние 2-недельного введения (3 мг / кг / день) на включение BrdU, экспрессия маркера пролиферации, Ki67 и маркера незрелых нейронов, doublecortin (DCX), в зубчатой извилине у мышей, которые долгое время подвергались употреблению алкоголя при DID (рис.3A). Наблюдалось, что длительное потребление алкоголя значительно уменьшало плотность иммунореактивных (BrdU+) клеток BrdU в зубчатой извилине у мышей, у которых изъяли алкоголь, по сравнению с мышами, не пробовавшими алкоголь, и это снижение было предотвращено длительным введением тандоспирона (рис.3В). Количественная оценка иммунореактивных клеток Ki67 (Ki67+) Ki67 не выявила влияния воздействия алкоголя или лечения тандоспироном на плотность пролиферирующих клеток по сравнению с «наивными» животными (не пробовавшими алкоголя), обработанными плацебо (рис.3C). Однако, длительное употребление алкоголя значительно уменьшало плотность иммунореактивных (DCX +) DCX нейронов по сравнению с «наивными» животными, а длительное введение тандоспирона значительно меняла это снижение (рис. 3D). Показаны типичные микрофотографии влияния длительного употребления алкоголя и / или влияния длительного введения тандоспирона, на плотность иммунореактивных клеток BrdU и DCX в зубчатой извилине (рис. 3Е, F соответственно).
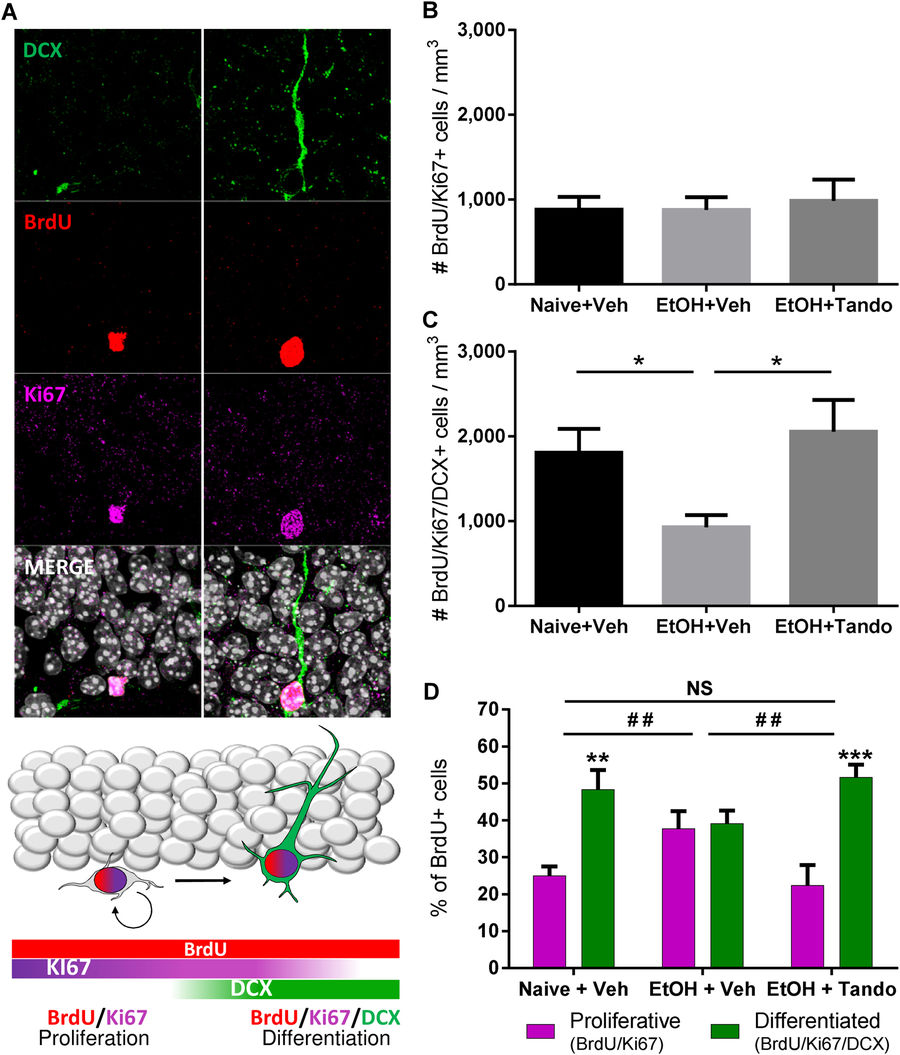
 Для дальнейшей оценки того, был ли нарушен процесс дифференцировки нейронов алкоголем или тандоспироном в течение последних двух недель DID, было исследовано распределение пролиферации и незрелых маркеров нейронов в популяции клеток BrdU+. Мы количественно определили плотность клеток BrdU+, коэкспрессирующих Ki67 (BrdU / Ki67 +: пролиферирующие предшественники) или оба Ki67 и DCX (BrdU / Ki67 / DCX +: дифференцированный нейробласт) (рис. 4A). Количественная оценка плотности клеток BrdU / Ki67 + не выявила влияния воздействия алкоголя или лечения тандсопироном по сравнению с «наивными» животными (рис.4В). Однако, воздействие алкоголя значительно снижает плотность клеток BrdU / Ki67 / DCX+, по сравнению с животными, никогда не употребляющими спиртного. Хроническое лечение тандоспироном отменяет это снижение (рис.4C). Кроме того, анализ распределения различных клеточных популяционных маркеров в клетках BrdU+ показал, что длительное воздействие алкоголя изменяет специфику судьбы нейронов по сравнению с «наивными» животными, а длительное введение тандоспирона у животных, подвергшихся воздействию алкоголя, восстанавливает нормальный процесс нейрогенеза (рис. 4D). Эти результаты показывают, что длительная частичная активация 5-HT1A-рецепторов при двухнедельном лечении тандоспироном является достаточной для полного устранения нарушений нейрогенной и нейронной дифференцировки, вызванного 15-недельным потреблением алкоголя, подобного употреблению при DID.
Для дальнейшей оценки того, был ли нарушен процесс дифференцировки нейронов алкоголем или тандоспироном в течение последних двух недель DID, было исследовано распределение пролиферации и незрелых маркеров нейронов в популяции клеток BrdU+. Мы количественно определили плотность клеток BrdU+, коэкспрессирующих Ki67 (BrdU / Ki67 +: пролиферирующие предшественники) или оба Ki67 и DCX (BrdU / Ki67 / DCX +: дифференцированный нейробласт) (рис. 4A). Количественная оценка плотности клеток BrdU / Ki67 + не выявила влияния воздействия алкоголя или лечения тандсопироном по сравнению с «наивными» животными (рис.4В). Однако, воздействие алкоголя значительно снижает плотность клеток BrdU / Ki67 / DCX+, по сравнению с животными, никогда не употребляющими спиртного. Хроническое лечение тандоспироном отменяет это снижение (рис.4C). Кроме того, анализ распределения различных клеточных популяционных маркеров в клетках BrdU+ показал, что длительное воздействие алкоголя изменяет специфику судьбы нейронов по сравнению с «наивными» животными, а длительное введение тандоспирона у животных, подвергшихся воздействию алкоголя, восстанавливает нормальный процесс нейрогенеза (рис. 4D). Эти результаты показывают, что длительная частичная активация 5-HT1A-рецепторов при двухнедельном лечении тандоспироном является достаточной для полного устранения нарушений нейрогенной и нейронной дифференцировки, вызванного 15-недельным потреблением алкоголя, подобного употреблению при DID.
Обсуждение
Было выявлено значение рецепторов 5-НТ1А при тревоге, вызванной алкоголизмом, приеме алкоголя, вызванном тревожностью, и нейрогенном дефиците, вызванном алкоголем, после долговременного хронического потребления в парадигме «выпивка в темноте» (DID). Предыдущие исследования с использованием форсированного введения алкоголя, включая жидкую диету, зонд или вдыхания паров алкоголя, предположили участие 5-HT1A в тревоге 21) и вызванном стрессом беспокойстве после кратковременной или длительной отмены длительного воздействия алкоголя. Однако, в этих исследованиях был предложен только вклад 5-HT1A-рецепторов с использованием частичного агониста-буспирона, неселективного лекарственного средства, который, как было показано, обладает антагонистической активностью на дофаминовых D2-рецепторах, что может объяснить противоречивые результаты, свидетельствующие о седативном, анксиолитическом, анксиогенном или неэффективном действии буспирона в различных поведенческих парадигмах 22). Аналогичным образом, клинические испытания буспирона для лечения злоупотребления алкоголем или лечение беспокойства, вызванного отменой алкоголя, привели к противоречивым результатам, таким образом, повышая неопределенность в отношении эффективности частичной активации рецепторов 5-НТ1А при лечении зависимостей, связанных с употреблением алкоголя.
 Анксиолитический препарат тандоспирон является частичным агонистом 5-HT1A-рецепторов (60%-ная эффективность), имеющим на два-три порядка меньшую эффективность относительно адренергических, мускариновых, дофаминовых или любых других рецепторов 5-НТ 23). Связывающие участки тандоспирона преимущественно расположены в гиппокампе (зубчатой извилине), медиальной обонятельной извилине, энторинальной области коры, межножковом ядре и ядре шва 24). Анксиолитическое действие тандоспирона у грызунов наблюдалось в тестах конфликта, при страхе, обусловленном замораживанием, и в тестах закапывания мраморных шариков, однако, в недавнем докладе не наблюдалось анксиолитического действия тандоспирона (3, 10 и 30 мг / кг) на основную тревожность крысы в приподнятом крестообразном лабиринте 25). Была установлена эффективность тандоспирона (3 мг / кг) при облегчении тревоги, вызванной употреблением алкоголя, не только при закапывании мраморных шариков и в испытаниях на открытом поле, но и в приподнятом крестообразном лабиринте. Независимо от того, обусловлено ли различие между вышеупомянутым исследованием и данной работой способом применения (пероральный или внутрибрюшинный), или обнаруживает специфический эффект тандоспирона на вызванное алкоголем беспокойство после долговременного DID, еще нужно определить. Хроническая зависимость от алкоголя увеличивает чистое возбуждение нейронов ядра шва и усиливает экспрессию и функцию ауторецептора 5-HT1A, что способствует тревоге при отмене алкоголя. Напротив, тандоспирон уменьшает скорость «выстреливания» нейронов DR 5-HT и снижает чувствительность 5-HT1A-ауторецепторов без влияния на гетерорецепторы 5-HT1A гиппокампа 26). Следовательно, наблюдаемые эффекты тандоспирона могут быть опосредованы его действием на ауторецепторы 5-HT1A, нормализуя 5-НТ-нейротрансмиссию в DR и уменьшая как вызванное алкоголем беспокойство, так и поддержание пьянства у мышей, потребляющих алкоголь с раннего возраста до поздней зрелости. Однако, антиконфликтный эффект тандоспирона, по-видимому, опосредуется 5-HT1A-рецепторами, расположенными в дорсальном гиппокампе. Было продемонстрировано, что ауторецепторы 5-HT1A необходимы для развития нормального тревожноподобного поведения. Имеются убедительные доказательства того, что агонисты рецептора 5-HT1A постсинаптически проявляют свои анксиолитические эффекты в гиппокампе 27). Поэтому, необходима дальнейшая работа с использованием местных инъекций в ядре шва или гиппокампе, для определения того, опосредуется ли анксиолитический эффект тандоспирона у мышей, у которых отняли алкоголь 5-HT1A, ауто- или гетерорецепторами.
Альтернативно, развитие частичных агонистов 5-HT1A-рецепторов, демонстрирующих высокую селективность как для ауто-, так и для гетерорецепторов, представляет собой потенциальную стратегию для решения этого вопроса. Схема, связанная с ядром шва, сложна, а спинной и вентральный гиппокамп дифференциально иннервируются дорсальным, а также медианным ядром шва, с побочными связями внутри брюшного / дорсального гиппокампа и дорсального / медианного ядрами шва 28). Кроме того, нейронная активность этих областей регулируется кортико-стриоспинальными петлями, образуя сложную нейронную сеть, которая кодирует различные аспекты процессов вознаграждения. В результате, роль гиппокампа в системе вознаграждения представляется топографически организованной, причем дорсальный гиппокамп, вероятно, играет более заметную роль в контекстной / пространственной памяти, а вентральный гиппокамп больше участвует в эмоциональной / мотивационной памяти 29). Таким образом, тандоспирон может действовать пресинаптически на 5-HT1A-ауторецепторах в качестве полного агониста в дорсальном яре и в качестве частичного агониста в срединном шве 30) для дифференциального ингибирования высвобождения 5-HT в целевых областях головного мозга, включая вентральный / дорсальный гиппокамп, а также префронтальную кору, миндалину или ядро ложа конечной полоски, мозговые области, в которых передача сигналов серотонина широко затрагивалась как в поведении, связанном с приемом алкоголя, так и в эмоциональном дефиците, вызванном его отменой. Тандоспирон может также действовать постсинаптически в качестве полного агониста на 5-HT1A гетерорецепторах, расположенных в разных нейронных подтипах (глутаматные нейроны или нейроны ГАМК) в этих областях мозга, модулируя их возбудимость / активность. Дальнейшая работа с использованием последних достижений в области оптогенетики и / или хемогенетики помогла бы проанализировать специфический для региона и схемы 5-HT1A ауто- и гетерорецепторов при поведении, связанном с употреблением алкоголя и связанным с ним эмоциональными или нейрогенными дефицитами. За предыдущие десятилетия, большое количество доклинических и клинических данных связывают дефицит гомеостаза 5-HT с нарушениями нейрогенеза гиппокампа и расстройствами, связанными с депрессией. Позже, как сообщалось, взрослый гиппокампальный нейрогенез модулирует тревожное поведение у грызунов 31). Повторные циклы запойного пьянства в течение относительно коротких периодов времени (от 4 дней до 7 недель) с использованием принудительного потребления (внутрижелудочный желудочный зонд или пары этанола), спиртосодержащей диеты или подслащенного раствора, связано с поведением, связанным с пониженной пролиферацией предшественников (включение BrdU и маркировка Ki67) и нарушение дифференцировки нейронов (маркировка DCX) в зубчатой извилине 32). Было показано, что 12-дневное добровольное употребление подслащенного этанола вызывает тревожное и депрессивное поведение и снижает плотность пролиферирующих клеток BrdU + и незрелых нейронов DCX +.
Было показано, что долгосрочное добровольное употребление алкоголя в парадигме DID, начиная с раннего подросткового возраста до поздней зрелости, не только приводит к значительному снижению пролиферации предшественников в DG, но, как только они распространились, изменяется спецификация их нейронов. Интересно отметить, что было возможно отменить как дефицит пролиферации, так и дифференциации при длительном введении тандоспирона в течение последних двух недель 15-недельного воздействия при DID. Это говорит о том, что нарушения в нейрогенезе после длительного употребления алкоголя, могут быть опосредованы, по крайней мере, частично, при помощи механизмов, зависящих от 5-HT1A рецептора. Одним из объяснений может быть то, что длительное воздействие алкоголя может уменьшить экспрессию и / или функцию гетерорецепторов 5-HT1A в зубчатой извилине. Это уменьшение экспрессии или функции рецепторов 5-НТ1А может быть результатом снижения передачи сигналов BDNF / TrkB64, вызванным длительным воздействием алкоголя 33). В свою очередь, снижение функции 5-HT1A может повлиять на активацию пути фосфорилирования CREB, что может привести к уменьшению нейрогенеза и увеличению тревожноподобного поведения. С другой стороны, усиление 5-HT1A-ауторецепторов может способствовать эффекту, наблюдаемому при употреблении алкоголя и поведении, связанном с беспокойством.
Следовательно, тандоспирон может действовать как частичный агонист ауторецепторов 5-HT1A и полный агонист на 5-HT1A гетерорецепторах, компенсируя измененную передачу сигналов 5-HT1A-рецепторов в дорсальном ядре шва и гиппокампе, уменьшая тревожное поведение и корректируя нейрогенный дефицит, соответственно. Так как аналогичные изменения в нейрогенезе гиппокампа наблюдались после хронического введения алкоголя при помощи желудочного зонда у крыс с этими изменениями, связанными с сопутствующими когнитивными нарушениями 34), необходима дальнейшая работа для определения того, приводят ли нейрогенные дефициты после длительного DID к когнитивным дефицитам и независимо от того, опосредуются ли эти дефициты механизмом, зависящим от рецептора 5-НТ1А.
Анксиолитический препарат тандоспирон является частичным агонистом 5-HT1A-рецепторов (60%-ная эффективность), имеющим на два-три порядка меньшую эффективность относительно адренергических, мускариновых, дофаминовых или любых других рецепторов 5-НТ 23). Связывающие участки тандоспирона преимущественно расположены в гиппокампе (зубчатой извилине), медиальной обонятельной извилине, энторинальной области коры, межножковом ядре и ядре шва 24). Анксиолитическое действие тандоспирона у грызунов наблюдалось в тестах конфликта, при страхе, обусловленном замораживанием, и в тестах закапывания мраморных шариков, однако, в недавнем докладе не наблюдалось анксиолитического действия тандоспирона (3, 10 и 30 мг / кг) на основную тревожность крысы в приподнятом крестообразном лабиринте 25). Была установлена эффективность тандоспирона (3 мг / кг) при облегчении тревоги, вызванной употреблением алкоголя, не только при закапывании мраморных шариков и в испытаниях на открытом поле, но и в приподнятом крестообразном лабиринте. Независимо от того, обусловлено ли различие между вышеупомянутым исследованием и данной работой способом применения (пероральный или внутрибрюшинный), или обнаруживает специфический эффект тандоспирона на вызванное алкоголем беспокойство после долговременного DID, еще нужно определить. Хроническая зависимость от алкоголя увеличивает чистое возбуждение нейронов ядра шва и усиливает экспрессию и функцию ауторецептора 5-HT1A, что способствует тревоге при отмене алкоголя. Напротив, тандоспирон уменьшает скорость «выстреливания» нейронов DR 5-HT и снижает чувствительность 5-HT1A-ауторецепторов без влияния на гетерорецепторы 5-HT1A гиппокампа 26). Следовательно, наблюдаемые эффекты тандоспирона могут быть опосредованы его действием на ауторецепторы 5-HT1A, нормализуя 5-НТ-нейротрансмиссию в DR и уменьшая как вызванное алкоголем беспокойство, так и поддержание пьянства у мышей, потребляющих алкоголь с раннего возраста до поздней зрелости. Однако, антиконфликтный эффект тандоспирона, по-видимому, опосредуется 5-HT1A-рецепторами, расположенными в дорсальном гиппокампе. Было продемонстрировано, что ауторецепторы 5-HT1A необходимы для развития нормального тревожноподобного поведения. Имеются убедительные доказательства того, что агонисты рецептора 5-HT1A постсинаптически проявляют свои анксиолитические эффекты в гиппокампе 27). Поэтому, необходима дальнейшая работа с использованием местных инъекций в ядре шва или гиппокампе, для определения того, опосредуется ли анксиолитический эффект тандоспирона у мышей, у которых отняли алкоголь 5-HT1A, ауто- или гетерорецепторами.
Альтернативно, развитие частичных агонистов 5-HT1A-рецепторов, демонстрирующих высокую селективность как для ауто-, так и для гетерорецепторов, представляет собой потенциальную стратегию для решения этого вопроса. Схема, связанная с ядром шва, сложна, а спинной и вентральный гиппокамп дифференциально иннервируются дорсальным, а также медианным ядром шва, с побочными связями внутри брюшного / дорсального гиппокампа и дорсального / медианного ядрами шва 28). Кроме того, нейронная активность этих областей регулируется кортико-стриоспинальными петлями, образуя сложную нейронную сеть, которая кодирует различные аспекты процессов вознаграждения. В результате, роль гиппокампа в системе вознаграждения представляется топографически организованной, причем дорсальный гиппокамп, вероятно, играет более заметную роль в контекстной / пространственной памяти, а вентральный гиппокамп больше участвует в эмоциональной / мотивационной памяти 29). Таким образом, тандоспирон может действовать пресинаптически на 5-HT1A-ауторецепторах в качестве полного агониста в дорсальном яре и в качестве частичного агониста в срединном шве 30) для дифференциального ингибирования высвобождения 5-HT в целевых областях головного мозга, включая вентральный / дорсальный гиппокамп, а также префронтальную кору, миндалину или ядро ложа конечной полоски, мозговые области, в которых передача сигналов серотонина широко затрагивалась как в поведении, связанном с приемом алкоголя, так и в эмоциональном дефиците, вызванном его отменой. Тандоспирон может также действовать постсинаптически в качестве полного агониста на 5-HT1A гетерорецепторах, расположенных в разных нейронных подтипах (глутаматные нейроны или нейроны ГАМК) в этих областях мозга, модулируя их возбудимость / активность. Дальнейшая работа с использованием последних достижений в области оптогенетики и / или хемогенетики помогла бы проанализировать специфический для региона и схемы 5-HT1A ауто- и гетерорецепторов при поведении, связанном с употреблением алкоголя и связанным с ним эмоциональными или нейрогенными дефицитами. За предыдущие десятилетия, большое количество доклинических и клинических данных связывают дефицит гомеостаза 5-HT с нарушениями нейрогенеза гиппокампа и расстройствами, связанными с депрессией. Позже, как сообщалось, взрослый гиппокампальный нейрогенез модулирует тревожное поведение у грызунов 31). Повторные циклы запойного пьянства в течение относительно коротких периодов времени (от 4 дней до 7 недель) с использованием принудительного потребления (внутрижелудочный желудочный зонд или пары этанола), спиртосодержащей диеты или подслащенного раствора, связано с поведением, связанным с пониженной пролиферацией предшественников (включение BrdU и маркировка Ki67) и нарушение дифференцировки нейронов (маркировка DCX) в зубчатой извилине 32). Было показано, что 12-дневное добровольное употребление подслащенного этанола вызывает тревожное и депрессивное поведение и снижает плотность пролиферирующих клеток BrdU + и незрелых нейронов DCX +.
Было показано, что долгосрочное добровольное употребление алкоголя в парадигме DID, начиная с раннего подросткового возраста до поздней зрелости, не только приводит к значительному снижению пролиферации предшественников в DG, но, как только они распространились, изменяется спецификация их нейронов. Интересно отметить, что было возможно отменить как дефицит пролиферации, так и дифференциации при длительном введении тандоспирона в течение последних двух недель 15-недельного воздействия при DID. Это говорит о том, что нарушения в нейрогенезе после длительного употребления алкоголя, могут быть опосредованы, по крайней мере, частично, при помощи механизмов, зависящих от 5-HT1A рецептора. Одним из объяснений может быть то, что длительное воздействие алкоголя может уменьшить экспрессию и / или функцию гетерорецепторов 5-HT1A в зубчатой извилине. Это уменьшение экспрессии или функции рецепторов 5-НТ1А может быть результатом снижения передачи сигналов BDNF / TrkB64, вызванным длительным воздействием алкоголя 33). В свою очередь, снижение функции 5-HT1A может повлиять на активацию пути фосфорилирования CREB, что может привести к уменьшению нейрогенеза и увеличению тревожноподобного поведения. С другой стороны, усиление 5-HT1A-ауторецепторов может способствовать эффекту, наблюдаемому при употреблении алкоголя и поведении, связанном с беспокойством.
Следовательно, тандоспирон может действовать как частичный агонист ауторецепторов 5-HT1A и полный агонист на 5-HT1A гетерорецепторах, компенсируя измененную передачу сигналов 5-HT1A-рецепторов в дорсальном ядре шва и гиппокампе, уменьшая тревожное поведение и корректируя нейрогенный дефицит, соответственно. Так как аналогичные изменения в нейрогенезе гиппокампа наблюдались после хронического введения алкоголя при помощи желудочного зонда у крыс с этими изменениями, связанными с сопутствующими когнитивными нарушениями 34), необходима дальнейшая работа для определения того, приводят ли нейрогенные дефициты после длительного DID к когнитивным дефицитам и независимо от того, опосредуются ли эти дефициты механизмом, зависящим от рецептора 5-НТ1А.











