Содержание
Ацетальдегид
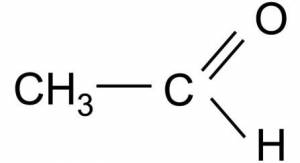 Ацетальдегид (систематическое название этанал) представляет собой органическое химическое соединение с формулой CH3CHO, иногда сокращенно называемое MeCHO (Me = метил). Это один из наиболее важных альдегидов, широко распространенных в природе и производимых в промышленных масштабах. Ацетальдегид встречается в кофе, хлебе и спелых фруктах и производится растениями. Вещество также производится путем частичного окисления этанола ферментом печени алкогольдегидрогеназой, и является причиной похмелья после употребления алкоголя. Пути воздействия на организм включают воздух, воду, землю или грунтовые воды, а также алкоголь и курение. Потребление дисульфирама ингибирует ацетальдегиддегидрогеназу, фермент, ответственный за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Ацетальдегид (систематическое название этанал) представляет собой органическое химическое соединение с формулой CH3CHO, иногда сокращенно называемое MeCHO (Me = метил). Это один из наиболее важных альдегидов, широко распространенных в природе и производимых в промышленных масштабах. Ацетальдегид встречается в кофе, хлебе и спелых фруктах и производится растениями. Вещество также производится путем частичного окисления этанола ферментом печени алкогольдегидрогеназой, и является причиной похмелья после употребления алкоголя. Пути воздействия на организм включают воздух, воду, землю или грунтовые воды, а также алкоголь и курение. Потребление дисульфирама ингибирует ацетальдегиддегидрогеназу, фермент, ответственный за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Международное агентство по исследованию рака (IARC) включило ацетальдегид в группу 1 канцерогенов. Ацетальдегид является «одним из наиболее часто встречающихся токсинов воздуха с риском рака более одного на миллион». 1)
История
Впервые ацетальдегид был обнаружен шведским фармацевтом / химиком Карлом Вильгельмом Шееле (1774); затем его исследовали французские химики Антуан Франсуа, граф де Фуркруа и Луи Николя Воклен (1800), и немецкие химики Иоганн Вольфганг Доберейнер (1821, 1822, 1832) и Юстус фон Либих (1835). В 1835 году Либих назвал его «альдегидом», позднее название было изменено на «ацетальдегид» 2).
Производство
В 2003 году мировое производство ацетальдегида составило около 1 миллиона тонн. До 1962 года этанол и ацетилен были основными источниками ацетальдегида. С тех пор этилен является доминирующим сырьем. 3) Основным методом производства является окисление этилена в процессе Вакера, который включает окисление этилена с использованием гомогенной системы палладий / медь: 2 CH2 = CH2 + O2 → 2 CH3CHO В 1970-х годах мировая производительность процесса прямого окисления Wacker-Hoechst превышала 2 миллиона тонн в год. Меньшие количества могут быть получены путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 °C. CH3CH2OH + 1⁄2O2 → CH3CHO + H2O Этот метод является одним из старейших способов промышленного получения ацетальдегида.
Другие методы
Гидратация ацетилена
До процесса Вакера и доступности дешевого этилена, ацетальдегид производился путем гидратации ацетилена. Эта реакция катализируется солями ртути (II): C2H2 + Hg2 + + H2O → CH3CHO + Hg Механизм включает промежуточный виниловый спирт, который таутомеризуется в ацетальдегид. Реакцию проводят при 90–95 ° С, а образовавшийся ацетальдегид отделяют от воды и ртути и охлаждают до 25–30 ° С. В процессе мокрого окисления, сульфат железа (III) используется для повторного окисления ртути обратно в соль ртути (II). Полученный сульфат железа (II) окисляется в отдельном реакторе азотной кислотой.
Окисление этанола
Традиционно ацетальдегид получают частичным дегидрированием этанола: CH3CH2OH → CH3CHO + H2 В этом эндотермическом процессе пары этанола пропускаются при температуре 260–290 ° C через катализатор на основе меди. Этот процесс когда-то был привлекателен из-за ценности побочного продукта водорода, но в наше время экономически невыгоден.
Гидроформилирование метанола
Гидроформилирование метанола с помощью катализаторов, таких как соли кобальта, никеля или железа, также приводит к получению ацетальдегида, хотя этот процесс не имеет промышленного значения. Ацетальдегид образуется из синтез-газа с небольшой селективностью.
Реакции
Как и многие другие карбонильные соединения, ацетальдегид таутомеризуется с образованием энола (винилового спирта; название IUPAC: этенол): CH3CH = O⇌CH2 = CHOH ∆H298, г = +42,7 кДж / моль Константа равновесия составляет 6×10−7 при комнатной температуре, поэтому относительное количество энольной формы в образце ацетальдегида очень мало. 4) При комнатной температуре ацетальдегид (CH3CH = O) более стабилен, чем виниловый спирт (CH2 = CHOH), на 42,7 кДж / моль: В целом, кето-энольная таутомеризация происходит медленно, но катализируется кислотами. Фотоиндуцированная таутомеризация кето-энола является жизнеспособной в атмосферных или стратосферных условиях. Эта фототавтомеризация имеет отношение к атмосфере Земли, поскольку считается, что виниловый спирт является предшественником карбоновых кислот в атмосфере.
Реакции конденсации
Ацетальдегид является распространенным электрофилом в органическом синтезе. 5) В реакциях конденсации, ацетальдегид является прохиральным. Он используется главным образом в качестве источника синтона «CH3C + H (OH)» в альдоле и связанных с ним реакциях конденсации. Реагенты Гриньяра и литийорганические соединения реагируют с MeCHO с образованием гидроксиэтильных производных. В одной из наиболее впечатляющих реакций конденсации, три эквивалента формальдегида добавляют к MeCHO с получением пентаэритрита, C (CH2OH) 4. В реакции Штрекера ацетальдегид конденсируется с цианидом и аммиаком, давая после гидролиза аминокислоту аланин. Ацетальдегид может конденсироваться с аминами с образованием иминов; например, с циклогексиламином с получением N-этилиденциклогексиламина. Эти имины могут быть использованы для направления последующих реакций, таких как альдольная конденсация. Это вещество также является строительным блоком в синтезе гетероциклических соединений. В одном примере он превращается после обработки аммиаком в 5-этил-2-метилпиридин («альдегид-коллидин»). 6)
Производные ацеталя
Три молекулы ацетальдегида конденсируются с образованием «паральдегида», циклического тримера, содержащего простые связи C-O. Аналогичным образом, конденсация четырех молекул ацетальдегида дает циклическую молекулу метальдегида. Паральдегид может быть получен с хорошим выходом с использованием сернокислотного катализатора. Метальдегид получают только с выходом в несколько процентов и при охлаждении, часто с использованием HBr вместо H2SO4 в качестве катализатора. При температуре -40 °C в присутствии кислотных катализаторов образуется полиацетальдегид. Ацетальдегид образует стабильный ацеталь при реакции с этанолом в условиях, благоприятствующих дегидратации. Продукт CH3CH (OCH2CH3) 2 формально называют 1,1-диэтоксиэтаном, но обычно называют «ацеталем». Это может привести к путанице, так как «ацеталь» чаще используется для описания соединений с функциональными группами RCH (OR ') 2 или RR'C (OR' ') 2, а не для ссылки на это конкретное соединение - фактически 1,1-диэтоксиэтан также описывается как диэтилацеталь ацетальдегида.
Предшественник винилфосфоновой кислоты
Ацетальдегид является предшественником винилфосфоновой кислоты, которая используется для изготовления клеев и ионопроводящих мембран. Последовательность синтеза начинается с реакции с трихлоридом фосфора: 7)
- PCl3 + CH3CHO → CH3CH (O-) PCl3 +
- CH3CH (O-) PCl3 + + 2 CH3CO2H → CH3CH (Cl) PO (OH) 2 + 2 CH3COCl
- CH3CH (Cl) PO (OH) 2 → CH2 = CHPO (OH) 2 + HCl
Биохимия
В печени фермент алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем дополнительно окисляется в безвредную уксусную кислоту ацетальдегиддегидрогеназой. Эти две реакции окисления связаны с восстановлением NAD + до NADH. В головном мозге, фермент каталаза в основном отвечает за окисление этанола в ацетальдегид, а алкогольдегидрогеназа играет незначительную роль. Последние стадии алкогольной ферментации у бактерий, растений и дрожжей включают превращение пирувата в ацетальдегид и диоксид углерода ферментом пируватдекарбоксилазой с последующим превращением ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, которая работает в обратном направлении.
Использование
 Традиционно ацетальдегид использовали, в основном, в качестве предшественника уксусной кислоты. Этот метод больше не используется, потому что уксусная кислота более эффективно производится из метанола в процессах Monsanto и Cativa. Ацетальдегид является важным предшественником производных пиридина, пентаэритрита и кротонового альдегида. Мочевина и ацетальдегид образуют полезную смолу. Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата, предшественника винилацетата, который используется для производства поливинилацетата.
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве пластификаторов, которые сместились из-за того, что н-бутиральдегид реже производится из ацетальдегида, а не образуется при гидроформилировании пропилена. Аналогично, уксусная кислота, однажды произведенная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. Влияние на спрос привело к росту цен и, следовательно, замедлению процессов на рынке.
Китай является крупнейшим потребителем ацетальдегида в мире, на его долю пришлось почти половина мирового потребления в 2012 году. Основное использование - производство уксусной кислоты. Ожидается, что другие области применения, такие как пиридины и пентаэритритол, будут расти быстрее, чем уксусная кислота, но объемы не достаточно велики, чтобы компенсировать снижение уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может немного вырасти до 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на долю которого приходится 20% мирового потребления в 2012 году. Как и в случае с Китаем, западноевропейский рынок ацетальдегида будет расти очень незначительно - 1% в год в течение 2012–2018 гг. Однако, Япония может стать потенциальным потребителем ацетальдегида в течение следующих пяти лет из-за нового использования в промышленном производстве бутадиена. Поставки бутадиена были нестабильными в Японии и в остальной части Азии. Это должно обеспечить столь необходимый стимул для вялого рынка с 2013 года. 8)
Традиционно ацетальдегид использовали, в основном, в качестве предшественника уксусной кислоты. Этот метод больше не используется, потому что уксусная кислота более эффективно производится из метанола в процессах Monsanto и Cativa. Ацетальдегид является важным предшественником производных пиридина, пентаэритрита и кротонового альдегида. Мочевина и ацетальдегид образуют полезную смолу. Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата, предшественника винилацетата, который используется для производства поливинилацетата.
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве пластификаторов, которые сместились из-за того, что н-бутиральдегид реже производится из ацетальдегида, а не образуется при гидроформилировании пропилена. Аналогично, уксусная кислота, однажды произведенная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. Влияние на спрос привело к росту цен и, следовательно, замедлению процессов на рынке.
Китай является крупнейшим потребителем ацетальдегида в мире, на его долю пришлось почти половина мирового потребления в 2012 году. Основное использование - производство уксусной кислоты. Ожидается, что другие области применения, такие как пиридины и пентаэритритол, будут расти быстрее, чем уксусная кислота, но объемы не достаточно велики, чтобы компенсировать снижение уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может немного вырасти до 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на долю которого приходится 20% мирового потребления в 2012 году. Как и в случае с Китаем, западноевропейский рынок ацетальдегида будет расти очень незначительно - 1% в год в течение 2012–2018 гг. Однако, Япония может стать потенциальным потребителем ацетальдегида в течение следующих пяти лет из-за нового использования в промышленном производстве бутадиена. Поставки бутадиена были нестабильными в Японии и в остальной части Азии. Это должно обеспечить столь необходимый стимул для вялого рынка с 2013 года. 8)
Безопасность
Пределы воздействия
Пороговое предельное значение составляет 25 частей на миллион (STEL / потолочное значение), а MAK (максимальная концентрация на рабочем месте) составляет 50 частей на миллион. При 50 ч / млн ацетальдегида не наблюдается раздражения или локального повреждения ткани слизистой оболочки носа. При поглощении организмом, ацетальдегид быстро метаболизируется в печени до уксусной кислоты. Лишь небольшая часть выдыхается без изменений. После внутривенного введения период полураспада в крови составляет приблизительно 90 секунд.
Опасности
Токсичность
Ацетальдегид токсичен при наружном применении в течение длительного времени, является раздражителем и вероятным канцерогеном. Ацетальдегид естественным образом разрушается в организме человека, но было показано, что он выделяется с мочой крыс.
Раздражение
Ацетальдегид является раздражителем кожи, глаз, слизистых оболочек, горла и дыхательных путей. Это происходит при концентрациях до 1000 чнм. Симптомы воздействия этого соединения включают тошноту, рвоту и головную боль. Эти симптомы могут возникнуть не сразу. Порог восприятия ацетальдегида в воздухе находится в диапазоне от 0,07 до 0,25 ч / млн. При таких концентрациях, очевиден фруктовый запах ацетальдегида. Раздражения конъюнктивы наблюдались после 15-минутного воздействия концентраций 25 и 50 частей на миллион, но о переходном конъюнктивите и раздражении дыхательных путей сообщалось после воздействия 200 частей на миллион ацетальдегида в течение 15 минут. Вещество обладает общим наркотическим действием, и большие дозы могут даже привести к смерти от дыхательного паралича. Ацетальдегид также может вызывать сонливость, бред, галлюцинации и потерю интеллектуальных способностей. Воздействие может также вызывать серьезные повреждения рта, горла и желудка; скопление жидкости в легких, хронические респираторные заболевания, повреждение почек и печени, раздражение горла, головокружение, покраснение и отек кожи.
Канцерогенность
Ацетальдегид является канцерогенным для человека. 9) В 1988 году Международное агентство по исследованию рака заявило: «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) у экспериментальных животных». В октябре 2009 года Международное агентство по исследованию рака обновило классификацию ацетальдегида, и заявило, что ацетальдегид, включенный и выработанный эндогенно из алкогольных напитков, является канцерогеном I группы для людей. Кроме того, ацетальдегид повреждает ДНК и вызывает ненормальное развитие мышц, поскольку он связывается с белками. 10)
Отягчающие факторы
Болезнь Альцгеймера
 Люди с генетическим дефицитом фермента, ответственного за превращение ацетальдегида в уксусную кислоту, могут иметь больший риск болезни Альцгеймера. «Эти результаты показывают, что дефицит ALDH2 является фактором риска для болезни Альцгеймера с поздним началом…» 11)
Люди с генетическим дефицитом фермента, ответственного за превращение ацетальдегида в уксусную кислоту, могут иметь больший риск болезни Альцгеймера. «Эти результаты показывают, что дефицит ALDH2 является фактором риска для болезни Альцгеймера с поздним началом…» 11)
Генетические условия
Исследование 818 пьющих алкоголиков показало, что люди, подвергающиеся воздействию большего количества ацетальдегида, чем обычно, из-за дефекта в гене ацетальдегиддегидрогеназы, подвержены большему риску развития рака верхних отделов желудочно-кишечного тракта и печени.
Дисульфирам
Препарат дисульфирам (антабус) предотвращает окисление ацетальдегида в уксусную кислоту. Антабус иногда используется как средство лечения для алкоголиков, желающих оставаться трезвыми.
Источники воздействия
Воздух в помещении
Ацетальдегид является потенциальным загрязнителем на рабочем месте, в помещении и окружающей среде. Более того, большинство людей проводят более 90% своего времени в помещениях, увеличивая воздействие и риск для здоровья. Во французском исследовании, средняя концентрация ацетальдегидов в помещении, измеренная в 16 домах, была примерно в семь раз выше, чем концентрация наружного ацетальдегида. В гостиной было в среднем 18,1 ± 17,5 мкг м-3, а в спальне - 18,2 ± 16,9 мкг м-3 ацетальдегида, тогда как наружный воздух содержал среднюю концентрацию 2,3 ± 2,6 мкг м-3. Был сделан вывод, что летучие органические соединения (ЛОС), такие как бензол, формальдегид, ацетальдегид, толуол и ксилолы, должны рассматриваться в качестве приоритетных загрязнителей с точки зрения их воздействия на здоровье. Было отмечено, что в отремонтированных или полностью новых зданиях концентрации ЛОС часто на несколько порядков выше. Основными источниками ацетальдегидов в домах являются строительные материалы, ламинат, линолеум, деревянные лакированные и пробковые / сосновые полы. Он также встречается в пластиковых водоэмульсионных и матовых эмульсионных красках, в деревянных потолках, а также в мебели из дерева, ДСП, фанеры сосны. 12)
Наружный воздух
Использование ацетальдегида широко распространено в различных отраслях промышленности, и возможны его сбросы в сточные воды или воздух при производстве, использовании, транспортировке и хранении. Источники ацетальдегида включают выбросы от сжигания топлива от стационарных двигателей внутреннего сгорания и электростанций, которые сжигают ископаемое топливо, древесину или мусор, от добычи нефти и газа, нефтеперерабатывающих заводов, цементных печей, лесозаготовительных и лесоперерабатывающих заводов и бумажных фабрик. Ацетальдегид также присутствует в выхлопных газах автомобилей и дизельных двигателей. В результате, ацетальдегид является «одним из наиболее часто встречающихся авиационных ядов с риском рака более одного на миллион».
Табачный дым
Было показано, что природные полисахариды табака, включая целлюлозу, являются основными прекурсорами, делающими ацетальдегид важной составляющей табачного дыма. 13) Было продемонстрировано, что ацетальдегид обладает синергетическим эффектом с никотином в исследованиях зависимости на грызунах. Ацетальдегид также является наиболее распространенным канцерогеном в табачном дыме; он растворяется в слюне во время курения.
Курение конопли
Ацетальдегид был обнаружен в дыму каннабиса. Это открытие стало возможным благодаря использованию новых химических методов, которые продемонстрировали, что присутствующий ацетальдегид вызывает повреждение ДНК в лабораторных условиях.
Потребление алкоголя
Многие микробы производят ацетальдегид из этанола, но они имеют меньшую способность расщеплять ацетальдегид, что может привести к накоплению ацетальдегида в слюне, желудочной кислоте и кишечном содержимом. Ферментированная пища и многие алкогольные напитки также могут содержать значительные количества ацетальдегида. По-видимому, ацетальдегид, полученный в результате окисления этанола, табачного дыма и диеты, в слизистой оболочке или микробами, действует как кумулятивный канцероген в верхних отделах пищеварительного тракта человека. По мнению Научного комитета Европейской комиссии по безопасности потребителей (SCCS) «Мнение об ацетальдегиде» (2012), предел особого риска для косметических средств составляет 5 мг / л, и ацетальдегид не должен использоваться в средствах для полоскания рта. 14)
Пластмассы
Ацетальдегид также образуется в результате термического разложения или ультрафиолетового фотодеградации некоторых термопластичных полимеров во время или после изготовления. Один распространенный пример - если оставить бутылку воды в машине без кондиционера на несколько часов в жаркий солнечный день, можно заметить странный сладкий вкус воды после разрушения контейнера из полиэтилентерефталата (PETE). Водная промышленность обычно признает 20-40 частей на миллиард в качестве порога вкуса / запаха для ацетальдегида. Уровень, при котором средний потребитель может обнаружить ацетальдегид, все еще значительно ниже, чем любая токсичность. 15)
Candida
Было показано, что у пациентов с потенциально канцерогенными заболеваниями полости рта Candida albicans продуцирует ацетальдегид в количествах, достаточных для возникновения проблем.










