Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Октопамин
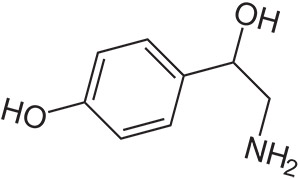
Октопамин (β, 4-дигидроксифенэтиламин) является эндогенным биогенным амином, тесно связанным с норадреналином, и оказывающим влияние на адренергические и дофаминергические системы. Установлено также, что он содержится в составе многих растений, в том числе горьком апельсине. Биосинтез D-(-)-энантиомера октопамина осуществляется при β-гидроксилировании тирамина с помощью фермента допамин β-гидроксилазы. Октопамин под торговыми марками Epirenor, Норден и Norfen также используется в медицине как симпатомиметический препарат. Метаболит синефрина, октопамин представляет собой стимулирующее соединение, которое предположительно обладает жиросжигающим действием. Запрещен Всемирным антидопинговым агентством в связи с его стимулирующими свойствами, заявление о прямом жиросжигающем действии может быть неактуальным и не было эффективно протестировано на людях.
Необходимо знать:
- Октопамин включен в перечень запрещенных веществ 2014 г. Всемирного антидопингового агентства.
Источники и структура
Источники и структура
Фармакологическая группа: биогенные амины
Систематическое (ИЮПАК) наименование: (RS)-4-(2-амино-1-гидроксиэтил) фенол
Правовой статус: отпускается только по рецепту
Применение: перорально
Период полураспада: 15 минут у насекомых. Теоретически может быть больше у позвоночных
Синонимы: Norsympathol, Norsynephrine, норфен, пара-октопамин, бета-гидрокситирамин, пара-гидрокси-фенил-этаноламин
Формула: C8H11NO2
Мол. масса: 153,178 г / моль
Октопамин (β,4-дигидроксифенэтиламин) представляет собой малый амин, эндогенно обнаруженный в головном мозге человека, где он взаимодействует с передачей сигнала катехоламинов; близок по структуре к синефрину и тирамину, является метаболитом последнего (посредством допамин β-гидроксилазы) и субстратом для синтеза первого (посредством фенэтаноламин N-метилтрансферазы1)), при этом является наиболее близким по структуре к норадреналину. Широко распространенное название октопамин происходит от его источника, обнаруженного в 1940 г., слюнной железы осьминога (осьминог обыкновенный; приводится косвенною, так как оригинальный источник не размещен в сети Интернет). Октопамин и мелкий амин тирамин представляют собой преобладающие нейростимуляторы у беспозвоночных, где их путь передачи сигнала соединен с аденилил циклазой (для выработки цАМФ) и параллелен человеческой системе передачи сигнала катехоламина;2) тем не менее, эти рецепторы не выражены у людей, и октопамин взаимодействует с адренергическими рецепторами или малыми аминовыми рецепторами. Октопамин является одним из конечных продуктов метаболизма L-тирозина у людей и используется в качестве посредника, из которого организм может вырабатывать синефрин. Играет главную роль у беспозвоночных, что не распространяется на людей (подобно экдистероидам). Пищевые добавки, содержащие горький апельсин (померанец), могут также содержать синефрин, октопамин и тирамин, при этом синефрин является преобладающим включением, а октопамин содержится в диапазоне 140-900 мкг/г (хотя обычно составляет 1,0-1,3% содержания синефрина и сопоставим с содержанием тирамина).3)
Померанец содержит множество биогенных аминов со структурным сходством:
- L-тирозин - родительская аминокислота, из которой получены биогенные амины (не принадлежат к классу фенилэтиламина)
- Декарбоксилированный L-тирозин – тирамин
- Метилирование аминовой группы тирамина приводит к образованию N-метилтирамина, а другое метилирование ведет к образованию горденина
- Гидроксилирование тирамина дает в результате октопамин, в то время как гидроксилирование N-метилтирамина дает синефрин
Другие натуральные источники, которые содержат октопамин, включают:
- Шелуху чеснока, которая содержит N-транс-кумароилоктопамин и N-транс-ферулоилоктопамин,4) два ингибитора тирозиназы (значения ИК50 составляют менее чем 10 микромоль)
- Аир Татаринова (содержит N-транс-кумароилоктопамин и N-транс-ферулоилоктопамин)
Октопамин обнаружен в горьком апельсине подобно многим биогенным аминам, имеющим отношение к L-тирозину и применяющимся в качестве пищевой добавки, которые включают синефрин и горденин. Октопамин в целом может наблюдаться в виде одного из трех изомеров со стоящим впереди префиксом мета (m), орто (o) или пара (p) для образования названий изомеров, таких как p-октопамин; подобная система образования названий у синефрина. Кроме того, R форма (-)- и S форма (+)- существуют в качестве энантиомеров, которые дают шесть возможных вариантов октопамина:5)
- (-)-p-октопамин
- (+)-p-октопамин
- (-)-m-октопамин
- (+)-m-октопамин
- (-)-o-октопамин
- (+)- o-октопамин
Выделенные курсивом l или d в некоторых случаях используются для обозначения энантиомеров и соответствуют R и S соответственно, означая, что R-p-октопамин, (-)-p-октопамин и D-p-октопамин являются синонимами. Другие синонимы включают норзинефрин (относится к p-октопамину) и норфенефрин (относится к m-октопамину). P-октопамин эндогенно синтезируется из пищевого L-тирозина (косвенно) и предположительно эндогенно представлен исключительно в виде R энантиомера, свидетельствуя, что R-p-октопамин является основной формой естественного происхождения у людей. Некоторое количество m-октопамина было обнаружено в нервных тканях и головном мозге человека, несмотря на отсутствие в растениях,6) при этом o-октопамин считается абсолютно синтетическим, поскольку не был обнаружен в природе. Октопамин может существовать в одной из шести различных форм в зависимости от положения гидроксильной группы на бензоловом кольце (дает изомеры) или ориентации гидроксильной группы в аминовой боковой цепи (дает энантиомеры вышеупомянутых изомеров).
Молекулярные мишени
Малые аминовые рецепторы
Малые аминовые рецепторы (TA рецепторы или TAAR) – это внутриклеточные рецепторы, которые вызывают аккумулирование цАМФ в результате активации и демонстрируют структурное и функциональное сходство с суперсемейством β-адренергических и родопсиновых рецепторов; лиганды для этих рецепторов включают октопамин и другие малые амины, такие как фенилэтиламин (PEA) и тирамин, но также многие галлюциногенные и наркогенные вещества.7)
Фармакология
Абсорбция
 В связи с тем, что выведение с мочой октопамина и его метаболитов сопоставимо с пероральным приемом (8 мг на голодный желудок) и внутривенным введением той же дозы, считается, что биологическая усвояемость у людей является полной. Несмотря на практически полную абсорбцию, было отмечено, что он с трудом конъюгируется в кишечнике и печени, так как 0,58% пероральной дозы составляет «свободный» октопамин (после учета метаболизма посредством моноамин оксидазы и конъюгации).
В связи с тем, что выведение с мочой октопамина и его метаболитов сопоставимо с пероральным приемом (8 мг на голодный желудок) и внутривенным введением той же дозы, считается, что биологическая усвояемость у людей является полной. Несмотря на практически полную абсорбцию, было отмечено, что он с трудом конъюгируется в кишечнике и печени, так как 0,58% пероральной дозы составляет «свободный» октопамин (после учета метаболизма посредством моноамин оксидазы и конъюгации).
Перенос в сыворотку
Независимо от приема, исходный уровень октопамина в сыворотке находится в низком наномолярном диапазоне, включая 4,28+/-0,28 нг/мл у здоровых старых (60) контролей. Он был обнаружен в тромбоцитах в концентрациях, подобных адреналину и норадреналину.8) В результате приема 8 мг p-октопамина период полувыведения является двухфазным и составляет 76 и 175 минут, что предположительно может объясняться коньюгатами, которые гидролизируются обратно в свободный p-октопамин.
Неврологическое распределение
Подобно фенилэтиламину и другим малым аминам, октопамин ( p и m энантиомеры) эндогенно выражен в зонах головного мозга, способствуя автономному функционированию, где также выражены малые аминовые рецепторы.
Метаболизм
Октопамин метаболизируется ферментами моноамин оксидазы (MAO) типа A и B, подобно фенилэтиламину,9) но также может метаболизироваться семикарбазид-чувствительной аминоксидазой (SSAO или аминоксидаза). Когда подвергается действию одного из этих ферментов, октопамин дезаминируется в метаболит, известный как p-гидроксиминдальная кислота (в случае p-октопамина) или m-гидроксиминдальная кислота (в случае m-октопамина). Октопамин может быть конъюгирован, и по меньшей мере в отношении m-октопамина доля неконьюгированного октопамина выше в результате внутривенного введения (10,5%) по сравнению с пероральным приемом (0,58%), что свидетельствует о высокой степени конъюгирования во время пресистемного метаболизма. Возможно, что это в некоторой степени ослабляет эффективность октопамина, так как его применение в целях лечения гипотензивных нарушений обладает меньшей силой действия при пероральном приеме по сравнению с внутривенным введением. Прием ингибиторов моноамин оксидазы у крыс, принимавших тирамин (отвечает за уровень октопамина в моче), может повышать уровень свободного октопамина в моче в 10 крат за счет снижения окислительного метаболизма в отношении гидроксиминдальных кислот.10)
Выведение
Метаболиты гидроксиминдальной кислоты составляют две трети перорально принятого октопамина у людей и выводятся с мочой. Другие метаболиты включают либо неизменный октопамин, либо метаболит гидроксифенолгликоль, либо оба вышеупомянутых, а также октопамин, конъюгированный посредством пресистемного метаболизма. До 93% принятого октопамина выводятся с мочой в течение 24 часов, при этом пиковые значения в моче наблюдаются через четыре часа после перорального приема (предметные исследования в целях допинг-контроля). При пероральном приеме высокой дозы синефрина участниками октопамин не вырабатывается эндогенно, свидетельствуя, что синтез синефрина из октопамина посредством N-метилирования11) происходит обратным путем (деметилирование) в степени, сопоставимой с окислительным распадом октопамина в гидроксиминдальную кислоту, что приводит к незначительному аккумулированию октопамина. Большая часть мочевых метаболитов синефрина также представлена гидроксиминдальной кислотой соответствующего энантиомера. В то время как октопамин является посредником в метаболизме синефрина и должен временно повышаться при приеме синефрина, предполагается, что быстротечный метаболизм октопамина, вырабатываемого в этой манере, предотвращает повышение уровня октопамина в моче (важно, так как октопамин запрещен Всемирным антидопинговым агентством, а синефрин нет).
Неврология
Адренергическая нейропередача
У беспозвоночных роль путей передачи сигнала октопамина/тирамина сравнима с ролью пути передачи сигнала катехоламина (адреналин и допамин) у людей, при этом октопамин у людей всего лишь косвенно причастен к адренергической нейропередаче в качестве лиганда малого аминового рецептора. Большое количество информации в отношении октопамина, каким образом он относится к адренергической нейропередаче, полученной касательно беспозвоночных, не может надежно распространяться на людей в связи с межвидовыми различиями. Это включает исследования в лабораторных условиях, применявшие клетки или рецепторы, выделенные из насекомых, а не из клеток млекопитающих. Октопамин является агонистом человеческих β1-рецепторов (ЭК50 в 3,129+/-461 наномоль) и агонистом β3 (адипоцитs), хотя не оказывает влияния на β2 рецепторы (трансфицированный HEK293) в концентрации до 6,7 микромоль, в то же время аллостерически ингибируя другие агонисты (изопреналин). На уровне α-адренергического рецептора m-октопамин представляет собой агонист, который обладает одной сотой силы действия норадреналина в целом,12) что предположительно в меньшей степени связано с его силой действия на α2-адренергические рецепторы (примерно в 150 крат меньшая сила действия) и больше связано с его действием на α1-адренергические рецепторы, так как оно всего лишь в 6 крат менее сильное. M-октопамин представляет собой наиболее сильнодействующий изомер октопамина в отношении этих рецепторов, при этом p-октопамин более чем в 10 крат слабее m-октопамина, а o-октопамин является наиболее слабым, в то время как в отношении образования энантиомеров (-)- более эффективен, чем в образовании (+)-. При оценке именно α2A-адренергического рецептора рацемическая смесь m-октопамина ингибирует цАМФ в концентрации 10 микромоль за счет этого рецептора, при этом наименее сильнодействующая форма (+)-p-октопамин не оказывает действия в концентрации 100 микромоль. Октопамин представляет собой лиганд для адренергических рецепторов, включая альфа и бета классы, хотя концентрации в отношении альфа рецепторов значительно выше, чем требующиеся для активации бета рецепторов. Хотя это обычно свидетельствует о селективности, концентрации, необходимые для воздействия октопамина на эти рецепторы (за исключением β3), выше тех, которые могут наблюдаться в результате перорального приема.
Допаминергическая нейропередача
Октопамин взаимодействует с допаминовыми рецепторами, связываясь с той же точкой рецептора D1, с которой связывается экспериментальный антагонист SCH-23390,13) при этом не обладает явной аффинностью для рецептора D2. По меньшей мере в ткани желудка антагонизм рецептору D1 наблюдается в концентрации 1 микромоль и может полностью устранять допамин (агонист) в концентрации, соответствующей значению ЭК50 или меньшей, также эффективен в головном мозге мышей за счет внутрибрюшинной (инъекция) дозы в 10 мг/кг. В других исследованиях в еюнальной (кишечной) ткани кроликов октопамин продемонстрировал агонистические свойства в отношении рецептора D1 в манере, блокируемой SCH-23390.14) Причина отличий между кишечной и невральной тканью не ясна. Хотя на сегодняшний день отсутствуют свидетельства в отношении человека, октопамин играет роль в ингибирование активности рецептора D1 (при этом меняя передачу допаминового сигнала в направлении других рецепторов, таких как D2), что наблюдается в концентрациях, которые являются не слишком высокими. Человеческий переносчик допамина (DAT) в клетках HEK293 обладает аффинностью для dl-октопамина, взаимодействуя со значением KD в 220 микромоль, что слабее, чем у p-тирамина (22 микромоль) и D-амфетамина (5,5 микромоль), при этом его эффективность положительно соотносится с содержанием натрия в посреднике (DAT представляет собой натрия хлорид- зависимый переносчик), хотя и не зависит от него. Пониженная сила действия октопамина по сравнению с тирамином предположительно связана с гидроксилированием в β-углероде на боковой цепи, что снижает аффинность для DAT сходных по структуре соединений. Октопамин обладает аффинностью для переносчика допамина, предположительно как субстрат, но при тестировании в лабораторных условиях он обладает достаточно низкой аффинностью (по сравнению с его концентрацией, ожидаемой в головном мозге). Взаимодействие октопамина и DAT в лабораторных условиях требует дальнейших исследований.
Головные боли и кровоток
 Метаболизм малых аминов нарушен у людей, страдающих от мигреней,15) при этом уровень октопамина в тромбоцитах значительно выше у людей, страдающих от мигреней, не сопровождающихся предшествующим эпилептическому припадку состоянием, при этом при мигренях, сопровождающихся таким состоянием, уровень синефрина выше, а уровень октопамина не меняется. Уровень октопамина в тромбоцитах также выше у людей с первичной головной болью, хотя в других исследованиях у людей, страдающих хронической мигренью, уровень октопамина не менялся, несмотря на повышение уровня катехоламинов и тирамина у людей с хронической мигренью.
В других случаях мигрени, таких как мигрень, проявляющаяся наряду с расстройствами приема пищи (высокий коэффициент распространенности, нередко превышающий 75%), у людей с расстройствами приема пищи был выявлен уровень октопамина, сопоставимый с контрольными субъектами, хотя он может быть незначительно ниже при нервно-психической анорексии по сравнению с нервно-психической булимией (которая дает повышенный уровень тирамина по сравнению с анорексией).16)
Хроническая головная боль напряжения (CTTH) отличается от хронической мигрени, так как не обладает всеми побочными эффектами мигрени (светобоязнь, боязнь некоторых запахов, фонофобия, тошнота) и не дает патологических нарушений общего метаболического пути L-тирозина, как это делают хронические мигрени.
В целом, мигрени могут быть связаны с патологическими нарушениями метаболизма L-тирозина, который включает катехоламины (норадреналин и допамин), а также малые амины, такие как октопамин и тирамин. Эти нарушения не распространяются на все формы мигрени, при этом роль приема октопамина в этом отношении не известна.
Метаболизм малых аминов нарушен у людей, страдающих от мигреней,15) при этом уровень октопамина в тромбоцитах значительно выше у людей, страдающих от мигреней, не сопровождающихся предшествующим эпилептическому припадку состоянием, при этом при мигренях, сопровождающихся таким состоянием, уровень синефрина выше, а уровень октопамина не меняется. Уровень октопамина в тромбоцитах также выше у людей с первичной головной болью, хотя в других исследованиях у людей, страдающих хронической мигренью, уровень октопамина не менялся, несмотря на повышение уровня катехоламинов и тирамина у людей с хронической мигренью.
В других случаях мигрени, таких как мигрень, проявляющаяся наряду с расстройствами приема пищи (высокий коэффициент распространенности, нередко превышающий 75%), у людей с расстройствами приема пищи был выявлен уровень октопамина, сопоставимый с контрольными субъектами, хотя он может быть незначительно ниже при нервно-психической анорексии по сравнению с нервно-психической булимией (которая дает повышенный уровень тирамина по сравнению с анорексией).16)
Хроническая головная боль напряжения (CTTH) отличается от хронической мигрени, так как не обладает всеми побочными эффектами мигрени (светобоязнь, боязнь некоторых запахов, фонофобия, тошнота) и не дает патологических нарушений общего метаболического пути L-тирозина, как это делают хронические мигрени.
В целом, мигрени могут быть связаны с патологическими нарушениями метаболизма L-тирозина, который включает катехоламины (норадреналин и допамин), а также малые амины, такие как октопамин и тирамин. Эти нарушения не распространяются на все формы мигрени, при этом роль приема октопамина в этом отношении не известна.
Жировая масса и ожирение
Липогенез
Октопамин способен ингибировать поглощение глюкозы в адипоцитах (100 микромоль) за счет ингибирования адренорецептора β3, хотя может также наблюдаться аддитивное повышение поглощения глюкозы за счет противоположного механизма; октопамин может метаболизироваться в жировых клетках посредством моноамин оксидазы (MAO) или семикарбазид-чувствительной аминоксидазы (SSAO17)) в форму окислительного побочного продукта креатина перекиси водорода (H2O2), который сам по себе предположительно активирует АМФ-зависимую киназу. Данный путь также распространяется на тирамин, который метаболизируется подобно октопамину, при этом поглощение глюкозы повышается при повышении окисления.18) Смешанное действие на поглощение глюкозы в жировых клетках в связи с двумя противоположными механизмами, при этом практическая значимость этих сведений в отношении приема октопамина не известна.
Окисление жиров
При инкубации в жировых клетках, взятых у страдающих ожирением пациентов, m-октопамин (10 микромоль) повышает липолиз за счет активации α1-адренергического рецептора с аналогичной силой действия высокой концентрации норадреналина. Данный конкретный подкласс альфа рецепторов (в отличие от α2 рецепторов, которые являются антилиполитическими за счет ингибирования цАМФ) повышает концентрацию кальция и активацию протеинкиназы C, что приводит к высвобождению глицерина.19) Несмотря на предыдущее свидетельство, отметившее активацию α2 рецепторов в нейронах за счет октопамина в высоких концентрациях, было выявлено, что p-октопамин, который в концентрации до 100 микромоль в нейронах не активирует данный подкласс, не воспроизводит активацию в адипоцитах. При использовании изомера октопамина, который обладает липолитическим действием за счет агонизма β3 и антилиполитическим действием за счет агонизма α2, первое дает более значительные результаты в отношении общего липолитического эффекта; удаление рецепторов β3 вызывает слабое липогенное действие,20) что предположительно связано с действием в липолитической манере посредством α1 адренорецепторов. Октопамин активирует α1 адренергические рецепторы (вызывает липолиз) и α2 адренергические рецепторы (ингибирует липолиз), хотя p-октопамин широко используется в качестве жиросжигающей добавки, поскольку данный конкретный изомер не активирует последний подкласс адренергических рецепторов. P-октопамин взаимодействует с β-адренергическими рецепторами в адипоцитах, хотя он способен вызывать активный липолиз в значительно большей степени в клетках крыс и хомяков по сравнению с человеческими клетками, что предположительно связано со значительно большей процентной долей β3-адренорецепторов (представлены в буром жире, но содержатся в ограниченном количестве в белом жире у людей). P-октопамин обладает всего лишь в 2 крат меньшей силой действия, чем норадреналин, на β3-адренорецепторы, в тоже время обладая в 200 крат меньшей аффинностью в отношении клеток, выражающих β1 и β2. Октопамин представляет собой полный агонист β3 рецептора со слабой аффинностью для двух других подтипов рецепторов, свидетельствуя, что в результате перорального приема он будет выступать в качестве селективного активатора β3 рецептора. В то время как этот рецептор обусловливает жиросжигающее действие октопамина, он в меньшей степени выражен в белой жировой ткани человека (в большей степени выражен в бурой жировой ткани и у грызунов по сравнению с людьми).
Периферийные системы органов
Желудок
Допамин стимулирует секрецию кислоты из желудка крыс (ЭК50 в 600 наномоль) в манере, которая вызывает антагонизм октопамина в концентрации 1 микромоль. Допамин также вызывает противодействие селективного антагониста D1 рецептора (SCH23390), с которым октопамин обладает сходным действием и связывается с тем же активным центром.
Мочевой пузырь
M-октопамин тестировался в отношении его роли в лечении слабого недержания у женщин в связи с его агонистическими α-адренергическими свойствами (класс препаратов, применяющихся для лечения недержания у женщин), большая часть исследований использовала фармацевтическое средство Невадрал Ретард («ретард» относится к замедляющему высвобождение инкапсулированию). Данное средство в дозе 90 мг может резко повышать уретральное давление, которое предположительно сохраняется после шести недель приема.21) Первым исследованием, отметившим полезное действие, было пилотное исследование, применявшее 60 мг таблеток с медленным высвобождением в течение трех месяцев, которое выявило долю ответивших на лечение в 35% у субъектов, которые смогли контролировать мочеиспускание, при этом более поздние исследования повышали дозу до 30 мг три раза в день (90 мг всего) в течение более долгого периода времени (колеблется между 3-24 неделями) у женщин со слабым недержанием и выявили улучшения по сравнению с исходным состоянием, что определено часовым тестом с прокладкой. В двойном слепом исследовании с тем же протоколом дозировки (15-30 мг три раза в день, общая ежедневная доза 45-90 мг в течение шести недель) наблюдалось улучшение в 52% субъективных симптомов, при этом 26% субъектов сообщили о возможности контроля мочеиспускания; в то время как повышение уретрального давления, наблюдаемое за счет приема (10%), в целом было незначительным по сравнению с плацебо, оно было значительным у людей с худшим исходным состоянием.
Продолжительность жизни
Актуальность темы
У стареющих крыс было отмечено, что, несмотря на отсутствие патологических нарушений, наблюдаемых за счет катехоламинов при старении, уровень p-октопамина и p-тирамина был снижен по сравнению с молодыми субъектами,22) что теоретически связано с более низкой активностью фермента L-аминокислоты декарбоксилазы (которая обуславливает преобразование L-тирозина в тирамин).
Другие медицинские состояния
Болезнь Паркинсона
У людей с болезнью Паркинсона уровень октопамина в сыворотке ниже (1,80+/-0,22 нг/мл), в частности на ранних стадиях болезни (0,65+/-0,16 нг/мл), по сравнению с не страдающими болезнью контролями (4,28+/-0,28 нг/мл).
Безопасность и токсикология
Общие сведения
В то время как отсутствуют опубликованные данные в отношении побочных эффектов приема октопамина у людей (2014), это связано с отсутствием исследований на людях в отношении перорального приема. Дозы до 90 мг m-октопамина (норфенефрин) использовались до 24 недель без значительных побочных эффектов (за исключением одного субъекта, продемонстрировавшего тошноту, предположительно связанную с приемом), при этом та же доза, применявшаяся в шестинедельном двойном слепом исследовании, не проявила значительных побочных эффектов по сравнению с плацебо; следует отметить, что оба исследования использовали лекарственный состав, известный как Невадрал Ретард, который представляет собой состав с задержкой действия.
Роль у беспозвоночных
 Октопамин был впервые обнаружен итальянским ученым Витторио Эрспамером в 1948 году в слюнных железах осьминога. Было установлено, что октопамин выступает в качестве медиатора, нейрогормона и нейромодулятора у беспозвоночных. Хотя Эрспамер впервые обнаружил и назвал октопамин, фактически вещество на протяжении многих лет использовалось в качестве фармацевтического продукта. Октопамин широко используется у насекомых, ракообразных (крабов, омаров, раков) и пауков при энергозатратной деятельности, такой как полет, яйцекладка и прыжки.
Октопамин выступает в качестве эквивалента норадреналина у насекомых и участвует в регулировании агрессии у беспозвоночных, оказывая различные эффекты на разные виды беспозвоночных. Исследования показали, что снижение нейромедиатора октопамина и предотвращение кодирования тирамин бета гидроксилазы (фермента, превращающего тирамин в октопамин) уменьшает агрессию у дрозофилы, не влияя на другие модели поведения.
У саранчи октопамин модулирует активность мышц, способствуя более эффективному их сокращению. Это отчасти происходит из-за увеличения скорости сокращения и релаксации.
У медоносной пчелы и дрозофилы, октопамин играет важную роль в процессах обучения и памяти. У светлячка высвобождение октопамина приводит к продукции света в фонарике.
Октопамин также играет определенную роль у моллюсков (хотя было изучено действие октопамина только на центральную нервную систему улитки-прудовика).
У омаров октопамин в некоторой степени направляет и координирует нейрогормоны в центральной нервной системе, и было отмечено, что при инъекциях октопамина омарам и лангустам наблюдалось расширение конечностей и живота.
Хеберлайн др. провели исследования толерантности к алкоголю у плодовых мушек; было обнаружено, что мутация, которая вызывает дефицит октопамина, также вызывает снижение толерантности к алкоголю.
Изумрудная тараканья оса жалит хозяина для откладывания личинок (тараканов) в головной ганглии (мозг). Яд блокирует рецепторы октопамина, и таракан не ведет себя естественно и не пытается выбраться. Личинка становится послушной и оса приводит ее к своему логову, используя ее антенну как поводок.
Октопамин был впервые обнаружен итальянским ученым Витторио Эрспамером в 1948 году в слюнных железах осьминога. Было установлено, что октопамин выступает в качестве медиатора, нейрогормона и нейромодулятора у беспозвоночных. Хотя Эрспамер впервые обнаружил и назвал октопамин, фактически вещество на протяжении многих лет использовалось в качестве фармацевтического продукта. Октопамин широко используется у насекомых, ракообразных (крабов, омаров, раков) и пауков при энергозатратной деятельности, такой как полет, яйцекладка и прыжки.
Октопамин выступает в качестве эквивалента норадреналина у насекомых и участвует в регулировании агрессии у беспозвоночных, оказывая различные эффекты на разные виды беспозвоночных. Исследования показали, что снижение нейромедиатора октопамина и предотвращение кодирования тирамин бета гидроксилазы (фермента, превращающего тирамин в октопамин) уменьшает агрессию у дрозофилы, не влияя на другие модели поведения.
У саранчи октопамин модулирует активность мышц, способствуя более эффективному их сокращению. Это отчасти происходит из-за увеличения скорости сокращения и релаксации.
У медоносной пчелы и дрозофилы, октопамин играет важную роль в процессах обучения и памяти. У светлячка высвобождение октопамина приводит к продукции света в фонарике.
Октопамин также играет определенную роль у моллюсков (хотя было изучено действие октопамина только на центральную нервную систему улитки-прудовика).
У омаров октопамин в некоторой степени направляет и координирует нейрогормоны в центральной нервной системе, и было отмечено, что при инъекциях октопамина омарам и лангустам наблюдалось расширение конечностей и живота.
Хеберлайн др. провели исследования толерантности к алкоголю у плодовых мушек; было обнаружено, что мутация, которая вызывает дефицит октопамина, также вызывает снижение толерантности к алкоголю.
Изумрудная тараканья оса жалит хозяина для откладывания личинок (тараканов) в головной ганглии (мозг). Яд блокирует рецепторы октопамина, и таракан не ведет себя естественно и не пытается выбраться. Личинка становится послушной и оса приводит ее к своему логову, используя ее антенну как поводок.
Роль у позвоночных
У позвоночных октопамин заменяет норадреналин в симпатических нейронах с постоянным использованием ингибиторов моноаминоксидазы. Это может влиять на общий побочный эффект этих препаратов – ортостатическую гипотензию, хотя имеются также свидетельства того, что это на самом деле опосредовано повышением уровня N-ацетилсеротонина. В одном из исследований отмечалось, что октопамин может быть важным амином, влияющим на терапевтические эффекты ингибиторов, таких как ингибиторы моноаминоксидазы, особенно из-за значительного увеличения уровней октопамина при применении этого ингибитора у животных. Октопамин был идентифицирован в образцах мочи у млекопитающих, таких как люди, крысы и кролики, получавшие ингибиторы моноаминоксидазы. Очень небольшое количество октопамина также было обнаружено в некоторых тканях животных. Было отмечено, что в теле кролика, в сердце и почках наблюдались высокие концентрации октопамина. У млекопитающих октопамин может мобилизовать высвобождение жира из адипоцитов (жировых клеток), что привело к продвижению вещества в Интернете в качестве средства для похудения. Тем не менее, высвобожденный жир, вероятно, быстро будет перенесен в другие клетки, и все еще не имеется никаких доказательств того, что октопамин способствует снижению веса. Октопамин также может значительно повышать кровяное давление в сочетании с другими стимуляторами. Из-за отсутствия исследований, много чего все еще неизвестно об октопамине и его роли в организме человека.
:Tags
Читать еще: Дека-Дураболин (Нандролон деканоат) , Дорзоламид , Достинекс (Dostinex)/ Каберголин , Одуванчик , Оксид цинка ,










