Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Адреналин (Эпинефрин)
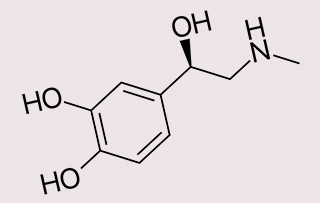 Эпинефрин (также известный, как адреналин или β,3,4-тригидрокси-N-метил-фенетиламин) – это гормон и, по совместительству, нейромедиатор.1) Эпинефрин и норэпинефрин – это два отдельных гормона, которые взаимодействуют между собой и выделяются мозговым веществом надпочечников. Оба гормона также синтезируются на концах волокон симпатического нерва, где они функционируют в качестве химических медиаторов, по которым нервные импульсы поступают в органы С открытием фармакологических свойств эпинефрина, ученые, наконец-то, разобрались в работе вегетативной нервной системы и основных функциях симпатической нервной системы. Эпинефрин зачастую эффективно помогает в критических ситуациях, когда жизнь больного «висит на волоске», не говоря уже о его неспецифическом воздействии на адренергические рецепторы (данное свойство крайне важно в медицине). В быту для обозначения эпинефрина используют слово «адреналин», которое отражает повышенную активность симпатической нервной системы на фоне выработки энергии и возбуждения катехоламинов в ответ на стресс. 2) Действие адреналина сводится в основном к ускорению обмена веществ и бронходилатации органов, но без непосредственного раздражения симпатической нервной системы.
Выражаясь «химическим» языком, эпинефрин представляет собой моноамин под названием «катехоламин». Эпинефрин вырабатывается отдельными нейронами центральной нервной системы и синтезируется внутри хромаффинных клеткок мозгового вещества надпочечников (из двух аминокислот: фенилаланина и тирозина).
Эпинефрин (также известный, как адреналин или β,3,4-тригидрокси-N-метил-фенетиламин) – это гормон и, по совместительству, нейромедиатор.1) Эпинефрин и норэпинефрин – это два отдельных гормона, которые взаимодействуют между собой и выделяются мозговым веществом надпочечников. Оба гормона также синтезируются на концах волокон симпатического нерва, где они функционируют в качестве химических медиаторов, по которым нервные импульсы поступают в органы С открытием фармакологических свойств эпинефрина, ученые, наконец-то, разобрались в работе вегетативной нервной системы и основных функциях симпатической нервной системы. Эпинефрин зачастую эффективно помогает в критических ситуациях, когда жизнь больного «висит на волоске», не говоря уже о его неспецифическом воздействии на адренергические рецепторы (данное свойство крайне важно в медицине). В быту для обозначения эпинефрина используют слово «адреналин», которое отражает повышенную активность симпатической нервной системы на фоне выработки энергии и возбуждения катехоламинов в ответ на стресс. 2) Действие адреналина сводится в основном к ускорению обмена веществ и бронходилатации органов, но без непосредственного раздражения симпатической нервной системы.
Выражаясь «химическим» языком, эпинефрин представляет собой моноамин под названием «катехоламин». Эпинефрин вырабатывается отдельными нейронами центральной нервной системы и синтезируется внутри хромаффинных клеткок мозгового вещества надпочечников (из двух аминокислот: фенилаланина и тирозина).
Применение в медицине
 Адреналин помогает при: остановке сердца, анафилаксии и сильных кровотечениях.3) При помощи него люди издревле снимали бронхиальные спазмы и повышали уровень сахара в крови, хотя в современном обществе с этими проблемами помогают справляться препараты нового поколения, действие которых направлено на бета-2 адренергические рецепторы (например, сальбутамол, синтетическое производное эпинефрина).
Адреналин помогает при: остановке сердца, анафилаксии и сильных кровотечениях.3) При помощи него люди издревле снимали бронхиальные спазмы и повышали уровень сахара в крови, хотя в современном обществе с этими проблемами помогают справляться препараты нового поколения, действие которых направлено на бета-2 адренергические рецепторы (например, сальбутамол, синтетическое производное эпинефрина).
Остановка сердца
Адреналин используют в качестве реанимирующего средства при остановке сердца и для борьбы с сердечной аритмией или при уменьшении объема сердца. Действие эпинефрина направлено на повышение периферического сопротивления сосудов (путем α1рецептор-зависимого сужения этих сосудов) и на увеличение объема сердца (посредством прикрепления к β1 – рецепторам). Замедление периферического кровообращения необходимо для повышения коронарного и церебрального перфузионного давления и, как следствие, усиленного снабжения клеток кислородом. Несмотря на то, что эпинефрин повышает кровяное давление в аорте, головном мозге и сонной артерии, он замедляет кровообращение внутри сонной артерии и снижает уровень углекислого газа в конце каждого спокойного выдоха (ETCO2). Получается, эпинефрин усиливает макро-циркуляцию за счет русел капилляров, в которых и происходит перфузия.4) Концентрация углекислого газа в легких при каждом спокойном выдохе является своего рода маркером, по которому судят о том, окажется ли реанимация эффективной и нормализуется ли у человека кровообращение. При повышении макроциркуляционного давления, не всегда усиливается кровообращение в нервных окончаниях. Уровень ETCO2 является более точным индикатором тканевой перфузии, чем маркеры перфузионного давления. Как выяснилось, эпинефрин не способствует улучшению тканевой перфузии и длительному выживанию; более того, он снижает коэффициент выживаемости при остановке сердца.5)
Анафилаксия
Эпинефрин/адреналин – это препарат «первого порядка» (лучшее средство) для лечения анафилаксии. Аллергикам, проходящим курс иммунотерапии, зачастую перед приемом вещества, вызывающего у них аллергию, внутривенно вливают адреналин, тем самым притупляя реакцию иммунной системы на принятый аллерген. Для различных экстренных ситуаций предусмотрены свои нормы приема эпинефрина (концентрации, дозы и места введения препарата). Универсальный авто-инжектор (шприц) эпинефрина вмещает 0,3 мг эпинефрина (0,3 мл, 1:1000) и применяется в качестве неотложной медицинской помощи при серьезных (I типа) реакциях, включая анафилаксию, аллергические реакции на укусы насекомых, контрастную среду, лекарства. Одна доза рассчитана на 30 (или чуть более) кг веса, в случае необходимости человеку делается повторный укол. В педиатрии используют более низкие дозы адреналина, 6) которые вызывают сужение сосудов в месте подкожной инъекции, замедляя всасывание препарата. Фармакокинетический профиль эпинефрина позволяет усиливать приток плазмы в место инъекции (2 наномоль/л); подобная концентрация достигается при использовании ингалятора с эпинефрином и при интенсивной физической нагрузке, но она слишком мала для воздействия на бета-1 адренергический рецептор или для (альфа) сужения сосудов, хотя ее хватает для активации бета-2 адренергического рецептора, благодаря которому концентрация калия в плазме снижается, а уровень глюкозы, наоборот, повышается (при этом у человека на фоне бронходилатации и бронхопротекции усиливается тремор пальцев рук). Аллергенная доза эпинефрина (0,1мл/кг 1/1000 эпинефрина при максимальной разовой дозе 0,3 мл подкожно или внутримышечно; второй способ предпочтительнее при слабой перфузии) эффективно борется с кожными реакциями в ответ на подкожную инъекцию антигена. Волдыри и высыпания на коже исчезают под действием бета-2 адренергических рецепторов, выступающих в роли медиаторов данной реакции. Отеки исчезают вследствие ограничения продвижения раствора по сосудам в участках, где пост-капиллярные венулы соединяются с эндотелием (при раздражении рецепторов на поверхности эндотелия). При повторном введении эпинефрина, либо при повышении дозировки не исключено дальнейшее сужение капилляров (за счет стимуляции альфа-рецепторов) и, как следствие, снятие воспалительных отеков.7) При внутривенном, внутрикостном или внутримышечном введении, действие эпинефрина в разы усиливается. Поэтому при рефракторном анафилактическом шоке или остановке сердца эпинефрин предварительно разбавляют в пропорции 1/10000, после чего вводят его внутривенно или внутримышечно (так он начинает быстрее действовать). При рефракторном анафилактическом шоке взрослым на протяжении 5 минут вводят 1 мг эпинефрина (1:10000; внутривенно/внутрикостно), а при остановке сердца делают струйные инъекции 1 мг (1:10000; внутривенно и внутрикостно). Принцип действия внутривенных и внутрикостных инъекций адреналина основан на взаимодействии с альфа-адренергическим рецептором, за счет которого сужаются сосуды, повышается центральное артериальное давление (причем агонисты альфа-адренергического рецептора считаются альтернативными лекарствами).8) С внутримышечными инъекциями дело обстоит сложнее, поскольку сам процесс более трудоемкий в связи с разной толщиной подкожной жировой прослойки у людей, поэтому у слишком полных людей врач попросту может не добраться до самой кости или по ошибке попасть в вену (при этом часто ошибаются с концентрацией). Безусловно, внутримышечные инъекции эффективнее подкожных (при таком способе введения адреналина улучшается его фармакокинетический профиль). Различные модификации α1 и β2 - рецепторов, в зависимости от способа введения адреналина, способствуют как повышению, так и понижению артериального давления, в зависимости от того, достигается ли (за счет повышения/снижения периферического сопротивления сосудов) баланс между инотропным и хронотропным действием адреналина на сердечную мышцу (эти эффекты способствуют повышению ее сократительной способности и ускорению сердцебиения, соответственно). Для подкожных и внутримышечных инъекций, стандартной концентрацией адреналина считается 0,15- 0,3 мл в пропорции of 1:1 000. В аптеках они продаются в виде уколов от аллергии марки «Эпипен».
Астма
Адреналин используют в качестве бронхо-расширяющего средства при лечении астмы, когда не помогают (или их нет в наличии) агонисты β2 рецепторов. Как правило, астматикам вводят (внутривенно и внутримышечно) 300–500 мкг адреналина. 9)
Круп
Рацемический эпинефрин испокон веков используют для лечения крупа (респираторного заболевания, наиболее распространенного среди детей дошкольного возраста, чаще всего в возрасте от трёх месяцев до трёх лет).10) Рацемический адреналин – это смесь правовращающихся (d) и левовращающихся (l) изомеров адреналина в пропорции 1:1. l- это активный компонент. Рацемический адреналин оказывают стимулирующее действие на α-адренергические рецепторы в воздушном потоке, вследствие чего сужаются сосуды слизистой горла и снимается отечность под голосовыми связками, что, в конечном итоге, приводит к расслаблению гладкой мускулатуры бронхов.
Местная анестезия
Адреналин добавляют в некоторые местные анестетики, такие как бупивакаин и лидокаин, за счет чего сосуды сужаются, всасывание анестетика замедляется, и он дольше действует. Благодаря сосудосуживающим свойствам эпинефрина, его часто добавляют в состав местных анестетиков, что, помимо всего прочего, помогает остановить кровотечение (и снизить общую потерю крови), когда пациент восстанавливается после амбулаторного хирургического вмешательства («малых» операций). Побочные эффекты (чувство тревоги и страх, тахикардия и тремор) обусловлены содержанием в составе местных анестетиков адреналина. Эпинефрин/адреналин часто добавляют в дентальные и спинальные анестетики, после чего у особо впечатлительных и чувствительных людей случаются приступы панических атак, на фоне которых они нередко лишаются дара речи и застывают на месте «как вкопанные» (в таких случаях говорят о поверхностном наркозе).11) Дневная доза адреналин-содержащего (сосудосуживающего) дентального анестетика не должна превышать 10 мкг/фунт общей массы тела.
Авто-инжекторы
 Зачастую адреналин вводится с помощью авто-инжектора. Двойная инъекция «Твинжект» (в настоящее время такие инъекции не практикуются) представляет собой авто-инжектор с двумя шприцами (в каждом из которых – по одной дозе адреналина). Несмотря на то, что «Эпипен» и «Твинжект» - это названия торговых марок, они также используются для обозначения любого другого авто-инжектора с адреналином.
Зачастую адреналин вводится с помощью авто-инжектора. Двойная инъекция «Твинжект» (в настоящее время такие инъекции не практикуются) представляет собой авто-инжектор с двумя шприцами (в каждом из которых – по одной дозе адреналина). Несмотря на то, что «Эпипен» и «Твинжект» - это названия торговых марок, они также используются для обозначения любого другого авто-инжектора с адреналином.
Побочные эффекты
К побочным реакциям организма на адреналин относятся такие явления, как учащенное сердцебиение, тахикардия, аритмия, повышенная тревожность, панические атаки, головная боль, тремор, гипертония и выраженный отек легких.12) Адреналин противопоказан людям, принимающим неселективные β-блокаторы, поскольку такая комбинация может вызывать резкие скачки (вверх) артериального давления и даже геморрагический инсульт. Несмотря на распространенное мнение о том, что адреналин, за счет сужения коронарных артерий, способствует развитию сердечной недостаточности, это не так. К коронарным артериям прикреплены только β2 -рецепторы, которые, в присутствии адреналина, наоборот, вызывают расширение кровеносных сосудов. И, тем не менее, высокие дозы адреналина – это отнюдь не выход при остановке сердца, поскольку до сих пор не доказано, что адреналин повышает шансы человека выжить и избежать серьезных последствий со стороны ЦНС.13)
Физиология
Мозговое вещество надпочечников вносит лишь незначительный «вклад» в общий уровень катехоламинов в крови, зато именно эта зона отвечает за синтез более чем 90% циркулирующего эпинефрина. Незначительное количество эпинефрина содержится и в других тканях организма, главным образом, в хромаффинных клетках. После резекции надпочечников уровень эпинефрина в крови резко падает практически до нулевой отметки. Надпочечники отвечают за выработку около 7% циркулирующего норэпинефрина, большая часть которого является побочным продуктом нейротрансмиссии и малоактивна на гормональном уровне. Эпинефрин оказывает стимулирующее воздействие на адренергические рецепторы α1, α2, β1, β2 и β3 симпатической нервной системы. Адренергическими рецепторами считаются рецепторы симпатических нервов (название связано с особой «чувствительностью» этих рецепторов к адреналину).14) Определение «адренергический» зачастую интерпретируют неправильно, считая, что основным нейромедиатором симпатической нервной системы является норэпинефрин (норадреналин), а не эпинефрин (Ульф фон Юлер; 1946). Безусловно, эпинефрин (воздействуя на β2 адренергический рецептор) ускоряет метаболизм и улучшает работу верхних дыхательных путей, но при этом симпатические ганглии не связаны напрямую (нейронами) с верхними дыхательными путями. 15) Само понятие мозгового вещества надпочечников и симпатической нервной системы (сформулированное Кэнноном) имеет прямое отношение к катехоламиновой реакции организма на стресс. Однако мозговое вещество надпочечников, в отличие от коры надпочечников, не влияет на то, выживет человек при остановке сердца или нет. После удаления надпочечников гемодинамическая и метаболическая реакции организма (на различные стимулы, такие, как гипогликемия и физические нагрузки) не меняются. 16) Эпинефрин является важным нейромедиатором ЦНС. В периферической нервной системе эпинефрин оказывает стимулирующее действие на пре-синоптический β-рецептор норадреналина, хотя степень важности данного свойства не установлена. Прием бета-блокаторов (у людей) и резекция надпочечников (у животных) свидетельствуют о том, что эндогенный эпинефрин значительно ускоряет обменные процессы в организме.
Физические упражнения
 Основным стимулом для выделения надпочечниками эпинефрина являются физические упражнения. Впервые это было продемонстрировано на примере денервированного зрачка кошки, а позднее в ходе изучения образцов мочи. С 1950 года в научных изданиях регулярно публикуются биохимические методы определения уровня катехоламинов в плазме. И, хотя в основу большинства таких публикаций легли данные флуоресцентного анализа, данный метод является слишком обобщенным и позволяет с точностью определить лишь малую долю растворенного в плазме эпинефрина. С открытием экстракционных методов и радиоизотопного анализа (РЭА) появилась возможность определять уровень эпинефрина в крови с точностью до 1пг. Результаты первых РЭА-анализов показали, что уровень эпинефрина и катехоламинов в крови повышается к концу тренировки, когда запускается анаэробный обмен веществ.17)
При физических нагрузках, концентрация эпинефрина в крови повышается как из-за повышенной секреции надпочечников (которыми и выделяется эпинефрин), так и вследствие замедления обмена веществ на фоне замедления печеночного кровотока. Внутривенное вливание эпинефрина людям в состоянии покоя (в целях повышения его уровня до такого, как при физических нагрузках) почти не влияет на гемодинамику, за исключением незначительного понижения диастолического артериального давления (за счет β2 рецептора). Внутривенные инъекции эпинефрина (в пределах физиологической концентрации) снижают повышенную реактивность верхних дыхательных путей, в достаточной степени для того, чтобы ингибировать сосудосуживающее действие ингаляционного гистамина.
В 1887 году впервые была установлена взаимосвязь между симпатической нервной системой и легкими; данное открытие считается заслугой Гроссмана, который в одном из своих исследований доказал, что при раздражении ускоряющих нервов сердца верхние дыхательные пути, которые до этого сузились под действием мускарина, начинают расширяться.18) В ходе простых экспериментов с собаками, у которых в области диафрагмы была разомкнута симпатическая цепочка, Джексон показал, что в данной реакции, при отсутствии прямой стимуляции легких со стороны симпатической нервной системы, выделившийся (мозговым веществом надпочечников) эпинефрин остановил процесс бронхостеноза (сужения просвета бронхов), повернув его в обратное русло. Это миф, что после резекции надпочечников люди становятся астматиками; тем, у кого есть предрасположенность к данному заболеванию, не лишним будет пройти кортикостероидную заместительную терапию, которая «защитит» их от повышенной реактивности верхних дыхательных путей. При регулярных интенсивных физических нагрузках верхние дыхательные пути постепенно расширяются за счет снижения тонуса блуждающего нерва. Бета-блокаторы, содержащие пропранолол, повышают сопротивление верхних дыхательных путей (если принимать их после тренировки; при этом временные рамки те же, что и при появлении бронхиальных спазмов на фоне астмы, индуцированной физическими нагрузками). Таким образом, за счет снижения сопротивления верхних дыхательных путей во время тренировки, человек делает меньшее количество вдохов и выдохов (то есть, ему становится легче дышать).19)
Основным стимулом для выделения надпочечниками эпинефрина являются физические упражнения. Впервые это было продемонстрировано на примере денервированного зрачка кошки, а позднее в ходе изучения образцов мочи. С 1950 года в научных изданиях регулярно публикуются биохимические методы определения уровня катехоламинов в плазме. И, хотя в основу большинства таких публикаций легли данные флуоресцентного анализа, данный метод является слишком обобщенным и позволяет с точностью определить лишь малую долю растворенного в плазме эпинефрина. С открытием экстракционных методов и радиоизотопного анализа (РЭА) появилась возможность определять уровень эпинефрина в крови с точностью до 1пг. Результаты первых РЭА-анализов показали, что уровень эпинефрина и катехоламинов в крови повышается к концу тренировки, когда запускается анаэробный обмен веществ.17)
При физических нагрузках, концентрация эпинефрина в крови повышается как из-за повышенной секреции надпочечников (которыми и выделяется эпинефрин), так и вследствие замедления обмена веществ на фоне замедления печеночного кровотока. Внутривенное вливание эпинефрина людям в состоянии покоя (в целях повышения его уровня до такого, как при физических нагрузках) почти не влияет на гемодинамику, за исключением незначительного понижения диастолического артериального давления (за счет β2 рецептора). Внутривенные инъекции эпинефрина (в пределах физиологической концентрации) снижают повышенную реактивность верхних дыхательных путей, в достаточной степени для того, чтобы ингибировать сосудосуживающее действие ингаляционного гистамина.
В 1887 году впервые была установлена взаимосвязь между симпатической нервной системой и легкими; данное открытие считается заслугой Гроссмана, который в одном из своих исследований доказал, что при раздражении ускоряющих нервов сердца верхние дыхательные пути, которые до этого сузились под действием мускарина, начинают расширяться.18) В ходе простых экспериментов с собаками, у которых в области диафрагмы была разомкнута симпатическая цепочка, Джексон показал, что в данной реакции, при отсутствии прямой стимуляции легких со стороны симпатической нервной системы, выделившийся (мозговым веществом надпочечников) эпинефрин остановил процесс бронхостеноза (сужения просвета бронхов), повернув его в обратное русло. Это миф, что после резекции надпочечников люди становятся астматиками; тем, у кого есть предрасположенность к данному заболеванию, не лишним будет пройти кортикостероидную заместительную терапию, которая «защитит» их от повышенной реактивности верхних дыхательных путей. При регулярных интенсивных физических нагрузках верхние дыхательные пути постепенно расширяются за счет снижения тонуса блуждающего нерва. Бета-блокаторы, содержащие пропранолол, повышают сопротивление верхних дыхательных путей (если принимать их после тренировки; при этом временные рамки те же, что и при появлении бронхиальных спазмов на фоне астмы, индуцированной физическими нагрузками). Таким образом, за счет снижения сопротивления верхних дыхательных путей во время тренировки, человек делает меньшее количество вдохов и выдохов (то есть, ему становится легче дышать).19)
Эмоциональная реакция
В каждой эмоциональной реакции присутствует поведенческая, автономная и гормональная составляющие. Последняя подразумевает выделение эпинефрина, своего рода ответную реакцию мозгового вещества надпочечников на стресс, медиатором которой является симпатическая нервная система. Основная эмоция, которая ассоциируется с эпинефрином, это страх. В ходе эксперимента с участием добровольцев, которым сделали инъекции эпинефрина, выражение лица этих людей чаще было испуганным, чем спокойным (они смотрели фильмы ужасов), чего не скажешь о контрольной группе участников, которые во время просмотра сохраняли спокойствие. Те, кому ввели эпинефрин, боялись в кинотеатре гораздо больше и у них чаще проявлялись плохие воспоминания, чем у представителей контрольной группы. Результаты данного эксперимента являются наглядным примером тому, что негативные эмоции в той или иной степени связаны с повышенной концентрацией эпинефрина в крови. Поводом для этих открытий отчасти стала способность эпинефрина вызывать ответные реакции симпатической нервной системы на уровне физиологии, включая учащенное сердцебиение и дрожь в коленях (типичные признаки страха, возникающие независимо от фактической интенсивности страха, вызванного просмотром фильма). Несмотря на то, что в ходе проведенных исследований между эпинефрином и чувством страха была выявлена определенная взаимосвязь, на другие эмоции эта закономерность не распространяется. В ходе все того же эксперимента, участникам также давали смотреть комедии и боевики, отчего они не стали веселее или агрессивнее. Результаты данного эксперимента подтвердились в ходе опытов с грызунами, некоторые из которых были способны синтезировать эпинефрин, а другие - нет. Результаты опытов подтвердили тот факт, что эпинефрин действительно играет определенную роль в расшифровке эмоциональных реакций, раздражая нервную систему в ответ на страх. 20)
Память
Ученые доказали, что адренергические гормоны, такие как эпинефрин, могут способствовать ухудшению долговременной памяти у людей. Как известно, эндогенный адреналин выделяется надпочечниками в ответ на стресс, модулируя при этом консолидацию памяти (откладывание событий в долговременную память). Кроме того, активность ЦНС (в плане раскодирования информации) так или иначе зависит от концентрации эпинефрина в крови. По некоторым данным, эпинефрин играет определенную роль в долговременной адаптации организма к стрессу и, в частности, в кодировании эмоциональной памяти. Под действием эпинефрина повышается активность ЦНС и активизируется так называемая «память страха» (зачастую на фоне паталогических нарушений, таких, как пост-травматическое стрессовое расстройство). Результаты большинства исследований поддерживают идею о том, что «эндогенный эпинефрин, выделяемый надпочечниками на фоне умственной деятельности, притупляет долговременную память». Более того, ученые пришли к выводу, что опознавательная память (на лица, номера телефонов и т.д.) также формируется под действием эпинефрина, раздражающего B-адренергические рецепторы.21) Эпинефрин далеко не сразу преодолевает гематоэнцефалический барьер, и поэтому его влияние на память частично связано с периферийными B-адренергическими рецепторами. Результаты проведенных исследований показали, что соталол (антагонист B-адренергических рецепторов, который, подобно эпинефрину, не сразу проникает в головной мозг) нейтрализует стимулирующее действие адреналина на память. На основании этих открытий ученые пришли к выводу, что B-адренергические рецепторы и отвечают за способность эпинефрина консолидировать память. Норадреналин, находящийся под воздействием PNMT-клеток в цитозоле, необходимо предварительно очистить от гранул хромаффинных клеток. Это происходит внутри так называемого катехоламинового (H+) «обменника» ВМАП 1. ВМАП-1 также отвечает за перенос нового адреналина из цитозоли назад в гранулы хромаффинных клеток, откуда он впоследствии высвобождается. В клетках печени адреналин прикрепляется к β-адренергическому рецептору, который меняет его структуру и помогает глютамин-синтазе (G-белку) «обменять» ГДФ на ГТФ. Этот тримерный G – белок распадается на ГС-альфа и ГС-бета производные, первая из которых прикрепляется к аденил-циклазе, тем самым превращая ATФ в АМФ (циклический нуклеотид). В свою очередь, циклический AMФ прикрепляется к регуляторной подгруппе протеин- киназы А: протеин-киназа A фосфорилирует киназу фосфорилазы. Между тем, ГС бета/гамма встраивается в кальциевый канал, тем самым позволяя ионам кальция проникнуть в клеточную цитоплазму. Ионы кальция прикрепляются к белкам кальмодулина (содержащимся в эукариотических клетках), которые впоследствии объединяются с киназой фосфорилазы, тем самым активируя ее. Данная киназа фосфорилирует гликоген-фосфорилазу, которая, в свою очередь, фосфорилирует сам гликоген, превращаясь при этом в глюкоза-6-фосфат.
Патология
Повышенная секреция эпинефрина наблюдается при таких патологиях, как феохромоцитома, гипогликемия, инфаркт миокарда и (в меньшей степени) при доброкачественном наследственном эссенциальном треморе. В этих случаях у человека, как правило, начинает активнее функционировать симпатическая нервная система, при этом надпочечники выделяют большее количество адреналина; в случае гипоксии и гипогликемии можно говорить о селективности, поскольку у человека в крови существенно увеличивается концентрация адреналина (по отношению к норадреналину). Таким образом, мозговое вещество надпочечников обладает определенной степенью автономности по отношению к другим областям симпатической нервной системы (то есть обособлено от них). Инфаркт миокарда характеризуется высоким уровнем эпинефрина и норэпинефрина в крови (особенно в момент кардиогенного шока).22) На фоне доброкачественного наследственного тремора (ДНТ) раздражаются блокаторы периферических β- и бета-2 адренергических рецепторов, отчего у человека начинают трястись руки (зачастую все тело). Ученые обнаружили, что у больных с диагнозом «ДНТ» в плазме повышен уровень эпинефрина (чего не скажешь о норэпинефрине). Низкие (или нулевые) концентрации эпинефрина характерны для вегетативной нейропатии или следующей за ней резекции надпочечников. При нарушении функции коры надпочечников (болезнь Аддисона и т.д.) синтез эпинефрина прекращается, поскольку синтезирующий фермент (фенил-этанол-амин-N-метил-трансфераза) активен лишь при высоких концентрациях кортизола, поступающего из коры надпочечников в мозговое вещество.23)
Терминология
«Эпинефрин» - это название, данное гормону американцами, которое по совместительству является Международным Непатентованным Наименование, однако в быту часто используют более общее название – «адреналин». Сам термин «эпинефрин» (от греч. «над почками») придумал Джон Абель, который использовал его для обозначения приготовленных им экстрактов из надпочечников (1897). В 1901 году Йокиши Такамин запатентовал очищенный экстракт из надпочечников, дав ему название «адреналин» (от лат. «над почками»); адреналин поступил в продажу под маркой «Парке, Дэвис & Ко» в США. Будучи твердо убежденными в том, что экстракт Абеля ни в чем не отличается от экстракта Такамина (данное убеждение вызвало массу диспутов), американские ученые сделали «эпинефрин» родовым названием данного гормона. В Великобритании и на страницах европейских фармакопей общепринятым названием является «адреналин» (в этом и состоит одно из основных различий между МНН и БОН - системами).24) Американские доктора и ученые чаще используют термин «эпинефрин», нежели «адреналин». И, тем не менее, лекарственные препараты-аналоги эпинефрина зачастую называют «адренергиками», а рецепторы эпинефрина – «адренергическими» или «адрено-рецепторами». Воздействие адреналина на организм:
- Сердце: учащает сердцебиение
- Легкие: увеличивает скорость потока воздуха при дыхании; систематическое сосудосуживающее и сосудорасширяющее действие
- Печень: стимулирует гликогенолиз (распад гликогена)
- Организм в целом: вызывает липолиз (расщепление жиров); усиливает сократительную способность мышц
Будучи гормоном-нейромедиатором, эпинефрин воздействует практически на все ткани и органы. Специфика и интенсивность воздействия различается в зависимости от вида ткани и наличия в ней адренергических рецепторов. К примеру, в высоких концентрациях (физиологических), эпинефрин способствует расслаблению гладкой мускулатуры верхних дыхательных путей, но зато вызывает сокращения гладкой мускулатуры большинства мелких артерий. Эпинефрин прикрепляется к различным адренергическим рецепторам (основной механизм действия). Эпинефрин – это неселективный агонист всех адренергических рецепторов, включая основные подгруппы α1, α2, β1, β2 и β3. После прикрепления к рецепторам, адреналин вызывает ряд метаболических изменений. При примыкании к α-адренергическим рецепторам, он ингибирует выработку инсулина (поджелудочной железой), вызывает гликогенолиз (в печени и мышцах),[90] гликолиз, а также мешает мышечному инсулин-регулируемому гликогенезу. Прикрепляясь к β-адренергическому рецептору, эпинефрин стимулирует выработку глюкагона (поджелудочной железой), адренокортикотропного гормона (АКТГ) (гипофизом) и ускоряет расщепление жировой ткани. В совокупности, вышеописанные эффекты приводят к повышению уровня глюкозы в крови и стимулируют синтез жирных кислот (глюкоза и жирные кислоты насыщают клетки организма энергией). 25)
Биологические жидкости
В целях более точной диагностики различных заболеваний, современные врачи измеряют уровень эпинефрина в крови, плазме или сыворотке. У взрослых в состоянии покоя, концентрация эндогенного эпинефрина в плазме, как правило, ниже 10 мкг/л, однако при физических нагрузках данный показатель имеет тенденцию увеличиваться в 10 раз, а в периоды стресса и того более – в 50 раз. У больных с диагнозом «феохромоцитома» уровень адреналина в плазме достигает 1000–10 000 мкг/л. При парентеральном введении эпинефрина «сердечникам» в качестве интенсивной терапии или неотложной помощи, плазменные концентрации повышаются аж до 10 000 -100 000 мкг/л.26)
Биосинтез и регуляция
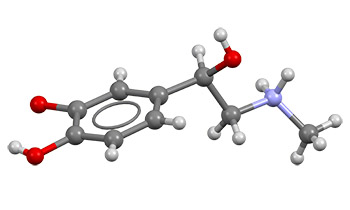 Эпинефрин синтезируется мозговым веществом надпочечников при участии ферментов, превращающих тирозин (аминокислоту) в некоторые ее производные, которые в конечном счете принимают форму эпинефрина. Сначала тирозин окисляется до состояния L-ДОФА , который впоследствии декарбоксилирует, образуя допамин. Норэпинефрин является продуктом его окисления. Последним этапом в биосинтезе эпинефрина является метилирование исходного амина норадреналина. В роли катализатора данной реакции выступает фермент фенил-этанол-амин-N-метил-трансфераза (ФНМТ), который использует S-аденозил-метиомин (SAMe) в качестве поставщика (донора) метила. Несмотря на то, что большая часть ФНМТ сосредоточена в цитозоле эндокринных клеток мозгового вещества надпочечников (также известных как хромаффинные клетки), данный фермент также обнаружен в сердце и головном мозге (в низких концентрациях).27)
Эпинефрин синтезируется мозговым веществом надпочечников при участии ферментов, превращающих тирозин (аминокислоту) в некоторые ее производные, которые в конечном счете принимают форму эпинефрина. Сначала тирозин окисляется до состояния L-ДОФА , который впоследствии декарбоксилирует, образуя допамин. Норэпинефрин является продуктом его окисления. Последним этапом в биосинтезе эпинефрина является метилирование исходного амина норадреналина. В роли катализатора данной реакции выступает фермент фенил-этанол-амин-N-метил-трансфераза (ФНМТ), который использует S-аденозил-метиомин (SAMe) в качестве поставщика (донора) метила. Несмотря на то, что большая часть ФНМТ сосредоточена в цитозоле эндокринных клеток мозгового вещества надпочечников (также известных как хромаффинные клетки), данный фермент также обнаружен в сердце и головном мозге (в низких концентрациях).27)
Регуляция
Основным психологическим стимулом для выделения адреналина является стресс (будь то угроза физическому здоровью, возбуждение, шум, яркий свет и высокие температуры). Все эти стимулы предварительно обрабатываются центральной нервной системой. 28) Адренокортикотропный гормон (АКТГ) и симпатическая нервная система стимулируют выработку веществ-предшественников адреналина, за счет повышения активности тирозин-гидроксилазы и допамин-β-гидроксилазы, двух основных ферментов, которые отвечают за синтез катехоламинов. АКТГ также оказывает стимулирующее действие на кору надпочечников, что необходимо для высвобождения кортизола, за счет которого увеличивается количество ФНМТ в хромаффинных клетках и, как следствие, усиливается выработка адреналина (чаще всего в ответ на стресс). Симпатическая нервная система, взаимодействуя посредством внутренних нервов с мозговым веществом надпочечников, стимулирует выработку адреналина. Ацетилхолин, который выделяется за счет преганглионарных симпатических волокон этих нервов, воздействует на никотиновые ацетилхолиновые рецепторы, что приводит деполяризации (уменьшению мембранного потенциала) клеток и активному притоку кальция по потенциал-зависимым кальциевым каналам. Кальций вызывает экзоцитоз гранул хромаффинных клеток и, как следствие, высвобождение адреналина (и норадреналина) из надпочечников, откуда они поступают в кровоток. В отличие от многих других гормонов, адреналин (как и прочие катехоламины) не обладает отрицательным эффектом «обратной связи» (то есть не мешает своему же синтезу).29) Концентрация адреналина в крови сильно повышается при некоторых обстоятельствах, в частности, вследствие неконтролируемого приема эпинефрина (без назначения врача), при феохромокарцитоме и прочих злокачественных образованиях в симпатических ганглиях. Адреналин временно перестает действовать при повторном попадании в нервные окончания (в виде слабых растворов), подвергаясь метаболизму со стороны моноамин-оксидазы и катехол-O-метил-трансферазы.
История
Экстракты надпочечников были впервые получены польским физиологом Наполеоном Цибульски в 1895 году. В составе эти вытяжек, которые он называл «nadnerczyna», присутствовал адреналин и прочие катехоламины. Американский офтальмолог Уильям Г. Бейтс первым стал использовать адреналин во время операций на глазах (до 20 апреля 1896 года). Японский химик Йокиши Такамин вместе со своим ассистентом Кейзо Уенакой сами открыли адреналин в 1900 году. В 1901 году Такамин провел успешный эксперимент, выделив чистый гормон из надпочечников овец и быков. Адреналин впервые искусственно синтезировали в своих лабораториях Фридрих Штольц и Генри Дрисдейл Дэйкин (независимо друг от друга в 1904 году).30)
Химия
Систематическое (ИЮПАК ) название: (R)-4-(1-гидрокси-2-(метил-амино)этил) бензен-1,2-диол
Категория тератогенности:
- США: C (риск не исключен)
Легальность:
- Австралия: отпускается только по рецепту (S4)
- Великобритания: отпускается только по рецепту (POM)
- США: отпускается без рецепта
Развитие зависимости: не вызывает привыкания
Пути введения препарата: внутривенно, внутримышечно, эндотрахеально, в конъюктивальный мешок, в носовую полость, в глаза (в виде капель)
Метаболизм: в адренергическом синапсе (MAO и КOMT )
Период полураспада: 2 минуты
Экскреция вместе с мочой
Химическая формула C9H13NO3
:Tags
Читать еще: Rubus suavissimus (Китайский сладкий чайный лист) , Амигдалин (Лаэтрил) , Диазепам (Валиум) , Долголетие , Орегано ,










