Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Диметилтриптамин
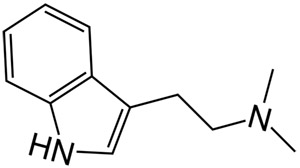 N,N-диметилтриптамин (DMT или N,N-DMT) – это психоделик из класса триптаминов. Он является структурным аналогом серотонина и мелатонина и функциональным аналогом других психоделических триптаминов, таких кк 4-AcO-DMT, 5-MeO-DMT, 5-OH-DMT, псилоцибин (4-PO-DMT) и псилоцин (4-OH-DMT).
Индейцы Амазонии используют ДМТ в ходе церемоний во время питья айяуаски в религиозных и медицинских целях.1)
N,N-диметилтриптамин (DMT или N,N-DMT) – это психоделик из класса триптаминов. Он является структурным аналогом серотонина и мелатонина и функциональным аналогом других психоделических триптаминов, таких кк 4-AcO-DMT, 5-MeO-DMT, 5-OH-DMT, псилоцибин (4-PO-DMT) и псилоцин (4-OH-DMT).
Индейцы Амазонии используют ДМТ в ходе церемоний во время питья айяуаски в религиозных и медицинских целях.1)
Систематическое (ИЮПАК) наименование 2-(1H-Indol-3-yl)-N,N-dimethylethanamine
Легальный статус
- Австралия: запрещён (S9)
- Канада: Список III
- Великобритания: контролируемое вещество
- США: список I
Способы применения Перорально (с ИМАО), инсуффляция, ректально, выпаривание, внутримышечно, внутривенно
Формула C12H16N2
Молекулярная масса 188,269 г/моль
История
DMT был впервые синтезирован в 1931 году канадским химиком Ричардом Хельмутом Фридрихом Манске (1901–1977).2) В общем, открытие DMT в качестве естественного вещества приписывается бразильскому химику и микробиологу Освальдо Гонсальвесу де Лима (1908–1989), который в 1946 году изолировал алкалоид, который он назвал nigerina (нигерин) из коры корня растения jurema preta (Mimosa tenuiflora).3) В методичном обзоре по этой теме, Джонатан Отт, однако, показывает, что эмпирическая формула нигерина, указанная Гонсальвесом де Лима, содержащая атом кислорода, может подходить только к частичной, «нечистой» или «загрязненной» форме DMT.4) Лишь в 1959 году Гонсальвес де Лима продемонстрировал американским химикам образец корней Mimosa tenuiflora, после чего стало без сомнения понятно, что в них содержится DMT. Менее противоречивым является вопрос об изоляции и формальной идентификации DMT в 1955 году в семенах и стручках Anadenanthera peregrina командой американских химиков под руководством Эвана Хорнинга (1916–1993). С 1955 года, DMT был обнаружен во многих организмах: по меньшей мере в пятидесяти видах растений, принадлежащих к десяти семействам, включая роговые кораллы, и в трех видах млекопитающих. Ещё одной исторической вехой является открытие DMT в растениях, часто используемых среди аборигенов Амазонии в качестве дополнения к лозе Banisteriopsis caapi для изготовления напитка айяуаска. В 1957 году американские химики Францис Хоштейн и Анита Парадайс идентифицировали DMT в «водном экстракте» листьев растения, которое они назвали Prestonia amazonicum (sic), «обычно смешиваемого» с B. caapi.5) Отсутствие точной ботанической идентификации Prestonia amazonica в этом исследовании вызвало серьезные сомнения в идентичности растения у американского этноботаника Ричарда Эванса Шультса (1915–2001) и других ученых. В 1965 году французский фармаколог Жак Пуассон смог предоставить более качественные данные. Он изолировал DMT в качестве единственного алкалоида из листьев, предоставленных и используемых индейцами Агваруна, идентифицированных в качестве лозы Diplopterys cabrerana (в те времена известной под названием Banisteriopsis rusbyana). DMT был впервые идентифицирован в растении Psychotria viridis, другом распространённом дополнительном веществе, содержащемся в айяуаске, командой американских исследователей под руководством фармаколога Ара дер Мардеросян (опубликовано в 1970 году).6) Они не только обнаружили DMT в листьях P. viridis, полученных от индейцев Кашинава, но также впервые идентифицировали его в образце айяуаски, подготовленном теми же индейцами.
Биосинтез
Диметилтриптамин является индольным алкалоидом, извлеченным из шикиматного пути биосинтеза. Его биосинтез относительно прост. В растениях, исходная аминокислота L-триптофан производится эндогенно, в то время как у животных L-триптофан является незаменимой аминокислотой, получаемой из пищи. Независимо от источника L-триптофана, биосинтез начинается с его декарбоксилирования ферментом декарбоксилазы ароматических аминокислот (AADC). Получаемый в результате декарбоксилированный аналог триптофана является триптамином. Триптамин проходит через трансметилирование: фермент индолэтиламин-N-метилтрансферазы (INMT) катализирует трансфер метиловой группы от кофактора S-аденощил-метионина (SAM), через нуклеофильную атаку, к триптамину. Эта реакция трансформирует SAM в S-аденозилгомоцистеин (SAH), и дает промежуточный продукт в виде N-метилтриптамина (NMT). NMT, в свою очередь, трансметилируется в хоте того же процесса, формируя конечный продукт N,N-диметилтриптамин. Трансметилирование триптамина регулируется двумя продуктами реакции: ex vivo было показано, что SAH и DMT являются двумя наиболее мощными ингибиторами активности INMT у кроликов. Механизм трансметилирования был повторно доказан путем радиоактивного мечения SAM метиловой группы углеродом-14 (14C-CH3)SAM).7)
У млекопитающих
В 1961 году Джулиус Аксельрот опубликовал в журнале Science свою работу, в которой описал фермент N-метилтрансферазы, способный опосредовать биотрансформацию DMT в лёгких кролика.8) Это открытие послужило началом растущего и поныне интереса к эндогенному производству DMT у человека и других млекопитающих. С тех самых пор, было получено две дополнительных линии доказательств: локализация и дальнейшее описание фермента N-метилтрансферазы и аналитические исследования эндогенно производимого DMT в жидкостях и тканях организма. В 2013 году исследователи впервые сообщили об обнаружении DMT в эпифизе грызунов.9) Исследование, опубликованное в 2014 году, помогло установить пути биосинтеза N,N-диметилтриптамина (DMT) в клетках меланомы человека SK-Mel-147, а также особенности его метаболизма при помощи пероксидаз. В работе 2014 года был впервые продемонстрирован иммуномодулирующий потенциал DMT и 5-MeO-DMT через сигма-1 рецептор в человеческих иммунных клетках. Эта иммуномодулирующая активность может лежать в основе мощного противовоспалительного действия DMT и его воздействия на регенерацию клеток.10)
INMT
До использования техник молекулярной биологии для локализации индолэтиламин N-метилтрансферазы (INMT), характеристика и локализация молекулы шли рука об руку: образцы биологического материала, в котором, гипотетически, INMT был активным, являются объектом ферментного анализа. Эти ферментные анализы выполняются либо при помощи радиомеченого метильного донора типа (14C-CH3)SAM, к которому добавляются известные количества немеченых субстратов типа триптамина или радиомеченый субстрат типа (14C)NMT для демонстрации формирования in vivo. Поскольку качественное определение радиоактивно меченого продукта ферментной реакции является достаточным для того, чтобы было возможно характеризовать существование и активность INMT (или отсутствие таковых), аналитические методы, применяемые в анализах INMT, не должны быть такими чувствительными, как методы, необходимые для непосредственного обнаружения и количественной оценки минимальных количеств эндогенно формируемого DMT. В подавляющем большинстве исследований применялся преимущественно качественный метод тонкослойной хроматографии. Кроме того, данные показывают, что INMT может катализировать трансметилирование триптамина в NMT и DMT может быть получен при помощи метода обратного изотопного разбавления в сочетании с масс-спектроскопией, что было продемонстрировано на лёгких кролика11) и человека 12) в начале 1970х. «Ахиллесовой пятой» некоторых методов TLC стала селективность, а не чувствительность, после открытия в 1974–1975 годах того, что анкубация кровяных клеток или ткани мозга крыс с (14C-CH3)SAM и NMT в качестве субстрата в основном приводит к образованию производных тетрагидро-β-карболина,13) а также незначительных количеств DMT в тканях мозга. Пришло одновременное понимание того, что TLC методы, применяемые до нашего времени почти во всех опубликованных исследованиях по биосинтезу INMT и DMT, не могут осуществить отделения DMT от этих тетрагидро-β-карболинов. Это нарушило всю предыдущую систему данных по активности INMT и биосинтезу DMT в мозгу пернатых и человека,14) в том числе in vivo, поскольку все они опираются на использование проблематичных методов TLC: их ценность оспаривается в повторных исследованиях с использованием улучшенных методов TLC. Кроме того, не наблюдается активности INMT, производящей DMT, в тканях мозга крысы и человека.15) Последнее исследование, опубликованное в 1978 году, в котором были сделаны попытки засвидетельствовать in vivo активность INMT и производство DMT в мозгу (крыс) с применением методов TLC показало, что биотрансформация радиомеченого триптамина в DMT является реальной, но «незначительной». Позднее была поставлена под вопрос способность метода, используемого в последнем исследовании, извлечь DMT из тетрагидро-β-карболинов. Для локализации INMT, качественный рывок достигается благодаря использованию современных техник молекулярной биологии и иммуногистохомии. У человека, ген, кодирующий INMT, располагается на седьмой хромосоме. Нозерн-блот анализ показывает, что матричная РНК INMT активно экспрессируется в лёгких кролика, а также в щитовидной железе и надпочечниках.16) Средняя экспрессия наблюдается также в сердце человека, скелетных мышцах, трахее, желудке, малом кишечнике, поджелудочной железе, семенниках, простате, плаценте, лимфатической железе и спинном мозге. Низкая или очень низкая экспрессия наблюдается в мозгу кролика, а также в зобной железе, печени, слезёнке, почках, толстой кишке, яичнике и костном мозге. Экспрессия мРНК INMT не наблюдается в лейкоцитах периферической крови у человека, в мозгу и в ткани семи специфических регионов мозга (таламус, субталамическое ядро, хвостатое ядро, гиппокамп, миндалина, чёрная субстанция и мозолистое тело). Иммуногистохимия показывает, что INMT присутствует в больших количествах в бокаловидных клетках малого и большого кишечников. В 2011 году, иммуногистохимия показала присутствие INMT в нервной ткани приматов, в том числе во внутренней оболочке глаза, двигательных нейронах спинного мозга и щитовидной железе.17)
Эндогенный DMT
 В июне 1965 года было впервые опубликовано сообщение об обнаружении эндогенного DMT у млекопитающих: немецкие исследователи Ф. Франзен и Х. Гросс сообщили об обнаружении и количественном измерении DMT, наряду с его структурным аналогом буфотенином (5-OH-DMT), в крови и моче человека.18) В статье, опубликованной четыре месяца спустя, метод, используемый в этом исследовании, был подвергнут серьёзной критике, как и достоверность полученных результатов.19)
Некоторые аналитические методы, используемые до 2001 года для измерения уровней эндогенно формируемого DMT, были достаточно селективны и чувствительны для производства достоверных результатов. Газовая хроматография, желательно в сочетании с масс-пректрометрией (ГХ-МС), считается необходимым минимумом для анализа. В исследовании, опубликованном в 2005 году, применяется наиболее чувствительный и селективный метод среди когда-либо используемых для измерения эндогенного DMT:20) жидкостная хроматография-тандемная масс-спектрометрия с ионизацией в электроспрее (LC-ESI-MS/MS), позволяющая достигать предела обнаружения от 12 до 200 раз меньше, чем при использовании лучших методов, применяемых в 1970х.
В июне 1965 года было впервые опубликовано сообщение об обнаружении эндогенного DMT у млекопитающих: немецкие исследователи Ф. Франзен и Х. Гросс сообщили об обнаружении и количественном измерении DMT, наряду с его структурным аналогом буфотенином (5-OH-DMT), в крови и моче человека.18) В статье, опубликованной четыре месяца спустя, метод, используемый в этом исследовании, был подвергнут серьёзной критике, как и достоверность полученных результатов.19)
Некоторые аналитические методы, используемые до 2001 года для измерения уровней эндогенно формируемого DMT, были достаточно селективны и чувствительны для производства достоверных результатов. Газовая хроматография, желательно в сочетании с масс-пректрометрией (ГХ-МС), считается необходимым минимумом для анализа. В исследовании, опубликованном в 2005 году, применяется наиболее чувствительный и селективный метод среди когда-либо используемых для измерения эндогенного DMT:20) жидкостная хроматография-тандемная масс-спектрометрия с ионизацией в электроспрее (LC-ESI-MS/MS), позволяющая достигать предела обнаружения от 12 до 200 раз меньше, чем при использовании лучших методов, применяемых в 1970х.
Физические и химические характеристики
DMT обычно хранится в форме фумарата, поскольку другие кислые соли DMT являются чрезмерно гигроскопическими и не быстро кристаллизуются. Рекреационные пользователи предпочитают DMT в форме свободного основания, поскольку так его проще выпаривать, т.к. он имеет более низкую точку кипения, несмотря на то, что в таком виде он менее стабилен, чем фумарат.21) В отличие от основания DMT, его соли являются водорастворимыми. В растворе, DMT относительно быстро разлагается, поэтому его следует хранить в изоляции от воздуха, света и тепла в холодильнике.
Отличия от 5-MeO-DMT
5-MeO-DMT, психоделический наркотик, имеющий структурные сходства с N,N-DMT, иногда называют DMT (из-за аббревиатуры). Внешне вещество также очень похоже на DMT, будучи белым, кристаллическим и твёрдым. Однако, 5-MeO-DMT является значительно более сильным веществом (стандартная доза для выпаривания 5–20 мг), поэтому для предотвращения случайной передозировки следует соблюдать осторожность.22)
Фармакология
Фармакокинетика
Пиковые концентрации уровней DMT (Cmax) в цельной крови после внутримышечной инъекции (0.7 мг/кг, n = 11) и в плазме после внутривенного применения (0.4 мг/кг, n = 10)23) полноценных психоделических доз в диапазоне ≈14-154 мкг/л и 32-204 мкг/л, соответственно. Соответствующие молярные концентрации DMT, таким образом, лежат в диапазоне 0.074–0.818 мкм в цельной крови и 0.170–1.08 мкм в плазме. Однако, некоторые исследования описывают активный транспорт и накопление DMT в мозгу собаки и крысы после периферического применения.24) Возможно, что в мозгу человека будет наблюдаться подобный активный транспорт и накопительные процессы, и что концентрация DMT в мозгу человека будет в несколько раз выше, чем в крови, в результате чего местная концентрация будет измеряться в микромолях. Подобные концентрации будут соразмерны концентрациям серотонина в мозговой ткани, которые впоследствии были определены в диапазоне 1.5-4 мкм.25) Среднее время достижения пиковой концентрации (Tmax), тесно связанное с пиковыми психоделическими эффектами, составило 10–15 минут в цельной крови после внутримышечной инъекции и 2 минуты в плазме после внутривенного применения.26) При пероральном приёме в смеси с айяуаской, а также при использовании лиофилизированных желатиновых капсул айяуаски, Tmax DMT значительно задерживается, составляя 107.59 ± 32.5 минуты, и 90–120 минут,27) соответственно. Фармакокинетика DMT при выпаривании не была изучена.
Фармакодинамика
DMT неселективно связывается с аффинностью < 0.6 мкм со следующими серотониновыми рецепторами: 5-HT1A, 5-HT1B, 5-HT1D, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT6 и 5-HT7. Агонистическая активность была определена на 5-HT1A, 5-HT2A и 5-HT2C.28) Его внутренняя агонистическая активность на других серотониновых рецепторах ещё не была определена. Особый интерес представляет определение его активности на рецепторе 5-HT2B у человека, поскольку два исследования in vitro свидетельствуют о высокой аффинности DMT по отношению к этому рецептору: 0.108 мкм29) и 0.184 мкм.30) Это может быть важным, поскольку постоянные или частые пользователи серотонергических препаратов, демонстрирующие предпочтительно высокую активность и чистый агонизм на 5-HT2B рецепторе, имеют повышенный риск порока сердца.31) Также была продемонстрирована аффинностьDMT по отношению к дофаминовым D1, α1-адренергическим, α2-адренергическим, имидазолиновым-1 и сигма-1 (σ1) рецепторам.32) Сходящиеся линии данных демонстрируют активацию σ1 рецептора при концентрациях 50–100 мкм. Неясна его активность на участках связывания с другим рецептором. Было показано, что DMT является субстратом in vitro для серотонинового транспортера, находящегося на клеточной поверхности (SERT) и внутриклеточного везикулярного моноаминного переносчика 2 (VMAT2), ингибируя SERT-опосредованный захват серотонина в тромбоцитах человека при средней концентрации 4.00 ± 0.70 мкм и VMAT2-опосредованный захват в пузырьках (в клетках Sf9 у гусеницы) при средних концентрациях 93 ± 6.8 мкм.33) Как и в случае с другими так называемыми «классическими галлюциногенами», большинство психоделических эффектов DMT может быть свзязано с функционально селективной активацией рецептора 5-HT2A.34) 50% максимального действия DMT (половина максимальной эффективной концентрации, EC50 или Kact) на рецепторе 5-HT2A у человека in vitro наблюдается при 0.118–0.983 мкм.35) Эти значения согласуются с диапазоном концентраций в крови и плазме после применения полной психоделической дозы. Поскольку DMT имеет незначительно большую активность связывания (EC50) на серотониновых 2C рецепторах у человека, чем на 2A рецепторе, скорее всего, в общие эффекты DMT вовлечен 5-HT2C.36) Другие рецепторы, такие как 5-HT1A, σ1, также могут играть определенную роль. В 2009 году было сделано предположение, что DMT может быть эндогенным лигандом для σ1 рецептора.37) Концентрация DMT, необходимая для активации σ1 in vitro (50–100 мкм) близка к поведенчески-активной концентрации в мозгу мышей, составляющей приблизительно 106 мкм. Это приблизительно на 4 порядка выше, чем средние концентрации в мозговой ткани крысы или человеческой плазме при базовых условиях, поэтому активация σ1 рецепторов возможна только при условии высоких местных концентраций DMT. Если DMT хранится в синаптических пузырьках, подобные концентрации могут наблюдаться в ходе высвобождения пузырьков. Чтобы проиллюстрировать это, представьте, что средняя концентрация серотонина в тканях мозга составляет 1.5-4 мкм,38) а концентрация серотонина в синаптических пузырьках – 270 мкм. После высвобождения пузырьков, наблюдаемые концентрации серотонина в синаптической щели, где располагаются серотониновые рецепторы, составляет около 300 мкм. Таким образом, несмотря на несомненную применимость таких данных, как in vitro аффинность, активность связывания и средние концентрации в тканях или плазме, они не могут помочь предсказать концентрации DMT в пузырьках или на синаптических или внутриклеточных рецепторах. При этих условиях, данные о селективности рецепторов являются чисто теоретическими, и кажется возможным, что большая часть рецепторов, идентифицированных в качестве целей для DMT, играют роль в его психоделических эффектах.
Психоделическая активность
DMT производится во многих видах растений, часто в сочетании с близкими к нему химическими веществами 5-MeO-DMT и буфотенин (5-OH-DMT).39) DMT-содержащие растения часто используются в шаманских практиках народов Южной Америки. DMT является одним из основных активных ингредиентов напитка айяуаска; однако, айяуаску иногда заваривают с растениями, не содержащими DMT. DMT является основным психоактивным алкалоидом в некоторых растениях, включая Mimosa tenuiflora, Diplopterys cabrerana и Psychotria viridis. DMT является второстепенным алкалоидом в табаке из смолы коры Виролы, основным активным алкалоидом которой является 5-MeO-DMT. DMT также является второстепенным алкалоидом коры, стручков и бобов Anadenanthera peregrina и Anadenanthera colubrina, применяемых для производства нюхательного табака Yopo и Vilca, активным алкалоидом которых является буфотенин.40) Псилоцин, активное химическое соединение, содержащееся во многих психоделических грибах, обладает структурным сходством с DMT. Психотропные эффекты DMT были впервые научно изучены венгерским химиком и психологом доктором Стефеном Сзара, который провёл исследование с участием добровольцев в середине 1950х. Сзара, работая позднее на Национальные Институты Здравоохранения США, обратил внимание на DMT после того, как его заказ на LSD из швейцарской компании Sandoz Laboratories был отклонен на основании того, что мощное психотропное воздействие вещества может быть опасным в руках коммунистической страны. DMT может обеспечить мощный психоделический опыт с яркими видениями, эйфорией и галлюцинациями.41) DMT в основном является перорально неактивным, если не используется в сочетании ингибитором моноаминоксидазы (ИМАО), таким, как обратимый ингибитор моноаминоксидазы А (ОИМАО), например, гармалин. Без ИМАО, организм быстро метаболизирует перорально принимаемый DMT, и, таким образом, он не имеет галлюциногенного действия, если доза не превышает метаболическую ёмкость моноаминоксидазы. Другие способы применения, такие как выпаривание, инъекции или инсуффляция, могут вызывать мощные галлюцинации на короткий промежуток времени (обычно менее часа), поскольку DMT достигает мозга до того момента, пока он метаболизируется естественной моноаминоксидазой в организме. Приём ИМАО до выпаривания или инъекции DMT продлевает и усиливает эффекты.
"Машинные эльфы"
Одной из общих характеристик галлюциногенного опыта при приёме DMT являются галлюцинации, связанные с видением трансцендентных гуманоидоподобных существ. Термин «машинный эльф» был придуман этноботаником Теренсом Маккейна для описания своего опыта. Маккейна также использовал такие термины, как «фрактальные эльфы» или «самотрансформирующиеся машинные эльфы».42) Сзара сообщил о своём опыте, связанном с галлюцинациями странных существ, в «Journal of Mental Science» (в настоящее время – «British Journal of Psychiatry») (1958 г.), в статье под названием “Dimethyltryptamine Experiments with Psychotics”. Стефен Сзара описал, что один из его испытуемых ощутил присутствие «странных существ, что-то вроде карликов» в начале эксперимента с DMT.43) Другие исследователи описывают «существ» или «сущностей» в форме гуманоидов или животных. Часто их называют «маленькими человечками» (нечеловеческого вида гномы, эльфы, чёртята и т.п.). Существует предположение, что активация эндогенного DMT может быть причиной опыта «похищения инопланетянами».44) Клифф Пиковер также описал опыт, связанный с «машинными эльфами», в своей книге «Sex, Drugs, Einstein, & Elves».45)
Вдыхание
 Стандартная доза DMT для выпаривания составляет 15–60 мг. Вещество вдыхают при помощи нескольких последовательных вдохов. Эффекты довольно краткосрочны, обычно они длятся 5-15 минут, в зависимости от дозы. Начало действия довольно быстрое (менее 45 секунд). Пик действия достигается в течение минуты. В 1960х, DMT называли «наркотиком бизнесменов», из-за относительно короткой продолжительности и быстрого начала действия при вдыхании.46)
Стандартная доза DMT для выпаривания составляет 15–60 мг. Вещество вдыхают при помощи нескольких последовательных вдохов. Эффекты довольно краткосрочны, обычно они длятся 5-15 минут, в зависимости от дозы. Начало действия довольно быстрое (менее 45 секунд). Пик действия достигается в течение минуты. В 1960х, DMT называли «наркотиком бизнесменов», из-за относительно короткой продолжительности и быстрого начала действия при вдыхании.46)
Инъекции
Опыт, наблюдаемый при инъекционном введении DMT, похож на опыт при вдыхании вещества что касается продолжительности и интенсивности действия и характеристики эффектов. В исследовании, проведенном в 1990-1995 годах психиатром Риком Страссманом из Университета Нью-Мексико, некоторые добровольцы, применявшие высокие инъекционные дозы DMT, сообщали об опыте восприятия неземных существ. Обычно эти существа воспринимались в качестве обитателей отдельной реальности, которую участники эксперимента «посещали» в ходе «трипа». В интервью для Examiner.com в сентябре 2009 года, Страссман так описал эффекты, которые испытали участники опыта: «Субьективно, наиболее интересным результатом было понимание того, что высокие дозы DMT позволяют сознанию участников входить в нетелесные, отдельные, независимые реальности, населённые существами света, с которыми можно взаимодействовать. Несмотря на то, что порой наблюдались мистические состояния и состояния, близкие к смерти, это было достаточно редким явлением».
Пероральное применение
DMT перерабатывается ферментом моноаминоксидазы в ходе процесса дезаминирования, и быстро дезактивируется перорально, если не применяется одновременно с ингибитором моноаминоксидазы (ИМАО). В традиционном южноамериканском напитке айяуаска (йяге), лоза айяуаски (Banisteriopsis caapi) смешивается с листьями одного или более растений, содержащих DMT, таких, как Psychotria viridis, Psychotria carthagenensis или Diplopterys cabrerana. Лоза айяуаски содержит алкалоиды гармалы, высокоактивные обратимые ингибиторы моноаминоксидазы A (ОИМА), благодаря которым DMT остается перорально активным, поскольку не проходит через дезаминирование. Существует огромное множество рецептов приготовления напитка, отличающихся в зависимости от цели айяуаска-сессии, а также от доступности ингредиентов. Двумя широко применяемыми источниками DMT на западе СГА являются канареечники Phalaris arundinacea и Phalaris aquatica. Эти инвазивные растения содержат низкие уровни DMT и других алкалоидов. Кроме того, DMT содержится в Mimosa tenuiflora: в розовом слое с внутренней стороны коры корня этого небольшого деревца содержатся высокие уровни N,N-DMT. При пероральном применении совместно с ОИМА, DMT производит длительные (продолжительностью более 3 часов), медленные, глубокие метафизические эффекты, похожие на действие галлюциногенных грибов, однако более интенсивные.47) ОИМА следует использовать с осторожностью, поскольку их применение в сочетании с некоторыми рецептурными препаратами, такими как антидепрессанты СИОЗС и некоторыми доступными без рецепта веществами, может быть опасно для жизни. Непереваренный DMT может вызывать смертельно опасную респираторную депрессию из-за алкалоза, который может быть нейтрализован при помощи уксуса или лимонного сока. DMT может вызывать сильное замедление времени, зрительный и слуховые галлюцинации и другие эффекты, которые включают вербальные и визуальные впечатления. Некоторые сообщают об эротических видениях и применяют вещество в сексуальном контексте.48)
Обнаружение в жидкостях организма
DMT может быть обнаружен и измерен в крови, плазме или моче с использованием хроматографических техник в качестве диагностического инструмента в случае клинического отравления или судебно-медицинской экспертизы. В общем, уровень DMT в крови или плазме у рекреационных пользователей составляет 10–30 мкг/л в течение нескольких часов после применения. Менее 0.1% пероральной дозы выводится в неизмененном виде в течение 24 часов с мочой.49)
Эффекты
Потенциал развития зависимости
Обзор исследований постоянных пользователей айяуаски (напитка, содержащего DMT) показал, что: «Смесь DMT и алкалоидов гармалы, используемая в религиозных церемониях, имеет коэффициент безопасности, сравнимый с кодеином, мескалином или метадоном. Потенциал зависимости перорального DMT и риск длительных психологических расстройств минимальны». 50)
Физические
В соответствии с «дозозависимым исследованием воздействия N,N-диметилтриптамина на человека», проведенного Риком Страссманом, «диметилтриптамин вызывает небольшое увеличение кровяного давления, ЧСС, диаметра зрачков и ректальной температуры, в дополнение к увеличению концентрации бета-эндорфина, кортикотропина, кортизола и пролактина в крови. Уровень гормона роста в крови увеличивается вне зависимости от дозы DMT, а уровень мелатонина не меняется».51)
Предположения
Существует несколько спекулятивных и неподтвержденных гипотез о том, что эндогенный DMT производится в мозгу человека и участвует в определенных психологических и неврологических состояниях.52) DMT в небольших количествах естественным образом содержится в мозгу крыс, спинномозовой жидкости у человека и в других тканях у человека и других млекопитающих. Биохимический механизм DMT был предложен медицинским исследователем Дж. С. Каллавэем, который предположил в 1988 году, что DMT может быть связан с феноменом визуальных снов: возможно, увеличение уровней DMT вызывает видение визуальных сновидений и, возможно, других естественных состояний сознания.53) Роль эндогенных галлюциногенов, включая DMT, в обработке и осознании сенсорной информации высшего порядка, была предложена Дж. В. Валлачем на основании гипотетической роли DMT в качестве нейротрансмиттера.54) Проводя исследование DMT в 1990х годах в Университете Нью-Мексико, доктор Рик Страссман предложил спорную гипотезу о том, что причиной феномена околосмертных переживаний является мощное высвобождение DMT из шишковидной железы до момента смерти. Несколько испытуемых сообщили о слуховых или визуальных галлюцинациях. Он объяснил это возможным отсутствием паники в клинических условиях и возможной разницей в дозировках DMT при приеме вещества и при действительном околосмертном опыте. Несколько испытуемых также сообщило о контакте с «другими существами», похожими на инопланетян, насекомообразными или рептилоидными по природе, в технологически сложном окружении, куда эти «существа» «уносили» испытуемых, чтобы «тестировать», «манипулировать», «расчленять», «обучать», «любить» или «насиловать» их. Основываясь на своем представлении о том, что весь ферментный материал, необходимый для производства DMT, находится в шишковидной железе, в значительно больших концентрациях, чем в любой другой части тела, Страссман сделал предположение, что DMT производится в шишковидной железе. В 1950х годах считалось, что эндогенное производство психоактивных веществ потенциально может объяснить галлюцинации, наблюдаемые при некоторых психиатрических заболеваниях; эта гипотеза известна под названием «гипотезы трансметилирования».55) В 2011 году Николя В. Коззи, из Школы Медицины и общественного здравоохранения Университета Висконсина, подчеркнул, что фермент амин-N-метилтрансферазы, который может быть связан с биосинтезом DMT и эндогенных галлюциногенов, присутствует в шишковидной железе приматов (макак-резусов), ганглиозных нейронов и в спинном мозге.
Легальный статус
Международное законодательство
 DMT считается наркотиком из списка I Конвенции ООН по психотропным веществам 1971 года, таким образом, его использование ограничивается сферой научных исследований и медицины. Международный рынок DMT жестко контролируется. Натуральные продукты, содержащие DMT, включая айяуаску, не регулируются Конвенцией.56)
DMT считается наркотиком из списка I Конвенции ООН по психотропным веществам 1971 года, таким образом, его использование ограничивается сферой научных исследований и медицины. Международный рынок DMT жестко контролируется. Натуральные продукты, содержащие DMT, включая айяуаску, не регулируются Конвенцией.56)
Законодательство в разных странах мира
Австралия
Между 2011 и 2012, годом Федеральное Правительство Австралии рассматривало возможность изменения Криминального Законодательства Австралии, в котором любые растения, содержащие любое количество DMT, считались бы контролируемыми. Сам DMT уже находился под законодательным контролем. Предлагаемые изменения включали другие подобные полные запреты других веществ, например, запрет любых или всех растений, содержащих мескалин или эфедрин. Предложение не получило развития, поскольку это сделало бы цветочный символ Австралии, Acacia pycnantha, нелегальным. Управление по контролю за оборотом лекарственных средств и изделий медицинского назначения Австралии и государственные власти также рассматривали возможность запрета до мая 2012 года (поскольку DMT может иметь потенциальную энтеогенную ценность для аборигенов и/или религиозных людей).57)
Канада
В Канаде, DMT входит в список III Закона о контролируемых веществах и препаратах.
Франция
DMT, наряду с большинством его растительных источников, во Франции классифицируется как stupéfiant (наркотик).
Новая Зеландия
В Новой Зеландии, DMT классифицируется как наркотик класса А Закона о злоупотреблении наркотиками 1975 года.58)
Великобритания
В Великобритании, DMT классифицируется в качестве наркотика из списка А.
США
В США, DMT классифицируется в качестве наркотика из списка I Закона о контролируемых веществах 1970 года. В декабре 2004 года Верховный суд США позволил церкви União do Vegetal (UDV), основанной в Бразилии, использовать отвар DMT во время рождественских церемоний в том году. Отвар представлял собой чай, изготовленный из листьев и лоз, известный как хоаска в UDV, и как айяуаска – в других культурах. В ходе дела Gonzales v. O Centro Espirita Beneficente Uniao do Vegetal, Верховный суд выслушал аргументы 1 ноября 2005 года, после чего вынес единодушное решение в феврале 2006 года, что федеральное правительство США должно позволить UDV импортировать и потреблять чай в ходе религиозных церемоний, благодаря принятию Закона о восстановлении религиозных свобод 1993 года. В сентябре 2008 года три церкви Santo Daime подали иск в федеральный суд с целью восстановить легальный статус импортируемого чая айяуаски, содержащего DMT. Это дело, Church of the Holy Light of the Queen v. Mukasey,59) на котором председательствовал судья Оуэн М. Паннер, завершилось в пользу церкви Santo Daime. По состоянию на 21 марта 2009 года, федеральный судья заявил, что члены церкви в Ашленде могут импортировать, распространять и заваривать айяуаску.
:Tags
Читать еще: Андрографис метельчатый (Andrographis paniculata) , Ацетилхолин , Диферуловые кислоты , Ноотропные средства , Тыква обыкновенная ,










