Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Фенилэтаноламин
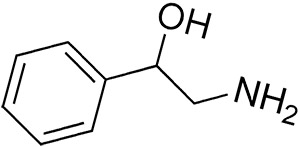
Фенилэтаноламин (иногда сокращенно PEOH), или β-гидрофенилэтаноламин, является биогенным амином, структурно связанным с главным нейромедиатором норадреналином и биогенным амином октопамином. В качестве органического соединения, фенилэтаноламин является β-гидроксилированным фенилэтиламином, структурно связанным с рядом синтетических препаратов, такими как фенилпропаноламин и семейство алкалоидов и препаратов эфедрина. Наряду с этими соединениями, фенилэтаноламин имеет сильную сердечнососудистую активность и, под названием Apophedrin, используется в качестве лекарственного средства для местного сужения сосудов. Внешне фенилэтаноламин представляет собой бесцветное твердое вещество. Фенилэтаноламин, возможно, известен в области биологических наук как часть названия фермента «фенилэтаноламин N-метилтрансферазы», со ссылкой на фермент, отвечающий за превращение норадреналина в адреналин, а также другие родственные превращения.
Фармакологическая группа: биогенные амины; фенилэтиламины
ИЮПАК наименование: 2-амино-1-фенилэтанол
Молекулярная формула: C8H11NO
Молярная масса: 137,18 г / моль
Внешний вид: бледно-желтое твердое вещество
Температура плавления: 56-57°C
Температура кипения: 157-160°С при 17 мм ртутного столба
Растворимость в воде: хорошая
Происхождение
Фенилэтаноламин встречается в природе в организме некоторых видов животных, включая человека.
Химия
Свойства
Химически, фенилэтаноламин является ароматическим соединением, амином и спиртом. Аминогруппа делает это соединение слабым основанием, способным вступать в реакцию с кислотами с образованием солей. Двумя общими солями фенилэтаноламина являются гидрохлорид, C8H11NO.HCl, пл. 212°C и сульфат, (C8H11NO) 2.H2SO4, пл. 239-240 ° С. РКа гидрохлорида фенилэтаноламина, при 25°С и при концентрации 10 мМ, равнялся 8,90. Наличие гидрокси-группы на бензильном C молекулы фенилэтаноламина создает хиральный центр, таким образом, соединение существует в виде двух энантиомеров, d- и l-фенилэтаноламина, или в виде рацемической смеси, d, l-фенилэтаноламина. Правовращающий изомер соответствует S-конфигурации, а левовращающий изомер – R-конфигурации. Производство и оборот фенилэтаноламина строго регулируется в большинстве стран мира, поскольку вещество может использоваться в качестве прекурсора при подпольном синтезе декстрометамфетамина («мет»), мощного и нейротоксичного стимулятора, вызывающего привыкание, который широко используется в среде наркоманов за эйфорические и энтактогенные эффекты. Вещество было практически запрещено в клинической практике (используясь только при синдроме дефицита внимания и нарколепсии) благодаря наличию ряда лекарственных средств, имеющих гораздо более благоприятные фармакологические профили (менее острую и долгосрочную токсичность, меньший потенциал злоупотребления, меньший риск фатальной передозировки, и меньше побочных эффектов), таких как декстроамфетамин, модафинил и метилфенидат. Незаконный метамфетамин является чрезвычайно опасным для здоровья пользователей, поскольку метамфетамин подпольного производства обычно готовится в антисанитарных условиях без тестирования чистоты конечного продукта. Химические вещества-прекурсоры присутствует в заметных концентрациях практически во всех продуктах, изымаемых D.E.A. США. Многие из этих прекурсоров представляют собой химически изменчивые, легко воспламеняющиеся, коррозионные и токсичные вещества. Отравления ими трудно поддаются лечению, как невозможно непосредственно сказать, какие прекурсоры использовались в производстве продукции (тестирование требует наличия современного лабораторного оборудования и занимает слишком много времени). Кроме того, дилеры часто добавляют к своей продукции другие ингредиенты с целью повышения ее объема и своей прибыли. Такие вещества часто являются токсичными и, поскольку такая практика очень распространена среди торговцев наркотиками на каждом этапе распределения, когда продукт наконец достигает пользователя, в нем может содержаться большое разнообразие потенциально опасных примесей, благодаря чему трудно или почти невозможно определить чистоту дозы. Несмотря на международные усилия, незаконный оборот декстрометамфетамина остается на эпидемическом уровне; наркотик доступен практически в каждом городе Америки. Фенилэтаноламин продолжает пользоваться большим спросом и является очень ценным на черном рынке (как и другие его прекурсоры, такие как метиламин и более известный псевдоэфедрин).
Фармакология
Первые классические фармакологические исследования фенилэтаноламина проводил Тайнтер, который наблюдал воздействия вещества на кроликов, кошек и собак. Препарат вызывал быстрое увеличение артериального давления при внутривенном введении, но не оказывал практически никакого воздействия при других путях введения. У кроликов дозы в 200 мг подкожно не вызывали изменения артериального давления. Никаких эффектов не наблюдалось при интубировании препарата в желудок. У человека, пероральный прием дозы 1 г также не давал никакого эффекта. Дозы препарата 1-5 мг / кг внутривенно не вызывали изменений в дыхании у кошек и кроликов. Дополнительные эксперименты также показали, что Фенилэтаноламин не оказывал влияния на бронхи у животных. Аналогично, никакого воздействия также не наблюдалось при подкожном приеме у человека. Эксперименты in vivo и in vitro на гладкой мышце кишечника кошек и кроликов показали, что препарат вызывает расслабление и торможение мышцы. Детальное рассмотрение мидриатического действия фенилэтаноламина привело Тайнтера к выводу, что препарат действует, непосредственно стимулируя радиальную мышцу дилататора зрачка в глазу. Шеннон и сотрудники подтвердили и расширили некоторые из исследований Тайнтера. После внутривенного введения фенилэтаноламина собакам, исследователи отметили, что 10-30 мг / кг препарата вызывает увеличение диаметра зрачка и снижение температуры тела; доза 10 или 17,5 мг / кг вызывает снижение частоты сердечных сокращений, а доза 30 мг / кг, напротив, вызывает увеличение частоты сердечных сокращений. Другие наблюдаемые эффекты включают обильное слюноотделение и пилоэрекцию. Фенилэтаноламин также производит поведенческие эффекты, такие как стереотипные движения головы, быстрые движения глаз и повторяющееся выталкивание языка. Эти и другие наблюдения объясняются действием на α- и β-адренорецепторы. Исследование Carpéné и сотрудников показало, что фенилэтаноламин не существенно стимулирует липолиз в культивируемых адипоцитах («жировых клетках») морской свинки или человека. Умеренная стимуляция (внутренняя активность равна примерно половине активности изопреналина) наблюдалось в адипоцитах крысы или хомяка. Этот липолиз полностью ингибировался бупранололом (неселективным β-блокатором), CGP 20712A (селективным β1-антагонистом), и ICI 118551 (селективным β2-антагонистом), но не SR 59230A (селективным β3-антагонистом). Используя β2 адренергические рецепторы, полученные из трансфицированных НЕК 293 клеток, Liappakis и коллеги установили, что в рецепторах дикого типа, рацемический фенилэтаноламин имел ~ 1/400 х сродства адреналина, и ~ 1/7 х сродства норадреналина в конкурентных экспериментах с 3 [ H]- CGP- 12177. Исследовательской группой из Eli Lilly было изучено два энантиомера фенилэтаноламина с точки зрения их взаимодействия с человеческим рецептором TAAR1. Из экспериментов с человеческим TAAR1, экспрессируемым в клетки rGαsAV12-664, Wainscott и соавторы обнаружили, что R-(-)-фенилэтаноламин (R- (-)- β -гидрокси- β -фенилэтиламин) имел ED50 ~ 1800 нм, Emax от ~ 110 %, тогда как S- (+)-фенилэтаноламин (S -(+) - β -гидрокси- β -фенилэтиламин) имел ED50 ~ 1720 нм, и Emax ~ 105%. Для сравнения, сам β-фенилэтиламин имел ED50 ~ 106 нМ и Emax ~ 100 %.
Фармакокинетика
Фармакокинетика фенилэтаноламина после внутривенного введения собакам изучалась Шенноном и коллегами, которые обнаружили, что препарат следовал «двухкамерной модели», с Т1 / 2 (α) ≃ 6.8 мин и T1 / 2 (β) ≃ 34,2 мин; период полураспада фенилэтаноламина в плазме составлял около 30 минут.
Биохимия
Было установлено, что фенилэтаноламин является отличным субстратом для фермента фенилэтаноламин N-метилтрансферазы (PNMT), впервые выделенном из надпочечников обезьяны Юлием Аксельродом, который трансформировал его в N-метилфенилэтаноламин. Последующие исследования Рафферти и сотрудников показали, что специфичность субстрата PNMT из бычьих надпочечников для различных энантиомеров фенилэтаноламина была следующей: R - (-)- PEOH > R, S- (рацемический) - PEOH > S - (+) - PEOH.
Токсикология
Минимальная летальная доза фенилэтаноламина при подкожном введении морским свинкам составила ~ 1000 мг / кг; при внутривенном введении кроликам – 25-30 мг / кг; при внутривенном введении у крыс – 140 мг / кг.
:Tags
Читать еще: Аминокислоты , Пограничное расстройство личности , Супердрол (метилдростонолон) , Фуразидин , Цинобуфагин ,










