Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Долголетие
 Долголетие – это термин, использующийся для обозначения сохранения жизнеспособности и физического/психического здоровья на протяжении длительного периода времени, возможно, превышающего среднюю продолжительность жизни других людей. Стремление к долголетию заключается в увеличении временного промежутка (продление жизни) и сохранении или улучшении функций организма на протяжении данного временного промежутка (жизнеспособность), то есть не только в увеличении продолжительности жизни, но и улучшении ее качества.
Изучение долголетия начинается с исследований на дрожжах, нематодах (C. Elegans) и плодовых мушках (drosophilia) из-за их короткого жизненного цикла. Для исследований с участием человека необходим промежуток в 90 лет, поэтому 90-дневная продолжительность жизни C.Elegans служит хорошей альтернативой для начальных исследований. После установления механизмов действия в небольших исследовательских моделях, исследования проводятся на млекопитающих, мышах и крысах. Исследования с участием человека не существуют по практическим соображениям.
Кроме того, ограничение калорий (40-50% от обычного объема потребляемых калорий) способствует продлению жизни во всех тестируемых моделях (кроме человеческой), а тематические исследования с участием человека показывают, что ограничение калорий замедляет старение; в связи с высокой вероятностью того, что ограничение калорий увеличивает продолжительность жизни, многие механизмы и процессы могут протекать «в связи с ограничением калорий» или «независимо от ограничения калорий».
Последующий обзор затрагивает молекулярные пути и цели, которые могут быть достигнуты при помощи лекарственных препаратов для обеспечения долголетия. «Явление, представляющее интерес» относится к процессу старения.
Долголетие – это термин, использующийся для обозначения сохранения жизнеспособности и физического/психического здоровья на протяжении длительного периода времени, возможно, превышающего среднюю продолжительность жизни других людей. Стремление к долголетию заключается в увеличении временного промежутка (продление жизни) и сохранении или улучшении функций организма на протяжении данного временного промежутка (жизнеспособность), то есть не только в увеличении продолжительности жизни, но и улучшении ее качества.
Изучение долголетия начинается с исследований на дрожжах, нематодах (C. Elegans) и плодовых мушках (drosophilia) из-за их короткого жизненного цикла. Для исследований с участием человека необходим промежуток в 90 лет, поэтому 90-дневная продолжительность жизни C.Elegans служит хорошей альтернативой для начальных исследований. После установления механизмов действия в небольших исследовательских моделях, исследования проводятся на млекопитающих, мышах и крысах. Исследования с участием человека не существуют по практическим соображениям.
Кроме того, ограничение калорий (40-50% от обычного объема потребляемых калорий) способствует продлению жизни во всех тестируемых моделях (кроме человеческой), а тематические исследования с участием человека показывают, что ограничение калорий замедляет старение; в связи с высокой вероятностью того, что ограничение калорий увеличивает продолжительность жизни, многие механизмы и процессы могут протекать «в связи с ограничением калорий» или «независимо от ограничения калорий».
Последующий обзор затрагивает молекулярные пути и цели, которые могут быть достигнуты при помощи лекарственных препаратов для обеспечения долголетия. «Явление, представляющее интерес» относится к процессу старения.
Также известно как: продление жизни, омоложение
Ключевые слова: жизнь, продление, старение, возраст
Молекулярные мишени
Различные метаболические пути считаются точкой локуса для долголетия, повышая или снижая его. Эти пути влияют на другие и помогают лекарственным мишеням достичь долголетия. Большое количество исследований проводится на нематодах (C. Elegans), а также на мышах и крысах. Исследования на людях не проводятся ввиду практических сложностей, так как наблюдение за человеком необходимо вести на протяжении всей его жизни.
Теломераза
Теломераза – это рибонуклеопротеин, который медиирует длину теломера (концевые участки хромосом), уменьшается в длине в процессе старения.1) Теломераза состоит из двух основных компонентов – каталитической TERT (иначе обратная транскриптаза, TRT или Est2), которая формирует ядро теломеразной РНК фермента (иначе TR, TER, TERC или TLC1), которая в свою очередь является шаблоном TERT;2) каталитический цикл включает в себя синтез одного теломерного повтора на 3′-конце теломерного ДНК-праймера и восстановление шаблона для синтеза дополнительных повторов. Присутствуют и другие белки в процессе функционирования теломеразы (вспомогательные белки), которые не всегда необходимы для функционирования. Проводится изучение влияния теломеразы на долголетие из-за ее связи со старением, но было отмечено, что она функционирует независимо от процесса старения в C. Elegans, а нутрицевтические исследования с применением астралогозида IV (из астрагала перепончатого) продемонстрировали успешное увеличение длины теломера у старых крыс независимо от увеличения продолжительности жизни.3) Теломеры связаны с процессом старения, но являются скорее биомаркерами старения, чем лекарственными мишенями. Повышение активности теломеразы или сохранение длинны теломеразы посредством экзогенных факторов не всегда означает увеличение продолжительности жизни, но не следует исключать возможность того, что теломераза может быть лекарственной мишенью.
FOXO/DAF-16
Транскрипционные факторы семейства forkhead box класса O или FOXO (ортолог DAF-16 в C. Elegans) - это термин, использующийся по отношению к группе генов, известных как FKHRL1 (FOXO3a), FKHR (FOXO1) и AFX (FOXO4);4) DAF-16 и FOXO взаимозаменяемы, и относятся к основным ядерным механизмам, которые происходят из сигналов IIS и TOR, оба этих пути (рассматриваются как препятствующие долголетию) способствуют ядерному исключению FOXO и снижают экспрессию его генных продуктов. FOXO активируется с помощью ROS (активные формы кислорода) и является негативным регулятором REDOX посредством своих генным продуктов, положительно модулируется АМФК (молекулярная мишень метморфина и берберина, также положительно регулируется ROS5)). При DAF-16/FOXO сигнале с помощью генома (с корегулятором Smk-1), генный продукт связан со стрессовой реакцией и продлением жизни. Генные продукты, уровень образования которых повышается вслед за ядерным накоплением DAF-16 (и таким образом увеличивается продолжительность жизни), включают белки теплового шока (HSP-70 и HSP16-1), семейство SIR-2, повышенную активность PGC-1a и супероксиддисмутазы 3 (SOD3). Другие гены, регулирующиеся посредством DAF-16, включают vha-3, E3 лигазу убиквитина, zfp-1 и кальций АТФазы саркоэндоплазматического ретикулума (список не окончательный).6) Ядерное накопление DAF-16 индуцирует генные продукты с широким диапазоном свойств, но чаще всего это связано со стрессовым выживанием и окислительной защитой, при этом наблюдается значительное повышение активности супероксиддисмутазы. Также может наблюдаться сильное взаимодействие между активацией DAF-16 и аутофагией, опосредованной шаперонами.
FOXA/PHA-4
PHA-4 является ортологом C. Elegans для семейства генов человека FOXA,7) который состоит FOXA1-3 и является обязательным для проявления благоприятного воздействия на долголетие при ограничении калорийности рациона. PHA4 также необходим для развития глотки C.Elegans, которая медиирует кормление, и стимулирует геном (здесь ответный элемент) для индуцирования генных продуктов. FOXA также активируется ядерными факторами гепатоцитов (HFNs) с помощью HFNα, β и γ, относящихся к FOXA1, FOXA2 и FOXA3 соответственно. FOXA1 регулируется стероидными гормонами, так как FOXA1 необходим для сигнала андрогенного рецептора, как кофактор, активно учавствует в передаче геномного сигнала эстрогена (α подмножества), таким образом он необходим для развития ткани молочной железы.8) FOXA2 дополнительно активируется глюкокортикоидами и цАМФ, уровень которых повышается при голодании. FOXA2 также взаимодействует с жёлчными кислотами, что может быть объяснением синергизма ограничения калорийности рациона и приема литохолевой кислоты. Сигнал FOXA необходим для обеспечения благоприятного воздействия на долголетие при ограничении калорийности, хотя стимуляторы FOXA имеют достаточно общий характер и взаимодействуют с большим количеством гормонов (в том числе и с обоими классами стероидных гормонов, андрогенами и эстрогенами).
Сигнальные пути инсулина/DAF-2/IGF-1
Сигнальный путь инсулин/IGF-1 (IIS; Daf-2 ортолог рецептора C. Elegans) является регулятором долголетия в различных исследовательских моделях 9), и действует посредством FOXO/DAF-16.10) Фосфорилирование DAF-16 с помощью протекиназы B (даунстрим инсулинового рецептора и апстрим TOR) способствует накапливанию DAF-16 в цитоплазме, что препятствует передаче ядерного сигнала и продлению жизни, так как для этого требуется ядерное накоплени (происходит без фосфорилирования). Активация данного пути снижает продолжительность жизни, а мутанты (со слабоактивным уровнем сигнала) имеют увеличенную продолжительность жизни. Протекиназа B активирует сигналы TOR (с помощью PRAS40), а также она способна фосфорилировать TSC1, инактивируя его и сохраняя активацию mTOR с помощью Rheb.11) Данные механизмы установления протекиназы B в роли положительного модулятора TOR, а также пути IIS и TOR (следующий раздел) тесно связаны между собой. Передача сигнала с помощью инсулинового рецептора может активировать протекиназу B, а также это способствует накоплению FOXO/Daf-16 в цитоплазме и ограничению в ядре. Передача сигнала с помощью инсулинового рецептора является одним из наиболее биологически релевантных механизмов, лежащих в основе ограничения продолжительности жизни. Длительная передача сигнала с помощью инсулинового рецептора к FOXO/DAF-16 активирует компоненты пути протекиназы B, что является отрицательным эффектом. На практике отрицательный потенциал воздействия FOXO на IIS может уменьшить эффект «антидолголетия».
Мишень рапамицина (TOR)
TOR - это белок, который является мишенью иммуноподавляющего препарата рапамицина (сиролимус), носит название mTOR или CeTOR, в зависимости от того, кому принадлежит белок - млекопитающему (mTOR) или C. Elegans (CeTOR). TOR модулирует биогенез рибосом, аутофагию и транскрипцию, является молекулярной мишенью лейцина и метаболитом HMB. TOR содержит комплекс, известный как комплекс 1 (или TORC1), который является наиболее интересным для исследований, так как другой комплекс (TORC2) нечувствителен к рапамицину, компоненты данного комплекса включают TOR киназу (let-363 в C. Elegans),12) Raptor (daf-15 в C. Elegans), и LST8 хотя LST8 не является жизненно необходимым для сигнала TORc1. LST8 также принимает участие в комплексе 2, и единственный присутствует в обоих комплексах, в состав комплекса 2 также входят (Rapamycin Insensitive Companion of TOR; рапамицин нечувствительный компаньон TOR), Sin1 (stress-activated map kinase-interacting protein 1; стресс-активируемая map киназа взаимодействующая с белком 1), и сам TOR.13) TOR (mTOR у млекопитающих) - является промежуточным путем в IIS, который также является прямой мишенью различных метаболитов, считается лекарственной мишенью, так как ингибируется рапамицином, что обеспечивает долголетие. TOR частично противодействует передаче сигнала PHA-4/FOXA, следом за супрессором PHA-4, известным как ruvb-1, что уменьшает эффективность ограничения калорийности рациона, как способа продления жизни. Белок ГТФазы, известный как Rheb напрямую стимулирует TORC1, является посредником, с помощью которого белки-супрессоры опухоли TSC1 and TSC2 ингибируют TORc1, так как изолирование Rheb с помощью TSC понижает активацию TORc1. Rag ГТФазы также вовлечены в положительное регулирование TORC1 с помощью raptor, а ингибирование происходит при помощи метморфина.14) TOR активируется в моменты переизбытка питательных веществ с помощью молекул, передающих сигналы, вызванные переизбытком таких веществ, например, аминокислот; активация пути TOR подавляет путь FOXA, что является обязательным условием для продления жизни при ограничении калорийности.
Сигналы каннабиноидов
Каннабиноиды - это эндогенные амиды жирных кислот, которые передают сигналы с помощью каннабиоидных рецепторов, известных как CB1 and CB2; эти рецепторы получили названия от cannabis (марихуана), так как там они были обнаружены, эндогенные каннабиноиды включают анандамид и олеамид. По меньшей мере, одно исследование отметило, что устранение рецептора CB1 способствует более длинной продолжительности жизни (C. Elegans), как и снижение концентрации N-ацилетаноламина или повышение активности фермента FAAH (который метаболизирует N-ацилетаноламины), но другие исследования на нокаутных мышах показали, что CB1 укорачивает продолжительность жизни.15) Передача сигнала с помощью рецептора CB1 неоднозначно влияет на продолжительность жизни.
Серотонин
Серотонин обладает действием, обратным по отношению к увеличению продолжительности жизни, накопление DAF-16 в ядре выше, чем при воздействии экзогенного серотонина или SSRI. Процесс, зависящий от ADF хемосенсорных нейронов, проходит через daf-2 (инсулиновый рецептор) и обладает такими же сигнальными свойствами, как и путь IIS, серотонин и антипсихотики усиливают передачу инсулинового сигнала и связаны с активацией протекиназы B.16) Серотонин усиливает передачу сигнала с помощью IIS, TOR, с последующим снижением ядерного накопления DAF-16 и нарушением передачи сигнала FOXO; сам по себе серотонин не препятствует увеличению продолжительности жизни, а только усиливает воздействие других путей.
Сфинголипиды
Снижение синтеза сфинголипидов в дрожжах увеличивает их продолжительность жизни с помощью Sch9-зависимых (S6K гомолог человека) механизмов, путь Sch9/S6K располагается по ходу транскрипции IIS/TOR, а также активирует Pkh1/2 у дрожжей17) которые активируют Sch9. Сфинголипиды являются негативными регуляторами долголетия, а также активируют S6K.
Убиквитинирование
HECT E3 убиквитинлигаза WWP-1 является позитивным регулятором долголетия независимо от пути IIS, также способна увеличивать продолжительность жизни независимо от ограничения калорий рациона. Любопытно, что снижение уровня WWP-1 или повышение уровня метаболически неактивной формы WWP-1 снижает эффективность ограничения калорий; обязательный кофактор UBC-18 также необходим для проявления благоприятного действия ограничения калорий. Действие сверхэкспрессии WWP-1 устраняется c устранением PHA-4, но при устранении DAF-16 продолжительность жизни также уменьшается; WWP-1 связан скорее с метаболизмом FOXA, чем с ISS передачей сигнала. Ферменты убиквинированного пути являются модуляторами долголетия C.Elegans.
SKN-1/Nrf2
SKN-1 является гомологом C. Elegans человеческого гена Nrf,[68] Nrf2 учавствует в сигнальном пути с цитоплазматическим белком Keap1; если Keap1 фосфорилируется, то он высвобождает Nrf2 в ядро для воздействия на антиоксидантный ответный элемент (АОЭ) и индуцирцет выработку окислительных ферментов. Nrf2 стимулируется при ограничении калорий, считается, что он лежит в основе гормезисных свойств ограничения калорийности.18) Nrf2 человека (C. Elegans SKN-1) - это белок, который передает сигнал для производства антиокислительных ферментов, активируется окислительным стрессом и в результате голодания; возможная механистическая связь между ограничением калорийности и долголетием.
Raf-1/MEK1/2/ERK1/2
Путь Raf-1/MEK1/2/ERK1/2 - это путь, который позитивно регулирует аутофагию, так как ERK1/2 фосфорилирует Gα-взаимодействующий белок, который увеличивает скорость ГТФ гидролиза (с помощью белка Gαi3), что в результате вызывает аутофагию;19) этот путь ингибируется аминокислотами и питательными веществами, считается, что он связан с ограничением калорийности рациона.
Представляющие интерес процессы
Клеточное старение
 Клеточное старение - это старение отдельной клетки, фенотипические и метаболические изменения которой замедляют или приостанавливают функционирование клетки.
Накопление стареющих клеток связано с возрастной патологией, а клиренс стареющих клеток обращает патологические изменения.20)
Старение тесно связано с геном-онкосупрессором p16, а p16Ink4a является биомаркером старения,] удаление этого белка снижает фенотипические изменения, связанные с возрастом, в ткани, из которой p16Ink4a был удален, а родственный белок p19Arf способствует сохранению продолжительности жизни(отменяя возрастные изменения).21) p16Ink4a может накапливаться после активации PPARγ, и индуцируется агонистами, например, росиглитазоном.
Клеточное старение - это старение отдельной клетки, фенотипические и метаболические изменения которой замедляют или приостанавливают функционирование клетки.
Накопление стареющих клеток связано с возрастной патологией, а клиренс стареющих клеток обращает патологические изменения.20)
Старение тесно связано с геном-онкосупрессором p16, а p16Ink4a является биомаркером старения,] удаление этого белка снижает фенотипические изменения, связанные с возрастом, в ткани, из которой p16Ink4a был удален, а родственный белок p19Arf способствует сохранению продолжительности жизни(отменяя возрастные изменения).21) p16Ink4a может накапливаться после активации PPARγ, и индуцируется агонистами, например, росиглитазоном.
Митохондриальный гормезис
Механизм зависит от pmk-1 в C. Elegans (ортологом человека является p38 MAP киназа), устраняется антиокислительными соединениями. Некоторые соединения, которые вызывают незначительные повреждения митохондрий, способствуют продлению жизни; среди таких соединений - мышьяк, лонидамин22) в низких дозах.
Аутофагия
Аутофагия - это процесс, при котором изолирующая мембрана окружает клеточные структуры и создает аутофагосомы, процесс имеет общие черты с клеточной рециклизацией.23) Аутофагосомы могут быть сформированы из эндоплазматического ретикулума клетки (омегасомы), липиды, которые формируют мембрану аутофагосом, могут быть получены из митохондрии или цитоплазматической мембраны. Различают три типа аутофагии - микроаутофагия (отсутствует у млекопитающих), макроаутофагия (основная и селективная аутофагия целевых поврежденных молекул) и шаперон-зависимая аутофагия, опосредованная Hsc70 и ко-шаперонами.24) Этот процесс опосредован белками, связаннами с аутофагией. Более 30 из них были индентифицированны, они могут появляться как в случае переизбытка питательных веществ, так и в случае их дефицита. При дефиците питательных веществ аутофагия становится неселективной, и служит для того, чтобы привестисубстрат к энергетическому уровню клетки; при переизбытке питательных веществ действие карго-специфичного белка направлено на удаление поврежденных органелл. Аутофагия представляет собой процесс направленного клеточного разрушения, который действует как контроль качества для клетки. У млекопитающих наблюдается два типа аутофагии - макроактофагия (в которую входит большая часть процессов) и шаперон-зависимая аутофагия.
Митофагия
Митофагия - это избирательная аутофагия митохондрий, необходима для поддержания митохондриальной функции и качества при рециклинге поврежденных митохондрий.25) Осуществляется посредством микромитофагии (выпадение вакуолярной/лизосомальной границы мембраны) или макромитофагии (изолирование в автофагосомах); если у дрожеей наблюдается и микромитофагия, и макромитофагия, то у млекопитающих только макромитофагия. Митофаги являются скорее карго-специфическими аутофагами, чем неспецифическими. Клетки (дрожжей) без макромитофагии имеют более крупные митохондрии округлой формы с укороченной кристой,26) при ограничении калорий без митофагии отмечается накопление дисфункциональных митохондрий и последующее окисление. Митофагия сохраняет митохондриальную функцию в течение длительного периода времени27) и предшествует митохондриальному делению. Митофагия представляет собой клеточный рециклинг митохондрий, который необходим для длительного функционирования клетки. Митофагия в некотором смысле находится под влиянием NIX (NIP3-подобный белок X или BNIP3L) с дрожевым гомологом ATG32; NIX - это белок, который расположен во внешней мембране митохондрии и может связываться с LC3, его гомолог (GABARAP)28) действует в роли мембранного рецептора для митофагии. Паркин - это белок (E3 убиквитинлигаза), который селективно перемещается в поврежденную митохондрию после стресса, избыточная экспрессия паркина разрушает поврежденные митохондрии, не оказывая воздействия на здоровые митохондрии. Паркин привлекается к поврежденной митохондрии с помощью PINK1, белка, который обычно метаболизируется в митохондрии, но накапливается в поврежденной митохондрии при меньшем протеолизе. PINK1 может фосфорилировать и активировать паркин, который затем действует как убиквитин в наружней мембране митохондрии.29) Считается, что паркин нацелен на два белка - митофьюжн 1 и 2, которые вызывают митофагию. Паркин и PINK1 являются белками-мишенями, которые вовлечены в карго-специфичную митофагию.
Шаперон-зависимая аутофагия
Шаперон-зависимая аутофагия (ШЗА) - это селективный процесс аутофагии для цитозольных белков, который заключается в транспортирвке белков через лизосомальную мембрану,30) не разрушает органеллы, например, митохондрии; ШЗА, как и другие процессы аутофагии, активируется клеточным стрессом и ограничением питательных веществ, но целенаправленное ограничение питательных веществ активирует неселективну. макроаутофагию, которая в процессе длительного голодания постепенно переходит в ШЗА. Функционирование ШЗА снижается с возрастом, но может быть активированно окислительным стрессом, уровень лизосом, участвующих в ШЗА, увеличивается с 20-30% до 60-80% после трех дней голодания (гомогенаты печени крысы).31) Шаперон-зависимая аутофагия - это селективный процесс аутофагии, медиируемый их эндоплазатического ретикулума; способствует сохранению гомеостаза белка в цитоплазме (но не органелл) посредством отыетных реакций белка. KFERQ мотив обеспечивает связывание ШЗА с белком (IκBα, РНКаза A и c-Fos; около 30% белков-мишений), также отмечаются схожие пентамино мотивы, такие как QREFK или VDKFQ. Голодание, которое повышает активность ШЗА, снижает количество цитозольных белков с KFERQ везде, кроме скелетных мышц и нейронов (но исходный уровень активности ШЗА в нейронах выше).32) Цитозольные белки становятся мишенью шаперонов и ко-шаперонов, первыми шаперонами являются родственные белки теплового шока 70-kDa (Hsc70 или Hsp70), который также присутствует в лизосомах, и Hsc90, который по большей части связан с внутренней счастью; оба белка (Hsc70 и Hsc90) являются шаперонами, которые принимают участие в развертывании белка.33) Шапероны также достигают лизосом с помощью гликопротеинового рецептора, известного как LAMP-2A (отсутствует аффинность к LAMP-2B или 2C). Скорость-лимитирующей стадией в ШЗА является экспрессия LAMP-2A; генетически аблирующий lamp-1A летален.34) Цитоплазматические белки становятся мишенью шаперонов посредством последовательного связывания аминокислот, затем рецептор LAMP-2A, действующий как рецептор ШЗА, способствует деградации белка-мишени внутри лизосомы. Скорость разрушения белка замедляется с возрастом, что приводит к накапливанию измененного или поврежденного белка, процесс, связанный со снижением шаперон-зависимой аутофагии (среди других причин играет первостепенную роль). В стареющих фибропластах активность ШЗА снижена, и больше не регулируется сывороточным голоданием35) (любопытно, что некоторые молекулы, такие как куркумин действуют через ограничение калорий, но не оказывают воздействие на пожилых людей), что было отмечено in vivo. Наблюдается снижение регуляции скорость-лимитирующей стадии, что вызывает снижение скорости протеолиза, это происходит не из-за транскрипционного сниженного регулирования или изменений в скорости синтеза и доставки данного рецептора к лизосомальному компартменту, а из-за динамичности и устойчивости лизосомальной мембраны, которая уменьшается с возрастом.36) Генетически восстановленная активность LAMP-2A старых крыс позволяет устранить возрастные заболевания и окислительный стресс в клетках печени, а также сохранить функцию ШЗА. Наблюдается пониженная регуляция LAMP-2A у мышей, в рационе которых преобладают жиры, но механизмы, лежащие в основе повышенной нестабильности мембраны LAMP-2A (и снижения активности с возрастом) по большей части неизвестны. Пониженная регуляция LAMP-2A демонстрирует, что ограничение калорийности больше влияет на молодых, чем на пожилых, также играет решающую роль в ШЗА.
Ограничение калорийности
На сегодняшний день ограничение калорийности является наиболее надежным методом достижения долголетия, и поэтому чаще всего используется в исследованиях.
Процессы при ограничении калорийности
Удаление гена (atg32Δ), который регулирует митофагию, блокирует эффект «долголетия» в дрожжах при ограничении калорийности. Естественный ко-регулятор DAF-16, smk-1, и сигнал FOX(A) 37) необходимы для обеспечения долголетия при ограничении калорийности, хотя ядерное накопление DAF-16 (и FOXO сигнал), сами по себе, не обязательны.
Физические упражнения
Шаперон-зависимая аутофагия
Физические упражнения повышают трансляцию Hsp72 с помощью мРНК, так как Hsp72 повышает последующее окислительное, тепловое, гипоксическое/гипероксическое и физическое повреждения ткани; такое повышение отмечалось в печени,38) сердце, лейкоцитах и надпочечниках и натренированных скелетных мышцах. Механизм активации заключается в следующем - побочные продукты мышечного метаболизма (лактат, радикалы и глюкозная депривация) и гормоны стресса39) фосфорилируют белок, известный как белок теплового шока-1 (БШП-1), который становится тримером, передает сигнал через геном и производит Hsp72. Hsp72 работает так же, как и другие молекулярные шапероны, способствует разрушению белков в цитоплазме и сохраняет клеточный гомостаз белка. Степень его повышения под воздействием физических упражнений связана со степенью метаболического повреждения ткани (повышенная регуляция в течение 30 минут после часового бега и в течение 24 часов после марафона), регуляция становится выше при выполнении физических упражнений при высокой температуре окружающей среды. Повышение экспрессии Hsp72 в мышцах оказывает защитное воздействие против патологий и старения, но не повышается при ограничении калорийности, как это делает Hsp90.40) Физические упражнения могут стимулировать молекулярные шапероны для создания клеточного гомеостаза белков, механизм протекает схожим образом с шаперон-зависимой аутофагией. Шапероны, участвующие в стрессовой реакции на физические упражнения, отличаются от тех, что вовлечены в процесс при ограничении калорийности.
Продлевающие жизнь добавки
Мелатонин
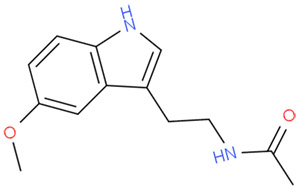 Мелатонин - это гормон эпифиза, который хорошо известен за препарат для облегчения засыпания, принимает активное участие в процессах, направленных на продление жизни (с информацией о препарате можно ознакомиться на соотвествующей странице), может использоваться как профилактическое, так и реабилитационное средство.
Мелатонин демонстрирует эффективное действие в нематодах, плодовых мушках и млекопитающих (крысах и мышах) при ежедневном использовании в допустимых дозах 5,45 мг (эквивалент для человека весов 68 кг, доза выведена на основании 1 мг/кг для крыс). Согласно исследованиям на крысах, повышение дозы в 10 раз не способствует увеличению защитного действия и в одинаковой степени эффективно.
Хотя механизм действия неизвестен, считается, что процесс осуществляется напрямую посредством ингибирования теломеразы или опосредованно.
Прием мелотонина - безопасный способ продления жизни, который допустимо принимать ежедневно. Повторные исследования демонстрируют действие, направленное на продление жизни, у млекопитающих.
Мелатонин - это гормон эпифиза, который хорошо известен за препарат для облегчения засыпания, принимает активное участие в процессах, направленных на продление жизни (с информацией о препарате можно ознакомиться на соотвествующей странице), может использоваться как профилактическое, так и реабилитационное средство.
Мелатонин демонстрирует эффективное действие в нематодах, плодовых мушках и млекопитающих (крысах и мышах) при ежедневном использовании в допустимых дозах 5,45 мг (эквивалент для человека весов 68 кг, доза выведена на основании 1 мг/кг для крыс). Согласно исследованиям на крысах, повышение дозы в 10 раз не способствует увеличению защитного действия и в одинаковой степени эффективно.
Хотя механизм действия неизвестен, считается, что процесс осуществляется напрямую посредством ингибирования теломеразы или опосредованно.
Прием мелотонина - безопасный способ продления жизни, который допустимо принимать ежедневно. Повторные исследования демонстрируют действие, направленное на продление жизни, у млекопитающих.
Адаптогены
Родиола розовая и элеутерококк колючий способствуют теплостойкости долголетию у дрозофил, считается, что процесс связан с сигналом DAF-16 (так как эта молекула медиирует теплостойкость у дрозофил и долголетие), осуществляется независимо от потери плодовитости или сокращения калорийности. Оба вышеупомянутых адаптогена снижают продолжительность жизни при использовании 10-кратной дозы. Адаптогены индуцируют долголетие, процесс вторичный по отношению к ядерному накоплению DAF-16, осуществляемый независимо от ограничений калорийности. На данный момент исследований с участием человека не проводилось.
Литохолевая кислота
Литохолевая кислота (ЛХК) - жёлчная кислота, которая действует синергично с ограничением калорий для продления жизни дрожжей, процесс связан с митофагами, так как их блокирование отменяет синергизм. ЛХК работает независимо от TOR и сигнала cAMP/PKA (устранение Rim15 не отменяет эффект), и проявляет действие только в определенные жизненные фазы дрожжей.41) Авторы исследования предполагают, что мишени ЛХК могут быть ингибированы активацией TOR и cAMP/PKA. Возможным объяснением наблюдаемого синергизма может быть взаимодействие белков FOXA с жёлчными кислотами и снижение аккумуляции липидов (свободные жирные кислоты и диациглицерол) эндоплазматическом ретикулуме42) (ЛХК способна сохранить изменения, связанные с уменьшением продолжительности жизни, при бета-оксислении). Литохолевая кислота способствует продлению жизни в синергизме с ограничением калорийности в дрожжах (на данный момент исследований на млекопитающих нет), возможно, процесс связан с динамикой липидов и эндоплазматическим ретикулумом. Литохолевая кислота активирует рецептор витамина D, рецептор желчной кислоты TGR5, рецептор PXR, а также рецептор FXRα, но для активирования ВДР и PXR необходима концентрация свыше 30 мкм. Также следует отметить, что литохолевая кислота токсично воздействует на крыс при пероральном использовании в объеме 0.03% от общего рациона.43) Хотя вещество довольно перспективно в синергизме с ограничением калорийности, слишком рано делать выводы для млекопитающих. Молекулярные мишени еще полностью не определены.
Кофеин
Кофеин (ксантин в чае и кофе) способствует продлению жизни червей с помощью механизма зависимого от фосфорилирования CREB1, ингибирования TORC1 и ядерного аккумулирования DAF-16.
:Tags
Читать еще: Ампакины , Бетаметазон (бетаметазона дипропионат) , Нокодазол , Кемпферол ,










