Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Пролин
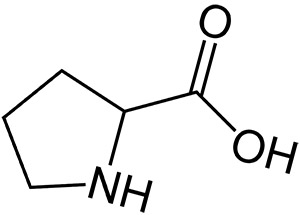
Пролин (сокращенно Pro или Р) – альфа-аминокислота, одна из двадцати ДНК-кодируемых аминокислот. Её кодоны CCU, CCC, CCA и CCG. Пролин не является незаменимой аминокислотой, то есть может синтезироваться в организме человека. Эта [[аминокислоты|аминокислота]] считается уникальной среди 20 аминокислот, формирующих белки потому, что аминный азот здесь привязан не к одной, а к двум алкильным группам, что делает вещество вторичным амином. Более распространенная L форма в стереохимии обозначается как S.
Фармакологическая группа: аминокислоты
Биосинтез пролина
Пролин выделяют из аминокислоты L-глутамата и его непосредственного предшественника имино кислоты 1) путем биосинтеза. Ферменты, участвующие в биосинтезе, обычно включают:
Глутамат 5-киназу, глутамат 1-киназу (АТФ-зависимые) Глутаматдегидрогеназу (необходим NADH - никотинамидадениндинуклеотид или NADPH - никотинамидадениндинуклеотидфосфат) Редуктаза пирролин-5-карбоновой кислоты (необходим NADH или NADPH)
Функции в структуре белка
Своеобразная циклическая структура пролина в боковой цепи ограничивает его фи-задний двугранный угол примерно на 60°, что обеспечивает пролину исключительную конформационную жесткость по сравнению с другими аминокислотами. Следовательно, пролин теряет меньше конформационной энтропии при фолдинге (складывании), что может объяснить его широкое распространение в белках термофильных организмов. Пролин действует как структурный разрушитель в середине регулярных элементов вторичной структуры, таких как альфа-спирали и бета-листы. Пролин обычно встречается в качестве первого остатка альфа-спирали, а также в крайних нитях бета листов. Пролин также часто встречается на изгибах, что может объяснить такой любопытный факт, что пролин, как правило, подвергается растворению, несмотря на наличие совершенно алифатических боковых цепей. Когда пролин связан, как амид, пептидной связью, его азот не взаимодействует ни с каким атомом водорода, то есть не может служить донором в водородной связи, однако может участвовать в ней в качестве акцептора. Различные взаимодействия боковых цепей/аминных групп позволяют пролину образовывать бета изгибы. Несколько пролинов и/или гидроксипролинов в ряду могут создавать полипролиновую спираль, преобладающую вторичную структуру коллагена. Гидроксилирование пролина с помощью пролилгидроксилазы (или других добавок электроноакцепторных заместителей, таких как фтор) значительно увеличивает конформационную стабильность коллагена. Таким образом, гидроксилирование пролина является важнейшим биохимическим фактором для поддержания соединительной ткани высших организмов. Тяжелые заболевания, такие как цинга, могут быть результатом дефектов данного гидроксилирования, например мутации фермента пролилгидроксилазы или отсутствия необходимого кофактора аскорбиновой кислоты (витамин С). Последовательности пролина и 2-аминоизомасляной кислоты (Aib) также образуют спиральную структуру. Пептидная связь с поступающими Pro-tRNAPro образуется значительно медленнее, чем с другими тРНК, что является общей чертой N-алкиламиновых кислот. Образование пептидной связи между входящей тРНК и концом цепи пролина также происходит медленно; связь пролин-пролин образуется медленнее всего.
Цис-транс изомеризация
Пептид связывается с пролином и с другими N-замещенными аминокислотами (такими, как саркозин), и способен заполнять как цис-, так и транс- изомеры. Большинство пептидных связей принимают транс-изомер (в естественных условиях обычно в 99,9% случаев), главным образом потому, что амид водород (транс-изомер) имеет меньшее стерическое отталкивание с предыдущим \ mathrm {C} ^ {\} альфа атомом, чем со следующим \ mathrm {C} ^ {\} альфа атомом (цис-изомер). В противоположность этому, цис-и транс-изомеры X-Pro пептидной связи (где Х представляет собой любую аминокислоту) испытывают стерические столкновения с соседними замещениями и энергетически почти равны. Таким образом, доля X-Pro пептидных связей в цис-изомере в естественных условиях составляет от 10 до 40%, эта доля слабо зависит от предыдущей аминокислоты с ароматическими остатками в пользу цис-изомера. С кинетической точки зрения, цис-транс-изомеризации пролина - очень медленный процесс, который может препятствовать прогрессу сворачивания белка путем захвата одного или более остатков пролина, что имеет решающее значение для складывания ненативных изомеров, особенно когда нативный белок требует наличия цис-изомеров. Это происходит потому, что остатки пролина синтезируются исключительно в рибосоме, как транс-форма изомера. Все организмы имеют ферменты пролил изомеразы, катализирующие эту изомеризацию, а некоторые бактерии имеют специальные пролил изомеразы, связанные с рибосомой. Однако не все пролины необходимы для фолдинга. Фолдинг (складывание) белков может протекать с нормальной скоростью, несмотря на наличие ненативных конформеров на многих X-Pro пептидных связях.
Использование пролина
Пролин и его производные часто используются в качестве асимметричных катализаторов органических реакций. Наиболее яркими примерами являются снижение CBS и катализация пролином альдольной конденсации. L-пролин является осмопротектором и, следовательно, используется в фармацевтике и биотехнологии. В пивоварении белки, богатые пролином, в сочетании с полифенолами используются для создания дымка (мутности).
Детали
Пролин, наряду с глицином, является одной из двух аминокислот, которые не входят в список Рамачандрана. Из-за образования кольца, соединенного с бета-углеродом, пси- и фи- углы около пептидной связи имеют меньше допустимой степени вращения. В результате пролин часто встречается в «витках» белков, так как его свободная энтропия (ΔS) не так велика в сравнении с другими аминокислотами и, следовательно, в сложенном состоянии энтропия изменяется меньше, чем в разложенном. Кроме того, пролин редко встречается в альфа- и бета-структурах, так как его наличие ведет к уменьшению устойчивости этих структур, поскольку его боковая цепь альфа-N может формировать только одну водородную связь. Кроме того, пролин является единственной аминокислотой, не образующей синий/фиолетовый цвет при обработке нингидрином в хроматографии. Пролин здесь производит оранжевый/желтый цвет.
История
 Ричард Вильштеттер синтезировал пролин с помощью реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном в 1900 году. В 1901 году Герман Эмиль Фишер изолировал пролин из казеина и продуктов распада гамма-фталимидо- пропилмалонового эфира.
Ричард Вильштеттер синтезировал пролин с помощью реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном в 1900 году. В 1901 году Герман Эмиль Фишер изолировал пролин из казеина и продуктов распада гамма-фталимидо- пропилмалонового эфира.
Синтез
Рацемический пролин может быть синтезирован из диэтилового эфира малоновой кислоты и акрилонитрила.
Доступность:
L-пролин применяется для укрепления суставных соединений, связок и сердечной мышцы; улучшения структуры кожи; ускорения реабилитации после перенесенных травм. Отпускается из аптек без рецепта.
:Tags
Читать еще: Алимта (Пеметрексед) , Буфоталин , Демпинг-синдром , Мускатный орех , Экстракт листьев оливы ,










