Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Тестостерон
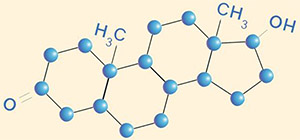 Тестостерон представляет собой стероидный гормон из группы андрогенов и обнаруживается у людей и других позвоночных. В организме людей и других млекопитающих тестостерон секретируется, в первую очередь, в семенниках самцов и, в меньшей степени, в яичниках самок. Небольшие его количества секретируются надпочечниками. Является основным мужским половым гормоном и анаболическим стероидом.
У мужчин тестостерон играет ключевую роль в развитии мужских репродуктивных тканей, таких как яички и предстательная железа, а также содействует развитию вторичных половых признаков, таких как увеличение мышц, костной ткани и рост волос на теле. Кроме того, тестостерон имеет важное значение для здоровья и благополучия, а также предотвращает развитие остеопороза1).
В среднем, у взрослых мужчин уровень тестостерона примерно в 7-8 раз выше, чем у взрослых женщин. Поскольку метаболическое потребление тестостерона у мужчин больше, суточная выработка у мужчин в 20 раз выше, чем у женщин2). Женщины также чувствительны к этому гормону. Тестостерон наблюдается у большинства позвоночных. У рыб отмечается наличие несколько другой формы, а именно 11-кетотестостерона3). Его аналогом у насекомых является экдизон. Предполагается, что половые гормоны имеют древнюю эволюционную историю.
Тестостерон представляет собой стероидный гормон из группы андрогенов и обнаруживается у людей и других позвоночных. В организме людей и других млекопитающих тестостерон секретируется, в первую очередь, в семенниках самцов и, в меньшей степени, в яичниках самок. Небольшие его количества секретируются надпочечниками. Является основным мужским половым гормоном и анаболическим стероидом.
У мужчин тестостерон играет ключевую роль в развитии мужских репродуктивных тканей, таких как яички и предстательная железа, а также содействует развитию вторичных половых признаков, таких как увеличение мышц, костной ткани и рост волос на теле. Кроме того, тестостерон имеет важное значение для здоровья и благополучия, а также предотвращает развитие остеопороза1).
В среднем, у взрослых мужчин уровень тестостерона примерно в 7-8 раз выше, чем у взрослых женщин. Поскольку метаболическое потребление тестостерона у мужчин больше, суточная выработка у мужчин в 20 раз выше, чем у женщин2). Женщины также чувствительны к этому гормону. Тестостерон наблюдается у большинства позвоночных. У рыб отмечается наличие несколько другой формы, а именно 11-кетотестостерона3). Его аналогом у насекомых является экдизон. Предполагается, что половые гормоны имеют древнюю эволюционную историю.
Систематическое (МСТПХ) название:
(8R,9S,10R,13S,14S,17S)-17-гидрокси-10,13-диметил-1,2,6,7,8,9,11,12,14,15,16,17- додекагидроциклопента[а]фенантрен-3-он
Клинические данные:
Торговые названия – Андродерм, Делатестрил;
Употребление при беременности – США: противопоказано, противопоказано из-за тератогенных эффектов;
Правовой статус – Канада: список IV, США: список III, только по рецепту;
Способы употребления – внутримышечные инъекции, трансдермальный (крем, гель или пластырь), подкожно.
Фармакология:
Биологическая доступность – низкая (из-за экстенсивного пресистемного метаболизма);
Метаболизм – печень, яички и простата;
Период полураспада – 2-4 часа;
Экскреция – с мочой (90%), фекалиями (6%).
Свойства:
Химическая формула - C19H28O2.
Последствия для здоровья
В общем, андрогены способствуют синтезу белка и росту тканей с андрогенными рецепторами. Эффекты тестостерона могут быть классифицирован как вирилизирующие и анаболические, хотя это различие является несколько искусственными, так как эти эффекты часто проявляются вместе.
- Анаболические эффекты включают рост мышечной массы и силы, повышение плотности костной ткани и силы, а также стимулирование линейного роста и созревания костей.
- Андрогенные эффекты включают созревание половых органов, в частности, пениса, и образование мошонки у плода; после рождения (обычно в период полового созревания) отмечается углубление голоса, рост бороды и подмышечных волос. Многие эти признаки представляют собой мужские вторичные половые признаки.
До рождения
Пренатальные андрогенные эффекты возникают в ходе двух различных стадий. Они имеют место между 4 и 6 неделями гестации.
- Генитальная вирилизация (по средней линии слияния, фаллическая уретра, истончение и проявление складок мошонки, фаллическое увеличение); роль тестостерона в данном случае ниже, чем дигидротестостерона.
- Развитие простаты и семенных пузырьков.
Во время второго триместра уровень андрогенов связан с формирование пола4). Этот период влияет на феминизацию или маскулинизацию плода, он может быть лучшим предиктором женской или мужской моделей поведения, предполагая типичное поведение каждого из полов. Уровень тестостерона у матери во время беременности коррелирует с половым поведением дочери, когда она станет взрослой, причём эта корреляция является более выраженной, нежели уровень тестостерона у самой дочери5).
Ранее детство
Андрогенные проявления в раннем детстве менее всего изучены. В первые недели жизни младенцев мужского пола уровень тестостерона увеличивается. Его уровни остаются в пубертатном диапазоне несколько месяцев, но, как правило, достигают едва обнаруживаемых уровней в 4-6 месяцев6). Функция его увеличения не выяснена. Предполагалось, что это объясняется «маскулинизацией головного мозга», так как не было выявлено значительных изменений в других частях организма. Следует отметить, что мужской головной мозг маскулинизируется с помощью ароматизации тестостерона в эстроген, который пересекает гематоэнцефалический барьер и попадает в мужской головной мозг, в то время как младенцы женского пола обладают альфа-фетопротеином, который связывает эстроген, поэтому на их головной мозг подобного влияния не отмечается7).
Препубертат
Препубертатные эффекты являются первыми обнаруживаемыми эффектами увеличения уровней андрогенов в конце детства; происходит у мальчиков и девочек.
- Запах тела;
- Повышенная жирность кожи и волос, акне;
- Пубархе (появление волос на лобке);
- Подмышечный рост волос;
- Быстрый рост, ускоренное созревание костей;
- Волосы над верхней губой, подбородке, рост бакенбардов.
Пубертат
Пубертатные эффекты начинают проявляться, когда уровень андрогенов выше нормального уровня взрослой женщины в течение месяцев или лет. У мужчин пубертат наступает обычно позже и происходит у женщин после длительного периода повышенного уровня свободного тестостерона в крови.
- Расширение сальных желёз. Это может вызвать акне;
- Фаллическое увеличение или клиторомегалия;
- Повышение либидо и частоты эрекций или клиторального нагрубания;
- Лобковые волосы (могут проявляться на бёдрах и достигать пупка);
- Волосы на лице (бакенбарды, борода, усы);
- Потеря волос на голове (андрогенная алопеция);
- Волосы на груди, париареолярные волосы, перианальные волосы.
- Волосы на ногах;
- Подмышечные волосы;
- Доля подкожного жира на лица уменьшается;
- Увеличение мышечной силы и массы;
- Углубление голоса;
- Рост кадыка;
- Рост сперматогенеза тканей в яичках, мужская фертильность;
- Рост челюсти, лба, подбородка, носа и ремоделирование костных контуров лица совместно с гормоном роста человека;
- Плечи становятся шире, грудная клетка расширяется;
- Завершение созревания костей и прекращение их роста. Это происходит косвенно с помощью метаболитов эстрадиола, и, следовательно, этот процесс более постепенен у мужчин, чем у женщин.
Период взрослости
Эффекты проявления тестостерона во взрослом периоде наиболее проявляются у мужчин, нежели у женщин, однако важны для обоих полов. Некоторые из этих эффектов могут не проявляться в случае снижения уровней тестостерона в последние десятилетия взрослой жизни.
Биологическое применение
- Тестостерон необходим для нормального развития сперматозоидов. Он активирует гены в клетках Сертоли, которые способствуют дифференциации сперматогоний.
- Регулирует острую реакцию ГГН (гипоталамус-гипофиз-надпочечники) при доминантной конкуренции;
- Является регулятором когнитивной и физической энергии;
- Поддерживает мышечную трофику;
- Тестостерон регулирует популяцию рецепторов тромбоксанов А2 в мегакариоцитах и тромбоцитах, и, следовательно, он определяет агрегацию тромбоцитов у человека8);
- Высокие уровни андрогенов связаны с нарушениями менструального цикла в клинических исследованиях на здоровых женщинах.
Профилактика рака и риски для здоровья
- Тестостерон не оказывает негативного влияния при раке простаты. У людей, которые подверглись терапии лишения тестостерона, после чего этот гормон увеличивался выше уровня, отмечаемого при кастрации, выявлялось увеличение частоты распространения имеющегося рака простаты9).
- Последние исследования показали противоречивые результаты, касающиеся важности тестостерона в отношении поддержания здоровья сердечно-сосудистой системы. Тем не менее, поддержание нормального уровня тестостерона у пожилых мужчин, как выяснилось, улучшает множество параметров (увеличение мышечной массы тела, снижение массы висцерального жира, снижение уровня общего холестерина, гликемический контроль), которые, как полагают, могут помочь уменьшить риск сердечно-сосудистых заболеваний.
- Мужчины, чьи уровни тестостерона немного выше среднего, реже имеют высокое кровяное давление, а также менее подвержены сердечным приступам, ожирению, они также менее предрасположены к оценке состояния своего здоровья как удовлетворительного или плохого. Тем не менее, мужчины с высоким уровнем тестостерона склонны сообщать об одной или большем числе травм, более склонны потреблять пять или более алкогольных напитков в день, а также у них чаще встречается опыт заражения заболеваниями, передающихся половым путём, также они чаще курят.
Романтические отношения и отцовство
Влюбчивость понижает уровень тестостерона у мужчин, повышая при этом его уровни у женщин. Было выдвинуто предположение, что эти изменения уровней тестостерона приводят к временному снижению разницы поведений между полами10). Тем не менее, предполагается, что после окончания «фазы медового месяца» (от одного до трёх лет отношений) это изменение уровня тестостерона более не является очевидным. Отцовство также снижает уровни тестостерона у мужчин, предполагая эмоциональные и поведенческие изменения, которые способствуют отцовской заботе. Мужчины с более низким уровнем тестостерона более склонны быть в отношениях и / или жениться, а мужчины, у которых вырабатывается больше тестостерона, склонны к разводам11); тем не менее, причинно-следственная связь не может быть определена в этом отношении. Брак или обязательства могут вызвать снижение уровней тестостерона. Одинокие мужчины без опыта отношений имеют более низкие уровни тестостерона, чем одинокие мужчины с таким опытом. Предполагается, что эти одинокие мужчины с опытом являются более конкурентными, чем мужчины без опыта. Женатые мужчины, которые проводят время с супругом или ребёнком, имеют такие же уровни тестостерона, как и в случае, если бы они этим не занимались. В целом, эти результаты показывают, что наличие конкурентной активности больше, чем обязанности (обычно в семье), влияют на изменение уровней тестостерона. Мужчины с более высокими уровнями тестостерона более склоны участвовать во внебрачном сексе. Уровень тестостерона не зависит от физического присутствия партнёра у мужчин, находящихся в отношениях (например, в том же городе или нет), у этих мужчин отмечается схожий уровень тестостерон. Физическое присутствие необходимо для женщин, которые находятся в отношениях, для обеспечения взаимодействия с тестостероном партнёра; у женщин, чей партнёр проживает в одном с ними городе, отмечается более низкий уровень тестостерон, чем у тех, чей партнёр живёт в другом населённом пункте.
Тестостерон и сексуальное возбуждение
Было обнаружено, что когда тестостерон и эндорфины из эякулята спермы попадают в стенку шейки матки после полового акта, у женщины наблюдается всплеск уровня тестостерона, эндорфина и окситоцина; у мужчин после оргазма в ходе совокупления отмечается увеличение уровней эндорфина и окситоцина. Это является положительным фактором для физиологической среды женщины в отношении способности внутренних половых путей к зачатию, а затем благотворное влияние распространяется на развитие зародыша в предварительных эмбриональных стадиях, при этом также стимулируется чувство любви, желание; у мужчин отмечается проявление отцовской заботы (это единственный случай, когда окситоцин у мужчин конкурирует с этим же гормоном у женщин). Уровни тестостерона следуют циклу дня – ночи, достигая пика в начале каждого дня вне зависимости от сексуальной активности. Существует положительная корреляция между положительным опытом оргазма у женщин и уровнем тестостерона, где расслабление было ключевым фактором получения этого опыта. Не существует корреляции между тестостероном и мужском представлении о своём опыте получения оргазма; не существует корреляции между более высокими уровнями тестостерона и большей сексуальной уверенностью у обоих полов. Увеличение уровней тестостерона отмечается у мужчин и женщин, которые достигают оргазма с помощью мастурбации12).
Исследования на млекопитающих
Исследования, проведённые на крысах, показали, что степень их сексуального возбуждения чувствительна к снижению тестостерона. Когда у крыс, лишённых тестостерона, его уровень доводили до средних значений, их сексуальное поведение (совокупление, предпочтение партнёров и т.д.) восстанавливалось, но не тогда, когда им давали этот гормон в маленьких дозировках. Таким образом, эти млекопитающих могут быть моделью для изучения клинических популяций среди людей, страдающих от дефицита сексуального возбуждения, известного как гиполибидемия13). В одном исследовании, почти каждый исследованный вид млекопитающих показал заметное увеличение уровня тестостерона у самцов при встрече с новой самкой. Джейс П.Дж. и другие исследовали роль генотипа на так называемых рефлексивных увеличениях тестостерона у самцов мышей. Они также пришли к выводу, что эта реакция связана с начальным уровнем сексуального возбуждения у самца14). У приматов, как предполагается, тестостерон в период полового созревания стимулирует сексуальную мотивацию, которая позволяет приматам искать сексуальный опыт с самками, создавая сексуальные предпочтения у самок. Некоторые исследования также показали, что если тестостерон устранён у взрослого мужчины или другого самца-примата, его сексуальная мотивация снижается, однако не отмечается наличие соответствующего уменьшения способности заниматься сексуальной активностью (садка, эякуляция и др.).
Мужское сексуальное возбуждение
Более высокие уровни тестостерона связывают с периодами сексуальной активности, однако более высокие уровни тестостерона отмечались у менее сексуально активных людей15). Мужчины, которые смотрят фильмы сексуального содержания, обладают на 35% более высоким уровнем тестостерона, который достигает своего пика через 60-90 минут после окончания фильма; не отмечается никакого увеличения уровня гормона у мужчин, которые смотрят фильмы без сексуального содержания. Мужчины, которые смотрят фильмы с сексуальным содержанием, обладают повышенной мотивацией, конкурентоспособностью, а также пониженным истощением16). Предыдущие исследования нашли связи между расслаблением после сексуального возбуждения и уровнями тестостерона. Исследование от 2002 года показало, что уровень тестостерона увеличивался у гетеросексуальных мужчин после того, как они имели краткую беседу с женщиной. Повышений уровня тестостерона связано со степенью того, насколько сильно женщины пытались произвести на них впечатление17). Уровни тестостерона, гормона, который как известно, влияет на отношение мужчин к браку, могут меняться, в зависимости от того, с какой женщиной мужчина имеет контакт – с той, у которой происходит овуляция, или той, у которой её сейчас нет. Мужчины, которые контактировали с женщиной, вырабатывавшей «запах овуляции», обладали стабильными уровнями тестостерона, которые превышали аналогичные показатели у мужчин, которые контактировали с женщинами вне стадии овуляции. Уровни тестостерона и сексуального возбуждения подвержены сильному влиянию гормонального цикла у женщин18). Это может быть связано с гипотезой овуляционного сдвига19), в рамках которой самцы приспособлены реагировать на овуляции в рамках женского цикла для того, чтобы выявить момент, когда женщина наиболее способна к оплодотворению; в эти периоды женщины также выглядят лучше всего, являясь при этом наиболее расположенными к зачатию; эти оба фактора связаны с гормонами. В исследовании от 1991 года мужчины были подвержены визуальным или звуковым эротическим стимулам, после чего они должны были решить когнитивную задачу, где число ошибок в задании показывало, насколько сильно стимулы повлияли на расслабление участника. Был сделан вывод о том, что мужчины с более низким порогом сексуального возбуждения предрасположены к восприятию сексуальной информации, и тестостерон может влиять на повышение их внимания на соответствующие стимулы20). Теория конкуренции спермы: уровни тестостерона у самцов крыс увеличиваются в качестве реакции на ранее нейтральный стимул, когда условно он становился сексуальным. Эта реакция вызывала рефлексы пениса (например, эрекцию и эякуляцию), что помогало сперме быть более конкурентной в случаях, когда более одного самца участвовало в оплодотворении самки, что позволило выработать более качественную сперму, повысив, тем самым, вероятность зачатия.
Женское сексуальное возбуждение
Андроген может модулировать физиологию вагинальных тканей, способствуя сексуальному возбуждению у женщин21). Уровни тестостерона у женщин выше перед половым актом, чем перед объятьями, а также после полового акта, нежели после объятий. Существует эффект запаздывания в отношении генитального возбуждения при применении тестостерона. Кроме того, постоянное увеличение вагинального сексуального возбуждения может привести к увеличению сексуальных ощущений и сексуального аппетитивного поведения22). Когда у женщин отмечается более высокий исходный уровень тестостерона, они будут обладать более высокими уровнями сексуального возбуждения, но меньшими приростами тестостеронами, что указывает на эффект предела в отношении уровня тестостерона у женщин. Сексуальные мысли также меняют уровень тестостерона, но не уровень кортизола у женщин; гормональные контрацептивы могут оказывать влияние на изменение уровня тестостерона в ответ на сексуальные мысли. Тестостерон может оказаться эффективным в отношении лечения женских расстройств сексуального возбуждения. В настоящее время не существует одобренного FDA андрогенного препарата для лечения андрогенной недостаточности, тем не менее, их использовали не по назначению для лечения низкого либидо и сексуальной дисфункции у пожилых женщин. Тестостерон может быть лечебным у женщин в постменопаузе, пока у них эффективно вырабатывается эстроген23).
Поведение и личность
Уровни тестостерона играют важную роль в принятии финансовых решений, сопряжённых с риском24).
Головной мозг
 Так как тестостерон влияет на весь организм (часто за счёт эффекта увеличения: самцы имеют более большое сердце, лёгкие, печень и т.д.), головной мозг также подвержен этой «половой» дифференциации; фермент ароматазы превращает тестостерон в эстрадиол, который является ответственным за маскулинизацию головного мозга самцов мышей. У людей маскулинизация головного мозга плода (в ходе наблюдений половых предпочтений у пациентов с врождёнными заболеваниями формирования андрогенов или функций андрогенных рецепторов) связаны с функциональными андрогенными рецепторами.
Существуют некоторые отличия между мужским и женским головным мозгом (возможно, это результат различных уровней тестостерона) – одним из них является размер: мужской мозг, в среднем, больше женского. В исследовании от 2003 года, проведённом в Дании, у 20-летних мужчин были выявлены миелиновые волокна длиной 176000 километр, в то время как у женщин общая длина составила 149000 километров (примерно на 15% меньше)25).
Исследование от 1996 года не выявило никаких непосредственных краткосрочных эффектов на настроение или поведением при употреблении супрафизиологических дозировок тестостерона в течение 10 недель 43 здоровыми мужчинами. Другое исследование нашло корреляцию между тестостероном и терпимостью к риску при выборе карьеры у женщины26).
Литературные источники показывают, что внимание, память и ориентация в пространстве являются ключевыми когнитивными функциями, затрагиваемыми тестостероном. Предварительные данные свидетельствуют о том, что низкие уровни тестостерона могут быть рисковым фактором когнитивных отклонений и возможной деменцией типа Альцгеймера27); это является главным аргументом использования тестостерона в терапии по борьбе со старением. Большинство источников, тем не менее, предполагает криволинейную или даже квадратную связь между ориентацией в пространстве и циркулирующими уровнями тестостерона28), причём гипосекреция и гиперсекреция циркулирующих андрогенов негативно влияют на когнитивные свойства.
Так как тестостерон влияет на весь организм (часто за счёт эффекта увеличения: самцы имеют более большое сердце, лёгкие, печень и т.д.), головной мозг также подвержен этой «половой» дифференциации; фермент ароматазы превращает тестостерон в эстрадиол, который является ответственным за маскулинизацию головного мозга самцов мышей. У людей маскулинизация головного мозга плода (в ходе наблюдений половых предпочтений у пациентов с врождёнными заболеваниями формирования андрогенов или функций андрогенных рецепторов) связаны с функциональными андрогенными рецепторами.
Существуют некоторые отличия между мужским и женским головным мозгом (возможно, это результат различных уровней тестостерона) – одним из них является размер: мужской мозг, в среднем, больше женского. В исследовании от 2003 года, проведённом в Дании, у 20-летних мужчин были выявлены миелиновые волокна длиной 176000 километр, в то время как у женщин общая длина составила 149000 километров (примерно на 15% меньше)25).
Исследование от 1996 года не выявило никаких непосредственных краткосрочных эффектов на настроение или поведением при употреблении супрафизиологических дозировок тестостерона в течение 10 недель 43 здоровыми мужчинами. Другое исследование нашло корреляцию между тестостероном и терпимостью к риску при выборе карьеры у женщины26).
Литературные источники показывают, что внимание, память и ориентация в пространстве являются ключевыми когнитивными функциями, затрагиваемыми тестостероном. Предварительные данные свидетельствуют о том, что низкие уровни тестостерона могут быть рисковым фактором когнитивных отклонений и возможной деменцией типа Альцгеймера27); это является главным аргументом использования тестостерона в терапии по борьбе со старением. Большинство источников, тем не менее, предполагает криволинейную или даже квадратную связь между ориентацией в пространстве и циркулирующими уровнями тестостерона28), причём гипосекреция и гиперсекреция циркулирующих андрогенов негативно влияют на когнитивные свойства.
Агрессия и преступность
Большинство исследований поддерживает связь между взрослой преступностью и тестостероном, хотя эта связь является скромной, если рассматривать эту статистику отдельно для каждого пола. Практически все исследования связи преступности несовершеннолетних и тестостерона не показали никакой значимости. Большинство исследований показали, что тестостерон связан с поведением или личностными чертами, связанными с преступностью, например, антисоциальным поведением и алкоголизмом. Большинство исследований также были проведены в изучении связи агрессивным поведением / чувствами и тестостероном. Почти половина исследований нашла связь, однако другая половина исследований не выявила этой связи29). Тестостерон является одним из многих факторов, которые влияют на агрессию; эффекты предыдущего опыта и окружающих стимулов, как выяснилось, коррелируют более выраженно. Несколько исследований показали, что тестостерон, будучи производным эстрадиола (одна из форм эстрогена), может играть ещё более важную роль в мужской агрессии30). Эмпирически было показано, что мальчики, которые имели опыт высокой физической агрессии в возрасте от 6 до 12 лет, имели более низкие уровни тестостерона в 13 лет по сравнению с мальчиками без опыта высокой физической агрессии. Первая группа терпела неудачи в ходе учёбы в школе, а также была непопулярной среди своих сверстников. Одновременно проведённые продольные анализы показывают, что уровень тестостерона положительным образом связан с социальной успешностью, а не физической агрессией31). Исследование в Университете Цюриха и Royal Holloway в Лондоне с более чем 120 испытуемыми, показало, что половой гормон может стимулировать справедливое поведение. Для исследования испытуемые приняли участие в поведенческом эксперименте, где необходимо было принять решение о распределении денег. Правила позволяли разделить деньги справедливо и несправедливо. Партнёр по переговорам мог принять или отклонить предложение. Чем честнее было предложение, тем меньше была вероятность отказа партнёром. Если не было достигнуто никакого соглашения, ни одна из сторон ничего не зарабатывала. Испытуемые с искусственно увеличенным уровнем тестостерона предлагали более честные сделки, чем те, кто принимал плацебо, тем самым снижая риск отказа от их сделки к минимуму. Два последующих исследования подтвердили эти результаты32). Эстрадиол, как известно, коррелирует с агрессией у самцов мышей. Кроме того, превращение тестостерона в эстрадиол регулирует мужскую агрессию у воробьёв в периоды размножения33).
Медицинское применение
Основным применением тестостерона является лечение мужчин со слишком маленьклй естественной выработкой эндогенного тестостерона или полным её отсутствием; речь идёт о мужчинах с гипогонадизмом. В данном случае обсуждается заместительная гормональная терапия или заместительная терапия тестостероном (TRT), которая поддерживает уровень тестостерона в нормальном диапазоне. Помимо заместительной терапии, тестостерон выписывают для многих других целей. В качестве примеров приводятся снижение вероятности бесплодия, коррекция отсутствующего либидо или эректильной дисфункции, исправление остеопороза, способствование увеличению пениса, линейного роста, стимулирование костного мозга и ликвидация последствий анемии, а также стимулирование аппетита. К концу 1940-х годов тестостерон преподносился в качестве чудодейственного препарата по борьбе со старением (например, смотрите работу Пола де Крюи «Мужской гормон»)34). Снижение выработки тестостерона с возрастом привело к повышенному вниманию к заместительной терапии андрогенами. Тестостерон может использоваться в качестве монотерапии при дистимии и малой депрессии или в качестве дополнения к терапии при большой депрессии у мужчин среднего возраста с низким уровнем тестостерона. Тем не менее, обзор современной литературы не выявил статистически значимого влияния на настроение мужчин с нормальными уровнями тестостерона или настроение пожилых мужчин с низкими уровнями тестостерона35). Для того, чтобы испытать благотворное влияние от вирилизирующих эффектов, тестостерон часто применяют в отношении трансгендерных мужчин в рамках заместительной гормональной терапии, «целевым уровнем» которой является нормальный мужской уровень тестостерона. Точно так же, трансгендерным женщинам иногда назначают антиандрогены для снижения уровня тестостерона в организме и способствования выработке эффектов воздействия эстрогенов. Терапия тестостероном применяться для лечения сахарного диабета 2 типа36). Низкий уровень тестостерона также связан с развитием болезни Альцгеймера. Небольшое исследование от 2005 года показало смешанные результаты в отношении использования тестостерона для борьбы с проявлениями старения. Мужчины с пограничными уровнями тестостерона и сексуальной дисфункцией могут получить положительный эффект от использования тестостерона37).
Низкие уровни из-за старения
Уровень тестостерона постепенно снижается с возрастом. В 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) постановило, что ни благотворное влияние, ни безопасность тестостерона не были установлены в отношении низких уровней тестостерона в ходе старения38). FDA также потребовало, чтобы фармацевтические этикетки препаратов тестостерона включали предупреждающую информацию о возможности повышенного риска сердечных приступов и инсульта.
Недостаточность
Недостаточность тестостерона (также называется гипотестостеронемизмом или гипотестостеронемией) связана с аномально низкой выработкой тестостерона. Она может происходит из-за дисфункции яичек (первичный гипогонадизм) или гипоталамо-гипофизарной дисфункции (вторичный гипогонадизм); эти заболевания могут быть врождёнными или приобретёнными. Приобретённая форма гипотестостеронемизма представляет собой снижение уровня тестостерона, которое происходит из-за старения, иногда этот процесс ещё называют «андропаузой» у мужчин по аналогии со снижением уровня эстрогена у женщин в ходе менопаузы. В Западных странах средний уровень тестостерона снижается у людей всех возрастов39).
У женщин
Употребление тестостерона является эффективным в краткосрочной перспективе при гиполибидемии. В долгосрочной перспективе безопасность его употребления, тем не менее, не ясна40). Лечение низких уровней андрогенов тестостероном не рекомендуется в отношении женщин, когда это обосновано гипопитуитаризмом, надпочечниковой недостаточностью или хирургическим удалением яичников. Это также обычно не рекомендуется для улучшения когнитивных функций, риска сердечно-сосудистых заболеваний, прочности костей или общего благополучия.
Немедицинское использование
Спорт
 Тестостерон может использоваться спортсменами с целью повысить свою производительность, однако это принимается за допинг в большинстве видов спорта. Есть несколько методов применения тестостерона, в том числе на базе внутримышечных инъекций, трансдермальных гелей и пластырей, а также в виде имплантируемых таблеток. Употребление гормона приводит к более низкой метаболической выработке через явление Фаркухарсона, создавая при этом долгосрочную зависимости для улучшения уровня производительности.
Анаболические стероиды (включая тестостерон) также принимаются для усиления мышечного развития, силы и выносливости. Это обеспечивается напрямую, за счёт увеличения синтеза мышечного белка. В качестве результата, мышечные волокна становятся больше, восстанавливаясь быстрее, чем у обычного человека. После серии скандалов и публичность в 1980-е годы (например, в 1988 году Бен Джонсон повысил таким образом производительность на летних Олимпийских играх), запреты на анаболические стероиды были возобновлены, а также ужесточены большинством спортивных организаций. В 1990 году Конгрессом Соединённых Штатов тестостерон и другие анаболические стероиды были признаны «контролируемыми веществами» в рамках Закона о контроле анаболических стероидов41). Их использование рассматривается в качестве серьёзной проблемы в современном спорте, особенно учитывая то желание спортсменов и профессиональных лабораторий скрыть их использование от спортивных регуляторов. Применение стероидов было снова в центре внимания после убийства-самоубийства, совершённого в 2007 году Крисом Бенуа, однако не было выявлено никаких доказательств в отношении того, что одним из повлиявших факторов было использование стероидов.
Некоторые спортсменки могут естественным образом иметь более высокие уровни тестостерона, поэтому им могут намекнуть на «терапевтическое решение» данного вопроса, в том числе за счёт использования хирургического вмешательства или препаратов для снижения уровней тестостерона до такого уровня, чтобы они могли честно конкурировать с другими соперниками.
Тестостерон может использоваться спортсменами с целью повысить свою производительность, однако это принимается за допинг в большинстве видов спорта. Есть несколько методов применения тестостерона, в том числе на базе внутримышечных инъекций, трансдермальных гелей и пластырей, а также в виде имплантируемых таблеток. Употребление гормона приводит к более низкой метаболической выработке через явление Фаркухарсона, создавая при этом долгосрочную зависимости для улучшения уровня производительности.
Анаболические стероиды (включая тестостерон) также принимаются для усиления мышечного развития, силы и выносливости. Это обеспечивается напрямую, за счёт увеличения синтеза мышечного белка. В качестве результата, мышечные волокна становятся больше, восстанавливаясь быстрее, чем у обычного человека. После серии скандалов и публичность в 1980-е годы (например, в 1988 году Бен Джонсон повысил таким образом производительность на летних Олимпийских играх), запреты на анаболические стероиды были возобновлены, а также ужесточены большинством спортивных организаций. В 1990 году Конгрессом Соединённых Штатов тестостерон и другие анаболические стероиды были признаны «контролируемыми веществами» в рамках Закона о контроле анаболических стероидов41). Их использование рассматривается в качестве серьёзной проблемы в современном спорте, особенно учитывая то желание спортсменов и профессиональных лабораторий скрыть их использование от спортивных регуляторов. Применение стероидов было снова в центре внимания после убийства-самоубийства, совершённого в 2007 году Крисом Бенуа, однако не было выявлено никаких доказательств в отношении того, что одним из повлиявших факторов было использование стероидов.
Некоторые спортсменки могут естественным образом иметь более высокие уровни тестостерона, поэтому им могут намекнуть на «терапевтическое решение» данного вопроса, в том числе за счёт использования хирургического вмешательства или препаратов для снижения уровней тестостерона до такого уровня, чтобы они могли честно конкурировать с другими соперниками.
Обнаружение злоупотребления
Был разработан ряд методов для обнаружения того, что спортсмены употребляли тестостерон, большинство базируются на анализе мочи. Они включают показатель соотношения тестостерона к эпитестостерону (обычно значение меньше 6), показатель соотношения тестостерона к лютеинизирующему гормону, а также показатель соотношения углерода-13 к углероду-12 (фармацевтический тестостерон содержит меньше углерода-13, чем эндогенный тестостерон). В некоторых программах тестирования, история результатов человека может служить в качестве справочной информации для интерпретации подозрительных находок. Другой исследуемый подход базируется на обнаружении употреблённой формы тестостерон, обычно это сложный эфир, который находится в волосах42).
Побочные эффекты
В 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) постановило, что ни благотворное влияние, ни безопасность тестостероны не были установлены в отношении низких уровней тестостерона в ходе старения. FDA также потребовало, чтобы фармацевтические этикетки препаратов тестостерона включали предупреждающую информацию о возможности повышенного риска сердечных приступов и инсульта.
Сердечно-сосудистые заболевания
31 января 2014 года на базе сообщений об инсультах, сердечных приступов и смертей в ходе употребления мужчинами утверждённых FDA препаратов заместительной терапии тестостероном вынудило Управление по санитарному надзору за качеством пищевых продуктов и медикаментов объявить, что оно будет расследовать эти случаи. FDA требует указывать предупреждения на этикетках препаратов в отношении возможного развития тромбоза глубоких вен и эмболии лёгочной артерии. Побочные эффекта употребления добавок тестостерона могут включать увеличение побочных эффектов сердечно-сосудистой системы (включая инсульты и сердечные приступы), а также смертей; данные основываются на базе трёх рецензируемых исследований людей, принимавших препараты заместительной терапии тестостероном43). Кроме того, сообщается об увеличении на 30% смертей и сердечных приступов у пожилых людей. За счёт повышенного проявления побочных эффектов в отношении сердечно-сосудистых заболеваний по сравнению с группой плацебо, рандомизированное исследование «Тестостерон у пожилых мужчин и двигательные ограничения (TOM)», проведённое Национальным Институтом старения, было досрочно прекращено Комиссией по безопасности данных и мониторингу. 31 января 2014 года на базе сообщений об инсультах, сердечных приступов и смертей в ходе употребления мужчинами утверждённых FDA препаратов заместительной терапии тестостероном вынудило Управление по санитарному надзору за качеством пищевых продуктов и медикаментов объявить, что оно будет расследовать эти случаи44). Позже, а именно в сентябре 2014 году, FDA объявило в качестве результата «потенциального проявления побочных явлений со стороны сердечно-сосудистой системы» обзор целесообразности и безопасности заместительной терапии тестостероном (TRT). Вплоть до 2010 года исследования не показывали никакого эффекта на риск смерти, рак простаты или сердечно-сосудистые заболевания; более современные исследования, тем не менее, выразили озабоченность45). Исследование от 2013 года, опубликованное в журнале «Journal of the American Medical Association», показало, что «использование терапии тестостероном значительно связано с проявлением побочных эффектов». Исследование началось после предыдущего рандомизированного клинического испытания терапии тестостероном, которое было преждевременно остановлено «из-за побочных эффектов со стороны сердечно-сосудистой системы, что, как считается, было вызвано терапией тестостероном».
Рак
Тестостерон в условиях медленно растущей раковой опухоли, как предполагается, может увеличить темпы её роста. Тем не менее, связь между употреблением тестостерона и развитием рака простаты не доказана. Но, всё же, врачи предупреждают о риске развития рака в ходе употребления тестостерона. У различных этнических групп отмечаются различные показатели частоты развития рака простаты46). Разница в половых гормонах, включая тестостерон, как предполагается, является объяснением этих различий. Этот парадокс может быт разрешён за счёт того, что рак простаты является довольно распространённым явлением. При вскрытии, у 80% 80-летних мужчин отмечалось наличие рака простаты.
Другие
Другими значительными побочными эффектами употребления тестостерона являются ускорение роста уже существовавшего рака простаты у людей, которые подверглись лишению андрогенов; повышенный гематокрит, для лечения которого могут потребоваться венепункции; обострение апноэ сна. Побочные эффекты также могут включают незначительные побочные эффекты, включая акне и жирную кожу, а также значительную потерю волос или их уточнение; этот побочный эффект может быть предотвращён с помощью ингибиторов 5-альфа-редуктазы, которые обычно используются для лечения доброкачественной гиперплазии предстательной железы, они включают финастерид или дутастерид. Экзогенный тестостерон также может вызвать подавление сперматогенеза, что приводит в некоторых случаях к бесплодию47). Рекомендуется, чтобы врачи проводили скрининг рака простаты с помощью пальцевого ректального исследования и измерения уровня простат-специфического антигена (ПСА) перед началом терапии; мониторинг уровней ПСА и гематокрита должны проводиться в ходе терапии.
Беременность и кормление грудью
Тестостерон противопоказан при беременности и не рекомендуется к употреблению во время грудного вскармливания.
Биохимия
Биосинтез
Как и другие стероидные гормоны, тестостерон является производным холестерина. Первый шаг биосинтеза включает окислительное расщепление боковой цепи холестерина с помощью CYP11A, митохондриальной цитохром Р450-оксидазы с потерей шести атомов углерода, чтобы отдать прегненолон. На следующем этапе, два дополнительные атома углерода удаляются при помощи ферменты CYP17A в эндоплазматическом ретикулуме для того, чтобы получить различные стероиды C1948). Кроме того, 3-гидроксильная группа окисляется 3-бета-HSD для выработки андростендиона. В конце при стадии, лимитирующей скорость реакции, кетогруппа андростендиона C-17 уменьшается при помощи 17-бета гидроксистероиддегидрогеназы с целью получения тестостерона. Наибольшее количество тестостерона (более 95%) вырабатывается в яичках у мужчин. Он также синтезируется в гораздо меньших количествах у женщин в дуральных клетках яичников, плаценте и зоне сетчатой коры надпочечников; отмечается его выработка кожей у обоих полов. В яичках тестостерон вырабатывается в клетках Лейдига49). Мужские генеративные железы содержат клетки Сертоли, которым требуется тестостерон для сперматогенеза. Как и в случае с большинством гормонов, тестостерон поставляется в целевые ткани через кровь, где его большая часть связывается со специфическим плазменным белков и половым гормоном, связывающем глобулин (SHBG).
Регуляция
У мужчин тестостерон синтезируется, в первую очередь, в клетках Лейдига. Количество клеток Лейдига, в свою очередь, регулируется лютеинизирующим гормоном (ЛГ) и фолликулостимулирующим гормоном (ФСГ). Кроме того, количество тестостерона, вырабатываемого с помощью существующих клеток Лейдига, находится под контролем ЛГ, который регулирует экспрессию 17-бета гидроксистероиддегидрогеназы50). Часть синтезируемого тестостерона регулируется гипоталамо-гипофизарно-семенниковой осью. Когда уровни тестостерона являются низкими, гонадотропин-рилизинг-гормон (ГнРГ) высвобождается гипоталамусом, который, в свою очередь, стимулирует высвобождение ФСГ и ЛГ. Эти последние два гормона стимулируют яички с целью синтеза тестостерона. Наконец, повышение уровня тестостерона через отрицательное взаимодействие управляющего сигнала с гипоталамусом и гипофизом способствует ингибированию высвобождения ГнРГ и ФСГ / ЛГ соответственно. Факторы, влияющие на уровень тестостерона, включают:
- Потеря веса может привести к увеличению уровня тестостерона. Жировые клетки синтезируют фермент ароматазы, который превращает тестостерон (мужской половой гормон) в экстрадиол, который является женским половым гормоном.
- Секостероидный витамин D на уровне 400-1000 МЕ / сутки (10-25 мкг / сутки) повышает уровень тестостерона.
- Дефицит цинка понижает уровни тестостерона, однако чрезмерное его употребление не имеет никакого влияет на уровень тестостерона в сыворотке крови51).
- Дефицит витамина А может привести к неоптимальным плазменным уровням тестостерона.
- Соревнование превосходства может в некоторых случаях увеличить высвобождение тестостерона у мужчин.
- Старение уменьшает высвобождение тестостерона52).
- Гипогонадизм.
- Сон (фаза быстрого сна) увеличивает ночные уровни тестостерона.
- Тренировки на выносливость увеличивают уровни тестостерона. Тем не менее, у пожилых мужчин, это увеличение может быть предотвращено употреблением белков.
- Солодка. Активный компонент корня солодки глицирризиновая кислоты связана с незначительными снижениями уровней тестостерона. В отличие от этого, более современное исследование показало, что употребление солодки способствовало существенному снижению тестостерону у женщин.
- Естественный или искусственные антиадрогены, в том числе мятный чай, снижают уровень тестостерона53).
- Использование мощных невербальных проявлений через обращение к открытым, экспансивным позам может увеличить уровень тестостерона.
Метаболизм
Около 7% тестостерона распадается до 5альфа-дигидротестостерона (ДГТ) с помощью фермента цитохрома Р450 фермента 5альфа-редуктазы, фермента, который экспрессируется на высоком уровне в мужских половых органах и волосяных фолликулах. Около 0,3% тестостерона превращается в эстрадиол с помощью ароматазы (CYP19A1)54), фермент, который экспрессируется в головном мозге, печени и жировой ткани. ДГТ является более мощной формой тестостерона, в то время как эстрадиол оказывает совершенно другой эффект (феминизация) по сравнению с тестостероном (маскулинизация). Кроме того, тестостерон и дигидротестостерон могут быть деактивированы или очищены ферментами, которые гидроксилируются в позициях 6, 7, 15 или 16.
Механизм действия
Эффекты тестостерона в организме человек и других позвоночных проявляются путём двух основных механизмов: за счёт активации рецептора андрогенов (напрямую или в качестве ДГТ) или за счёт превращения в экстрадиол и активации определённых рецепторов эстрогена. Свободный тестостерон (Т) транспортируется в цитоплазму клеток тканей-мишеней, где он может связываться с рецептором андрогена или распадаться до 5альфа-дигидротестостерона (ДГТ) с помощью цитоплазматического фермента 5-альфа-редуктазы. ДГТ связывается с тем же андрогенным рецептором даже сильнее, чем тестостерон, так что его андрогенная активность в 5 раз превышает таковую у Т55). Комплекс Т-рецепторов или ДГТ-рецепторов подвергаются структурным изменениям, которые позволяют им перемещаться в ядро клетки и напрямую связываться непосредственно с конкретной нуклеотидной последовательностью хромосомной ДНК. Области связывания называются гормон-респонсивными элементами (ГРЭ), и они влияют на активность транскрипции определённых генов, проявляя андрогенные эффекты. Андрогенные рецепторы находятся в различных тканях позвоночных, мужчины и женщины реагируют одинаково на их влияние. Значительное отличаясь в количестве в пренатальном, пубертатном периодах, а также на протяжении жизни, они формируют биологические отличия между мужчинами и женщинами. Кости и головной мозг являются двумя важными тканями организма человека, в которых основное действие тестостерона проводится путём ароматизации в эстрадиол. В костях эстрадиол ускоряет окостенение хряща в кость, что приводит к закрытию эпифизов и завершению роста. В центральной нервной системе тестостерон также ароматизируется в эстрадиол. Эстрадиол, а не тестостерон является наиболее важным сигналом обратной связи в гипоталамусе (особенно затрагивая секрецию ЛГ). У многих млекопитающих пренатальная или перинатальная «маскулинизация» полового диморфизма областей головного мозга происходит под влиянием эстрадиола, полученного из тестостерона, что отсрочивает проявление мужского сексуального поведения.
Синтетические аналоги
Было разработано несколько синтетических аналогов тестостерона с улучшенными биологической доступностью и метаболическим периодом полураспада в сравнении с тестостероном. Большинство этих аналогов включают алкильную группу в позиции C-17 с целью предотвратить сопряжение и, следовательно, улучшить пероральную биологическую доступность. Их принято называть семейством «17-аа» (17-алкил андрогены); в их число входят флюоксиместерон и метилтестостерон.
Связанные препараты
Некоторые препараты косвенно нацелены на тестостерон в качестве способа лечения определённых состояний. Например, ингибиторы 5-альфа-редуктазы, такие как финастерид, ингибируют превращение тестостерона в дигидротестостерон (ДГТ), который является более мощным, чем тестостерон. Эти ингибиторы 5-альфа-редуктазы используются для лечения различных состояний, связанных с андрогенами, таких как андрогенная алопеция (облысение по мужскому типу), гирсутизм, доброкачественная гиперплазия предстательной железы (ДГПЖ) и рак предстательной железы. В отличие от этого, антагонисты ГнРГ связываются с рецепторами ГнРГ в гипофизе, блокируя высвобождение лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) из гипофиза56). У мужчин снижение ЛГ в дальнейшем приводит к быстрому подавлению высвобождения тестостерона из яичек. Антагонисты ГнРГ используются для лечения рака простаты.
Варианты употребления
 Существует множество вариантов употребления тестостерона. Доступные формы тестостерона для употребления человеком включают инъекции (такие как тестостерона ципионат или тестостерона энантат в масляном растворе), пероральное употребление, трансбуккальное употребление, трансдермальные кремы, гели и имплантируемые таблетки57). Назальные спреи находятся в стадии разработки.
Существует множество вариантов употребления тестостерона. Доступные формы тестостерона для употребления человеком включают инъекции (такие как тестостерона ципионат или тестостерона энантат в масляном растворе), пероральное употребление, трансбуккальное употребление, трансдермальные кремы, гели и имплантируемые таблетки57). Назальные спреи находятся в стадии разработки.
История
В одной из ранних работ по кастрации и трансплантации яичек у птиц Арнольда Адольфа Бертольда (1803-1861) действие яичек связывалось с циркулирующими фракциями крови (теперь под ними понимается семейство андрогенных гормонов). В 1889 году исследования по действия тестостерона получило кратковременный испульс, когда гарвардский профессор Шарль Эдуар Броун-Секар (1817-1894) в Париж самостоятельно ввёл подкожно «омолаживающий эликсир», состоявший из экстракта яичек собаки и морской свинки. В журнале The Lancet он сообщил о значительном восстановлении энергии и чувства благополучия, однако эффекты являлись преходящими, и надежды учёного на успех рухнули. После ученый отказался от своей работы над механизмами и эффектами последствий андрогенов на человеческий организм. В 1927 году профессор физиологической химии из Университета Чикаго Фред К. Кох получил доступ к крупному источнику яичек быков (скотные дворы Чикаго), после чего нанял студентов, желавших терпеть утомительную работы извлечения их изолятов. В тот год Кох и его студент Лемюэль МакДжи, получивший 20 мг вещества от источника в 40 фунтов бычьих яичек, выявили, что при введении его кастрированных петухам, свиньям и крысам происходила их ремаскулинизация58). В 1934 году группа Эрнста Лакера из Университета Амстердама очистила тестостерон из бычьих яичек таким же методом, однако изолирование гормона из животных тканей в количествах, позволявших провести серьёзное исследование на людях, не представлялось возможным до тех пор, пока в 1930-х годах три европейских фармацевтических гиганта, а именно Шеринг (Берлин, Германия), Органон (Осс, Нидерланды) и Сиба (Базель, Швейцария), не начали полномасштабные стероидные исследования. Компания «Органон» в Нидерландах стала первой компанией, изолировавшей гормон, зафиксировав этот факт в 1935 году в работе «О кристаллическом мужском гормоне из яичек (тестостерон)». Они назвали гормон тестостероном, собрав слово из английских слов testicle (русс. – яички) и sterol (русс. – стерол), добавив кетоновый суффикс. Структура была разработана сотрудником компании «Шеринг» Адольфом Бутенандтом59). Химический синтез тестостерона из холестерина был достигнут в августе того же года Бутенандтом и Ханищем. Только неделю спустя группа Сиба из Цюриха, а именно Леопольд Ружичка (1887-1976) и А. Веттштайн, опубликована их синтез тестостерона. Эти независимые частные процессы синтеза тестостерона на базе холестерина принесли в 1939 году Бутенандту и Ружичке Нобелевскую премию по химии. Тестостерон был идентифицирован как 17бета-гидроксиандрост-4-ен-3-она (C19H28O2), являясь твёрдым полициклическим спиртом с гидроксильной группой на 17 атоме углерода. Это также сделано очевидным факт, что возможно создание дополнительных модификаций на без синтезированного тестостерона, например, этерификацию и алкилирование. Проведённый в 1930-е годы частичный синтез сильнодействующих эфиров тестостерона позволил сформировать характеристику эффектов гормона, так что Кочакяну и Мурлин (1936 год) удалось показать, что тестостерон способствовал удержанию азота (механизм, являющийся центральным в отношении анаболизма) у собаки, после чего группа Аллана Кенона смогла показать анаболические и андрогенные эффекты тестостерона пропионата у мужчин и мальчиков с признаками евнухоидизма, а также женщин. Период с начала 1930-х годов до 1950-х годов называют «Золотым веком стероидной химии»60), работа в этом отношении была прогрессировала. Исследования, проведённые в этот период, доказали, что это новое синтезированное вещество (тестостерон) или, вернее, семейство соединений (многие производные были выработаны в период с 1940 по 1960 годы), являлось мощным мультипликатором мышц, силы и благополучия.
Общество и культура
В отношении производителей тестостерона ведётся несколько судебных исков из-за значительного повышения риска проявления инсульта и сердечного приступа у пожилых мужчин, принимающих добавки тестостерона.
:Tags
Читать еще: Ароматизация тестостерона , Лецитин соевый , Синдром Туретта , Фарестон (торемифен цитрат) , Флунаризин ,










