Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Капсаицин

Капсаицин – вещество, содержащееся в красном перце, и отвечающее за его жгучий вкус. Он является агонистом адреналиновых и TRPV1 рецепторов (как и Эводия рутоплодная), благодаря чему способен быстро повышать температуру тела. Капсаицин имеет небольшой потенциал в качестве жиросжигателя, умеренный потенциал в уменьшении воспалений, и спорный – в защите от раковых образований.
Краткая информация
Другие названия: экстракт чили, экстракт острого перца, ванилиламид 8-метил-6-ноненовой кислоты, капсаициноиды. Не следует путать с: пиперином (экстрактом чёрного перца).
Является:
- жиросжигающим средством
- пряностью
- средством для наращивания мускулатуры
- средством для повышения активности
Описание действия
Алкалоид, высокоселективный антагонист ваниллоидного рецептора TPRV1. После активации ноцицепторов TRPV1 в коже происходит приток ионов К + и Ca 2 + в клетку и высвобождение вазоактивных нейропептидов, вызывая расширение сосудов (эритему) и раздражение. Ноцицепторы кожи становятся менее чувствительными к раздражителям. Действие капсаицина, определяемое как „анестезия” связанная с ним деполяризация в результате закупорки синаптической передачи, отвечают за обезболивание. Изменения в ноцицепторах , вызванные капсаицином, обратимы (несколько недель). Препарат вводят местно с помощью трансдермальный системы. Высвобождение капсаицина из пластыря является линейным. В течение 1 ч абсорбция в кожу составляет 1% препарата. tmax составляет 20 мин после снятия пластыря (после 60–90 мин лечения), средний t1/2 – 130 мин.
Капсаицин: инструкция по применению
Лечение периферической невропатической боли у взрослых (не страдающих диабетом) в монотерапии или в сочетании с другими анальгетиками.
Противопоказания
Повышенная чувствительность к любому компоненту препарата. В случае случайного контакта кожи с капсаицином следует приложить к этому месту очищающий гель и подержать в течение 1 мин, затем снять остатки сухой марлей и промыть водой с мылом. В случае попадания в глаза или на слизистые оболочки немедленно промыть водой. Во время процедуры с применением пластыря следует контролировать артериальное давление, потому как под влиянием нарастающей боли оно может повышаться (в среднем <8 мм рт.ст.). в этом случае следует применить симптоматическое лечение (охлаждение, пероральные анальгетики, например, опиоиды короткого действия). У больных с нестабильной или плохо контролируемой артериальной гипертензией и недавно перенесёнными сердечно-сосудистыми событиями следует учитывать риск неблагоприятных сердечно-сосудистых реакций. Не следует применять патчи для лечения болезненной диабетической нейропатии. Очищающий гель может вызвать местные реакции кожи или раздражение глаз и слизистых оболочек. Не рекомендуется применять детям и подросткам.
Взаимодействие с другими препаратами
Нет данных в связи с незначительной и кратковременной абсорбцией.
Капсаицин: побочные эффекты
Очень часто боль и эритема в месте применения. Часто: зуд, папулы, везикулы, отек, припухлость, сухость в месте применения. Не очень часто: крапивница, парестезии, дерматит, раздражение, посинение кожи, периферические отеки, боль в конечностях, мышечные судороги, кожная сыпь, тошнота, кашель, раздражение горла, атриовентрикулярная блокада первой степени, тахикардия, сердцебиение, высокое кровяное давление, раздражение глаз, извращение вкуса, гипестезия, ощущение жжения, опоясывающий лишай. В случае передозировки (сильная боль, жжение, зуд в месте применения) следует немедленно удалить пластырь и применить симптоматическое лечение. Нет специфического антидота.
Беременность и лактация
Нет информации о применении в период беременности и лактации. Рекомендуется прервать грудное вскармливание в день процедуры.
Капсаицин: дозировка
Пластырь на сухую, неповреждённую, очищенную кожу (за исключением лица, над линией волос и на слизистых оболочках), с использованием нитриловых перчаток, должен накладывать врач или квалифицированный медицинский персонал. Следует оставить пластырь на коже в течение 30 минут на стопах (например, в полинейропатии, в результате заражения вирусом ВИЧ) или на 60 мин в других местах (опоясывающий герпес). При необходимости лечение можно повторить каждые 90 дней. В целях улучшения адгезии пластыря, вырезать волосы в месте применения (не брить), промыть это место водой с мылом, потом тщательно высушить. Чтобы уменьшить дискомфорт, сопровождающий терапию, следует обработать поверхность кожи под пластырь и 1-2 см вокруг анестетиком местного действия. В случае необходимости пластырь можно разрезать перед снятием защитной плёнки. После снятия пластыря следует применить большое количество очищающего геля, оставить на 1 минуту, затем вытереть остатки сухой марлей и промыть это место водой с мылом. Использованные пластыри должны быть помещены в контейнер для медицинских отходов.
Источники и структура
Источники
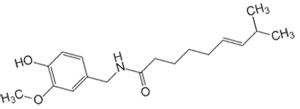 Капсаицин (E)-N-(4-гидрокси-3-метоксифенил)метил)-8-метил-6-ноненовой кислоты) – алкалоид, известен как капсаициноид, который чаще всего ассоциируется с перцем чили из семейства паслёновых (стручковый перец). Был открыт около 1500 года (благодаря его вкусовым свойствам), извлечён в 1846[2], в 1919 году описали его структуру, синтезировали в 1930. 1)
Изначально данный овощ (в особенности, род стручкового перца) назывался «чили» (от ацтекского слова tlacuilos), позже его стали называть красным перцем из-за схожести свойств с чёрным перцем, несмотря на то, что последний принадлежит к другому семейству (Перец чёрный). 2) Термин «Capsicum» неизвестного происхождения. Он мог произойти от греческого слова kapto (греч. кусать), что указывает на его острый вкус, или же от латинского слова caspa (лат. «коробка») из-за того, что внутренняя структура растения похожа на коробку.
Существует шесть известных видов капсаициноидов: капсаицин, дигидрокапсаицин, нордигидрокапсаицин, гомокапсаицин, гомодигидрокапсаицин и нонивамид. При рассмотрении основного механизма действия капсициноидов (активация канала рецепторов TRPV1), можно сказать, что нонивамид и капсаицин являются самыми мощными аналогами, за ними следует дигидрокапсаицин. 3)
Так же, как и куркумин (из куркуминоидов) и берберин (из протобербериновых алкалоидов), капсаицин является самой известной молекулой в скоплении молекул капсаициноидов. Из-за того, что капсаицин содержится по большей части в плодах перца, он известен как экстракт острого перца.
Существует еще одна подгруппа молекул, в чём-то похожих на капсаициноиды, содержащиеся в сладком перце (CH-19, экстракт сладкого перца, культура стручкового перца с низким уровнем жгучестью); это каспиатовые соединения, такие как каспиат, дигидрокаспиат и нордигидрокаспиат. Несмотря на то, что они не обладают теми же вкусовыми свойствами, каспиаты также повышают температуру тела и замедляют процесс набора жира у грызунов. В исследованиях, проведённых на людях, пероральный приём CH-19 или выделенного капсаицина повысил потребление кислорода (признак повышения скорости обмена веществ). Сладкий перец не содержит классических капсаициноидов, но в нём имеются похожие соединения каспиатов, являющихся биоэквивалентными. 4)
Капсаицин (E)-N-(4-гидрокси-3-метоксифенил)метил)-8-метил-6-ноненовой кислоты) – алкалоид, известен как капсаициноид, который чаще всего ассоциируется с перцем чили из семейства паслёновых (стручковый перец). Был открыт около 1500 года (благодаря его вкусовым свойствам), извлечён в 1846[2], в 1919 году описали его структуру, синтезировали в 1930. 1)
Изначально данный овощ (в особенности, род стручкового перца) назывался «чили» (от ацтекского слова tlacuilos), позже его стали называть красным перцем из-за схожести свойств с чёрным перцем, несмотря на то, что последний принадлежит к другому семейству (Перец чёрный). 2) Термин «Capsicum» неизвестного происхождения. Он мог произойти от греческого слова kapto (греч. кусать), что указывает на его острый вкус, или же от латинского слова caspa (лат. «коробка») из-за того, что внутренняя структура растения похожа на коробку.
Существует шесть известных видов капсаициноидов: капсаицин, дигидрокапсаицин, нордигидрокапсаицин, гомокапсаицин, гомодигидрокапсаицин и нонивамид. При рассмотрении основного механизма действия капсициноидов (активация канала рецепторов TRPV1), можно сказать, что нонивамид и капсаицин являются самыми мощными аналогами, за ними следует дигидрокапсаицин. 3)
Так же, как и куркумин (из куркуминоидов) и берберин (из протобербериновых алкалоидов), капсаицин является самой известной молекулой в скоплении молекул капсаициноидов. Из-за того, что капсаицин содержится по большей части в плодах перца, он известен как экстракт острого перца.
Существует еще одна подгруппа молекул, в чём-то похожих на капсаициноиды, содержащиеся в сладком перце (CH-19, экстракт сладкого перца, культура стручкового перца с низким уровнем жгучестью); это каспиатовые соединения, такие как каспиат, дигидрокаспиат и нордигидрокаспиат. Несмотря на то, что они не обладают теми же вкусовыми свойствами, каспиаты также повышают температуру тела и замедляют процесс набора жира у грызунов. В исследованиях, проведённых на людях, пероральный приём CH-19 или выделенного капсаицина повысил потребление кислорода (признак повышения скорости обмена веществ). Сладкий перец не содержит классических капсаициноидов, но в нём имеются похожие соединения каспиатов, являющихся биоэквивалентными. 4)
Структура и свойства
Капсаицин растворим только при температуре воды, равной или выше 52°C. 5)
Шкала Сковилла и вкусовые свойства
Острый перец (в особенности его острота) измеряется по шкале Сковилла, названной так в честь ученого Уилбура Сковилла. 6) Чтобы определить количество капсаицина в перце, используется высокоэффективная жидкостная хроматография. Субъективное ощущение жгучести измеряется по шкале Сковилла. Оценочная шкала Сковилла базируется на разбавлении. Оценка жгучести зависит от процентного разбавления вещества в алкоголе, чтобы на языке не ощущалось жгучести. Вещество в 50,000 сковиллей должно быть разбавлено в концентрации 1:50,000, чтобы на языке не оставалось ощущения жгучести, в то время как 100,000 сковиллей означает, что необходима концентрации 1:100,000. Оценка жгучести по шкале Сковилла означает то, насколько сильно нужно разбавить вещество, чтобы не было ощущения жгучести, большее значение означает большую жгучесть (так как необходима большая концентрация спирта, чтобы вещество потеряло свои свойства). Человеческий язык может обнаружить признаки капсаицина в такой низкой концентрации, как 0.1-1 мкг/мл. Для того, чтобы капсаицин был на вкус «жгучим» и «горячим», необходима концентрации в 10-100 мкг/мл. 7)
Фармакология
Метаболизм
В основном капсаицин метаболизируется с помощью печёночных ферментов CYP450 и ферментов класса карбоксилэстеразы, и производит большое количество побочных продуктов, проходя через алкильные, ароматические и амидные метаболические пути. Из-за метаболических изменений в ванилоидном кольце и гидрофобной алкильной боковой цепи, его метаболиты обладают меньшим потенциалом на рецепторах VR1. В капсаицине содержится большое количество «электрофильных» метаболитов, которые могут вступать в связь с печёночными ферментами и протеинами с помощью реакционно-способной окиси арены (ароматического соединения) или хенонметидной группы. 8)
Ферментные взаимодействия
In vitro, капсаицин ингибирует CYP3A4 при IC50 = 21 мкм, в то время как другие капсаициноиды (капсиат, дигидрокапсиат и нордигидрокапсиат) не в состоянии ингибировать CYP3A4. CYP3A4 является главным ферментом метаболизма лекарственных препаратов в печени, составляя 30-40% всех ферментов группы P450 (в названии которых имеется приставка CYP-), и его ингибиторы продлевают период воздействия препаратов на организм (что определяется с помощью измерения средней концентрации в моче). В исследованиях, проведённых на крысах, капсаицин (в дозе 3-25 мг/кг перорально), принимаемый в течение недели до статина, (известного как симвастатин, в основном метаболизируется с помощью CYP3A49), а также в небольшой степени CYP2C8) способен уменьшить среднюю концентрацию симвастатина в моче на 67.06-77.49%. Было предположено, что ферментная индукция является реакцией на ингибирование. Несмотря на то, что изначально капсаицин взаимодействует с CYP3A4 (через игнибирование), фермент адаптируется и пролиферируется спустя неделю после инъекций капсаицина. В результате активность CYP3A4 повышается, а процесс выведения лекарства из организма ускоряется.
Молекулярные мишени
Рецепторы транзитного потенциала (TRP)
TRPV (рецепторы транзитного потенциала по ванилоиду; ванилоидные рецепторы) являются молекулярными мишенями, проводниками катионов. 10) Изначально эти рецепторы были названы ванилоидными, так как они реагируют на ванилоидные вещества (есть четыре типа таких веществ: капсаициноиды, ресинифераноиды, ненасыщенные диальдегиды, а также трифенил-фенолы). Когда были открыты лиганды, не являющиеся ванилоидными веществами, ванилоидные рецепторы стали называть рецепторами транзитного потенциала по ванилоиду. Капсаицин является их специфическим агонистом. TRPV1 канал чувствителен к теплу (при температуре выше 48°C), и данная особенность служит молекулярным объяснением термотерапии. Капсаицин понижает порог, необходимый для активации этого канала, поэтому при капсаицине TRPV1 активируется при комнатной температуре.11) Другими факторами, которые сенсибилизируют TRPV1 рецепторы, являются кислотность (низкое значение pH) и воспаление (негативные последствия гиперальгезии), так же, как и эндогенные лиганды лейкотриена B4 и 15(S)-12-гидроксиэйкозатетраеновая кислота. Капсаицин сенсибилизирует TRPV1, кальциевый канал, активируемый теплом. В присутствии капсаицина количество необходимого тепла для активизации TRPV1 понижается с 48°C до комнатной температуры. Активизация TRPV1 запускает кальциевый инфлюкс, а так как кальциевый инфлюкс, направленный внутрь клетки, является достаточно мощной сигнальной трансдукцией, TRPV1 обладает широким спектром механизмов действия. Данный кальциевый инфлюкс, исходящий из TRPV1, медиирует улучшения, относящиеся к капсаицину, в упражнениях на выносливость (с помощью митохондриального биосинтеза и образования окислительных волокон по первому типу), образовании окислительных волокон по первому типу (с помощью активации гена PGC-1α), митохондриальном биогенезе (с помощью активации гена PGC-1α), мышечном белковом синтезе (с помощью активации мишени рапамицина), адреналиновой секреции из надпочечных желез12) (а также β-адренергической стимуляции и скорости метаболизма13)). Активация TRPV1, приводящая к внутриклеточному кальциевому инфлюксу, лежит в основе большинства полезных свойств капсаицина. Отмечается 50% повышение регуляции TRPV1 в мышечных клетках, в ответ на длительную диетотерапию (0.01% капсаицина на протяжении четырёх месяцев), уровень других протеинов, на которые оказывает влияние TRPV1 (включая PGC-1α), оказался повышенным. Более высокие дозировки капсаицина (инъекции 50 мг/кг) повышают регуляцию рецептора на 40%, эффект проявляется в пределах одних суток. Количество рецепторов TRPV1 снижается при пролиферации адипоцитов и липогенезе. При меньшей экспрессии TRPV1, капсаицин менее эффективен в высвобождении внутриклеточного кальция.14) Известно, что у людей, имеющих лишний вес, наблюдается меньшее количество TRPV1 в их висцеральный и подкожной жировой клетчатке (жировая ткань, 14% и 72%, в зависимости от худобы), и механизмы действия капсаицина (стимуляция симпатической нервной системы) менее эффективны у людей с лишним весом. Было проведено исследование на мышах, где дополнительно к диете был добавлен длительный курс капсаицина, что предотвратило снижение количества TRPV1 рецепторов. В нормальной контрольной группе длительный курс капсаицина повысил содержание рецепторов TRPV1. Активация TRPV1 рецептора в поджелудочной железе способствует выработке провоспалительных цитокинов, которые воздействуют на сам TRPV1, улучшая дальнейшую сигнальную трансдукцию; этот процесс был назван «упреждающим эффектом» (он противоположен обратной связи).15) В отличие от большинства взаимодействий лекарств с рецепторами, которым свойственна десенсибилизация и отрицательная обратная связь для достижения некоторой регуляции, взаимодействие капсаицина с TRPV1 рецептором известно своим упреждающим эффектом (усиливающим) и пролиферацией рецепторов, что, по сути, является противоположностью рецепторной десенсибилизации.
STAT-протеины
Передатчик сигнала и активатор транскрипции (STAT), в особенности STAT3, является молекулярной мишенью терапии рака вследствие того, что он вовлечён в выживание клеток, пролиферацию, химиорезистентность и ангиогенез. Он активируется таким фактором, как интерлейкин 6, затем активирует янус-киназы (JAK) и src-киназы, формируя димер и влияя на генетическую сигнальную трансдукцию.16) Капсаицин ингибирует коституитивную и индуцибельную активацию STAT3 (посредством интерлейкина 6), не оказывая воздействия на STAT5,17), благодаря чему он подавляет активацию генных продуктов, зависящих от STAT3, таких как циклин D1, Bcl-2, Bcl-xL, сурвивин, а также фактор роста эндотелия сосудов VEGF. Данное ингибирующее действие проявляется при дозировке капсаицина в 50 мкм, не затрагивая содержание белка в STAT3, и обуславливается истощением внутриклеточных запасов GP130 (капсаицин при дозировке в 100 мкм усиливает эндоплазматический ретикулум и способствует редукции GP130; уровни GP130 коррелируют с активностью STAT3). Капсаицин является ингибитором STAT3, хотя низший порог необходимой для этого дозировки (50 мкм) заметно выше, чем нужно для стимуляции TRPV1 (1 мкм). Практическая ценность STAT3 не выяснена до сих пор. По меньшей мере одно исследование доказало обратный эффект, где капсаицин (100 мкм в раковых клетках SW480) привел к активации STAT3, и последующему улучшению перегруппировки и инвазивного потенциала клеток. Капсаицин потенциально способен активировать STAT3, но детали активации и ингибирования STAT3 являются неизученными.
Рецепторы нейрокининов
Капсаицин фосфорилирует регулируемую внеклеточными сигналами киназу в сенсорные нейроны, что эффективно предотвращается блокировкой NK1 рецептора (нейрокинина)18), несмотря на то, что NK2 рецептор медиирует эффекты капсаицина в дорсальных корешковых ганглиях. Капсаицин также высвобождает субстанцию Р, которая оказывает воздействие на NK1 рецепторы, фосфорилируя регулируемую внеклеточными сигналами киназу.19) Данная стимуляция лежит в основе способности капсаицина индуцировать фактор роста нервов (NGF), вторично после фосфорилирования регулируемой внеклеточными сигналами киназы. Капсаицин стимулирует рецепторы нейрокинина, возможно, из-за увеличения секреции субстанции Р (являющейся лигандом NK1 и NK2); данное свойство проявляется независимо от TRPV каналов.
Воздействие на организм
Неврология
Анальгезия
Капсаицин может воздействовать на невропатическую боль, усиливая её, так как улучшает сигнальную трансдукцию через TRPV1. TRPV1 – позитивный модулятор невропатической боли. Улучшение сигнальной трансдукции (воспаление, кислотность, действие капсаицина) и пролиферация TRPV1 рецепторов20) ведут к усугублению невропатической боли.
Аппетит
Приём капсаицина способствовал уменьшению количества потребляемой пищи у мышей, которые содержались на богатой жирами диете, а также у мышей в контрольной группе (дозировка не уточняется). Данный эффект исчез после десяти дней перорального приёма капсаицина.21) Капсаицин способен уменьшить количество потребляемой пищи грызунами, но теряет свою эффективность примерно в течение недели. Уменьшение количества принимаемой пищи и субъективного ощущения аппетита наблюдалось и у людей при потреблении красного перца (6-10 г), что объясняется β-адренергической стимуляцией, а приём 750 мг капсаицина здоровыми людьми (даже после устранения его жгучести) уменьшил количество потребляемой пищи на 8,1-8,5%; в первую очередь уменьшился приём жиров (на 13,3-15,5%). Также было отмечено относительное уменьшение потребления жиров при употреблении перца. Уменьшение аппетита было подтверждено при употреблении капсаицина и острого перца (содержащего капсаицин), но все исследования проводились в течение короткого времени.
Здоровье сердечнососудистой системы
Частота сердцебиений
Приём 150 мг капсаицина за час до малоинтенсивной активности (в том числе, отдыха) не повышает частоту сердцебиений у здоровых людей.
Скорость метаболизма
Капсаицин стимулирует скорость метаболизма, на фоне β-адренергической активности, что связывают с выделением катехоламина (адреналина) надпочечными железами. Выделение катехоламина надпочечными железами берёт начало в активации TRPV1 под воздействием капсаицина. Потребление 10 г красного перца улучшает скорость метаболизма в течение 30 минут после еды (не оказывая никакого значимого эффекта в последующие 120 минут), что происходит вследствие β-адренергической стимуляции, так как данный эффект пропадал при приёме пропранолола Капсаицин влияет на TRPV1 рецепторы в надпочечных железах, способствуя выделению адреналина, а повышение уровня адреналина непосредственно повышает скорость метаболизма, воздействуя на β-адренергические рецепторы в жировых клетках.22)
Окисление жиров
Окисление жиров (процентное содержание потраченных калорий, взятых из жирных кислот, а не из других субстратов, например, глюкозы) повышается после приёма капсаицина крысами; максимальная эффективность достигается при дозировке в 10 мг/кг перорально, на фоне адреналиновой секреции.23) 150 мг капсаицина за час до малоинтенсивных упражнений повышает окисление жиров в здоровом человеческом организме (при отсутствии дополнительных тренировок). Окисление жиров повышается после перорального приёма капсаицина, что было доказано в исследованиях на людях, принимающих стандартные дозировки капсаицина.
Термогенез
Капсаицин способствует выделению тепла посредством нейронной стимуляции24). Возможно, это происходит благодаря нейронам, экспрессирующим VR1 рецепторы. Похоже, что повышение тепла косвенно происходит через β-адренергическую стимуляцию. Данные эффекты наблюдались также при приёме капсиата, нежгучего капсаициноидного вещества.
Липогенез
 Жировые клетки (адипоциты), включая 3T3-L1 адипоциты, экспрессируют TRPV1.
В изолированных 3T3-L1 адипоцитах, капсаицин проявляет активность при 10 нМ, максимальная активность достигается при 1000 нМ (1 мкм). Максимальная активность капсаицина после 8 дней снижает массу жировых клеток на 62 процента от контрольной массы во время липогенеза, одновременно снижая активность синтазы жировых кислот (на 91%). Капсаицин не оказывает никакого воздействия на организм мышей без TRPV1 рецептора.
При содержании мышей на диете, богатой жирами, при одновременном приёме капсаицина (дозировка не уточняется), было отмечено эффективное предотвращение ожирения на протяжении 120 дней; значительного изменения в количестве употребляемой пищи замечено не было. Данный эффект не наблюдался при отсутствия у мышей TRPV1 рецептора.
Похоже, что капсаицин может применяться как средство против ожирения, своим действием предотвращая аккумуляцию триглицеридов в жировых клетках. Это свойство проявляется при низких концентрациях капсаицина, что позволяет принимать его в качестве пищевой добавки.
Жировые клетки (адипоциты), включая 3T3-L1 адипоциты, экспрессируют TRPV1.
В изолированных 3T3-L1 адипоцитах, капсаицин проявляет активность при 10 нМ, максимальная активность достигается при 1000 нМ (1 мкм). Максимальная активность капсаицина после 8 дней снижает массу жировых клеток на 62 процента от контрольной массы во время липогенеза, одновременно снижая активность синтазы жировых кислот (на 91%). Капсаицин не оказывает никакого воздействия на организм мышей без TRPV1 рецептора.
При содержании мышей на диете, богатой жирами, при одновременном приёме капсаицина (дозировка не уточняется), было отмечено эффективное предотвращение ожирения на протяжении 120 дней; значительного изменения в количестве употребляемой пищи замечено не было. Данный эффект не наблюдался при отсутствия у мышей TRPV1 рецептора.
Похоже, что капсаицин может применяться как средство против ожирения, своим действием предотвращая аккумуляцию триглицеридов в жировых клетках. Это свойство проявляется при низких концентрациях капсаицина, что позволяет принимать его в качестве пищевой добавки.
Скелетные мышцы и физическая результативность
Гипертрофия
Известно, что нейрональная синтаза оксида азота (нейрональная NO-синтаза, находящаяся в сарколемме мышц25)) активируется в ответ на механический стресс, приводя к активации TRPV1 (тоже находится в сакролемме26)), который, в свою очередь, активируется пероксинитритом (субстанцией оксида азота и супероксида, медиируемой ферментом NADPH-оксидазы 4 (NOX4)), и является причиной кальциевого инфлюкса. Данный кальциевый инфлюкс индуцирует синтез мышечного белка с помощью активации мишени рапамицина. Блокировка нейрональной синтазы оксида азота преуменьшает (но не останавливает) мышечный рост, не взаимодействуя с воспалением, составом волокна, и не укрепляет клетки-сателлиты. Во время исследований пути цГМФ (активация с помощью оксида азота, воздействия на цГМФ рецептор, производство цГМФ), не было обнаружено никаких доказательств, что этот путь отвечает за синтез мышечного белка. Несмотря на то, что оксид азота непосредственно оказывает воздействие на TRPV каналы, 27) секвестрация пероксинитрита отменяет наблюдаемые полезные свойства (что свидетельствует о том, что оксид азота оказывает воздействие исключительно с помощью пероксинитрита), а отмена NADPH-оксидазы 4 (NOX4) предотвращает гипертрофию, вызванную упражнениями; ингибирование нейрональная NO-синтазы, секвестрация пероксинитрита, а также ингибирование NADPH-оксидазы 4 (NOX4) могут быть обойдены с помощью прямой стимуляции TRPV1 с помощью капсаицина (инъекции дозировкой в 10 мкм мышам), активируя мишень рапамицина, не затрагивая АМФ-зависимую киназу, протеинкиназу В и киназу гликогенсинтазы 3. Сокращение мышц вызывает синтез мышечного белка. По-видимому, один из этих путей, который вызывает синтез мышечного белка в ответ на физическую нагрузку, содержит сигнальную трансдукцию оксида азота через TRPV1. Капсаицин является прямым активатором TRPV1 и способен стимулировать синтез мышечного белка, несмотря на присутствие ингибиторов окисления в клетках.
Биоэнергетика
Митохондриальный фактор гена PGC-1α в активном состоянии может изменять скелетные мышцы, на фоне возросшего потребления энергии и изменения типа мышц от второго к первому типу; обычно это является следствием внутриклеточной кальциевой сигнальной трансдукции после физических нагрузок28). В связи со способностью капсаицина вызывать кальциевый инфлюкс через TRPV1, были проведены исследования его взаимодействия с геном PGC-1α. В соответствии с вышеизложенной теорией, применение 100 нм капсаицина к культуре мышечных клеток повышает активацию гена PGC-1, делая её зависимой от кальциевого инфлюкса. Механистически, активация TRPV1 рецептора капсаицином активирует также и ген PGC-1α, который регулирует митохондриальный биосинтез и пролиферацию. Применение лекарства во время разгрузок или же одноразовое применение капсаицина (инъекции дозировкой в 10 мкм) не оказали никакого эффекта на состав мышечной ткани, в то время как потребление капсаицина мышами в дозировке 0,01% с пищей в течение четырёх месяцев без сопутствующих силовых упражнений вызвало повышение окислительных мышечных волокон первого типа, по сравнению с волокнами второго типа. Длительный приём капсаицина активирует мышцы первого типа (оксидативность), кратковременное же применение не оказывает такого эффекта.
Физическая результативность
Пероральный приём вплоть до 10 мг/кг капсаицина (мышами) вызывает дозозависимое улучшение в выполнении плавательных упражнений, что обуславливается повышением выработки адреналина, которая возникает только спустя 2 часа после разового приёма (на 60 и на 180 минутах – никакого эффекта). Доза 15 мг/кг капсаицина не оказала никакого влияния на мышей, но оказалась достаточной для крыс.29) Данное улучшение в выполнении упражнений ассоциируется с повышением количества жирных кислот и катехоламинов в плазме, и не влияет на мышей, у которых отсутствуют надпочечные железы. В связи с повышением секреции адреналина из надпочечных желез, капсаицин повышает выносливость во время выполнения упражнений грызунами. Капсаицин (0,01%, принимаемых с пищей в течение четырёх месяцев) способен повысить выносливость мышей (никак иначе не тренируемых) во время выполнения беговых упражнений; это происходит из-за повышения концентрации митохондрий и увеличения содержания мышц первого типа, и не возникает у мышей, не имеющих TRPV1. Капсаицин улучшает выносливость у мышей во время выполнения упражнений, вследствие активации TRPV1, которая вызывает пролиферацию митоходрий в мышечных тканях (см. отдел Биоэнергетика). Требуется длительный период времени, чтобы данный эффект проявился, разового приёма недостаточно.
Взаимодействия с системой органов
Желудок
В исследовании, проведённом на новорожденных крысах, приём капсаицина способствовал ульцерогенезу (образованию язв), что, по-видимому, обуславливается нейродегенерацией в желудке30), так как данные нейроны являются гастропротекторными. Висцеральная гиперчувствительность – это феномен, при котором ответные реакции на различные стимулы (химические, механические или температурные) усиливаются сверх нормальных уровней. Висцеральная гиперчувствительность – это основная причина расстройства пищеварения, не связанного с язвообразованиями в желудке. Считается, что капсаицин может быть использован с целью выявления гиперчувствительности, так как его применение вызывает раздражение у здорового организма, в случаях же применения лицами с расстройствами пищеварения возникает гиперчувствительность.31) В некоторых исследования было выдвинуто предположение, что капсаицин эффективнее плацебо в выявлении гиперчувствительности. Из-за гиперчувствительности к капсаицину в желудке человека с расстройством пищеварения, не относящегося к язвам, но относящегося к висцеральной гиперчувствительности, капсаицин может служить средством, выявляющим вышеназванную гиперчувствительность.
Надпочечные железы
Вливание 200 мкг/кг капсаицина крысам, находящимся под наркозом, вызвало адреналиновую секрецию из надпочечных желез, практически без выделения норадреналина.32) Стимуляция TRPV1 вызывает адреналиновую секрецию двухфазным способом[64], что было показано in vivo с помощью капсаицина, а также других ванилоидов, таких как 10-шогаол, извлекаемый из имбиря. Активация канала TRPA1 вызывает адреналиновую секрецию аналогичным способом. Периодически капсаицин стимулирует адреналиновую секрецию из надпочечных желез на фоне стимуляции TRPV1. Капсаицин способен подавить неврогенную ответную реакцию на адреналиновую секрецию, но является неэффективным в случае с ответной реакцией не неврогенной природы. Повышение уровня адреналина впоследствии инсулинового стресса (из-за гипогликемии) и стресса от низкой температуры можно ослабить или устранить с помощью приема капсаицина33), уменьшив уровень чувствительности надпочечных желез по отношению к данным стимулам. Данное ингибирование секреции катехоламина при использовании стимуляторов подавляется при IC50 в 9,5 мкм (карбохолин), 11,8 мкм (вератридин), а 62 мкм (высокий уровень калия) и базальный синтез катехламина уменьшаются при 10,6 мкм в зависимости от ДОФА-декарбоксилазы; эти механизмы действуют в основном независимо от TRPV1 и кальциевых каналов. Капсаицин оказывает ингибирующий эффект на адреналиновую секрецию в надпочечных железах, что обуславливается десенсибилизацией нейронов в данном органе, так что они проявляют меньшую реакцию на те стимулы, которые бы в обычном состоянии вызвали адреналиновую секрецию. Механизм действия неизвестен, но никак не связан с TRPV1.
Взаимосвязь с раковым метаболизмом
Канцерогенность
 Один из механизмов действия, с помощью которого капсаицин может способствовать развитию рака и росту опухолей, заключается в ингибировании фермента CYP450-2E1, препятствующего метаболизму определенных канцерогенов (винил карбамат, димитил-нитрозамин) в токсические метаболиты.34) Несмотря на это, аналогичный механизм действия может оказаться эффективным против других канцерогенов, биологически активируемых ферментами P450.35)
Похоже, что капсаицин обладает другими канцерогенными эффектами, будучи соединенным с некоторыми канцерогенами в той дозировке, в которой он применяется в качестве пищевой добавки.
Один из механизмов действия, с помощью которого капсаицин может способствовать развитию рака и росту опухолей, заключается в ингибировании фермента CYP450-2E1, препятствующего метаболизму определенных канцерогенов (винил карбамат, димитил-нитрозамин) в токсические метаболиты.34) Несмотря на это, аналогичный механизм действия может оказаться эффективным против других канцерогенов, биологически активируемых ферментами P450.35)
Похоже, что капсаицин обладает другими канцерогенными эффектами, будучи соединенным с некоторыми канцерогенами в той дозировке, в которой он применяется в качестве пищевой добавки.
Антиканцерогенность
Капсаицин обладает защитным эффектом против рака лёгких, который вызывается полициклическими ароматическими углеводородами, такими как нафталин и ННК (главный нитрозамин в сигаретном дыме36)). Данный эффект может быть обусловлен уменьшением активности P450, так как данные канцерогены непосредственно биологически активируются этими веществами, а не нейтрализуются.
Воздействие холода
Похоже, что повышение адреналина из надпочечных желез в плазме, которое наблюдалось у крыс, подвергнутых стрессу из-за холода, было устранено с помощью предварительного приёма капсаицина.
Безопасность и токсикология
Общая информация
Капсаицин признан полностью безопасными для применения в пищу.37) Во время исследований острой пероральной токсичности капсаицина, была выявлена 50-процентная летальная дозировка при пероральном приёме, которая равнялась 161.2 мг/кг (для крыс) и 118.8 мг/кг (для мышей). При инъекциях капсаицина требуется меньшая дозировка (0,58 мг/кг и 1,6 мг/кг).
Случаи из практики
По меньшей мере, известно об одном случае приёма капсаицина, который привёл к смерти. Несмотря на это, множество смертей связано с использованием перцовых баллончиков.
Препараты на рынке, содержащие капсаицин
- Эспол (мазь 30 г)
- Кутенза 179 мг (пластырь)
Доступность
Препарат отпускается без рецепта врача.
:Tags
Читать еще: Анастрозол (Аримидекс) , Антибиотики , Велаксин (Венлафаксин) , Куркума , Ункария клюволистная ,










