Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Треонин
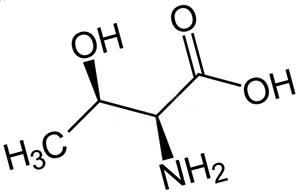 Треонин (сокращенно Thr или T) - α-аминокислота с химической формулой HO2CCH (NH2) СН (ОН) СН3. Ее кодоны ACU, ACA, ACC и ACG. Это незаменимая аминокислота, классифицируемая как полярная. Вместе с серином треонин является одной из двух протеиногенных аминокислот, имеющих спиртовую группу (тирозин является фенолом, а не спиртом, так как его гидроксильная группа присоединена непосредственно к ароматическому кольцу, придавая ему различные кислотные/основные и окислительные свойства). Треонин также является одной из двух обычных аминокислот, имеющих хиральную боковую цепь, наряду с изолейцином.
Остаток треонина подвергается многочисленным посттрансляционным модификациям. Гидроксильная боковая цепь может подвергаться О-связанному гликозилированию. Кроме того, треонин подвергается фосфорилированию под воздействием треонин киназы. В фосфорилированной форме он может упоминаться как фосфотреонин.
Треонин (сокращенно Thr или T) - α-аминокислота с химической формулой HO2CCH (NH2) СН (ОН) СН3. Ее кодоны ACU, ACA, ACC и ACG. Это незаменимая аминокислота, классифицируемая как полярная. Вместе с серином треонин является одной из двух протеиногенных аминокислот, имеющих спиртовую группу (тирозин является фенолом, а не спиртом, так как его гидроксильная группа присоединена непосредственно к ароматическому кольцу, придавая ему различные кислотные/основные и окислительные свойства). Треонин также является одной из двух обычных аминокислот, имеющих хиральную боковую цепь, наряду с изолейцином.
Остаток треонина подвергается многочисленным посттрансляционным модификациям. Гидроксильная боковая цепь может подвергаться О-связанному гликозилированию. Кроме того, треонин подвергается фосфорилированию под воздействием треонин киназы. В фосфорилированной форме он может упоминаться как фосфотреонин.
Фармакологическая группа: аминокислоты
История
Треонин был обнаружен в 1930 году Уильямом Роузом Каммингом в качестве последней из 20 известных протеиногенных аминокислот.
Стереоизомерия
Треонин является одной из двух аминокислот, имеющих два хиральных центра. Треонин может существовать в четырех возможных стереоизомерах в следующих конфигурациях: (2S, 3R), (2R, 3S), (2S, 3S) и (2R, 3R). Однако название L-треонин используют для одного диастереомера, (2S, 3R)-2-амино-3-гидроксибутановой кислоты. Второй стереоизомер (2S, 3S), который редко присутствует в природе, называют L-алло-треонин. Два этих стереоизомера (2R, 3S)- и (2R, 3R)-2-амино-3- гидроксибутановая кислота имеют лишь второстепенное значение.
Биосинтез
Треонин является незаменимой аминокислотой, то есть не синтезируется в организме человека, поэтому ее необходимо потреблять в виде треонин-содержащих белков. У растений и микроорганизмов треонин синтезируется из аспарагиновой кислоты с помощью α-аспартил-полуальдегида и гомосерина. Гомосерин подвергается О-фосфорилированию, эта эфир фосфорная кислота подвергается гидролизу одновременно с перемещением группы ОН ферментов, участвующих в типичном биосинтезе треонина, включающем:
аспартокиназу\\ β-аспартат полуальдегиддегидрогеназу\\ гомосериндегидрогеназу\\ гомосерин киназу\\ треонинсинтазу.
Биосинтез треонина
Метаболизм
Треонин метаболизируется двумя способами:
Он превращается в пируват через треонин дегидрогеназу. Промежуточное соединение на этом пути может подвергаться тиолизу с коферментом А (СоА), производя ацетил-СоА и глицин. У человека он преобразуется в α-кетобутират через фермент серин дегидратазы, и таким образом способствует образованию сукцинил- СоА.
Источники
Продукты с высоким содержанием треонина включают творог, птицу, рыбу, мясо, чечевицу, фасоль сорта Черная черепаха и семена кунжута.
Рацемический треонин может быть получен из кротоновой кислоты путем альфа-функционализации с использованием ртуть (II) ацетата.
:Tags
Читать еще: ACE-031 , Адефовир , Ампакины , Бутея роскошная , Дигидроэрготамин ,










