Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Лютеолин
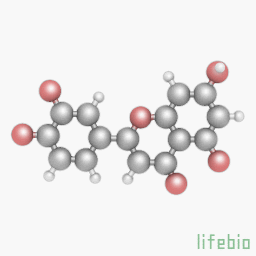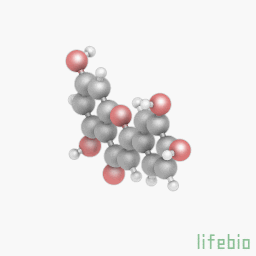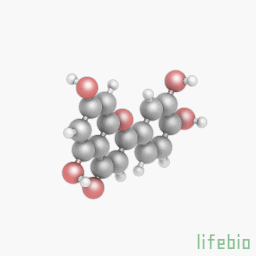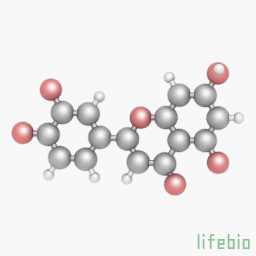
Лютеолин является флавоном, типом флавоноидов. Как и все флавоноиды, внешне он выглядит как желтые кристаллы. Лютеолин может содержаться в растении Terminalia chebula. Чаще всего он содержится в листьях, но также встречается в верхнем слое, коре, в цветах клевера и пыльце амброзии. Он также был выделен из растения Salvia Tomentosa. Диетические источники включают сельдерей, брокколи, зеленый перец, петрушку, тимьян, одуванчик, периллц, ромашковый чай, морковь, оливковое масло, мяту, розмарин, апельсины авель и орегано. Лютеонин также может содержаться в семенах пальмы Aiphanes aculeata.
Фармакологическая группа: флавоны; флавоноиды
ИЮПАК название: 2 - (3,4 -дигидроксифенил) - 5,7- дигидрокси -4- хроменон
Другие названия: Лютеолол
Молекулярная формула C15H10O6
Молярная масса 286,24 г моль-1
Метаболизм
Частью метаболизма лютеолина являются следующие ферменты:
Лютеолин О-метилтрансферазы Флавон 7-O-бета-глюкозилтрансферазы Лютеолин-7-O-диглюкоронид 4' -O- глюкуронозилтрансферазы Лютеолин 7-О-глюкуронозилтрансферазы
Гликозиды
Изоориентин, 6-C глюкозид Ориентин, 8-C глюкозид лютеолина Цинарозид,7 -глюкозид, и лютеолин-7-диглюкозид, содержащийся в одуванчиковом кофе Вероникастрозид,7-О-неохесперидозид Лютеолин-7-O -бета-D-глюкуронид можно найти в Acanthus hirsutus
Биомедицинские исследования
Лютеолин изучался в рамках нескольких предварительных научных исследований in vitro. Предлагаемые действия включают антиоксидантную активность (т.е. способность поглощать свободные радикалы), продвижение углеводного обмена и модуляцию иммунной системы. Другие исследования in vitro предполагают, что лютеолин обладает противовоспалительным действием, и что он действует как активатор моноаминового транспортера, ингибитор фосфодиэстеразы и ингибитор интерлейкина 6. Исследования in vivo показывают, что лютеолин воздействует на анестезию, вызванную ксилазином/кетамином у мышей. Эксперименты in vitro и in vivo также показали, что лютеолин может препятствовать развитию рака кожи. Важно отметить, что терапевтическая ценность вышеуказанных выводов неясна, и останется таковой до тех пор, пока не будут проведены более подробные токсические и клинические исследования in vivo.
Побочные эффекты
Могут наблюдаться желудочно-кишечные побочные эффекты, такие как тошнота, рвота, и гиперсекреция желудка. Также недавно было установлено, что Лютеолин оказывает неблагоприятные изменения в исследованиях in vitro на раковые клетки эндометрия.
Лютеолин как потенциальное средство для предотвращения и лечения рака
Лютеолин, 3', 4', 5,7-тетрагидроксифлавон, является распространенным флавоноидом, который присутствует во многих типах растений, включая фрукты, овощи и лекарственные травы. Растения, богатые лютеолином, использовались в традиционной китайской медицине для лечения различных заболеваний, таких как гипертония, воспалительные заболевания и рак. Обладая множественными биологическими эффектами, такими как противовоспалительное, противоаллергическое и противоопухолевое действие, лютеолин функционирует биохимически как антиоксидант, так и прооксидант. Биологические эффекты лютеолина могут быть функционально связаны друг с другом. Например, его противовоспалительная активность может быть связана с его противораковыми свойствами. Противораковые свойства лютеолина связаны с индукцией апоптоза и ингибированием пролиферации клеток, метастазов и ангиогенеза. Кроме того, лютеолин сенсибилизирует раковые клетки до терапевтически индуцированной цитотоксичности посредством подавления путей выживания клеток, таких как фосфатидилинозитол-3'-киназа (PI3K) / Akt, ядерный фактор каппа B (NF-κB) и X-связанный ингибитор белка апоптоза (XIAP), и стимулирует пути апоптоза, включая пути, которые индуцируют опухолевый супрессор р53. Эти наблюдения показывают, что лютеолин может быть противоопухолевым средством для лечения различных видов рака. Более того, недавние эпидемиологические исследования приписывают лютеолину свойство профилактики рака. Здесь мы суммируем ход недавних исследований по лютеолину, с особым акцентом на его противоопухолевую активность и молекулярные механизмы, лежащие в основе этой активности. 1)
Лютеолин, 3', 4', 5,7-тетрагидроксифлавон, относится к группе встречающихся в природе соединений, называемых флавоноидами, которые широко встречаются в растительном царстве. Флавоноиды – это полифенолы, которые играют важную роль в защите клеток растений от микроорганизмов, насекомых и УФ-облучения 1). Данные исследований клеточной культуры, животных и людей показали, что флавоноиды также полезны для здоровья человека и животных. Из-за их обилия в пищевых продуктах, например, овощах, фруктах и лекарственных травах, флавоноиды являются распространенными питательными веществами, антиоксидантами, эстрогенными регуляторами и противомикробными средствами 2). Было замечено, что флавоноиды могут выступать в качестве средств для профилактики рака 3). Флавоноиды могут блокировать несколько точек прогрессирования канцерогенеза, включая трансформацию клеток, инвазию, метастазы и ангиогенез, путем ингибирования киназ, снижения факторов транскрипции, регулирования клеточного цикла и индуцирования апоптотической гибели клеток.
Лютеолин, принадлежащий к флавоновой группе флавоноидов, имеет структуру С6-С3-С6 и имеет два бензольных кольца (А, В), третье кислородсодержащее (С) кольцо и двойную связь на 2-3 атомах углерода. Лютеолин также имеет гидроксильные группы в положениях атомов углерода 5, 7, 3 'и 4' (рис.1) 4). Гидроксильные фрагменты и 2-3 двойные связи являются важными структурными особенностями лютеолина, которые связаны с его биохимической и биологической активностью. Как и у других флавоноидов, лютеолин часто гликозилирован в растениях, а гликозид гидролизуется до свободного лютеолина во время абсорбции. Часть лютеолина превращается в глюкурониды при прохождении через слизистую оболочку кишечника. Лютеолин устойчив к теплу, а потери при кулинарной обработке относительно низки.
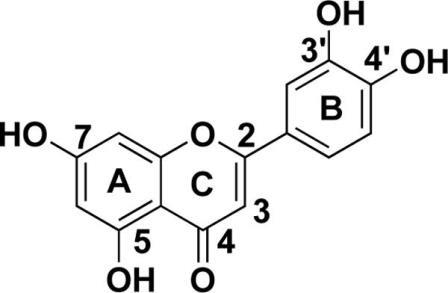 Овощи и фрукты, такие как сельдерей, петрушка, брокколи, листья лука, морковь, перец, капуста, яблочная кожура и цветы хризантемы, содержат большое количество лютеолина 5). Растения, богатые лютеолином, использовались в традиционной китайской медицине для лечения гипертонии, воспалительных заболеваний и рака. Фармакологические активности лютеолина могут быть функционально связаны друг с другом. Например, противовоспалительное действие лютеолина также может быть связано с его противоопухолевой функцией. Противораковое свойство лютеолина связано с индуцированием апоптоза, который включает редокс-регуляцию, повреждение ДНК и протеинкиназы в ингибировании пролиферации раковых клеток и подавлении метастазов и ангиогенеза. Кроме того, лютеолин сенсибилизирует различные раковые клетки до терапевтически индуцированной цитотоксичности путем подавления путей выживания клеток и стимулирования путей апоптоза. Примечательно, что лютеолин проникает через гематоэнцефалический барьер, что делает его применимым для лечения заболеваний центральной нервной системы, включая рак мозга 6). Кроме того, недавние исследования показывают, что лютеолин имеет потенциал для профилактики рака. В этом обзоре мы суммируем недавний прогресс в исследованиях лютеолина. В частности, мы фокусируемся на ролях и молекулярных механизмах, лежащих в основе противоопухолевого действия лютеолина.
Овощи и фрукты, такие как сельдерей, петрушка, брокколи, листья лука, морковь, перец, капуста, яблочная кожура и цветы хризантемы, содержат большое количество лютеолина 5). Растения, богатые лютеолином, использовались в традиционной китайской медицине для лечения гипертонии, воспалительных заболеваний и рака. Фармакологические активности лютеолина могут быть функционально связаны друг с другом. Например, противовоспалительное действие лютеолина также может быть связано с его противоопухолевой функцией. Противораковое свойство лютеолина связано с индуцированием апоптоза, который включает редокс-регуляцию, повреждение ДНК и протеинкиназы в ингибировании пролиферации раковых клеток и подавлении метастазов и ангиогенеза. Кроме того, лютеолин сенсибилизирует различные раковые клетки до терапевтически индуцированной цитотоксичности путем подавления путей выживания клеток и стимулирования путей апоптоза. Примечательно, что лютеолин проникает через гематоэнцефалический барьер, что делает его применимым для лечения заболеваний центральной нервной системы, включая рак мозга 6). Кроме того, недавние исследования показывают, что лютеолин имеет потенциал для профилактики рака. В этом обзоре мы суммируем недавний прогресс в исследованиях лютеолина. В частности, мы фокусируемся на ролях и молекулярных механизмах, лежащих в основе противоопухолевого действия лютеолина.
МОДУЛЯЦИОННАЯ АКТИВНОСТЬ REDOX
Антиоксидантная активность
Большинство флавоноидов, включая лютеолин, считаются антиоксидантами. Активные формы кислорода (АФК) относятся к разнообразной группе реакционноспособных короткоживущих кислородсодержащих видов, таких как супероксид (O2-), перекись водорода (H2O2), гидроксильный радикал (OH), синглетный кислород (1O2) и липидный пероксил-радикал (ЛПР). АФК служат вторичными мессенджерами для клеточной сигнализации. Однако, чрезмерное производство АФК приводит к окислительному стрессу и повреждению ДНК, липидов и белка, которые вовлечены в развитие рака, а также сердечно-сосудистых и нейродегенеративных заболеваний. Было обнаружено, что лютеолин ингибирует индуцированное АФК повреждение липидов, ДНК и белка. Множество механизмов могут лежать в основе антиоксидантного эффекта лютеолина. Во-первых, лютеолин функционирует как поглотитель АФК через свое собственное окисление. Лютеолин обладает структурами, необходимыми для антиоксидантной активности флавоноидов: 3', 4' гидроксилирование, наличие двойной связи между атомами углерода 2 и 3 и карбонильной группы на углероде 4. Атом водорода из ароматической гидроксильной группы может быть передан свободным радикалам. В качестве ароматического соединения, лютеолин может поддерживать неспаренные электроны вокруг системы M-электронов. Прямые доказательства, показывающие, что лютеолин является поглотителем АФК, были получены в бесклеточных системах. Во-вторых, лютеолин ингибирует АФК-генерирующие оксидазы. Например, лютеолин подавляет образование O2 путем ингибирования активности ксантиноксидазы. Однако, неясно, влияет ли лютеолин в клетках млекопитающих на появление АФК в митохондриях, основном участке генерации АФК, хотя он препятствует транспортной цепи митохондриальных электронов в паразитарных (лейшманских) клетках. В-третьих, лютеолин может оказывать антиоксидантное действие путем защиты или усиления эндогенных антиоксидантов, таких как глутатион-S-трансфераза (GST), глутатионредуктаза (GR), супероксиддисмутаза (SOD) и каталаза (CAT). В-четвертых, лютеолин может непосредственно ингибировать ферменты, которые катализируют окисление клеточных компонентов. Например, лютеолин подавляет образование липоксигеназы, циклооксигеназы и стимулированное аскорбиновой кислотой образование малональдегида в липидах печени 7). Наконец, лютеолин может хелатировать ионы переходных металлов, ответственные за образование АФК, и, следовательно, ингибировать реакцию липооксигеназы или подавлять непереходное металлозависимое окисление 8). Следует отметить, что согласные антиоксидантные механизмы действия лютеолина могут встречаться in vivo. Например, ингибирование LPS-индуцированного производства OH в макрофагах лютеолином может осуществляться путем удаления O2-, ингибирования активности ксантиноксидазы или комбинации обоих факторов.
Прооксидантная активность
Хотя способность флавоноидов защищать клетки от окислительного стресса была хорошо изучена, появляется все больше доказательств их прооксидантной активности 9). Прооксидантная активность флавоноидов может быть связана с их способностью подвергаться автоокислению, катализируемому переходными металлами, для получения супероксидных анионов 10). В других отчетах, однако, было отмечено, что фенольные кольца флавоноидов метаболизируются пероксидазой с образованием прооксидантных феноксильных радикалов, которые являются достаточно реакционноспособными для совместного окисления глутатиона (GSH) или никотинамид-аденинового водорода (NADH), сопровождаемого обширным поглощением кислорода и образованием АФК 11). Исследование зависимости структуры-активности от прооксидантной цитотоксичности флавоноидов показывает, что флавоноиды с фенольным кольцом, как правило, более биологически активны, чем содержащие катехольные кольца. Цитотоксичность, вызванная флавоноидами, коррелирует с их чувствительностью к электрохимическому окислению и липофильностью. Было показано, что лютеолин индуцирует образование АФК в нетрансформированных и раковых клетках 12). В клетках рака легкого, лютеолин индуцировал накопление O2, в то же время уменьшая концентрацию H2O2. Хотя наблюдалось подавление активности супероксиддисмутазы марганца (MnSOD), которая преобразует O2 в H2O2, остается определить, лежат ли другие механизмы в основе лютеолин-индуцированного проокисления. Не было точно определено, как именно лютеолин действует как анти- или прооксидант. Считается, что флавоноиды могут действовать как антиоксиданты или прооксиданты в зависимости от концентрации и источника свободных радикалов 13). Кроме того, контекст и микроокружение клетки могут быть важными детерминантами эффектов, вызванных лютеолином, на клеточный редокс статус. Например, антиоксидантная активность лютеолина зависит от ионов Cu, V и Cd в клетках. Изменения в концентрациях ионов Fe резко влияют на эффект редокс-регулирующей активности лютеолина. При низких концентрациях ионов Fe (<50 мкМ), лютеолин ведет себя как антиоксидант, в то время как высокие концентрации Fe (> 100 мкМ) индуцируют проокислительный эффект лютеолина. Понимание того, как активность редокс-регуляции лютеолина участвует в его клеточных эффектах, является ключом к оценке его потенциала как противоопухолевого средства, кардиопротектора или ингибитора нейродегенерации. Поскольку окислительные стрессы тесно связаны с мутагенезом и канцерогенезом, лютеолин, как антиоксидант, может действовать как химиопревентивное вещество, агент для защиты клеток от различных форм окислительных стрессов и, таким образом, предотвращать развитие рака. С другой стороны, прооксидантные свойства лютеолина могут быть связаны с его способностью индуцировать апоптоз опухолевых клеток, что достигается частично за счет прямого окислительного повреждения ДНК, РНК и / или белка в клетках 14). Вмешательство АФК в клеточную сигнализацию может также способствовать индуцированному лютеолином апоптозу в раковых клетках. Было обнаружено, что индуцированный лютеолином окислительный стресс вызывает подавление пути NF-κB, одновременно инициируя активацию JNK, которая потенцирует цитотоксичность, вызванную TNF, в клетках рака легких. Было высказано предположение, что антиоксидантная активность лютеолина связана с апоптозом в клеточной линии рака легких CH27. Однако, индукция белков SOD-1 и -2 лютеолином является умеренной, и не было установлено причинно-следственной связи между индукцией белков SOD и подавлением АФК или апоптозом. Таким образом, анти-и прооксидантные роли лютеолина в цитотоксичности необходимо дополнительно исследовать.
ЭСТРОГЕННАЯ И АНТИЭСТРОГЕННАЯ АКТИВНОСТЬ
Эстрогены являются гормонами, участвующими в пролиферации и дифференцировке своих клеток-мишеней. В ответ на эстрогены, рецептор эстрогена (ЭР) активируется для стимуляции синтеза ДНК и пролиферации клеток. Флавоноиды являются естественными фитоэстрогенами, потому что они могут связываться с ЭР и активировать их сигнальные пути. Поскольку лютеолин обладает мощной эстрогенной активностью при низких концентрациях, он может быть полезным агентом для заместительной гормональной терапии. Однако, также имеются сообщения, свидетельствующие об антиэстрогенных эффектах лютеолина. Механизм, лежащий в основе этого явно противоречивого эффекта, можно объяснить его относительной низкой эстрогенной активностью, когда он связывается с ЭР. Флавоноиды связывают и активируют ЭР, когда количество эстрогена недостаточно. Однако, из-за их относительной слабой эстрогенной активности, которая в 103-105 раз ниже, чем у 17-β-эстрадиалютеолина, они могут функционировать в качестве антиэстрогенных агентов путем конкуренции с эстрогенами для связывания с ЭР. Другим механизмом антиэстрогенной активности лютеолина является то, что он ингибирует ароматазу, функция которой заключается в ароматизации андрогенов и продуцировании эстрогенов. Кроме того, лютеолин снижает уровень экспрессии ЭР за счет ингибирования транскрипции ЭР-гена или потенцирования деградации ЭР-белка. Наконец, также могут быть задействованы некоторые альтернативные механизмы сигнализации, не связанные с ЭР. Хотя взаимодействие агонистов и антагонистов эстрогенов с ЭР является основным эффектом, лежащим в основе действия эстрогена, клетки млекопитающих содержат второй участок связывания (участок типа II) для эстрогена для контроля роста клеток, который находится в эндогенных белках, таких как гистон. Было обнаружено, что лютеолин необратимо связывается с участками клеточного типа II и конкурирует за связывание эстрадиола с этими участками. Этиология рака молочной железы, предстательной железы, яичника и эндометрия связана с эстрогенной активностью. Таким образом, наличие лютеолина в рационе может снизить риск этих видов рака путем регулирования эстроген-индуцированных клеточных эффектов. Действительно, лютеолин, а также другие флавоноиды способны ингибировать синтез и пролиферацию ДНК в эпителиальных клетках молочной железы и клетках рака молочной железы, индуцированную эстрогенами как in vitro, так и in vivo. Подавление эстроген-индуцированной пролиферации раковых клеток может способствовать терапевтической и профилактической активности лютеолина против эстроген-ассоциированного рака.
Противовоспалительное действие
Воспаление является одним из защитных механизмов, которые защищают организм от инфекции и помогают залечить травмы. Тем не менее, хроническое воспаление может привести к тяжелым болезням, таким как артрит, хроническая обструктивная болезнь легких и рак. Во время воспаления, макрофаги активируются различными молекулами, включая цитокины из организма хозяина и токсины из патогенов. Липополисахарид (LPS), внешний мембранный компонент грамотрицательных бактерий, представляет собой общий эндотоксин и триггер воспаления. Активированные макрофаги быстро продуцируют воспалительные молекулы, такие как фактор некроза опухоли α (TNFα), интерлейкины (IL) и свободные радикалы (АФК и активные формы азота, АФА), что приводит к рекрутированию воспалительных клеток, таких как нейтрофилы и лимфоциты, к участку заражения и клиренсу патогенов 15). Постоянное производство этих молекул во время хронического воспаления может привести к заболеваниям, таким как рак. Лютеолин оказывает противовоспалительное действие, подавляя производство этих цитокинов и их пути передачи сигналов 16). Эксперименты с животными показывают, что лютеолин подавляет воспаление, вызванное липосахаридами (ЛПС) или бактериями in vivo 17). Высокая смертность, вызванная ЛПС, эффективно снижалась лютеолином, что связано с уменьшением высвобождения ЛПС-стимулированного TNFα (фактора некроза опухоли-альфа) в сыворотке и межклеточной молекулой адгезии-1 (ICAM-1) в печени. Было обнаружено, что лютеолин подавляет воспаление в легочной ткани, вызываемое Chlamydia pneumoniae 18). Эксперименты in vitro обеспечили более прямое доказательство противовоспалительного эффекта лютеолина. Предварительно обработанные лютеолином мышиные макрофаги (RAW 264.7) ингибировали ЛПС-стимулированное высвобождение TNFα и IL-6, что было связано с блокировкой ЛПС-индуцированной активации ядра kappa B (NF-κB) и членов митоген-активированной протеинкиназы (MAPK) ERK, p38 и JNK. NF-κB и MAPK являются двумя основными путями, которые участвуют в активации макрофагов и в ответах эпителиальных тканей и стромальных клеток на медиаторы воспаления, такие как TNFα и ILs. Подавление этих путей лютеолином лежит в основе основного механизма его ингибирующего действия как на острое, так и на хроническое воспаление. Подавление индуцируемой воспалительным цитокином сигнализации, по меньшей мере, частично зависит от уровня рецептора, поскольку накопление липидных плотов, которое является критическим этапом для передачи сигналов рецепторов, блокируется лютеолином. NF-κB может активироваться как первичными (LPS), так и вторичными (TNFα и IL-1) воспалительными стимуляторами. В качестве гетеродимера, обычно состоящего из RelA (p65) / p50, NF-κB сохраняется в цитоплазме в виде неактивной формы в сочетании с белками IκB. Через связывание с Toll-подобным рецептором 4 (TLR-4), LPS активирует киназу IKB (IKK), которая, в свою очередь, фосфорилирует IκB, чтобы вызвать ее быструю деградацию. Это позволяет NF-κB мигрировать в ядро и активировать его мишени, включая ряд генов с антиапоптотическими свойствами и цитокинами, такими как TNFα и IL-1. Цикл положительной обратной связи для активации NF-κB устанавливается этими цитокинами посредством связывания с их родственными рецепторами. Пути NF-κB, активированные LPS, и воспалительные цитокины сходятся при активации IKK. Лютеолин может эффективно блокировать путь NF-κB и мешать функциям первичных (LPS) и вторичных (TNFα и IL-1) воспалительных стимуляторов посредством ингибирования активации IKK и деградации IκB. Однако, еще предстоит определить, непосредственно ли лютеолин ингибирует активность IKK или блокирует восходящие стадии в пути активации IKK, такие как образование комплекса сигнализации рецептора. С другой стороны, механизм, с помощью которого лютеолин подавляет MAPK, который ожидает вскрытия каскада MAPKKK-MAPKK-MAPK для каждой активации MAPK, менее понятен. Маловероятно, что лютеолин подавляет связывание TNFα и IL-1 с их соответствующими рецепторами, поскольку лютеолин избирательно подавляет каждый MAPK в макрофагах 19). Основываясь на наблюдениях, что некоторые флавоноиды с сильной антиоксидантной активностью полностью неэффективны в подавлении продуцируемой ЛПС продукции TNF, предполагается, что ингибирующее действие флавоноидов на продукцию провоспалительных цитокинов напрямую не связано с их антиоксидантными свойствами 20). Однако, поскольку лютеолин способен самостоятельно удалять ROS и подавлять активированную LPS продукцию оксида азота в активированных макрофагах, антиоксидантная активность лютеолина, по крайней мере, частично способствует противовоспалительному эффекту лютеолина 21). Поскольку воспаление и связанные с ним сигнальные пути сильно связаны с канцерогенезом, роль противовоспалительного действия лютеолина может способствовать профилактике рака.
ПРОТИВОРАКОВАЯ АКТИВНОСТЬ
Канцерогенез – это долговременный и многостадийный процесс, который является результатом клонирования экспрессии мутированных клеток. Типичный канцерогенный процесс можно разделить на три этапа: инициирование, продвижение и прогрессирование. Во время инициирования, потенциальный канцероген (про-мутаген) превращается в мутаген ферментами, такими как цитохром Р450. Затем мутаген реагирует с ДНК, вызывая необратимое генетическое изменение, включая мутации, трансверсии, переходы и / или небольшие делеции в ДНК. Во время стадии продвижения, изменения в экспрессии генома происходят в пользу роста и пролиферации клеток. На стадии прогрессирования, канцерогенность устанавливается и становится необратимой; она характеризуется кариотипической нестабильностью и злокачественным ростом в неконтролируемых масштабах. Трансформированные клетки приобретают ряд характерных изменений, в том числе, способность к пролиферации экзогенным стимулирующим рост и сигнал-зависимым образом, чтобы вторгаться в окружающие ткани и метастазировать в отдаленные участки. Кроме того, раковые клетки вызывают ангиогенную реакцию, избегая механизмов, которые ограничивают клеточную пролиферацию (например, апоптоз и старение), и ускользают от иммунного наблюдения 22). Эти свойства раковых клеток отражаются изменениями клеточных сигнальных путей, которые контролируют пролиферацию, подвижность и выживаемость у нормальных клеток.
Предотвращение метаболической активации канцерогенов
В более ранних исследованиях было обнаружено, что лютеолин ингибирует метаболизм канцерогенов, который генерирует активные мутагены в микросомах печени 23). Недавно было установлено, что лютеолин эффективно ингибирует ферменты семейства цитохрома P450 (CYP) 1 у человека, такие как CYP1A1, CYP1A2 и CYP1B1, тем самым подавляя мутагенную активацию канцерогенов. Подавление этих ферментов уменьшает образование активных мутагенов, таких как бензо[а]пиреноилэпоксид, метаболит канцерогенеза табак-специфичного канцерогена бензо[а]пирена 24).
Ингибирование распространения раковых клеток
Неограниченная пролиферация, которая часто происходит из-за потери контроля клеточного цикла, позволяет раковым клеткам перерастать и образовывать опухоли. Как и многие другие флавоноиды, лютеолин способен ингибировать пролиферацию раковых клеток, полученных практически из всех видов рака, главным образом, путем регулирования клеточного цикла 25). В эукариотических клетках, пролиферация протекает через репликацию ДНК с последующим разделением ядра и разделением цитоплазмы с образованием дочерних клеток. Последовательный процесс, называемый клеточным циклом, состоит из четырех различных фаз: G1, S, G2 и M 26). Периодичность клеточного цикла своевременно регулируется циклин-зависимыми киназами (CDK) и их субъединицами циклина на двух контрольных точках G1 / S и G2 / M. Контрольная точка G1 / S регулируется CDK4-циклином D, CDK6-циклином D и CDK2-циклином E. Когда это связано с циклином A, CDK2 контролирует S-фазу, тогда как переход G2 / M регулируется CDK1 в сочетании с циклинами A и B. Активность CDK отрицательно контролируется двумя группами ингибиторов CDK (CKI), INK4 и CIP / KIP. Члены семейства INK4 ингибируют CDK4 и CDK6; в то время как семейство CIP / KIP, состоящее из p21cip1 / waf1, p27kip1 и p57kip2, ингибирует широкий диапазон CDK.
Ингибирование прогрессирования клеточного цикла
Было обнаружено, что флавоноиды ингибируют пролиферацию многих раковых клеток путем остановки прогрессирования клеточного цикла либо на контрольной точке G1 / S, либо G2 / M 27). Лютеолин способен останавливать клеточный цикл во время фазы G1 при раке предстательной железы и раке желудка и в клетках меланомы 28). Задержка клеточного цикла G1, вызванная лютеолином, связана с ингибированием активности CDK2 в клетках меланомы OCM-1 и колоректального рака HT-29. Эта задержка достигается путем регуляции ингибиторов CDK p27 / kip1 и p21 / waf1 или прямого ингибирования активности CDK2. Лютеолин задерживает клетки рака мыши tsFT210 на контрольной точке G2 / M. Активированный гибелью ДНК белок-супрессор опухоли p53 участвует в регуляции перехода G1 / S и G2 / M 29). Лютеолин может связывать и подавлять ДНК-топоизомеразы I и II, ферменты, необходимые для восстановления поврежденной ДНК, и непосредственно интеркалирует с ДНК-субстратом, вызывая разрывы двух нитей ДНК. Это действие лютеолина индуцирует остановку клеточного цикла через p53-опосредованную экспрессию p21 / waf1.
Подавление передачи сигналов, опосредованных рецептором фактора роста
Факторы роста способствуют синтезу ДНК и развитию клеточного цикла посредством связывания с их соответствующими рецепторами. Общие факторы роста включают эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), инсулиноподобный фактор роста (IGF) и фактор роста фибробластов (FGF). TNFα также может стимулировать пролиферацию раковых клеток через NF-κB. Ингибирующее действие лютеолина на пролиферацию раковых клеток частично достигается за счет блокирования сигнальных путей пролиферации, вызванных этими факторами. EGF-рецептор (EGFR) представляет собой типичную рецепторную тирозинкиназу (PTK), которая опосредует рост и пролиферацию клеток. При активировании его лигандами, EGFR фосфорилируется, чтобы опосредовать активацию сигнальных путей ниже по потоку, включая MAPK и PI3K / Akt 30). Было обнаружено, что лютеолин ингибирует пролиферацию рака поджелудочной железы и предстательной железы и клеток эпидермоидной карциномы человека, что тесно связано с ингибированием активности ПТК и аутофосфорилированием EGFR, трансфосфорилированием нисходящей EGFR эффекторной белковой эннолазы и активацией MAPK / ERK 31). Лютеолин способен ингибировать IGF-1-индуцированную активацию IGF-1R и Akt и фосфорилирование мишеней Akt p70S6K1, GSK-3β и FKHR / FKHRL1. Это ингибирование связано с подавленной экспрессией циклина D1 и повышенной экспрессией p21 / waf1 и пролиферацией в клетках рака простаты in vitro. Лютеолин также подавлял рост опухоли предстательной железы in vivo посредством подавления передачи сигналов IGF-1R / Akt. Аналогично, лютеолин ингибирует индуцированную PDGF пролиферацию, ингибируя фосфорилирование рецептора PDGF в клетках гладкой мускулатуры сосудов 32). Как следствие, лютеолин значительно ингибирует индуцированную PDGF активацию ERK, PI3K / Akt и фосфолипазы C (PLC) -γ1 и экспрессию гена c-fos. Эти результаты свидетельствуют о том, что ингибиторное действие лютеолина на индуцированную PDGF пролиферацию может быть опосредовано путем блокирования фосфорилирования рецептора PDGF. Поскольку PDGF стимулирует пролиферацию раковых клеток, остается определить, может ли лютеолин блокировать индуцированную PDGF сигнализацию для подавления пролиферации раковых клеток. Как обсуждалось выше, ЭР индуцирует пролиферацию в нескольких типах раковых клеток. Лютеолин подавляет пролиферацию клеток предстательной железы и рака молочной железы как андрогензависимым, так и независимым образом, что указывает на то, что лютеолиновая антиэстрогенная активность может, по крайней мере, частично, способствовать его антипролиферационному эффекту. Аналогичные наблюдения были сделаны и в клеточных линиях карциномы щитовидной железы, несущих ЭР 33). Дальнейшие эксперименты, подавляющие экспрессию и функцию ЭР, необходимы для подтверждения роли ЭР-опосредованной передачи сигналов в индуцированной лютеолином антипролиферации в ЭР-чувствительных раковых клетках. Помимо влияния на рецепторы, лютеолин может непосредственно нацеливаться на нисходящие пути, которые участвуют в пролиферации клеток. Например, протеинкиназа С, семейство серин-треониновых протеинкиназ, которая регулирует реакцию фактора роста и пролиферацию, дифференцировку и апоптоз клеток, может быть ингибирована зависимым от концентрации образом лютеолином в обеих бесклеточных системах и в интактных клетках 34). В совокупности, вышеприведенные данные показывают, что лютеолин подавляет передачу пролиферации клеток на отдельных компонентах сигнальных путей рецептора фактора роста. Кроме того, канцерогены активируют пути выживания клеток, такие как NF-κB и MAPK в ходе канцерогенеза; эти пути могут быть дополнительными мишенями для флавоноидов, включая лютеолин, в качестве противоканцерогенных веществ 35).
Устранение трансформированных клеток путем индукции апоптоза
Накопленные данные показывают, что неконтролируемая пролиферация мутированных клеток из-за отсутствия запрограммированной гибели клеток или апоптоза тесно связана с канцерогенезом. Устойчивость раковых клеток к апоптозу приобретается с помощью целого ряда биохимических изменений, которые также способствуют снижению чувствительности клеток к противораковой терапии. Апоптоз – это жестко регулируемый процесс гибели клеток, который имеет решающее значение для поддержания гомеостаза тканей, а также для предотвращения развития рака. Во время эволюции устанавливаются два пути апоптоза, путь рецептора смерти (внешний) и митохондриальный (собственный) путь. Внутренний путь включает функциональную дезадаптацию митохондрий проапоптотическими членами семейства Bcl2, включая Bax, Bak и Bik, которые вызывают потерю потенциала митохондрий и высвобождают цитохром С для активации каспазы 9, что, в свою очередь, активирует каспазы-исполнители (-3, -7) и уничтожает клеточные белки 36). Внешний путь инициируется связыванием цитокинов семейства TNF (TNFα, Fas и связанного с TNF апоптоз-индуцирующего лиганда, TRAIL) с их родственными рецепторами смерти, для активации каспазы 8, которая, в свою очередь, активирует каспазы нижнего потока.
Лютеолин убивает раковые клетки, индуцируя апоптозную гибель клеток во многих типах раковых клеток, включая эпидермоидную карциному, лейкемию, опухоль поджелудочной железы и гепатому 37). Хотя механизмы, основанные на индуцированном лютеолином апоптозе, являются сложными, их можно обобщить как нарушение баланса выживаемости и клеточного баланса путем либо усиления апоптоза, либо уменьшения передачи сигналов выживаемости в раковых клетках, что суммировано на рисунке 2.
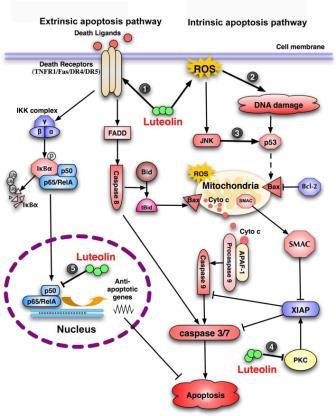
Активация пути апоптоза
Лютеолин эффективен для активации как внешних, так и собственных путей апоптоза. Прямое увеличение экспрессии рецептора смерти 5 (DR5), функционального рецептора TRAIL, было продемонстрировано в клетках рака шейки матки и предстательной железы, которое сопровождается активацией каспазы-8, -10, -9 и -3 и распадом Bcl-2-взаимодействующего домена (BID). Увеличение экспрессии DR5 возможно через активированную транскрипцию гена dr5 38). Интересно, что DR5 не индуцировался, и цитотоксичность не наблюдалась в лютеолиновых нормальных человеческих мононуклеарных клетках периферической крови. Было также обнаружено, что лютеолин усиливает экспрессию Fas для индуцирования апоптоза в клетках гепатомы человека путем инициирования деградации STAT3, известного отрицательного регулятора транскрипции fas. Лютеолин также активирует собственный путь апоптоза, индуцируя повреждение ДНК и активируя р53 39). Это достигается путем ингибирования ДНК-топоизомеразы. Кроме того, лютеолин вызывает устойчивую активацию JNK, которая может способствовать пути апоптоза, предположительно, посредством модуляции BAD или p53 40). Активируемая JNK активация p53 приводит к экспрессии транскрипции Bax, что облегчает апоптоз. Активация JNK приводит к транслокации митохондрий Bax и Bak, чтобы инициировать собственный путь апоптоза.
Подавление сигнализации о выживании клеток
С другой стороны, лютеолин подавляет пути выживания клеток, чтобы уменьшить порог апоптоза. Как обсуждалось выше, лютеолин ингибирует пути выживания, такие как PI3K / Akt, NF-κB и MAPKs в раковых клетках, которые могут имитировать отсутствие факторов роста, которые блокируют сигнальные пути, вызванные фактором роста. Подавляя пути выживания клеток, опосредованных рецепторами смерти, NF-κB увеличивает апоптоз, индуцированный их родственными лигандами TNFα или TRAIL. TNFα играет критическую роль в связанном с воспалением канцерогенезе посредством опосредованной NF-κB клеточной выживаемости и пролиферации 41). Блокирование NF-κB лютеолином сдвигает баланс выживания и смерти клеток в сторону смерти, превращая TNFα из опухолевого промотора в опухолевый супрессор. TRAIL может способствовать распространению и метастазированию в устойчивых к TRAIL раковых клетках с помощью механизма, включающего NF-κB; таким образом, подавление NF-κB лютеолином может сенсибилизировать раковые клетки к TRAIL-индуцированному апоптозу и предотвращать пагубный эффект TRAIL. Лютеолин также подавляет выживание клеток путем ингибирования ингибиторов апоптоза и членов анти-апоптозной семьи Bcl2. Было обнаружено, что лютеолин ингибирует активность PKC, что приводит к снижению уровня белка XIAP путем убиквитинирования и протеасомальной деградации этого антиапоптотического белка. Снижение XIAP сенсибилизирует раковые клетки к TRAIL-индуцированному апоптозу. В дополнение к увеличению белка Bax, лютеолин снижает уровень Bcl-XL в клетках гепатоцеллюлярной карциномы, что повышает соотношение Bax / Bcl-XL и снижает порог апоптоза 42). Кроме того, индуцированный лютеолином апоптоз в клетках предстательной железы и рака молочной железы связан с его способностью ингибировать синтазу жирных кислот (FAS), ключевой липогенный фермент, сверхэкспрессируемый во многих раковых опухолях человека. Хотя в настоящее время данный механизм неясен, ингибирование FAS вызывает апоптоз в раковых клетках.
Анти-ангиогенез
Из-за недостатка достаточного питания и кислорода, сосудистые опухоли не могут иметь диаметр 1-2 мм. Ангиогенез, процесс генерации новых кровеносных сосудов, имеет решающее значение для устойчивого роста опухоли и метастазов. Выращенные в гипоксическом микроокружении, опухолевые клетки секретируют факторы ангиогенеза, такие как фактор роста эндотелия сосудов (VEGF) и матриксные металлопротеазы (MMP) для инициирования ангиогенеза. Было обнаружено, что лютеолин является мощным ингибитором ангиогенеза 43). В модели опухоли ксенотрансплантата мыши, лютеолин ингибировал рост опухоли и ангиогенез в ксенотрансфузированных опухолях. Подавление секреции VEGF и сигналов, индуцированных VEGF, по-видимому, является основным механизмом индуцированного лютеолином антиангиогенеза. Транскрипция гена VEGF усиливается гипоксически-индуцируемым фактором-1α (HIF-1α) 44). Лютеолин может подавлять экспрессию VEGF, ингибируя HIF-1α через p53-опосредованную протеасомную деградацию этого транскрипционного фактора. Кроме того, лютеолин может подавлять индуцированную VEGF сигнализацию в эндотелиальных клетках. Лютеолин эффективно блокировал активацию рецептора VEGF и его нисходящих путей PI3K / Akt и PI3K / p70S6 киназы, которые могут непосредственно способствовать индуцированному лютеолином антиангиогенезу, что приводит к подавлению пролиферации и выживаемости эндотелиальных клеток пупочной оболочки человека. Лютеолин может также подавлять ангиогенез путем стабилизации гиалуроновой кислоты, барьера неоваскуляризации. Гиалуроновая кислота является одним из наиболее распространенных компонентов внеклеточного матрикса, которые блокируют образование и расширение неовакуола. Гиалуронидаза катализирует гиалуроновую кислоту, чтобы разрушить барьер и способствовать ангиогенезу через обработанный продукт. Олигосахариды, образующиеся из гиалуроновой кислоты, связываются с рецептором CD44 на мембранах эндотелиальных клеток, чтобы вызвать их пролиферацию, миграцию и, в конечном счете, ангиогенез. Было обнаружено, что лютеолин является мощным ингибитором гиалуронидазы и поддерживает барьер неоваскуляризации. Кроме того, ангиогенез опухоли зависит от активности ММР, особенно от MMP-9, что делает ингибиторы MMP потенциальным выбором для блокирования ангиогенеза опухоли 45). Таким образом, дополнительный механизм антииогенеза лютеолина может быть вызван подавлением ММР. Действительно, лютеолин является мощным ингибитором ММP, который подавляет экспрессию ММР через подавление NF-κB или непосредственно ингибирует активность MMP.
Анти-метастазирование
Помимо быстрого и непрерывного деления и пролиферации, еще одной важной и уникальной особенностью раковых клеток является их способность проникать в окружающие ткани и мигрировать с основного места на дистальные участки. Этот процесс, а именно, метастазы, способствует более 90% смертности от рака у людей 46). Предполагается, что каскад метастазов состоит из нескольких этапов: локальная инвазия; интравазация в системный оборот; выживание во время транспорта, экстравазация и установление микрометастазов в отдаленных органах; и колонизация макроскопических метастазов. Хотя непосредственных свидетельств того, что лютеолин подавляет метастазы рака, не встречается в литературе, имеющиеся результаты свидетельствуют о том, что лютеолин обладает этой функцией. Во-первых, лютеолин подавляет продукцию и секрецию цитокинов, таких как TNFα и IL-6, которые могут стимулировать миграцию и метастазы раковых клеток 47). TNFα стимулирует экспрессию молекул, участвующих в миграции раковых клеток и метастазов, таких как молекула межклеточной адгезии-1, которая может блокироваться лютеолином. Известно, что IL-6 индуцирует экспрессию MMP-1. Лютеолин мощно ингибирует производство IL-6 и IL-6-индуцированную экспрессию MMP-1. Во-вторых, лютеолин блокирует критические пути передачи сигнала для миграции и метастазов в раковых клетках. Например, активация EGFR связана с миграцией клеток. Блокируя путь передачи сигналов EGFR, лютеолин уменьшает инвазию клеток и метастазы 48). Лютеолин блокирует NF-κB, что является критическим фактором для экспрессии Twist и MMP. Twist – это фактор транскрипции, который важен для эпителиально-мезенхимального перехода для облегчения метастазирования. ММР участвуют в нескольких стадиях метастазов, в том числе, в выходе отдельных опухолевых клеток из первичной опухоли, их интравазация, экстравазация и установление очагов опухолей на вторичных участках. Активность фокальной адгезионной киназы (ФАК) в клетках карциномы человека связана с повышенным инвазивным потенциалом; ингибирующее действие лютеолина на фосфорилирование ФАК может способствовать подавлению способности инвазии клеток ФАК. Наконец, лютеолин непосредственно ингибирует активность фермента MMP или гиалуронидазы для поддержания барьера неоваскуляризации 49), что также может способствовать подавлению метастазирования раковых клеток. Исследования in vitro показали, что лютеолин эффективно ингибирует миграцию и инвазию раковых клеток путем блокирования путей MAPK / ERK и PI3K-Akt. Для доказательства антиметастазного действия лютеолина необходимы эксперименты с метастазированием животным раком.
ЛЮТЕОЛИН КАК ПРОТИВОРАКОВОЕ ИЛИ ХЕМОПРОФЕССИОНАЛЬНОЕ СРЕДСТВО
Как обсуждалось выше, лютеолин индуцирует апоптотическую гибель клеток при различных раковых заболеваниях 50), ингибирует пролиферацию раковых клеток 51) и подавляет ангиогенез опухоли. Таким образом, ожидается, что лютеолин будет обладать предполагаемым противораковым терапевтическим эффектом. Поддерживая результаты in vitro, эксперименты in vivo у бестимусных мышей с ксенотрансфузированными опухолями показали, что лютеолин подавлял рост опухолей, образованных из карциномы кожи человека, гепатомы и клеток рака яичника человека или мышиной карциномы легкого Льюиса дозозависимым образом. Интересно отметить, что в индуцированном 7,12-диметилбенз(а)антраценом (DMBA) канцерогенезе молочной железы в модели крысы Wistar, лютеолин значительно ингибировал частоту возникновения опухолей и уменьшал объем опухоли без изменения общей массы тела животных. Длительное введение не вызвало явной токсичности у крыс (30 мг / кг, перорально в течение 20 дней). Впоследствии лютеолин вызывает маргинальную цитотоксичность в нормальных клетках. Эти результаты предполагают, что лютеолин относительно безопасен при использовании в качестве противоопухолевого агента. Комбинированная терапия с различными противоопухолевыми препаратами может улучшить терапевтическую ценность комбинированных агентов, позволяя использовать более низкие, субтоксичные дозы для достижения более эффективного уничтожения раковых клеток. Лютеолин был протестирован с другими противоопухолевыми препаратами относительно его противораковых свойств и сенсибилизировал различную лекарственную цитотоксичность в различных раковых клетках. Тестируемые препараты включают цисплатин, TRAIL, TNFα и ингибитор mTOR рапамицин. Хотя механизм этой сенсибилизации варьируется в разных раковых клетках или с различными лекарственными средствами, обычно считается, что он подавляется сигналами выживаемости клеток в раковых клетках или активирует пути апоптоза. Раковые клетки часто имеют конститутивно активированные пути выживания клеток, такие как NF-κB и Akt. Терапия рака также активирует эти пути, притупляя их активность, связанную с раковыми клетками 52). Таким образом, подавление лютеолином конститутивных или лекарственно-индуцированных путей выживания клеток способствует сенсибилизированной противоопухолевой активности. Кроме того, лютеолин также способен стимулировать апоптотические пути. Например, индуцированная лютеолином регуляция DRA рецептора TRAIL способствует сенсибилизации не только индуцированной TRAIL, но и другой химиотерапевтической цитотоксичности 53). Таким образом, данные предыдущих исследований показывают, что лютеолин является перспективным средством противораковой терапии. Необходимо провести больше доклинической работы для определения эффективности и безопасности лютеолина в отдельности или в сочетании с другими терапевтическими средствами перед проведением клинических испытаний. Поскольку экстракты из фруктов, таких как черная малина, яблоки и виноград, оказывают противоопухолевую активность, которая связана с подавлением выживания клеток и потенцированием путей апоптоза, интересно определить, способствует ли лютеолин или другие флавоноиды противоопухолевой активности этих плодов. Основываясь на наблюдениях, что лютеолин способен вмешиваться практически во все аспекты канцерогенеза, и он относительно безопасен для животных и людей, считается, что он является потенциальным химиопревентивным средством против рака путем блокирования трансформации клеток, подавления роста опухоли и убийства опухолевых клеток. Использование лютеолина для подавления хронического воспаления может потенциально предотвратить канцерогенез, связанный с воспалением. В модели с фибросаркомой, индуцированной 20-метилхоланиреном, с использованием швейцарских мышей-альбиносов, лютеолин, вводимый в рацион, значительно подавлял опухолевые заболевания, которые связаны с уменьшением пероксидов липидов и цитохрома Р450, повышал активность GST и подавлял синтез ДНК. В мышиной двухступенчатой модели канцерогенеза кожи, местное применение лютеолина перед обработкой 12-тетрадеканоилфорбор-13-ацетатом (ТРА) в мышиной коже, вызванной диметилбензойная кислотой (DMBA), приводило к значительному снижению частоты и множественности опухоли, что связано с ингибированием воспалительной реакции и очистки реактивных кислородных радикалов. В модели карциногенеза толстой кишки, индуцированной 1,2-диметилгидразином (DMH), лютеолин (0,1, 0,2 или 0,3 мг / кг массы тела / суточная доза) значительно уменьшал заболеваемость раком толстой кишки при введении либо на стадии инициации, либо после инициации 54). Результаты показывают, что лютеолин оказывает химиопревентивное и антиканцерогенное действие в сочетании с его антипероксидными и антиоксидантными эффектами против рака толстой кишки. Эпидемиологические исследования показывают, что диетическое потребление флавоноидов обратно связано с риском рака легких, предстательной железы, желудка и молочной железы у людей 55). Тем не менее, существует несколько эпидемиологических данных, предназначенных для изучения роли лютеолина в профилактике рака. Недавнее исследование популяций в связи с употреблением диетических флавоноидов и заболеваемости эпителиальным раком яичников среди 66940 женщин показало значительное (34%) снижение (RR = 0,66, 95% ДИ = 0,49-0,91, р-тренд = 0,01). Данные свидетельствуют о том, что диетическое потребление лютеолина может снизить риск развития рака яичников, хотя необходимы дополнительные проспективные исследования. Было установлено, что диетическое потребление флавонолов и флавонов было обратно связано с риском развития рака легких. Однако, из-за многих вмешивающихся факторов, профилактический потенциал лютеолина для рака легких все еще остается неясным. Следует отметить, что смешанные биологически активные соединения, такие как различные флавоноиды, которые существуют в пищевых продуктах, могут влиять на биологические эффекты друг друга. Различия в образе жизни в исследовании могут повлиять на результаты. Кроме того, вариации в эпидемиологических исследованиях, включая различия в разработке вопросников, базы данных по содержанию флавоноидов в продуктах питания и методы анализа данных, могут существенно влиять на результаты различных исследований. Таким образом, следует проявлять осторожность при интерпретации результатов эпидемиологических исследований. Тем не менее, дальнейшие проспективные исследования на животных и человеке проводятся для проверки воздействия лютеолина на профилактику рака.
ВЫВОДЫ И ПЕРСПЕКТИВЫ
Полученные результаты свидетельствуют о том, что лютеолин обладает множеством полезных свойств, в том числе, являясь противовоспалительным и противоопухолевым агентом. Механизмы, лежащие в основе этих свойств, не были полностью поняты, но частично объясняются редокс-и эстроген-регулирующими свойствами лютеолина. Интересно и важно определить механизм селективной цитотоксичности лютеолина в раковых, но не нормальных клетках. Очевидно, что в нормальных клетках и злокачественных раковых клетках существуют различные механизмы модуляции клеточных сигнальных путей. Например, лютеолин подавляет JNK в макрофагах, в то время как он активирует эту киназу в раковых клетках. Кроме того, лютеолин подавляет NF-κB путем ингибирования активации IKK во время воспаления в эпителиальных клетках и макрофагах 56). Однако, в раковых клетках подавление NF-κB лютеолином, по-видимому, является ядерным событием. Остается определить, обусловлены ли отдельные механизмы различиями в контексте клеток. Поскольку лютеолин ингибирует NF-κB в клетках рака легких и связан с его прооксидантным эффектом, будет интересно определить, зависят ли различные механизмы подавления NF-κB от окислительно-восстановительного статуса клетки или от функции лютеолина регулировать окислительно-восстановительные реакции. Понимание механизмов, несомненно, будет способствовать использованию лютеолина в профилактике и терапии рака. Наконец, хотя он относительно безопасен, было обнаружено, что лютеолин (2% в рационе) ухудшает химически индуцированный колит у мышей. Необходимы дальнейшие исследования для решения вопросов безопасности лютеолина с эффективными дозами для профилактики и лечения рака у людей.
:Tags
Читать еще: MDMA , Дроксидопа (Нортера) , Левосальбутамол , Соматолиберин , Фенилаланин ,










