Содержание
Глутатион
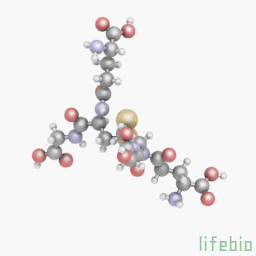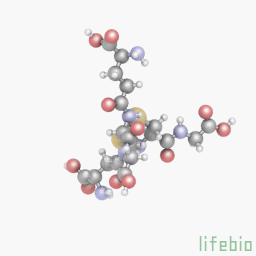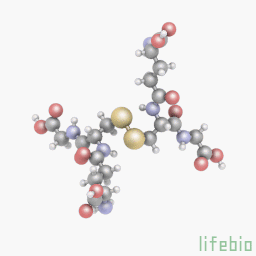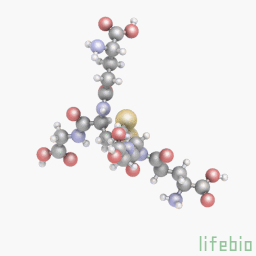
Глутатион является важным антиоксидантом у растений, животных, грибов и некоторых бактерий и архебактерий. Глутатион предотвращает повреждение важных клеточных компонентов, вызванных активными формами кислорода (свободными радикалами и пероксидами). Глутатион – это трипептид с гамма-пептидной связью между карбоксильной группой глутамата боковой цепи и аминогруппой цистеина (присоединенной с помощью нормальной пептидной связи с глицином). Тиоловые группы являются восстановителями, существующими в клетках животных в концентрации примерно 5 мм. Глутатион уменьшает образование дисульфидных связей в цитоплазматических белках с цистеинами, служа в качестве донора электронов. В ходе этого процесса, глутатион преобразуется в свою окисленную форму, глутатион дисульфид (GSSG), также называемый L-(-)-глютатион. После окисления глутатион может быть снова восстановлен при помощи глутатионредуктазы, используя NADPH в качестве донора электронов. Отношение восстановленного глутатиона к окисленному глутатиону в клетках часто используется как мера клеточной токсичности. Промежуточный продукт обмена веществ, эль-цистеин, может повысить уровень глутатиона в теле, но применение этого вещества для повышения уровня глутатиона является неэффективным и затратным.
Фармакологическая группа: пептиды; атиоксиданты
ИЮПАК название: (2S)-2-амино-4-1R-1-карбоксиметил карбамоил-2-сульфанилетил карбамоил бутановая кислота
Другие названия: γ -L- глутамил-L-цистеинглицин
(2S)- 2-амино- 5-2R-1-(карбоксиметиламино)-1-оксо-3-сульфанидпропан-2-ил амино-5- оксопентановая кислота
Молекулярная формула: C10H17N3O6S
Молярная масса: 307,32 г моль-1
Температура плавления: 195 ° С; 383 ° F; 468 К
Растворимость в воде: легко растворим
Растворимость в метаноле, диэтиловом эфире: нерастворим
Краткая информация
Глутатион (γ-L-Glutamyl-L-cysteinylglycine) – это маленькая молекула, содержащая аминокислоту (пептид), в состав которой входят одна молекула Л-глютаминовой кислоты, Л-цистеин, а так же Глицин в каждой отдельной молекуле. Данная молекула является абсолютно естественным составляющим употребляемых нами пищевых добавок, и играет роль главного антиоксиданта в человеческом организме. Действие глутатиона сильно зависит от целостности «глутатионовой системы», которая содержит ферменты, синтезирующие глутатион внутри клетки так же, как и специально предназначенные для этого ферменты, использующие глутатион как катализатор всех антиоксидантных эффектов. Глутатионовая добавка призвана сохранять уже существующий запас глутатиона в клетках и таким образом поддерживать эффективную работу всей системы. Вопреки существующей теории, сам по себе глутатион не имеет специально отведенной для него ниши в системе пищевых добавок, и когда это вещество оказывается целесообразным, то, вероятнее всего, оно является самым дорогостоящим и неэффективным методом для достижения той или иной желаемой цели. Все это, в конечном счете, происходит из-за малого количества фармакокинетических аспектов, которые и делают глутатионовые добавки бездейственными:
- 1) Глутатион – это трипептид, состоящий из трех аминокислот, и, хотя этот особый трипептид может сопротивляться процессу гидролиза, он все равно, по большей мере, всасывается в кишечнике.
- 2) Есть возможность того, что глутатион может абсорбироваться через кишечник в исходной форме, но это вещество в чистом виде попросту не может попасть в клетку; глутатион должен быть предварительно синтезирован из Л-цистеина (двух молекул Л-цистеина, связанных вместе) перед использованием.
- 3) Снабжение Л-цистеином клеток – все, что нужно для того, чтобы повысить уровень глутатионового синтеза, и Н-ацетилцистеин для этих целей – более надежное, действенное средство и дешевое средство, в сравнении с глутатионом.
Как следствие, глутатион – это не прямой и не эффективный метод для обеспечения организма Л-цистеином, который, в свою очередь является тем самым веществом, которое отвечает за все полезные свойства глутатиона. Глутатион синтезируется тогда, когда обеспечивается выработка Л-цистеина. Диетические протеины, включающие в себя богатые Л-цистеином источники, такие как сывороточный белок молока, являются эффективными, однако недейственными методы повысить уровень Л-цистеина. Н-ацетилцистеин в этом случае является одновременно и эффективным и дешевым способом замены глутатиона. В сущности, не существует известных преимуществ от приема глутатиона внутрь, которые не были бы легко имитированы добавкой Н-ацетилцистеина и, теоретически, поддерживались бы с помощью протеиновой диеты, включающей источники пищи, содержащие Л-цистеин (сывороточный белок молока).
Биосинтез
Глутатион не является незаменимым питательным веществом, поскольку может быть синтезирован в организме из L-цистеина, L-глутаминовой кислоты и глицина. Сульфгидрильная (тиоловая) группа (SH) цистеина служит в качестве донора протонов и отвечает за биологическую активность глутатиона. Цистеин является ограничивающим скорость фактором в клеточном синтезе глутатиона, поскольку эта аминокислота относительно редко встречается в пищевых продуктах.
Клетки производят глутатион путем двух аденозинтрифосфат (АТФ)-зависимых шагов:
Во-первых, гамма-глютамилцистеин синтезируется из L-глутамата и [[цистеин|цистеина]] с помощью фермента гамма-глютамилцистеин синтетазы (глутамат цистеин лигазы, ГЦЛ). Эта реакция является лимитирующей стадией в синтезе глутатиона. Во-вторых, глицин добавляется к С-концу гамма-глютамилцистеина через фермент глутатион-синтетазы.
Глутамат цистеин лигаза (ГЦЛ) у животных – это гетеродимерный фермент, состоящий из каталитической (ГЦЛК) и модуляторной (ГЦЛМ) субъединиц. ГЦЛК формирует всю ферментативную активность, в то время как ГЦЛМ повышает каталитическую эффективность ГЦЛК. Мыши, лишенные ГЦЛК (т.е., не способные осуществлять полный синтез глутатиона), умирают до рождения. Мыши, лишенные ГЦЛМ, не проявляют внешнего фенотипа, но у них наблюдается заметное снижение глутатиона и повышенная чувствительность к токсичным воздействиям. В организме человека все клетки способны синтезировать глутатион, однако особенно важным является синтез глутатиона в печени. Мыши с генетической мутацией - отсутствием ГЦЛК в печени (т.е. мыши, не способные синтезировать глутатион) - умирают в течение 1 месяца с момента рождения. Глутамат цистеин лигаза (ГЦЛ) у растений является гомодимерным, редокс-чувствительным ферментом. В окислительной среде образуются межмолекулярные дисульфидные мостики и фермент переходит в димерное активное состояние. Средний потенциал критической пары цистеина составляет 318 мВ. В дополнение к редокс-зависимому контролю, обратная связь фермента ГЦЛ у растения ингибируется глутатионом. ГЦЛ располагается исключительно в пластидах, и глутатион синтетаза направлена на пластиды и цитозоль, таким образом, глутатион и гамма- глутамилцистеин экспортируются из пластид. Оба фермента биосинтеза глутатиона являются жизненно важными для растений. Некоторые бактерии способны осуществлять биосинтез глутатиона, такие как цианобактерии и протеобактерии, однако многие другие бактерии не способны синтезировать глутатион. Большинство эукариот синтезируют глутатион, в том числе человек, но не все, например, бобовые, энтамёбы и лямблии не могут синтезировать глутатион. Единственные археи, которая производит глутатион – галобактерии.
Источники и состав
Происхождение и состав
Глутатион – это небольшая молекула, состоящая из трех аминокислот: Л-цистеина, Л-глютамина и глицина1). Этот трипептид известен как антиоксидант, из-за группы антиоксидантов, к которой его относят (глутатионовая система), в которой он используется, как субстрат для регулирования большинства окислительных процессов в клетке. Глутатион также исполняет роль конъюгата некоторых составляющих в теле и подготовки этих компонентов к удалению из организма. Эта роль была классифицирована, как «детоксикация2) организма», что доказывает приемлемость глутатиона, как пищевой добавки.
Источники и структура
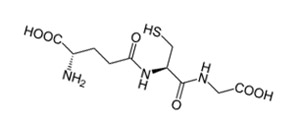 С одной стороны, являясь эндогенным антиоксидантом, глутатион встречается в пищевых добавках, которые, в свою очередь, содержатся в пище. В один образец вещества, содержащийся в одном приеме пищи, входит 34.8 мг глутатиона, но глутатион может содержаться и в больших дозах в других продуктах питания – 13-109.9 мг. Более половины всего получаемого нашим организмом глутатиона содержится в овощах и фруктах, и менее четверти – в мясе. Диетическое содержание глутатиона, однако, не соответствует его системной глутатионовой активности. 3)
Глутатион представлен в рационе человека в составе пищевых продуктов, хотя потребляемые нами дозы этого вещества, даже в самых богатых питательными веществами диетах, оказываются гораздо меньше, чем при приеме внутрь концентрированного вещества или предшественника глутатиона, (Н-ацетилцистеина). Поэтому, в плане диеты, глутатион не кореллирует с общей активностью.
С одной стороны, являясь эндогенным антиоксидантом, глутатион встречается в пищевых добавках, которые, в свою очередь, содержатся в пище. В один образец вещества, содержащийся в одном приеме пищи, входит 34.8 мг глутатиона, но глутатион может содержаться и в больших дозах в других продуктах питания – 13-109.9 мг. Более половины всего получаемого нашим организмом глутатиона содержится в овощах и фруктах, и менее четверти – в мясе. Диетическое содержание глутатиона, однако, не соответствует его системной глутатионовой активности. 3)
Глутатион представлен в рационе человека в составе пищевых продуктов, хотя потребляемые нами дозы этого вещества, даже в самых богатых питательными веществами диетах, оказываются гораздо меньше, чем при приеме внутрь концентрированного вещества или предшественника глутатиона, (Н-ацетилцистеина). Поэтому, в плане диеты, глутатион не кореллирует с общей активностью.
Биологическое значение
Глутатион – это трипептид (Л-глютаминовая кислота, Л-цистеин и Глицин), который является одним из самых важных ферментативных антиоксидантов в человеческом теле, и это субстрат для системы регуляции энзимов, вовлеченных в стабилизацию глутатионового обмена. Глутатион – это промежуточное звено в «глутатионовой системе», которое отвечает за стабилизацию окислительных процессов. Энзим, известный как Глютамил-цистеин синтетаза, это глютамат-цистеин лигаза, вовлеченная в синтез глутатиона. В частности, этот фермент является катализатором первой реакции синтеза – это соединение глютамата и цистеина в форму дипептида, известную как y-глютамин-цистеин. 4) Этот энзим является целью некоторых фармакологических исследований, дающих оценку роли глутатиона в клетке, так как он может ингибироваться Бутионин сульфоксимином, в результате чего происходит вымывание из кишечника глютамил-цистеина. И чем больше увеличивается число подобных эффектов, тем сильнее становится глутатионовая активность и действие антиоксидантов в клетках. Дефицит глютамил-цистеина приводит к истощению как глутатиона, так и замедляет действие передачи вещества клетками5). Из-за низких показателей глутатиона, как вещества, регулирующего энзимы (как в клетках бактерий, так и в клетках грызунов; последние исследования показали гомологичность с человеком[11]), маловероятно производство глутатиона из-за высокой активности фермента. Второй энзим, вовлеченный в синтез глутатиона, это фермент глутатион-синтетазы, который берет y-глютамил-цистеин, созданный в предыдущей ферментативной реакции, и присоединяет к нему глицин, вследствии чего и формируется трипептид – глутатион6). Этот энзим содержится в дрожжах и различных бактериях, хотя существует мало сходства между видами энзима у крыс и человека[13][14], а ведь образец грызунов (крыс) на 88% сходен с человеческим образцом7). Этот энзим, по всей видимости, использует Cys-422 для функционирования в человеческом организме, а его функции могут ингибироваться в экспериментах с Метионин сульф-оксимином. Лимитирующая стадия синтеза глутатиона не представляет из себя активность обоих энзимов в нормальных условиях, но скорее является произведением одной из амино-кислот (Л-цистеина), входящей в состав трипептида; поэтому, добавление Н-ацетилцистеина иногда используется для увеличения активности глутатионового синтеза (однако, после того, как Н-ацетилцистеин деактивируется в форму Л-цистеина) 8). Синтез глутатиона в организме включает в себя два фермента, первый из которых связывает L-цистеин и глутаминовую кислоту друг с другом в гамма-конфигурации (продуизводя γ-глютамил-цистеин), а второй фермент добавляет молекулу глицина, чтобы, в конечном счете, образовался глутатион. Сам глутатион (GSH) присутствует как в восстановленной форме, известной как восстановленный глутатион (rGSH), который проявляет антиоксидантное действие, так и окисленной форме (GSSG), после того, как он проявляет антиоксидантное воздействие на цели; две эти формы формируют соотношения, известное как отношение GSH / GSSG, где последняя форма обычно составляет 98% от общего количества глутатиона, и изменения в соотношении могут означать изменения в клеточном окислительном балансе. Окисленный глутатион (GSSG) может быть превращен обратно в GSH через фермент никотинамид аденин динуклеотид фосфат – зависимый от фермента глутатион дисульфида редуктазы[12], и активность этого фермента, по всей видимости, частично контролируется самим глутатионом. Активность этого фермента, очевидно, является одним из основных факторов в общем соотношении GSH / GSSG9). Глутатион существует в двух формах: в восстановленной форме (rGSH) и окисленной форме (GSSG). Отношение rGSH к GSSH указывает на общее состояние окисления в клетке, а увеличение окисленных форм глутатиона (GSSG) по отношению к восстановленной форме (rGSH) означает чрезмерное окисление. Ферменты-антиоксиданты, которые являются причиной антиоксидантных эффектов глутатиона, известны как глутатион S-трансферазы (GSTS). Они работают, заставляя молекулу глутатиона отдавать пару электронов (это явление называется «нуклонной атакой») и позволяя этой атаке успешно достичь цели, которая может принимать электроны (электрофильные цели), что в результате и приводит к передаче электронов. Сама эта передача и является антиоксидантным эффектом10). GST ферменты разделены на восемь различных классов для млекопитающих: альфа (α) 11), мю (μ) 12), пи (π) 13), тета (θ) 14), дзета (ζ) 15), сигма (σ) 16), омега (ω), и митохондриальная каппа (κ) [28][29] , и на два подсемейства растворимых GSTS, расположенных в цитозоле (за исключением каппа) и микросомальных GST, известных как мембранно-ассоциированные белки, участвующие в метаболизме эйконазоидов и глутатиона (MAPEG), которые связаны с клеточными мембранами17). Другая группа ферментов – глутатион-пероксидазы (GPx), ферменты, которые используют трипептиды глутатиона для снижения перекисного окисления липидов и содержания перекиси водорода в воде, действующие с различной эффективностью и на различные цели, в зависимости от того, какой из восьми изомеров исследуется18). Эти ферменты являются селен-зависимыми, и снижение их активности в организме может повлечь дефицит селена. Глутанин S-трансферазы (GST) и глутатион пероксидазы (GPx) – ферменты, являющиеся посредниками многих антиоксидантных действий глутатиона. Помимо использования глутатиона в качестве субстрата его же ферментами для оказания антиоксидантного действия, он может непосредственно модифицировать остатки L-цистеина в белки. Этот процесс называется S-глутатионилирование19), и, в целом, этот процесс модифицирует воздействие белков на организм, участвует в регуляции считывания генетического кода и обеспечивает как хорошую свертываемость белков, так и их распад20). В то же время, актуальность этой информации, описывающей глутатион как пищевую добавку (или глутатиона из N-ацетилцистеина), неизвестна. Сам глутатион может изменять функцию белка с помощью процесса, известного как S-глутатионилирование, который не зависит от его классических антиоксидантных свойств.
Фармакология
Абсорбция
Глутатион, будучи небольшой пептидной молекулой, подлежит гидролизу (расщеплению) в тонком кишечнике, как правило, с помощью γ-глутамилтрансферазы в щеточной каемке тощей кишки21), где преобладают ферменты. Там также может происходить гидролизная пост-абсорбция, так как глутатион, в основном, расщепляется на составляющие его аминокислоты, увеличивая концентрации Л-цистеина в сыворотке крови22). В клетках кишечника человека находится так называемый «транспортер для поглощения глутатиона» 23). Содержание глутатиона повышается в сыворотке крови и тканях у крыс, когда глутатион использовался в качестве пищевой добавки. В целом, дейсвтие глутатиона из пищевых добавок в организме человека не совпадает с действием этого вещества из пищи. Диетический (содержащийся в пище) глутатион или глутатион в чистом виде, при глотании может быть расщеплен на составные аминокислоты в кишечнике и в крови, хотя существует возможность того, что глутатион может расщепиться с помощью абсорбции в кишечнике.
Иммунная сыворотка (сыворотка крови)
Употребление в пищу 3 грамм глутатиона (0,15 / кг) в форме раствора здоровыми субъектами не показало увеличения концентрации циркулирующего глутатиона в течение следующих 270 минут, в сравнении с исходной концентрации24). Четыре недели употребления добавок по 1000 мг не повлияли на количество эритроцитов, и вливание (в форме настоя) глутатиона показало, что увеличение в сыворотке крови Л-цистеина, приблизительно эквивалентно количеству Л-цистеина в глутатионе25) (в его обычной форме), а это предполагает расщепление вещества в сыворотке крови. Глутатион нестабилен в крови, и с помощью перорального или внутривенного введения, глутатион будет легко восстанавливаться в Л-цистеин или другие молекулы, содержащие серу.
Клеточная динамика
Глутатион синтезируется внутриклеточно, и в то время как это может привести к оттоку вещества из клетки, глутатион все равно стремится к гидролизу, чтобы расщепиться на составные аминокислоты, дабы потом быть поглощенным клетками и повторно синтезироваться внутри клетки в глутатион (основное вещество). Глутамилтранспептидаза расщепляет химическую связь γ-глутамила в глутатион, производя цистеин-глицин дипептид и фрагмент γ-глутамила, который связан с другой аминокислотой (обычно это цистин, продукт объединения двух молекул Л-цистеина 26)) для внеклеточной транспортировки, и при достижении γ-глутамил аминокислоты другой ткани, дипептид расщепляется с помощью энзима, отвечающего за транспорт веществ от клетки к клетке. Таким образом, освобождаются аминокислоты, которые, в свою очередь, помогают произвести циклическую форму глутаминовой кислоты (5-оксопролин), которая преобразуется в глутамин с помощью 5-оксопролина27). Так как глутатион является трипептидом, может произойти эманация его из клетки, он не может быть поглощен обратно в большинство интактных клеток. Это приводит к базовому количеству содержания глутатиона в сыворотке крови, нормальный диапазон которого составляет 3.8-5.5μM с периодом полураспада около 14,1 +/- 9,2 мин. Клетки, которые были отмечены как способные поглощать глутатион в его нетронутом состоянии, включают гепатоциты (HepG2 28)), кишечные клетки слизистой оболочки29), и клетки сетчатки. Глутатион может быть экспортирован из клеток, где он синтезируется, и, таким образом он, в какой-то степени, существует в своей интактной форме в крови. Большинство клеток, однако, должны расщеплять это вещество, чтобы иметь возможность его абсорбировать.
Вторая фаза взаимодействия ферментов
Глутатион может быть конъюгирован с другими молекулами, участвующими во второй фазе взаимодействия ферментов. Этот процесс обычно называют «процессом детоксикации», так как эти соединения «помечают» определенные молекулы для их удаления с помощью печени и почек30). В некоторых случаях соединения глутатиона служат для биоактивации целевых молекул. Этот процесс применим как к ксенобиотикам (процессы, происходящие из вне тела), а также к некоторым эндогенным молекулам, таким как стероиды и простагландины31). Эти ферменты являются глутатион S-трансферазами (GSTS), и их соединительная реакция аналогична антиоксидантной реакции, где глутатион выполняет нуклонную атаку (отдает пару электронов) по отношению к электрофильным (свободным для приема электронов) молекулам в процессе слияния. После конъюгации, она либо выталкивается сразу из печени в кишечник (образуя фекальный метаболит), либо продолжает свой путь через почки, где, в конечном счете, выводится с мочой в виде ацетилированного Л-цистеина, более известного как меркаптуровая кислота. Глутатион использует ферменты глутатион S-трансферазы (GST) для того, чтобы соединять вместе определенные молекулы. Это слияние изменяет структуру молекул, и в то время как, в большинстве случаев, этот процесс играет роль детоксикации, помогая удалять конкретные молекулы из тела, в нескольких случаях так же было отмечено, что процесс может повысить действие/ токсичность молекул.
Функции глутатиона
Глутатион существует как в восстановленной, так и в окисленной форме. В восстановленном состоянии тиольная группа цистеина может жертвовать восстанавливающий эквивалент (H++е-) в другие нестабильные молекулы, такие как активные формы кислорода. Жертвуя электрон, глутатион сам становится реактивным, но легко реагирует с другим реактивным глутатионом, образуя глутатион дисульфид. Такая реакция возможна благодаря относительно высокой концентрации глутатиона в клетках (до 5 мм в печени).
Глутатион выполняет несколько функций:
Он является основным эндогенным антиоксидантом, производимым в клетках, непосредственно участвуя в нейтрализации свободных радикалов и реактивных соединений кислорода, а также в поддержании экзогенных антиоксидантов, таких как [[витамин_с|витамины С]] и [[витамин_е|Е]] в их активной (восстановленной) форме. Регулирование азотно-оксидного цикла, играющего важную роль в организме Он используется в метаболических и биохимических реакциях, таких как синтез и репарация ДНК, синтез белка, синтез простагландинов, транспорт аминокислот и активация ферментов. Таким образом, каждая система организма может зависеть от состояния системы глутатиона, особенно иммунная система, нервная система, желудочно-кишечный тракт и легкие. Он играет важную роль в метаболизме железа. Клетки дрожжей, имеющие низкие или токсические уровни глутатиона, испытывают недостаток железа и ухудшение деятельности экстра-митохондриальных ферментов ISC, а затем смерть.
Роль глутатиона в организме животных
Глутатион является субстратом реакций конъюгации и восстановительных реакций, катализируемых ферментами глутатион S-трансферазы в цитозоле, микросомах и митохондриях. Тем не менее, вещество также может участвовать в неферментативном сопряжении с некоторыми химическими веществами. В случае N-ацетил-p-бензохинон имина (NAPQI), реактивный цитохром Р450-реактивный метаболит, образуется при участии парацетамола (или, как он известен в США, ацетаминофена), который становится токсичным при снижении запасов глутатиона при передозировке ацетаминофена, глутатион является важным противоядием при передозировке. Глутатион сопрягается с NAPQI и служит его детоксикации. В этом качестве он защищает тиольные группы клеточного белка, которые в противном случае становятся ковалентно модифицированы. При истощении запасов глутатиона NAPQI начинает реагировать с клеточными белками, убивая в ходе этого процесса клетки. Предпочтительным средством для лечения передозировки этого болеутоляющего является введение (обычно в распыленном виде) N-ацетил-L-цистеина (часто в виде препарата под названием Mucomyst), который клетки превращают в L-цистеин и используют в синтезе глутатиона. Глутатион участвует в синтезе лейкотриенов и служит кофактором для фермента глутатионпероксидазы. Он также играет важную роль в качестве гидрофильной молекулы, которая добавляется к липофильным токсинам и отходам в печени при биотрансформации, прежде чем стать частью желчи. Глутатион также необходим для детоксикации метилглиоксаля, токсина, полученного в качестве побочного продукта метаболизма. Эта реакция детоксикации осуществляется системой глиоксалазы. Глиоксалаза I катализирует превращение метилглиоксаля и восстановленного глутатиона в SD- лактоил-глютатион. Глиоксалаза II катализирует гидролиз SD- лактоил- глутатиона в глутатиона и D-молочную кислоту. Не так давно глутатион начали применять в качестве ингибитора меланина в косметической промышленности. В таких странах, как Япония и Филиппины, этот продукт продается в виде мыла для отбеливания кожи. Глутатион конкурентно ингибирует синтез меланина в реакции тирозиназы и L-ДОФА, снижая способность L-ДОФА к связи с тирозиназой в процессе синтеза меланина. Ингибирование синтеза меланина обращалось при повышении концентрации L-ДОФА, но не за счет увеличения тирозиназы. Несмотря на то, что синтезированный меланин агрегировался в течение одного часа, это агрегирование ингибировалось при добавлении глутатиона. Эти результаты показывают, что глутатион ингибирует синтез и агглютинацию меланина, ингибируя функцию L-ДОФА».
Функция в растениях
У растений глутатион играет важную роль в биотической и абиотической борьбе со стрессом. Он является ключевым компонентом цикла глутатион-аскорбат, системы, которая восстанавливает ядовитую перекись водорода. Вещество является предшественником фитохелатинов, олигомеров глутатиона, которые хелируют тяжелые металлы, такие как кадмий. Глутатион необходим для эффективной защиты от растительных патогенов, таких как Pseudomonas syringae и Phytophthora Brassicae. APS-редуктаза, фермент пути ассимиляции серы, использует глутатион в качестве донора электронов. Другие ферменты, использующие глутатион в качестве субстрата, является глутаредоксин, эти маленькие оксидоредуктазы участвуют в развитии цветка, образовании салициловой кислоты и защитных реакциях растения.
Пищевые добавки
Повышение уровня глутатиона путем приема пищевых добавок довольно маловероятно. Исследования показывают, что при пероральном приеме глутатион плохо всасывается через желудочно-кишечный тракт. В исследовании постоянного перорального приема очень больших доз (3 г) перорального глютатиона, Witschi и его коллеги обнаружили, что «препарат не увеличивает уровни циркулирующего глутатиона до клинически полезного уровня при пероральном применении разовой дозы 3 г глутатиона». Однако, соответствующие уровни глутатиона можно увеличить и поддерживать за счет увеличения ежедневного потребления богатых цистеином продуктов и / или добавок. Кальцитриол (1,25 дигидроксивитамин D3), активный метаболит витамина D3, после синтезируемый из кальцифедиола в почках, увеличивает уровень глутатиона в мозге и может быть катализатором для производства глутатиона. Кальцитриол может увеличивать уровни глутатиона в крысиных первичных культурах астроцитов в среднем на 42%, увеличивая концентрации белка от 29 нмоль / мг до 41 нмоль / мг, через 24 и 48 часов после введения, причем этот эффект уменьшался до 11%, по отношению к контрольной группе, через 96 часов после введения. Организму для переработки витамина D3 в кальцитриол требуется около десяти дней. Другие добавки, в том числе S-аденозилметионин (SAMe) и сывороточный белок также увеличивают клеточное содержание глутатиона. N -ацетил цистеин (NАЦ) доступен как в качестве лекарственного средства, так и в качестве пищевой добавки, и оказывает положительное влияние на производство глутатиона. Альфа-липоевая кислота восстанавливает внутриклеточный глутатион. Мелатонин стимулирует связанный фермент, глутатионпероксидазу. Глутатион является регулируемым внутриклеточным компонентом, и его производство ограничивается ингибированием его собственного синтеза через фермент гамма-глутамилцистеин синтетазы, что значительно минимизирует любую возможность передозировки. Увеличение уровня глутатиона при применении прекурсоров синтеза глутатиона или внутривенного приема глутатиона – это стратегия, разработанная для лечения дефицита глутатиона, высокого окислительного стресса, иммунной недостаточности, и передозировки ксенобиотиками. Низкие уровни глутатиона обычно наблюдаются при дефиците баланса азота, при раке, ВИЧ / СПИДе, сепсисе, травмах, ожогах и спортивных перегрузках. Прием добавок глутатиона может противостоять этому процессу, и при СПИДе, например, приводит к улучшению показателей выживаемости. Тем не менее, в исследованиях многих этих заболеваний не удалось провести различия между низким уровнем глутатиона в результате постоянного (как у пациентов с сепсисом) или хронического (как в случае ВИЧ) увеличения окислительного стресса и увеличения патологии в результате уже существующих недостатков. Ограниченная серия тематических докладов и небольших клинических испытаний показывает, что окислительный стресс может быть фактором, лежащим в основе патофизиологии биполярного расстройства, большого депрессивного расстройства и шизофрении. Пополнение запасов глутатиона с использованием N-ацетил цистеина снижает симптомы обоих расстройств. Глутатион является основным антиоксидантом в мозгу. Уменьшение уровней глутатиона увеличивает уязвимость клеток к окислительному стрессу; характеризуется накоплением активных форм кислорода. Истощение глутатиона также влияет на клеточную предрасположенность к апоптозу. Глутатион также может содержать значительные количества глутамата в мозгу.
Рак
Предварительные результаты показывают, что глутатион изменяет уровни активных форм кислорода в изолированных клетках, выращенных в лаборатории, и может снижать развитие рака. Ни один из этих тестов не был проверен на людях. Однако повышенный уровень глутатиона в опухолевых клетках защищает раковые клетки в костном мозге, груди, толстой кишке, гортани и легких при развитии рака, создавая резистентность ряду химиотерапевтических препаратов.
Патология
Избыток глутамата в синапсах, который может быть высвобожден при таких условиях, как черепно-мозговые травмы, может предотвратить поглощение цистеина, необходимого составного вещества глутатиона. Без защиты от окислительного повреждения, обеспечиваемой глутатионом, клетки могут быть повреждены или убиты.
Методы определения глутатиона
Восстановленный глутатион может быть визуализирован с использованием реагентов Эллмана или производных биманов, таких как монобромобиман. Метод использования монобромобимана является более чувствительным. В этой процедуре клетки лизируются и тиолы экстрагируются с использованием буфера соляной кислоты. Затем тиолы восстанавливают при помощи дитиотреитола (ДТТ) и отмечается монобромобиманом. После связывания с глутатионом монобромобиман становится люминесцентным. Затем тиолы затем разделяют с помощью ВЭЖХ и флуоресценция количественно оценивается при помощи флуоресцентного детектора. Биман также можно быть использован для количественного определения глутатиона в естественных условиях. Количественное измерение производится с помощью конфокальной лазерной сканирующей микроскопии после нанесения краски на живые клетки. Другой подход, который позволяет измерять окислительно-восстановительный потенциал глутатиона при обширном пространственном и временном растворении в живых клетках на основе окислительно-восстановительных изображений с использованием редокс-чувствительного зеленого флуоресцентного белка (roGFP) или редокс-чувствительного желтого флуоресцентного белка (rxYFP).
Использование в виноделии
 Содержание глутатиона в сусле определяет эффект бурого окрашивания при производстве белого вина путем.
Содержание глутатиона в сусле определяет эффект бурого окрашивания при производстве белого вина путем.
Сердечнососудистые заболевания
Сердечная ткань
Исследования, проведенные на крысах, в ходе которых грызуны регулярно бегали на беговой дорожке, показали, что пищевые добавки из 5 г / кг глутатиона в течение 17 дней, даваемые до ишемической реперфузии, проявили защитный эффект; глутатион снижает вероятность появления ишемии, увеличивая свою концентрацию в левом желудочке сердца, и также вызывает улучшение сократимости сердечной мышцы (+ DP / DT). Все эти тесты показали, что глутатион действует лучше в сочетании с физическими упражнениями. 32)
Воспаления и иммунология
Вирусологическое взаимодействие
Макрофаги, находящиеся в человеческом организме, инфицированном ВИЧ-инфекцией, имеют более высокую концентрацию GSSG (относительно восстановленного глутатиона), чем макрофаги у неинфицированных людей[59]. Считается, что это связано с пониженной экспрессией глутамин-цистеин-лигазы (GCLC), наблюдаемой в организме людей с ВИЧ-инфекцией в макрофагах. 33) Макрофаги, выделенные из организмов ВИЧ-инфицированных пациентов, находящихся на постоянной антиретровирусной терапии, были инкубированы с микробактерией туберкулеза и 5-10μM глутатиона, что привело к увеличению восстановленного глутатиона (53-93% в ВИЧ + и 80-83% в контрольной группе ВИЧ), который совпал с Н-ацетилцистеином всего лишь в 10 мМ. Разница в содержании активного вещества сохранялась при оценке перекисного окисления липидов (через анализ малонового диальдегида) и в снижении внутриклеточного роста микробактерий туберкулеза.
Взаимодействие с окислением
Супероксид
Супероксид (O2-) получают, когда один электрон извлекается молекулой кислорода (O2) или впоследствии выработки побочного продукта метаболических реакций34). Супероксид является свободным радикалом, с которым как Н-ацетилцистеин, так и глутатион могут непосредственно и неэнзиматически контактировать, хотя константы скорости таких реакций являются слабыми (и, таким образом, эти антиоксиданты имеют низкую эффективность). Образование супероксида является общим первым этапом в производстве оксиданта, так как окислитель О2 способен легко пересекать мембраны (по аналогии с Н2О2, но не О2 -)35), и так как О2 повсеместно требуется для метаболических реакций. Ферменты, которые используют глутатион, чтобы оказывать ферментативные и антиоксидантные свойства (пероксидазы и S-трансферазы), кажется, не имеют мощного антиоксидантного воздействия на радикал, и эндогенное отторжение некротизированного участка от сохранивших жизнеспособность тканей от О2, как правило, обрабатываются супероксид дисмутазами (SOD), которые преобразовываются в супероксид перекиси водорода (H2O2). 36) Супероксид является одним из основных свободных радикалов, которые могут оказывать окислительное воздействие в клетке, и обычно обрабатываться с помощью фермента супероксид дисмутазы, который преобразует его в перекись водорода по мере уменьшения концентрации глутатиона; глутатион и его ферменты не имеют особенного антиоксидантного потенциала непосредственно в восстановлении супероксида.
Перекись водорода
Супероксидный радикал преобразуется в перекись водорода (H2O2) с помощью супероксид дисмутазы (SOD), и как только это происходит, фермент глутатион пероксидазы (GPx) способен свести его к H2O с помощью использования двух глутатион трипептидов (и последующего формирования GSSG) 37). Н2О2 может также быть получен как побочный продукт аэробных метаболических реакций. Антиоксидантный фермент – «каталаза» (гемсодержащий фермент), также удаляет H2O2 путем ее разложения на воду и кислород. 38) Каталаза и GPx действуют совместно, поэтому Н2О2 может инактивировать каталазу при высоких концентрациях, и, по-видимому, каталаза может быть защищена от инактивации благодаря глутатион пероксидазе39). Глутатион, использующий фермент GPx, играет, наряду с каталазой, роль в восстановлении потенциальных соединений окислителя, известного как перекись водорода (H2O2). Эти ферменты могут преобразовать перекись водорода обратно в воду (или в воду или кислород, в случае каталазы).
Гидроксил
Гидроксильный радикал (OH •, нейтральная форма гидроксида имеет формулу ОН) является мощным радикалом, производимым путем реакции О2 и железа через «реакцию Фентона» (реакция перекиси водорода с ионами железа, которая используется для разрушения многих органических веществ). В отличие от О2 и Н2О2, которые являются умеренными и обратимыми окислителями, OH • является необратимым модификатором белковых структур. Считается, что гидроксильные радикалы выступают посредником в устранении многих негативных реакций, связанных с повышенной концентрацией H2O2 в клетках, таких как, например, повреждения ДНК. 40)
Система периферийных органов
Кишечник
Воспалительные заболевания кишечника, включая неспецифический язвенный колит41) и болезнь Крона, характеризуются увеличением окислительного стресса и одновременным понижением уровня окислительной защиты, которую обеспечивает, например, концентрация глутатиона. В желудочно-кишечной ткани глутатион является основным неферментативным антиоксидантом. И, так как меры, применяемые для сохранения этого вещества, как правило, так же применяются для уменьшения воспалений и окислительного стресса у животных с этими же болезнями42), глутатион, таким образом, был признан в качестве терапевтического средства. У крыс, инъекция глутатиона (200 мг / кг) за час до индукции колита через тринитро бензен сульфатическую кислоту (TNBS), проявляет защитный эффект по сравнению с физиологическим раствором. После введения 50 мг / кг глутатиона в виде инъекций ежедневно, в течение восьми недель после индуцирования колита, отмечается практически полное удаление перекисного окисления липидов и самого воспаления. 43) В исследованиях на людях, проходящих лечение мезаламином, использовались дополнительные 800 мг Н-ацетилцистеина (который может восстановить уровень глутатиона), или плацебо. Защитный эффект при комбинированной терапии был легким и не достигал статистической значимости.
Мужские половые органы
Мужское бесплодие – это состояние, которое характеризуется чрезмерным окислительным стрессом, поэтому предполагается возможная терапевтическая роль антиоксидантов в целом. 44) В частности, дефицит глутатион пероксидазы (из-за дефицита селена), по-видимому, приводит к дефектам подвижности и морфологии, путем воздействия на среднюю часть сперматозоида (раздел между его головой и хвостом). 45) Терапевтический эффект глутатиона был подтвержден в одном исследовании, где использовалось 600 мг глутатиона в качестве внутримышечных инъекций, что, в свою очередь, улучшало подвижность сперматозоидов. 46) Этот конкретный вывод (улучшение подвижности) был также отмечен в лабораторном исследовании, когда Н-ацетилцистеин использовался бесплодными мужчинами в течение трех месяцев в дозе по 600 мг ежедневно. 47) Инъекции глутатиона могут улучшить мужскую плодовитость за счет улучшения морфологии и подвижности сперматозоидов. Этот эффект также отмечается в предварительных исследованиях с использованием пероральной добавки из N-ацетилцистеина; никаких исследований с использованием пищевых добавок глутатиона в настоящее времени проведено не было.
Долголетие и продление жизни
Обоснование
Содержание глутатиона в клетках снижается в процессе старения даже при отсутствии заболеваний, 48), что приводит к повышению окислительных процессов в организме. 49) По крайней мере, у стареющих крыс, причиной этого, как представляется, является снижение синтетической мощности на второй стадии анаболизма глутатиона (катализируемой глутатион-синтетазой). При этом нет каких-либо изменений в метаболизме γ-глутамилтранспептидазы или восстановлении вещества в качестве антиоксиданта при помощи глутатион редуктазы, хотя этот механизм не был исследован на людях. Было установлено, однако, что скорость синтеза глутатиона (дробного и абсолютного) у пожилых людей ниже, по сравнению с контрольным уровнем у молодых людей. Это снижение может быть связано со снижением оборота белка во всем теле (смена состава БЖУ происходит при старении организма), которое уменьшило бы пулы глицина и цистеина, нужные для синтеза глутатиона. В самом деле, уровень глутатиона в эритроцитах, а также входящие в его состав аминокислоты Л-цистеин и глицин (не глутамат), были отмечены в меньших количествах у пожилых людей, чем у молодежи. При употреблении пищевых добавок Н-ацетилцистеина (100 мг / кг Л-цистеин) и глицина (100 мг / кг) было отмечено восстановление концентрации глутатиона на 94,6% в течение двух недель, относительно уровня синтеза глутатиона, который наблюдается в молодости50). Недостаточное потребление белка в пищу также может повлечь снижение уровня глутатиона. Однако, как снижение синтеза глутатиона, так и смену его состава можно вызвать и у здоровых взрослых людей, путем ограничения уровня потребляемого в пищу белка51) или только серосодержащих аминокислот, находящихся в пищевом белке52). Уровень глутатиона, по всей видимости, снижается у пожилых людей по сравнению с юношескими показателями, даже в случае, если нет никаких очевидных болезненных состояний. Принимая в пищу аминокислоты, являющиеся предшественниками глутатиона (Л-цистеина и глицина), можно восстановить уровень глутатиона у тех людей, у которых в молодые годы уровень глутатиона восстанавливался довольно быстро.
Другие медицинские условия
Аутизм
Метаболизм глутатиона был исследован на людях, страдающих аутизмом. Аутизм связан с повышением окислительных метаболитов, таких как малоновый диальдегид (MDA) 53), и восстановленных минеральных хелатов, таких как серулоплазма и трансферрин (приводящих к производству большего количества свободных минералов, которые, как известно, вносят свой вклад в процесс проявления окислительного стресса) 54). Все это позволяет предположить, что в целом состояние организма детей, страдающих аутизмом, является более проокислительным, чем антиокислительным. Плазменные уровни глутатиона и его восстановленной формы55) находятся в низком содержании у детей аутистов, в сравнении с контрольной группой, а уровень окисленного глутатиона – выше. Не было обнаружено изменений в деятельности глутатион редуктазы у детей, страдающих аутизмом, и контрольной группой, хотя глутатион пероксидаза имеет различные показатели, (подавление56) и повышение57) – оба показателя были зафиксированы). Соотношение GSSG: GSH (обычно указывает на активность глутатион редуктазы[19]) также повышается, что свидетельствует о большем окислении у аутистов, по сравнению с контрольной группой. Аутизм в целом – это состояние, характеризующееся чрезмерным оксилительным стрессом, по сравнению с контрольной группой. Так как глутатион является основной составляющей антиоксидантной системы в организме, антиоксидантные расстройства во всем теле распространяются на глутатион-систему, которая, как доказано, менее активна у детей с аутизмом, относительно контрольной группы. Одно исследование с участием детей-аутистов было проведено с использованием либо пищевых добавок (жирорастворимый глутатион по 50-200 мг на примерно13 кг веса по два раза в день в возрастающих дозах), либо трансдермальных добавок (135-405 мг в три приема в возрастающих дозах). Исследование отметило незначительные увеличения общего количества глутатиона в обоих методах лечения и увеличение восстановленного глутатиона в крови у группы, принимавшей пищевые добавки; так как изучение измеряло базовую тяжесть аутизма, эти измерения не повторялись после болезни.
Взаимодействие с питательными веществами
Альфа-липоидная кислота
 Альфа-липоидная кислота (ALA) является тиолсодержащим антиоксидантом, который производится в митохондриях из октановой кислоты, используется в качестве РЕДОКС антиоксиданта (имеющего окисленную и восстановленную формы) и митохондриального ферментативного кофактора.58) Хотя он имеет сходство с глутатионом в том, что в нем есть серосодержащий антиоксидант, в отличие от глутатиона, альфа-липоидная кислота может обеспечить абсорбцию из кишечника в нетронутом виде и может эффективно использоваться организмом в виде пищевой добавки. 59)
ALA, по всей видимости, играет роль в синтезе глутатиона. Глутатион не может передаваться между интактными клетками; вместо этого, Л-цистин транспортируется между клетками, чтобы обеспечить Л-цистеин для синтеза глутатиона. Так как Л-цистин является продуктом окислительной деятельности Л-цистеина (две окисленные молекулы Л-цистеина связаны друг с другом), ALA может объединять молекулы Л-цистина в две аминокислоты Л-цистеина и, тем самым, увеличивать уровень синтеза глутатиона, освобождая его предшественник, который является субстратом, необходимым для стадии синтеза, лимитирующей скорость реакции при общем синтезе глутатиона. Кроме того, GSSG (окисленная форма глутатиона) может быть непосредственно превращена обратно в rGSH с помощью снижения уровня альфа-липоидной кислоты, которая, в свою очередь, становится его окисленной формой (дигидролипоидная кислота). Эта общая поддерживающая роль альфа-липоидной кислоты в деятельности глутатиона была отмечена в различных клеточных исследованиях60), и, кажется, может осуществляться даже в естественных условиях у крыс, при наличии в организме 16 мг / кг АЛК.
Альфа-липоидная кислота может уменьшить количество окисленного глутатиона, тем самым повышая эффективность и сохраняя действия глутатиона в клетке.
Альфа-липоидная кислота (ALA) является тиолсодержащим антиоксидантом, который производится в митохондриях из октановой кислоты, используется в качестве РЕДОКС антиоксиданта (имеющего окисленную и восстановленную формы) и митохондриального ферментативного кофактора.58) Хотя он имеет сходство с глутатионом в том, что в нем есть серосодержащий антиоксидант, в отличие от глутатиона, альфа-липоидная кислота может обеспечить абсорбцию из кишечника в нетронутом виде и может эффективно использоваться организмом в виде пищевой добавки. 59)
ALA, по всей видимости, играет роль в синтезе глутатиона. Глутатион не может передаваться между интактными клетками; вместо этого, Л-цистин транспортируется между клетками, чтобы обеспечить Л-цистеин для синтеза глутатиона. Так как Л-цистин является продуктом окислительной деятельности Л-цистеина (две окисленные молекулы Л-цистеина связаны друг с другом), ALA может объединять молекулы Л-цистина в две аминокислоты Л-цистеина и, тем самым, увеличивать уровень синтеза глутатиона, освобождая его предшественник, который является субстратом, необходимым для стадии синтеза, лимитирующей скорость реакции при общем синтезе глутатиона. Кроме того, GSSG (окисленная форма глутатиона) может быть непосредственно превращена обратно в rGSH с помощью снижения уровня альфа-липоидной кислоты, которая, в свою очередь, становится его окисленной формой (дигидролипоидная кислота). Эта общая поддерживающая роль альфа-липоидной кислоты в деятельности глутатиона была отмечена в различных клеточных исследованиях60), и, кажется, может осуществляться даже в естественных условиях у крыс, при наличии в организме 16 мг / кг АЛК.
Альфа-липоидная кислота может уменьшить количество окисленного глутатиона, тем самым повышая эффективность и сохраняя действия глутатиона в клетке.
Доступность
Глутатион является важным антиоксидантом у человека, животных и растений. Используется в качестве пищевой добавки.
:Tags
Читать еще: Артишок , ХГЧ (хорионический гонадотропин человека) , Сенна , Флутиказон (флутиказона пропионат) , Фторометолон ,










