Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Дигидромирицетин
 Наиболее распространенный естественный флавоноид, содержащийся в чае ротанга, дигидромирицетин (ДМИ) показал широкий диапазон фармакологических эффектов. 1)
Помимо общих характеристик флавоноидов, ДМИ является кардиопротектором, средством против диабета, гепатопротектором, нейропротектором, противоопухолевым средством и дерматопротектором. ДМИ также применяют для лечения бактериальных инфекций, остеопороза, астмы, повреждения почек, при нефротоксичности, и так далее. Эти эффекты, в некоторой степени, обогащают понимание роли ДМИ в профилактике и лечении ряда заболеваний.
Наиболее распространенный естественный флавоноид, содержащийся в чае ротанга, дигидромирицетин (ДМИ) показал широкий диапазон фармакологических эффектов. 1)
Помимо общих характеристик флавоноидов, ДМИ является кардиопротектором, средством против диабета, гепатопротектором, нейропротектором, противоопухолевым средством и дерматопротектором. ДМИ также применяют для лечения бактериальных инфекций, остеопороза, астмы, повреждения почек, при нефротоксичности, и так далее. Эти эффекты, в некоторой степени, обогащают понимание роли ДМИ в профилактике и лечении ряда заболеваний.
Тем не менее, на сегодняшний день нет доступной информации о точном механизме действия ДМИ, который может быть связан с антиокислительной и противовоспалительной активностью. Механизмы его действия могут быть связаны с различными молекулами, вовлеченными в клеточный апоптоз, процессы окислительного стресса и воспаления, такие как AMP-активированная протеинкиназа (AMPK), митоген-активируемая протеинкиназа (MAPK), протеинкиназа B (Akt), ядерный фактора- κB (NF-кВ), фактор 2, связанный с ядерным фактором Е2 (Nrf2), АТФ-связывающий кассетный транспортер А1 (ABCA1), рецептор, активируемый пероксисомным пролифератором-γ (PPARy), и так далее. Здесь мы кратко изложим текущие фармакологические разработки ДМИ, а также возможные механизмы, направленные на углубление понимания защитной роли ДМИ, а также доклинические исследования его нового применения.
Введение
Ampelopsis grossedentata (Hand.-Mazz.) W.T. Wang (Vitaceae) – дикое растение, содержащее большое количество флавоноидов, которое традиционно используется в качестве чая для лечения пиретической лихорадки или кашля. Его нежные стебли и листья используются для заваривания чая. На протяжении более сотни лет, растение используется в качестве травяного чая и средства традиционной китайской медицины. Фитохимические исследования показали, что двумя основными флавоноидами в A. grossedentata являются дигидромирицетин (ДМИ, структура показана на Рис. 1), и мирицетин, соответственно. Причем, содержание ДМИ (20-30%, процентное отношение масс) было значительно выше, чем содержание мирицетина (1,5–3,0%, процентное отношение масс).
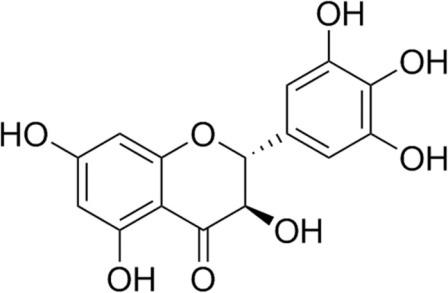 Как мы знаем, флавоноиды имеют много специфических эффектов, например, используются в качестве веществ, удаляющих свободные радикалы, в качестве антиоксидантов, противотромбозных средств, противовоспалительных препаратов, противоопухолевых средств, и так далее 2). В дополнение к общим характеристикам флавоноидов, ДМИ способен уменьшать воспаление, снижать потребление липидов, усиливать отток холестерина и ингибировать образование пенистых клеток при атеросклерозе. Кроме того, ДМИ является мощным кардиопротектором при реперфузионной ишемии миокарда, адриамицин-индуцированной кардиотоксичности, аритмии, ремоделировании миокарда и легочной артериальной гипертензии. ДМИ снижает уровень глюкозы в крови, улучшает инсулинорезистентность и ослабляет диабетическую кардиомиопатию при диабете. ДМИ помогает при печеночной реперфузии, химическом повреждении печени, алкогольной болезни печени, безалкогольной жировой болезни печени и острой печеночной недостаточности. Кроме того, было показано, что ДМИ защищает от болезни Альцгеймера, болезни Паркинсона, депрессивного расстройства, гипобарической гипоксии или смертельно опасного воздействия алкоголя на плод, вызванного черепно-мозговой травмой и расстройствами поведения. ДМИ также подавляет гепатоцеллюлярный рак, немелкоклеточный рак легкого (НМРЛ), остеосаркому, рак яичников, меланому и рак желудка. ДМИ также эффективно подавляет активность тирозиназы и уменьшает количество меланина в клетках, подавляет рост меланомы, а также защищает от ультрафиолетового повреждения кожи. ДМИ также применяется при бактериальных инфекциях, остеопорозе, астме, повреждениях почек, нефротоксичности и так далее.
Как мы знаем, флавоноиды имеют много специфических эффектов, например, используются в качестве веществ, удаляющих свободные радикалы, в качестве антиоксидантов, противотромбозных средств, противовоспалительных препаратов, противоопухолевых средств, и так далее 2). В дополнение к общим характеристикам флавоноидов, ДМИ способен уменьшать воспаление, снижать потребление липидов, усиливать отток холестерина и ингибировать образование пенистых клеток при атеросклерозе. Кроме того, ДМИ является мощным кардиопротектором при реперфузионной ишемии миокарда, адриамицин-индуцированной кардиотоксичности, аритмии, ремоделировании миокарда и легочной артериальной гипертензии. ДМИ снижает уровень глюкозы в крови, улучшает инсулинорезистентность и ослабляет диабетическую кардиомиопатию при диабете. ДМИ помогает при печеночной реперфузии, химическом повреждении печени, алкогольной болезни печени, безалкогольной жировой болезни печени и острой печеночной недостаточности. Кроме того, было показано, что ДМИ защищает от болезни Альцгеймера, болезни Паркинсона, депрессивного расстройства, гипобарической гипоксии или смертельно опасного воздействия алкоголя на плод, вызванного черепно-мозговой травмой и расстройствами поведения. ДМИ также подавляет гепатоцеллюлярный рак, немелкоклеточный рак легкого (НМРЛ), остеосаркому, рак яичников, меланому и рак желудка. ДМИ также эффективно подавляет активность тирозиназы и уменьшает количество меланина в клетках, подавляет рост меланомы, а также защищает от ультрафиолетового повреждения кожи. ДМИ также применяется при бактериальных инфекциях, остеопорозе, астме, повреждениях почек, нефротоксичности и так далее.
Различные фармакологические эффекты ДМИ
ДМИ является мощным кардиопроттором при атеросклерозе, реперфузионной ишемии миокарда, ремоделировании миокарда, аритмии и легочной артериальной гипертензии. ДМИ также снижает уровень глюкозы в крови, улучшает инсулинорезистентность и ослабляет диабетическую кардиомиопатию при диабете. ДМИ помогает при печеночной реперфузии, химическом повреждении печени, алкогольной болезни печени, безалкогольной жировой болезни печени и острой печеночной недостаточности. Кроме того, было показано, что ДМИ защищает от болезни Альцгеймера, болезни Паркинсона, депрессивного расстройства, гипобарической гипоксии или смертельно опасного воздействия алкоголя на плод, вызванного черепно-мозговой травмой и расстройствами поведения. ДМИ также подавляет гепатоцеллюлярный рак, немелкоклеточный рак легкого (НМРЛ), остеосаркому, рак яичников, меланому и рак желудка. ДМИ полезен при депигментации кожи, меланоме и повреждении кожи, вызванном ультрафиолетовым излучением типа А. ДМИ применялся для лечения бактериальной инфекции, остеопороза, астмы, повреждения почек, нефротоксичности и так далее. В данном обзоре суммируются фармакологические эффекты и возможные механизмы действия ДМИ.
Сердечно-сосудистая система
Атеросклероз
Атеросклероз является прогрессирующим воспалительным заболеванием, вызванным отложением жира, образованием тромбов, пролиферацией соединительной ткани и накоплением карбоната кальция в кровеносных сосудах, которое повреждает сосудистый эндотелий, вызывая или усугубляя развитие сосудистых заболеваний 3). Различные изменения во время атеросклероза обычно рассматриваются как различные стадии хронического воспаления. Предположительно, усиление воспаления является критическим механизмом при атеросклерозе. Пальмитиновая кислота (ПК) повысила пироптоз (консервативный механизм гибели клетки, характеризующийся расщеплением ДНК, активацией цитокинов и, в конечном счете, лизисом клетки вследствие образования пор в мембране и патологического выхода ионов) и провоспалительную запрограммированную смерть клетки в человеческих эндотелиальных клетках пуповинной вены (HUVECs) в зависимости от митохондриальной активной формы кислорода (АФК). Последние исследования обнаружили, что предварительная обработка ДМИ (0,5 и 1 мкм) в течение 12 ч с последующей парной ассоциативной стимуляцией в течение еще 24 ч увеличивает жизнеспособность клеток, снижает активность лактатдегидрогеназы (ЛДГ) и высвобождение интерлейкина-1β (Ил-1β), увеличивает целостность клеточной мембраны, ингибирует расщепление каспазы-1 и последующее созревание Ил-1β, и, наконец, подавляет созревание АФК, что предполагает, что ДМИ ослабляет индуцированный парной стимуляцией пироптоз в человеческих эндотелиальных клетках пупочной вены. Кроме того, вышеуказанные защитные эффекты ДМИ были недоступны, если фактор 2, связанный с ядерным фактором E2 (Nrf2), был снижен малой интерферирующей РНК Nrf2 4). Анти-пироптозный эффект на человеческих эндотелиальных клетках пупочной вены (HUVECs) был предложен в качестве нового механизма действия ДМИ против воспаления при атеросклерозе. Много потенциальных факторов участвуют в повышении воспалительной реакции и ускорении развития атеросклероза. Модифицированный липопротеин низкой плотности (ЛПНП), особенно окисленный ЛПНП (ox-ЛПНП), увеличивает накопление липидов в макрофагах. Увеличенная абсорбция липидов, а также нарушенное выведение холестерина, приводят к чрезмерному накоплению липопротеинов, образованию пенистых клеток и к серьезному воспалению. В макрофагах, производных из человеческих клеток острого моноцитарного лейкоза (клетках THP-1), предварительное введение ДМИ (µM 1-100) ингибировало внутриклеточное накопление холестерина и аккумуляцию липидов после стимуляции ox-ЛПНП. Тем не менее, ДМИ не оказывает очевидного влияния на экспрессию фагоцитарных рецепторов класса A (SR-A) и кластера дифференциации 36 (CD36) (два жизненно важных рецептора для поглощения холестерина). Кроме того, АТФ-связывающий кассетный транспортер A1 (ABCA1), АТФ-связывающий кассетный транспортер G1 (ABCG1) и фагоцитарный рецептор B1 (SR-B1), ответственные за отток холестерина, увеличивались благодаря действию ДМИ в макрофагах с или без введения ox-ЛПНП. Отмечалось, что опосредованный ДМИ выброс холестерина и его подавляющее действие на накопление холестерина ослаблялись после снижения ABCA1 или ABCG1. Исследователи также подтвердили, что усиленная экспрессия ABCA1 и ABCG1 при помощи ДМИ была опосредована печеночным X рецептором α (LXRa), но не рецептором, активируемым пероксисомным пролифератором-γ (PPARy). Эксперименты в естественных условиях также показали, что ДМИ ослаблял поражения от бляшек в корне аорты, повышал экспрессию LXRa, ABCA1 и ABCG1 в аорте аполипопротеина Е (апоЕ) −/− у мышей, питающихся диетой с высоким содержанием жира 5). Уменьшенная абсорбция липидов, но повышенный уровень холестерина при приеме ДМИ, предлагают большие возможности для профилактики или лечения атеросклероза. Другое исследование показало, что ДМИ также улучшает показатели гиперлипидемии и ингибирует воспаление путем снижения в сыворотке крови уровней интерлейкина-6 (ИЛ-6), фактора некроза опухоли-α (ФНО-α), экспрессии мРНК, подавления генерации АФК и никотинамидадениндинуклеотидфосфата (НАДФН) оксидазы 2 (NOX2), ядерного фактора-κB (NF-кВ), межклеточных молекул адгезии 1 (ICAM-1), молекул адгезии сосудистых клеток-1 (VCAM-1), экспрессии белка в аорте −/− мышей с рецептором ЛНП с диетой с высоким содержанием жиров. In vitro, ДМИ усиливал адгезию моноцитов и ослаблял окислительный стресс в HUVECs, простимулированных ox-ЛПНП. Кроме того, ДМИ усиливал отток холестерина, снижал уровни ox-ЛПНП и тормозил образование пенистых клеток 6). Предполагается, что ДМИ оказывал антиатеросклеротическое действие через различные механизмы. Дигидромирицетин также ослаблял фосфорилирование и деградацию ингибитора NF-кВ «альфа» (IkBa), и снижал транслокацию Р65 в ядро TNF-α-индуцированных клеток HeLa, что может быть связано с подавлением восходящего сигнала IκB киназы (IKK) посредством ингибирования экспрессии адаптерного белка, ФНО рецептор-связанного фактора 2 (TRAF2), и белка 1, взаимодействующего с рецептором (RIP1). Кроме того, ДМИ ингибирует экспрессию генов-мишеней, участвующих в воспалении и пролиферации с последующим ингибированием NF-kB, что позволяет предположить, что ДМИ является мощным естественным ингибитором NF-kB 7). Все эти исследования подтвердили потенциальный защитный эффект ДМИ против образования пенистых клеток, адгезии моноцитов, воспаления и окислительного стресса, что означает, что ДМИ может быть новым терапевтическим средством при атеросклерозе.
Кардиопротекция
Реперфузионная ишемия миокарда связана с восстановлением крови в течение определенного периода времени после прерывания кровоснабжения миокарда. Ишемические повреждения миокарда являются более сильными и серьезными, и связаны с аритмией и увеличенным размером инфаркта после реперфузии крови 8). Предварительное введение ДМИ в течение 7 дней снижало риск миокардиальной травмы путем лигирования левой передней нисходящей коронарной артерии в течение 30 минут с последующей реперфузией в течение 4 часов in vivo. Предварительная обработка ДМИ в течение 24 ч также облегчала повреждение клеток путем гипоксии в течение 6 ч и реоксигенацию в течение 24 ч в кардиомиоцитах H9c2. ДМИ усиливал антиоксидантную способность, ингибировал апоптоз, повышал (PI3K)/протеинкиназу В фосфатидилинозитол-3-киназы (Akt), но уменьшал экспрессию индуцируемого гипоксией фактора-1α (ФОМС-1α) как in vivo, так и in vitro 9). Кроме того, кардиопротекторный эффект ДМИ против повреждения от реперфузионной ишемии миокарда и апоптоза не наблюдался, если предварительно вводили ингибитор PI3K LY294002, что предполагает, что PI3K участвует в защитном эффекте ДМИ на реперфузионную ишемию миокарда. Адриамицин (АДР) является эффективным цитотоксическим препаратом, принадлежащим к антрациклинам для лечения онкологии. Однако, АДР обладает выраженной кардиотоксичностью для индуцирования апоптоза клеток миокарда 10). Одно исследование предложило, что ДМИ (125-500 мг / кг) увеличивает коэффициент выживаемости, улучшает показатели при электрокардиографических заболеваниях, уменьшает уровни ЛПНП, аминотрансферазы аланина (АЛТ) и сердечную фракцию креатинкиназы (CК-МB) в сыворотке от контрольного участка импринтинга у мышей (ICR) после приема АДР (20 мг/кг). Предварительная обработка ДМИ (50 мкм) в течение 24 ч также подавляла апоптоз и ослабляла АФК в стимулированных АДР (2 мкм) неонатальных кардиомиоцитах крыс в течение еще 24 ч. Кроме того, ДМИ восстанавливал нисходящую экспрессию анти-апоптозного белка с доменом активации каспазы (ARC), что связано с ингибирующим влиянием на мышиные двойные микрохромосомы (по мишеням MDM2) как убиквитин-лигаза Е3 от ARC 11). Данные показали, что одновременное использование ДМИ ослабляло токсичное воздействие адриамицина на сердце. Аритмия является распространенным симптомом многих сердечных заболеваний и характеризуется острым началом и высокой смертностью. Исследования показали, что ДМИ снижает частоту аконитин-индуцированных экспериментальных аритмий, сокращает длительность потенциала действия и амплитуду потенциала действия. Детальный электрофизиологический механизм ДМИ связан с блокированием тока натрия (INa) и увеличением тока кальция (IK1) 12). Представленные результаты подчеркивают новую роль ДМИ в борьбе с аритмией. Ремоделирование сердца, по-другому гипертрофия миокарда, или фиброз миокарда, является компенсаторной реакцией сердца на биомеханическое растяжение и нейрогуморальную стимуляцию 13). Ремоделирование миокарда обычно рассматривается как самостоятельный фактор риска сердечно-сосудистых заболеваний, которые могут перерасти в сердечную недостаточность и даже внезапную сердечную смерть 14). Важно найти более эффективные лекарства для ослабления гипертрофии миокарда. Настоящее исследование показало, что предварительное введение ДМИ (в дозе 20, 40, 80 и 160 мкм) уменьшало площадь клеток, ингибировало экспрессию гипертрофических генов, ослабляло окислительный стресс, повышало уровень циклического гуанозинмонофосфата (цГМФ), а фосфорилирование эндотелиальной синтазы оксида азота (NOS) на серине 1177 при ангиотензина II (Анг II) индуцировало гипертрофию кардиомиоцитов. Кроме того, профилактическое действие ДМИ на гипертрофию сердца было отменено, если неспецифический ингибитор NOS L-нитро аргинин метиловый эфир (L-NAME) предварительно инкубировали в течение 30 мин 15). Исследования также подтвердили анти-фибротический эффект ДМИ на Ang II стимулированные кардиальные фибробласты. Эксперименты in vitro показали, что предварительная инкубация ДМИ ослабляла пролиферацию сердечных фибробластов, ингибировала экспрессию коллагена типа I и типа III, подавляла мРНК α-гладкомышечного актина (α-SMA) и уровень белка, снижала уровни клеточного АФК и малонового диальдегида (МДА), но увеличила общую антиоксидантную емкость (T-АОС) и активность супероксиддисмутазы (СОД). Кроме того, ДМИ подавлял p22fox и усиливал экспрессию тиоредоксина (Trx) в сердечных фибробластах после стимуляции Ang II 16). Самое последнее исследование подтвердило, что после 4 недель приема ДМИ (250 мг/кг/день) внутрижелудочно, ослаблялась миокардиальная гипертрофия, вызванная поперечной гипертрофией аорты (TAC) через ингибирование окислительного стресса и повышение пути сиртуин-3 (SIRT3) 17). В целом, приведенные выше данные свидетельствуют о том, что ДМИ может быть идеальным естественным средством для борьбы с ремоделированием миокарда. Артериальная легочная гипертензия (АЛГ) – смертельно опасное заболевание, характеризующееся высоким легочным артериальным давлением и ремоделированием легочной сосудистой системы. Одна группа ученых обнаружила, что ДМИ снижает систолическое давление в правом желудочке (RVSP), ослабляет гипертрофию правого желудочка (RVH), облегчает ремоделирование легочной артерии и снижает экспрессию IL-6 в монокроталине (МКТ), что индуцировало АЛГ у крыс. Исследование in vitro также показало, что предварительная обработка ДМИ (100 μм) на 12 часов ингибировала вызванную IL-6 человеческую легочную артериальную миграцию гладкомышечных клеток (HPASMCs). Кроме того, как фосфорилирование преобразователя сигнала и активатора транскрипции 3 (STAT3, как жизненно важный нисходящий сигнал IL-6), так и матриксная металлопротеиназа-9 (MMP9, как критический медиатор миграции) подавлялись ДМИ при индуцированной МСТ АЛГ у крыс и IL-6 стимулированной HPASMCs 18). Предварительная обработка ДМИ значительно ослабила апоптоз, вызванный перекисью водорода (H2O2), и ингибировала внутриклеточное перепроизводство АФК в HUVECs. Дальнейшие исследования обнаружили, что ДМИ до стимуляции Н2О2 ингибирует активацию р53, с последующим регулированием B-клеточной лимфомы 2 (Bcl-2) и Bcl-2 ассоциированный X белок (Вах), снижением релиза цитохрома С, расщеплением экспрессии каспазы-9 и каспазы-3, и подавлением расщепления поли (АДФ-рибоза) полимеразы (PARP) в HUVECs 19). Полученные результаты позволяют предположить, что ДМИ является перспективным средством для профилактики или лечения сердечно-сосудистых заболеваний.
Диабет
 Прием дигидромирицетина в течение 8 недель снижает уровень глюкозы в крови и инсулина в плазме крови у крыс с диетой с высоким содержанием жира и резистентностью к инсулину. Определение спектра метаболитов показало, что ДМИ отрегулировал 24 метаболических пути, включая гликолиз, гликонеогенез, цикл трихлоруксусной кислоты (TCA), метаболизм пуринов, цикл мочевины и так далее. Дальнейшие исследования подтвердили, что ДМИ повысил фосфорилирование Akt, Akt субстрат 160 кДа (AS160) и АМФ-активируемую протеинкиназу (АМФК), что полезно для облегчения транслокации транспортера глюкозы 1 (GLUT1), ведь АМФК представляет собой чувствительный датчик глюкозы, который способствует повышению инсулин-независимого усвоения глюкозы и поддержанию гомеостаза глюкозы. ДМИ также ингибирует гликоген синтазу-3β (GSK-3β), сдерживая развитие инсулинорезистентности 20). Аналогичные результаты были также продемонстрированы на пре-адипоцитах 3t3-L1. Исследователи обнаружили, что ДМИ способствует усвоению глюкозы в липогенной дифференциации 3Т3-L1 клеток и обработанных дексаметазоном дифференцированных адипоцитах 21). Приведенные выше данные свидетельствуют о том, что ДМИ может быть мощным средством для ослабления инсулинорезистентности при диабете 2 типа.
Резистентность к инсулину в скелетных мышцах является жизненно важной характеристикой в патогенезе диабета 2 типа (Д2). Предыдущие исследования показали, что ДМИ регулирует фосфорилирование Akt, содействуя поглощению глюкозы с или без стимуляции инсулина в дифференцированных миотубах C2C12. Тест на толерантность к инсулину показал, что ДМИ в дозе 50 мг/кг / сут в течение 12 недель также улучшал чувствительность к инсулину у мышей. Кроме того, дальнейшие эксперименты показали, что улучшение чувствительности скелетных мышц к инсулину не наблюдалось в присутствии 3-метиладенина (3-мА), бафиломицина А1 (баф-А1), или малых интерферирующих рибонуклеиновых кислот гена, связанного с аутофагией-5 (Atg5) в мышечных трубочках C2C12, что предполагает, что усиление аутофагии имеет важное значение для улучшения чувствительности к инсулину при помощи ДМИ. Исследования также обнаружили, что ДМИ увеличивал фосфорилирование АМФК, повышал экспрессию коактиватора-1А рецептора, активируемого пероксисомным пролифератором (PGC-1α), и увеличивал активацию SIRT3 в скелетной мышце. Более того, трансфекция PGC-1α или малых интерферирующих рибонуклеиновых кислот AMФK отменяла вызванную ДМИ повышенную регуляцию SIRT3 и аутофагию в миотубах C2C12 22). В целом, ДМИ был полезен для улучшения чувствительности скелетных мышц к инсулину у диабетиков, и, возможно, в защитном эффекте участвовал сигнальный путь AMPK-PGC-1α-SIRT3.
Другое исследование подтвердило, что ДМИ улучшает чувствительность инсулина, вызванную дексаметазоном в адипоцитах. Было обнаружено, что ДМИ увеличивает поглощение глюкозы и уменьшает липогенез в адипоцитах, обработанных дексаметазоном . ДМИ ингибирует фосфорилирование PPARy на серине 273 (Ser273) и подавляет внеклеточную регулируемую киназу 1/2 (ERK)/циклин-зависимую киназу-5 (CDK5). Отмечено, что предварительное введение ингибитора PPARy gw9662 снижает положительное влияние ДМИ в дифференцированных адипоцитах. Дальнейшие исследования показали, что сочетание ДМИ с ингибитором митоген-активированной протеинкиназы (МАК) PD98059 синергически и устойчиво улучшает поглощение глюкозы и секрецию адипонектина в адипоцитах 23). Эти результаты подтвердили регуляторное влияние ДМИ на инсулинорезистентность, что имеет решающее значение для существенного снижения прогрессирования диабета.
Диабет, очевидно, способствует функциональным и структурным нарушениям, определяемым как диабетическая кардиомиопатия (ДКМ), которая увеличивает риск сердечной недостаточности даже при отсутствии гипертонии и ишемической болезни сердца. Одна группа ученых показала, что при лечении ДМИ в течение 14 недель нормализовалась масса тела, купировались патологические изменения в миокарде и улучшалась функция сердца у самцов мышей C57BL/6, которым вводили стрептозотоцин (СТЗ). ДМИ повышал активность антиоксидантных ферментов СОД миокарда и глутатионпероксидазу (GSH-Px), при этом снижался уровень MDA. ДМИ также проявлял противовоспалительное действие, снижая уровень IL-6 и TNF-α. ДМИ улучшал митохондриальную дисфункцию за счет повышения содержания АТФ, активности цитрат-синтазы и комплекса I/II/III/IV/V. ДМИ блокировал сердечный апоптоз, но восстанавливал аутофагию у мышей с диабетом, вызванным СТЗ, что могло быть связано с увеличенным фосфорилированием АМФК и нисходящей целью UNC-51 как экспрессия киназы (ULK1) 24). Эти результаты подразумевают, что ДМИ также оказывает фармакологическое влияние на диабетические осложнения.
Прием дигидромирицетина в течение 8 недель снижает уровень глюкозы в крови и инсулина в плазме крови у крыс с диетой с высоким содержанием жира и резистентностью к инсулину. Определение спектра метаболитов показало, что ДМИ отрегулировал 24 метаболических пути, включая гликолиз, гликонеогенез, цикл трихлоруксусной кислоты (TCA), метаболизм пуринов, цикл мочевины и так далее. Дальнейшие исследования подтвердили, что ДМИ повысил фосфорилирование Akt, Akt субстрат 160 кДа (AS160) и АМФ-активируемую протеинкиназу (АМФК), что полезно для облегчения транслокации транспортера глюкозы 1 (GLUT1), ведь АМФК представляет собой чувствительный датчик глюкозы, который способствует повышению инсулин-независимого усвоения глюкозы и поддержанию гомеостаза глюкозы. ДМИ также ингибирует гликоген синтазу-3β (GSK-3β), сдерживая развитие инсулинорезистентности 20). Аналогичные результаты были также продемонстрированы на пре-адипоцитах 3t3-L1. Исследователи обнаружили, что ДМИ способствует усвоению глюкозы в липогенной дифференциации 3Т3-L1 клеток и обработанных дексаметазоном дифференцированных адипоцитах 21). Приведенные выше данные свидетельствуют о том, что ДМИ может быть мощным средством для ослабления инсулинорезистентности при диабете 2 типа.
Резистентность к инсулину в скелетных мышцах является жизненно важной характеристикой в патогенезе диабета 2 типа (Д2). Предыдущие исследования показали, что ДМИ регулирует фосфорилирование Akt, содействуя поглощению глюкозы с или без стимуляции инсулина в дифференцированных миотубах C2C12. Тест на толерантность к инсулину показал, что ДМИ в дозе 50 мг/кг / сут в течение 12 недель также улучшал чувствительность к инсулину у мышей. Кроме того, дальнейшие эксперименты показали, что улучшение чувствительности скелетных мышц к инсулину не наблюдалось в присутствии 3-метиладенина (3-мА), бафиломицина А1 (баф-А1), или малых интерферирующих рибонуклеиновых кислот гена, связанного с аутофагией-5 (Atg5) в мышечных трубочках C2C12, что предполагает, что усиление аутофагии имеет важное значение для улучшения чувствительности к инсулину при помощи ДМИ. Исследования также обнаружили, что ДМИ увеличивал фосфорилирование АМФК, повышал экспрессию коактиватора-1А рецептора, активируемого пероксисомным пролифератором (PGC-1α), и увеличивал активацию SIRT3 в скелетной мышце. Более того, трансфекция PGC-1α или малых интерферирующих рибонуклеиновых кислот AMФK отменяла вызванную ДМИ повышенную регуляцию SIRT3 и аутофагию в миотубах C2C12 22). В целом, ДМИ был полезен для улучшения чувствительности скелетных мышц к инсулину у диабетиков, и, возможно, в защитном эффекте участвовал сигнальный путь AMPK-PGC-1α-SIRT3.
Другое исследование подтвердило, что ДМИ улучшает чувствительность инсулина, вызванную дексаметазоном в адипоцитах. Было обнаружено, что ДМИ увеличивает поглощение глюкозы и уменьшает липогенез в адипоцитах, обработанных дексаметазоном . ДМИ ингибирует фосфорилирование PPARy на серине 273 (Ser273) и подавляет внеклеточную регулируемую киназу 1/2 (ERK)/циклин-зависимую киназу-5 (CDK5). Отмечено, что предварительное введение ингибитора PPARy gw9662 снижает положительное влияние ДМИ в дифференцированных адипоцитах. Дальнейшие исследования показали, что сочетание ДМИ с ингибитором митоген-активированной протеинкиназы (МАК) PD98059 синергически и устойчиво улучшает поглощение глюкозы и секрецию адипонектина в адипоцитах 23). Эти результаты подтвердили регуляторное влияние ДМИ на инсулинорезистентность, что имеет решающее значение для существенного снижения прогрессирования диабета.
Диабет, очевидно, способствует функциональным и структурным нарушениям, определяемым как диабетическая кардиомиопатия (ДКМ), которая увеличивает риск сердечной недостаточности даже при отсутствии гипертонии и ишемической болезни сердца. Одна группа ученых показала, что при лечении ДМИ в течение 14 недель нормализовалась масса тела, купировались патологические изменения в миокарде и улучшалась функция сердца у самцов мышей C57BL/6, которым вводили стрептозотоцин (СТЗ). ДМИ повышал активность антиоксидантных ферментов СОД миокарда и глутатионпероксидазу (GSH-Px), при этом снижался уровень MDA. ДМИ также проявлял противовоспалительное действие, снижая уровень IL-6 и TNF-α. ДМИ улучшал митохондриальную дисфункцию за счет повышения содержания АТФ, активности цитрат-синтазы и комплекса I/II/III/IV/V. ДМИ блокировал сердечный апоптоз, но восстанавливал аутофагию у мышей с диабетом, вызванным СТЗ, что могло быть связано с увеличенным фосфорилированием АМФК и нисходящей целью UNC-51 как экспрессия киназы (ULK1) 24). Эти результаты подразумевают, что ДМИ также оказывает фармакологическое влияние на диабетические осложнения.
Гепатопротекция
ДМИ также продемонстрировал защитный эффект на печеночное повреждение в результате реперфузии миокарда. Исследования показали, что применение ДМИ (100 мг/кг/д) ежедневно через зонд в течение 7 дней до ишемии, очевидно, снижает активность сывороточных аминотрансфераз и ингибирует апоптоз. Гепатопротекторное действие ДМИ связано с различными жизненно важными генами, связанными с аутофагией, включая Atg5, Atg12, беклин 1 и легкую цепь 3 связанного с микротрубочками белка 1 (LC3). Кроме того, улучшение функции печени с помощью ДМИ ослаблялось ингибитором аутофагии хлорохином или подавлением Atg5. ДМИ также увеличивал экспрессию факторов семейства Forkhead O3a (FOXO3a), усиливал фосфорилирование Ser588 и способствовал ядерной транслокации FOXO3a 25). Эти механизмы способствовали развитию веществ, связанных с ДМИ. Этанол активирует молекулы кислорода для производства свободных радикалов кислорода и приводит к перекисному окислению липидов мембран гепатоцита, истощению глутатиона и накоплению МДА в печени, что, в совокупности, является факторами развития алкогольной болезни печени (АБП). ДМИ (75 и 150 мг/кг/сут) в течение 6 недель значительно ослабляет выпуск печеночных ферментов, облегчает перекисное окисление липидов печени, уменьшает отложение триглицеридов, снижает уровни воспалительных цитокинов и частично восстанавливает печеночные патологические повреждения у мышей C57BL/6, которых кормили диетой Lieber-DeCarli, содержащей спирт. Отмечалось, что ДМИ улучшает истощение глутатиона, вызванное спиртом (GSH) и увеличивает МДА (малональдегид) в печени. Дальнейшие исследования подтвердили, что ДМИ активирует Nrf2, ингибирует ядерную локализацию NF-кВ, усиливает экспрессию p62 и вызывает аутофагию у мышей, которым давали этанол, что, в свою очередь, способствовало положительной обратной связи в активации Nrf2 26). Был предложен новый терапевтический вариант для лечения хронических заболеваний печени, вызванных воздействием алкоголя. Одно из последних исследований показало, что добавка ДМИ также эффективно улучшает развитие NAFLD (неалкогольной жировой болезни печени), подавляя накопление липидов в печени как у мышей с HFD (диета с высоким содержанием жиров), так и в гепатоцитах с PA-стимуляцией. Было выявлено, что ДМИ восстанавливает дыхательную способность митохондрий, ослабляя окислительный стресс. ДМИ увеличивал экспрессию SIRT3, активируя сигнальный путь AMPK/PGC-1α/эстроген-связанный рецептор-α (ERRa). Интересно, что преимущества ДМИ не наблюдались у мышей с дефицитом SIRT3, и в гепатоцитах с трансфекцией SIRT3 siRNA или специфическим предварительным введением ингибитора SIRT3 27). Эти результаты позволили предложить новые профилактические и терапевтические стратегии для лечения неалкогольной жировой болезни печени с помощью ДМИ. Тетрахлорметан (CCl4) обычно применялся для индуцирования химического повреждения печени, характеризующегося некрозом гепатоцитов и дисфункцией печени, а высокая дозировка CCl4 даже приводила к жировой болезни печени 28). Предыдущие исследования показали, что введение ДМИ (150 мг / кг) в течение 4 дней после введения CCl4 способствовало пролиферации гепатоцитов и снижению некроза или апоптоза. ДМИ демонстрирует сильное противовоспалительное влияние и противоокислительное влияние со значительным уменьшением уровней аминотрансферазы аспартата (AST), ALT, IL-1β, IL-6 в сыворотке, но также способствует усилению активности SOD. Кроме того, ингибитор с-Jun N-терминальной киназы (JNK) SP600125 ослаблял снижение экспрессии ФНО-α и увеличивал выживаемость ALF после введения ДМИ, что предполагает, что ДМИ облегчает CCl4-индуцированное острое повреждение печени JNK-зависимым образом 29). ДМИ также предотвращает окислительный стресс в печени мышей с дефицитом рецепторов ЛПНП (ЛПНП−/−) с HFD (диетой с высоким содержанием жира), что может быть связано с нормализацией активности антиоксидантных ферментов для подавления генерации АФК и экспрессии NOX2 30). Эти результаты показали, что антиоксидантная способность, возможно, является важным механизмом гепатопротекторного действия ДМИ. Применение дигидромирицетина у самцов крыс Sprague-Dawley (SD) с диетой с высоким содержанием жиров (60% жиров) уменьшило печеночную инсулинорезистентность и снизило ожирение в печени через фосфорилирование AMФK. ДМИ также улучшил фосфорилирование Akt2 в Ser474 и IRS-1 на Ser612, снизил фосфорилирование GSK-3β, и уменьшил регулирование глюкозо-6-фосфатазы (G6Pase) и экспрессию фосфоэнолпируват кароксикиназы (PEPCK) в HepG2 клетках с высоким уровнем стимуляция глюкозы 31). Предполагается, что ДМИ может быть разработан в качестве нового препарата для улучшения печеночной инсулинорезистентности при диабете. В настоящее время, существует несколько клинических исследований, направленных на изучение влияния ДМИ на неалкогольную жировую болезнь печени. В двойном слепом клиническом исследовании, прием двух капсул ДМИ (150 мг) дважды в день в течение 3 месяцев значительно снижал уровни аланина, АСТ, γ-глутамилтранспептидазы (ГГТ), глюкозы, ЛПНП-холестерина, аполипопротеина B (apoB) и оценку гомеостазной модели индекса инсулинорезистентности (HOMA-IR) у взрослых пациентов, страдающих неалкогольной жировой болезнью печени. ДМИ также очевидно снижал уровни ФНО-α, фрагмента цитокератина-18 (CK-18) и фактора роста фибробластов 21 (FGF-21), но повышал уровень адипонектина в сыворотке крови 32). Данное исследование дает достаточные основания для применения ДМИ в клинической практике.
Нейропротекция
Все большее количество данных показывает, что повышенная регуляция микроРНК включается в связанные со старением заболевания. D-галактоза (d-gal) значительно увеличивает miR-34a в стареющем мозге крыс, что восстанавливалось при обработке ДМИ в дозе 100 и 200 мг/кг/день. Кроме того, ДМИ улучшил показатели обучения и ухудшения памяти, а также смягчил старение нейронов в D-gal-индуцированной модели старения мозга крыс. ДМИ значительно ингибировал апоптоз и спасал дисфункциональную аутофагию нейронов в гиппокампе D-gal-индуцированной модели старения мозга крыс через повышение регуляции сиртуина 1 (SIRT1) и p53/p21, а также снижение регуляции мишени рапамицина в клетках (mTOR) через mir-34a 33). Насколько нам известно, болезнь Альцгеймера (БА), дегенеративное заболевание центральной нервной системы, в основном, проявляется в виде разрушительной нейродегенерации и когнитивной дисфункции 34). ДМИ, возможно, имеет потенциал ослаблять БА. Болезнь Паркинсона (БП), paralysis agitans, или дрожательный паралич, характеризуется постепенным истощением дофамина (DA) из-за частичной потери дофаминергических нейронов. Катехол О-метилтрансфераза (COMT) – фермент, участвующий в метаболизме леводопы (L-допы), и ингибирование активности COMT значительно повышает биодоступность L-допы. Реакция метилирования цитозол-катализированной L-допы в печени человека in vitro подтвердила, что ДМИ успешно ингибирует активность COMT дозозависимым образом 35). БП может быть индуцирована дофаминергическим нейротоксическим составом 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MTPT) в лаборатории. ДМИ, очевидно, восстанавливает поведенческие нарушения, защищает нейроны DA и уменьшает производство АФК после стимуляции MPTP. Кроме того, ингибирующее влияние на активность ГСК-3β, возможно, способствует защите DA нейронов 36). Эти данные показали, что ДМИ может быть идеальным кандидатом для лечения БП. Большое депрессивное расстройство (БДР) – это актуальное и весьма распространенное заболевание. Растущий объем данных свидетельствует о том, что нейротрофический фактор головного мозга (BDNF) и нейровоспаление имеют тесную связь с депрессивным поведением 37). В гиппокампе пациентов с БДР наблюдалась меньшая экспрессия BDNF 38). Кроме того, биомаркерами в развитии МДД также являются нейровоспаление и некоторые медиаторы воспаления. Один из последних отчетов подтвердил, что предварительное введение ДМИ (10 и 20 мг/кг) в течение 3 дней, но не 1 или 2 дней, уменьшило время неподвижности в тесте подвешивания за хвост (TST) и тесте принудительного плавания (FST). ДМИ также уменьшал время неподвижности TST и FST, подавлял экспрессию TNF-α и IL-6 мРНК, но улучшал локомоцию общего расстояния, пройденного мышами после кратковременной инъекции липополисахаридов (ЛПС). Применение ДМИ в течение 7 дней увеличило предпочтение сахарозы, но уменьшило время FST и TST в модели хронического непредсказуемого умеренного стресса (CUMS). Ослабляющее влияние на поведение, связанное с депрессией и тревогой, вызванное CUMS, было связано с повышенным уровнем BDNF 39). Эти результаты дают убедительные доказательства того, что ДМИ может быть перспективным кандидатом для лечения БДР. Гипоксия может вызывать гиппокампальную нейродегенерацию и приводить к нарушениям памяти. Взрослые самцы крыс подвергались гипобарической гипоксии (HH) в течение 7 дней, и изучался возможный эффект ДМИ на крыс с HH. Результаты показали, что предварительная обработка ДМИ сохранила память, улучшила структуры синапсов нейронов гиппокампа, способствовала биогенезу митохондрий, снизила перекисное окисление липидов и подавила генерацию АФК у HH-стимулированных крыс. Дальнейшие эксперименты показали, что ДМИ увеличивает экспрессию и активность SIRT3, вызывая деацетилирование FOXO3 и защищая от окислительного стресса в нейронах гиппокампа и клетках HT22 с воздействием гипоксии 40). Полученные результаты позволяют предложить новые стратегии профилактики нейродегенерации и повышения когнитивной функции после воздействия гипоксии. Воздействие алкоголя на плод (FAE) связано с рядом заболеваний плода, включающих поведенческие и физиологические нарушения. Насколько нам известно, гамма-аминомасляная кислота (ГАМК) является важным ингибирующим передатчиком в центральной нервной системе, а рецептор ГАМКA (GABAAR) является одной из фармакологических мишеней алкоголя. ДМИ может выборочно противодействовать этанолу (алкоголю), как in vivo, так и in vitro, и увеличивать функцию GABAAR 41). Предыдущие исследования также показали, что ДМИ может противодействовать эффектам алкогольной интоксикации у взрослых крыс 42). Недавно, исследователи проверяли, что введение ДМИ увеличивает время входа, потерю рефлекса выпрямления (LORR), продолжительность и время судорог, вызванных пентиленететразолом (PTZ), но уменьшает продолжительность судорог, вызванных PTZ. ДМИ также предотвратил вызванные FAE изменения в дефиците роста и нарушениях при рождении. Кроме того, ДМИ предотвратил индуцированные FAE изменения в реакции синаптических и экстрасинаптических рецепторов ГАМКА на селективный агонист рецепторов ГАМКА 43). Отмечалось, что ДМИ в одиночку не оказывал негативного влияния на размер помета, массу потомства, уровень тревожности и поведение у беременных крыс. Защитная способность ДМИ к последствиям FAE без побочных эффектов свидетельствует о том, что ДМИ является привлекательным кандидатом для развития в качестве средства для профилактики нарушений, связанных с воздействием алкоголя на новорожденных. Накопление метилглиоксаля (MG), эндогенной токсической смеси, может привести к когнитивной дисфункции. MG смог увеличить окислительный стресс и перегрузку кальцием, приводя в итоге к митохондриальному апоптозу в клетках PC12. Данные показали, что ДМИ способен улучшать метаболизм глюкозы, подавлять окислительный стресс и ингибировать апоптоз с помощью сигнального пути AMPK/глюкозный транспортер 4 (GLUT4) в MG-стимулированных клетках PC12 44). В другом исследовании, ДМИ также дозозависимо защищал от повреждений, вызванных нитропруссидом натрия (SNP) в клетках PC12 через сигнализацию Akt и ERK1/2 45). 3-нитропионовая кислота (3-NP) также индуцировала нарушения когнитивных способностей и памяти из-за чрезмерного производства АФК. Исследования показали, что предварительная обработка ДМИ (10 мг/кг/сут) уменьшает время инициирования движения и прохождения через луч, время зависания, время нахождения платформы, что свидетельствует о том, что двигательное поведение, способность к обучению и памяти были улучшены с помощью ДМИ у крыс, индуцированных 3-NP. Исследователи обнаружили, что ДМИ повышает антиоксидантную способность, увеличивая активность SOD для снижения уровня MDA. Кроме того, ДМИ повышал регуляцию белка Bcl-2, но снижал регуляцию расщепляемой каспазы-3 и Bax, ингибируя апоптоз 46). Вышеприведенные данные свидетельствуют о том, что защитное действие ДМИ на поведенческие дефициты, в основном, объясняется антиоксидантным и антиапоптозным механизмом.
Противоопухолевое средство
Гепатоцеллюлярная карцинома (ГЦК) – заболевание, связанное с высокой смертностью из-за поздней диагностики. Исследования показали, что ДМИ может сдерживать рост клеток ГЦК и активировать апоптоз в клетках гепатокарциномы HepG2. Молекулярный механизм был связан с ингибированием фосфорилирования Akt-Ser473, промотированием Bax и Bcl-2-связанной экспрессией промотора клеточной смерти (Bad), так же, как и подавление фосфорилирования Bad-Ser112/Ser136. ДМИ также подавлял экспрессию Bcl-2 и усиливал расщепление и активацию каспазы-3. Эти данные свидетельствуют о том, что ДМИ индуцирует митохондриально-опосредованный апоптоз в клетках HepG2 через снижение регуляции пути Akt/Bad 47). Кроме того, еще одна группа ученых сообщила, что ДМИ изменял экспрессию белков клеточного цикла, таких как чекпойнт-киназа (ЧК), циклин-зависимая киназа 1 (Cdk1), циклин А, циклин В1, цикл клеточного деления (Cdc), 25c, p-Cdc25c и р53, что предполагает, что ДМИ индуцировал угнетение G2/M. Более того, siRNA Chk2, но не p53 или Chk1, отменял угнетение G2/M при помощи ДМИ 48). Кроме того, одно исследование подтвердило, что ДМИ в значительной степени индуцирует аутофагию для ингибирования пролиферации клеток в клетках HepG2. Дальнейшие исследования показали, что ДМИ подавляет активацию mTOR с помощью регуляции ERK1 / 2, AMPK и PI3K/Akt 49). ДМИ также ингибирует жизнеспособность клетки и повышает апоптоз в клетках гепатоцеллюлярной карциномы Hepal-6 у мышей, что было связано со снижением регулирования АФК путем уменьшения экспрессии трансформирующего фактора роста β (ТФР-β), Smad3 и никотинамид-аденин-динуклеотид фосфат оксидазы 4 (NOX4) 50). Кроме того, ДМИ также сильно ингибирует инвазию и миграцию двух различных клеточных линий гепатомы клеток аденокарциномы печени человека SK-Hep-1 и гепатоцеллюлярной карциномы человека MHCC97. Дальнейшие исследования показали, что ДМИ повышает экспрессию протеинкиназы C (PKC)-δ, уменьшая экспрессию MMP-9 путем ингибирования фосфорилирования p38, ERK1/2 и JNK 51). В целом, ДМИ может быть перспективным терапевтическим препаратом при росте и метастазировании гепатоцеллюлярной карциномы. Исследования показали, что при немелкоклеточном раке легких (НМРЛ), ДМИ оказывает селективное цитотоксическое действие на клетки А549 и Н1975 НМРЛ, но не на нормальные клетки фибробластов WI-38. ДМИ индуцировал апоптоз клеток путем деполяризации митохондриальной мембраны. Кроме того, ДМИ увеличивал внутриклеточный уровень пероксида и поддерживал активацию сигнальных путей ERK1/2 и JNK1/2, которая была обращена поглотителем АФК N-ацетилцистеином (NAC) 52). Кроме того, исследование показало, что подавление АФК-опосредованной активации ERK и JNK сенсибилизировало ДМИ-индуцированный митохондриальный апоптоз в клетках НМРЛ. Поэтому комбинированное лечение с ДМИ и ингибиторами ERK или JNK может быть идеальной стратегией для лечения НМРЛ. Остеосаркома является наиболее распространенной первичной злокачественной опухолью костей в детском и подростковом возрасте. ДМИ увеличил экспрессию p21 и индуцировал остановку клеточного цикла G2-M, вызывая повреждение ДНК в клетках остеосаркомы. Механистический анализ показал, что противоопухолевый потенциал ДМИ можно объяснить инактивацией GSK3β с помощью активации AMPKa и P38 53). В другом исследовании изучалось влияние ДМИ на окислительный стресс, индуцированный перекисью водорода, в клетках остеосаркомы. Установлено, что ДМИ препятствует снижению жизнеспособности и индукции апоптоза в клетках MG63 за счет ингибирования каспазы и активации Bcl-2 54). Эти данные свидетельствуют о том, что ДМИ может быть терапевтическим средством для лечения остеосаркомы. Полностью-транс-ретиноевая кислота (ATRA) является промежуточным продуктом метаболизма витамина А с широким спектром физиологических и фармакологических активностей. Она эффективна у пациентов с острым промиелоцитарным лейкозом (APL). Одно исследование показало сильную синергию, повышающую дифференцирование клеток APL NB4 при комбинированном лечении ATRA и ДМИ. Увеличенное дифференцирование зависело от сигнального пути активации p38-STAT1 55). Было высказано предположение о том, что совместное использование ДМИ и ATRA оказывает синергическое воздействие на дифференцировку клеток NB4, что открывает новые возможности для сочетания ДМИ и ATRA в качестве перспективного подхода для будущей дифференцированной терапии. Действие адриамицина, оказывающего противоопухолевое действие путем введения в клеточную ДНК, было оспорено из-за кардиотоксичности. Что интересно, ДМИ не только предотвратил кардиотоксичность, но также увеличил портивораковую активность в человеческих клетках лейкемии U937 и моделях ксенотрансплантатов 56). Приведенные выше данные свидетельствуют о том, что ДМИ может использоваться для потенцирования противораковой активности и увеличения терапевтического окна адриамицина. Рак яичников является одной из наиболее распространенных опухолей женских половых органов с самым высоким уровнем смертности при гинекологическом раке. Одно исследование продемонстрировало, что прием ДМИ привел к угнетению G0/G1 и S фазы в клетках рака яичников. ДМИ также эффективно индуцировал апоптоз клеток с помощью p53-опосредованного снижения регуляции сурвивина. Более того, ДМИ заметно обратило резистентность паклитаксела (PTX) и доксорубицина (DOX) против клеток рака яичника 57). Предполагается, что ДМИ может быть кандидатом в качестве химиотерапевтического средства для лечения рака яичников. Также, дигидромирицетин ингибирует пролиферацию, индуцирует клеточную цитотоксичность и повышает апоптоз при помощи увеличения регуляции р53 и снижения регуляции Bcl-2 в AGS человеческих клетках рака желудка 58). Предлагается, что ДМИ может быть потенциальной терапевтической целью для лечения рака желудка.
Дерматопротекция
Одна группа ученых обнаружила, что ДМИ эффектно блокирует активность тирозиназы и уменьшает количество меланина в клетках. Этот механизм может быть связан с ингибированием окислительного стресса, снижением регуляции сигнальных путей протеинкиназы А (PKA), PKC и митоген-активированной протеинкиназы (MAPK) 59). Исследование показало, что ДМИ потенциально может быть использован в качестве средства для ухода за кожей с депигментацией. Несмотря на относительно низкие показатели заболеваемости меланомой, метастазирующая меланома связана с около 80% смертей, вызванных раком кожи. Предыдущие исследования показали, что ДМИ подавляет пролиферацию клеток, индуцирует остановку клеточного цикла в фазе G1/S и способствует апоптозу клеток меланомы SK-MEL-28, что может быть связано с усиленной экспрессией белков Bax и снижением уровней IKK-α, NF-kB и P-p38 60). Кроме того, ДМИ индуцировал апоптоз и цитопротекторную аутофагию через сигнализацию ROS-NF-kB в клетках меланомы человека 61). Все эти результаты показали, что ДМИ может быть новым и эффективным средством для ослабления прогрессирования меланомы. Другая группа ученых обнаружила, что предварительное введение ДМИ (1,25–10 мкм) увеличивало жизнеспособность клеток, индуцированную ультрафиолетом A (UVA), но подавляло UVA-индуцированное воспаление, производство АФК и апоптоз в клетках линии кератиноцитов HaCaT человека. ДМИ увеличивал мембранный потенциал митохондрий и экспрессию Bcl-2 и Bcl-xl, при одновременном снижении уровня Bax и активации каспазы. Кроме того, ДМИ блокировал транслокацию NF-kB/p65 в ядро и ингибировал фосфорилирование JNK 62). Поэтому ДМИ может потенциально быть использован для защиты против вызванного ультрафиолетом A повреждения кожи.
Другие эффекты
 Золотистый стафилококк (S. aureus) является распространенной патогенной бактерией, которая производит много токсинов и инвазивных ферментов in vivo. S. aureus может вызывать местную гнойную инфекцию и системные инфекции, такие как пневмония, псевдомембранозный колит, перикардит и даже сепсис. Было установлено, что ДМИ разрушает целостность клеточной мембраны золотистого стафилокка. Между тем, ДМИ значительно снижает текучесть мембран и изменяет конформацию мембранного белка, что, вероятно, связано с взаимодействием с мембранными липидами и белками. Кроме того, ДМИ достигал бактерицидной активности путем взаимодействия с внутриклеточной ДНК через связывание по бороздкам молекулы ДНК в S. aureus 63). В общем, эти результаты показали, что ДМИ имеет большое значение для разработки в качестве нового пищевого консерванта.
Остеопороз – метаболическое поражение костей, характеризующееся низкой костной массой и структурным повреждением костной ткани. Исследование показало, что ДМИ блокирует дифференцирование и активацию остеокласта, ослабляет атрофию кости, уменьшает образование актинового кольца остеокласта in vitro. Дальнейшие исследования показали, что ДМИ ингибирует остеокластогенез несколькими путями. ДМИ снижает коэффициент рецептора активатора ядерного фактора-κB лиганда (RANKL) в остеопротегерин в сыворотке крови, и ингибирует производство ряда воспалительных цитокинов. ДМИ также подавляет несколько нисходящих путей после сигнализации RANKL, таких как MAPKs, ROS, PI3K/Akt, NF-κB, и активаторный белок 1 (AP-1) в прекурсороподобных линиях клеток остеокластов и остеокластах 64). Эти данные позволяют предположить, что ДМИ может быть использован для лечения остеокластических заболеваний, таких как ревматоидный артрит и остеопороз.
Астма – это хроническое воспалительное заболевание дыхательных путей, опосредованное различными клетками (эозинофилами, макрофагами, лимфоцитами, нейтрофилами, эпителиальными клетками дыхательных путей и др.), и клеточными компонентами. ДМИ, очевидно, снижает регулирование уровней IL-4, IL-5, IL-13 и уменьшает количество воспалительных клеток в бронхоальвеолярной жидкости лаважа (BAL) от астмы, вызванной овальбумином (OVA) у мышей 65). Предполагается, что ДМИ может быть возможным потенциальным противовоспалительным средством при астме.
В тканях почек, накопление кальция приводит к образованию камней в почках и повреждению почек. Экспериментальные результаты показали, что ДМИ снижает уровень молекул повреждения почек-1, и уровень азота в мочевине крови (BUN), а также кальция при остром повреждении почек (ОПП) у крыс. ДМИ ингибировал агрегацию кристаллов оксалата кальция и снижал уровень Са/креатинина в моче. Уровни CD44 и остеопонтина, а также популяция TUNEL-положительных клеток в почках, очевидно, снижались после приема ДМИ. Кроме того, ДМИ также оказывает антиоксидантное действие на почки. Таким образом, ДМИ предотвращал вызванное эндоксемией острое повреждение почек (ОПП) за счет снижения агрегации кальция и ингибирования генерации АФК 66). Цисплатин является основным противоопухолевым препаратом с тяжелыми побочными эффектами. Высокая доза цисплатина, вероятно, вызовет нефротоксичность или даже постоянное снижение функции почек. Прием ДМИ значительно снизил концентрацию азота мочевины в крови (BUN) и сывороточного креатинина (SCr), улучшил структурные повреждения и функциональные нарушения почек, вызванные цисплатином 67). Таким образом, ДМИ может быть полезен при лечении ОПП.
Трансплантация мезенхимальных стволовых клеток костного мозга (bmMSC) является перспективной новой стратегией для лечения ряда заболеваний. Исследования показали, что ДМИ повышает жизнеспособность мезенхимальных стволовых клеток с OH-стимуляцией, что может быть связано с антиоксидантным эффектом ДМИ. В точных механизмах его действия может быть задействована прямая очистка от свободных радикалов и Fe2+-хелатирование 68). Этот защитный эффект указывает на то, что ДМИ может быть перспективным средством для клеточной трансплантационной терапии.
Золотистый стафилококк (S. aureus) является распространенной патогенной бактерией, которая производит много токсинов и инвазивных ферментов in vivo. S. aureus может вызывать местную гнойную инфекцию и системные инфекции, такие как пневмония, псевдомембранозный колит, перикардит и даже сепсис. Было установлено, что ДМИ разрушает целостность клеточной мембраны золотистого стафилокка. Между тем, ДМИ значительно снижает текучесть мембран и изменяет конформацию мембранного белка, что, вероятно, связано с взаимодействием с мембранными липидами и белками. Кроме того, ДМИ достигал бактерицидной активности путем взаимодействия с внутриклеточной ДНК через связывание по бороздкам молекулы ДНК в S. aureus 63). В общем, эти результаты показали, что ДМИ имеет большое значение для разработки в качестве нового пищевого консерванта.
Остеопороз – метаболическое поражение костей, характеризующееся низкой костной массой и структурным повреждением костной ткани. Исследование показало, что ДМИ блокирует дифференцирование и активацию остеокласта, ослабляет атрофию кости, уменьшает образование актинового кольца остеокласта in vitro. Дальнейшие исследования показали, что ДМИ ингибирует остеокластогенез несколькими путями. ДМИ снижает коэффициент рецептора активатора ядерного фактора-κB лиганда (RANKL) в остеопротегерин в сыворотке крови, и ингибирует производство ряда воспалительных цитокинов. ДМИ также подавляет несколько нисходящих путей после сигнализации RANKL, таких как MAPKs, ROS, PI3K/Akt, NF-κB, и активаторный белок 1 (AP-1) в прекурсороподобных линиях клеток остеокластов и остеокластах 64). Эти данные позволяют предположить, что ДМИ может быть использован для лечения остеокластических заболеваний, таких как ревматоидный артрит и остеопороз.
Астма – это хроническое воспалительное заболевание дыхательных путей, опосредованное различными клетками (эозинофилами, макрофагами, лимфоцитами, нейтрофилами, эпителиальными клетками дыхательных путей и др.), и клеточными компонентами. ДМИ, очевидно, снижает регулирование уровней IL-4, IL-5, IL-13 и уменьшает количество воспалительных клеток в бронхоальвеолярной жидкости лаважа (BAL) от астмы, вызванной овальбумином (OVA) у мышей 65). Предполагается, что ДМИ может быть возможным потенциальным противовоспалительным средством при астме.
В тканях почек, накопление кальция приводит к образованию камней в почках и повреждению почек. Экспериментальные результаты показали, что ДМИ снижает уровень молекул повреждения почек-1, и уровень азота в мочевине крови (BUN), а также кальция при остром повреждении почек (ОПП) у крыс. ДМИ ингибировал агрегацию кристаллов оксалата кальция и снижал уровень Са/креатинина в моче. Уровни CD44 и остеопонтина, а также популяция TUNEL-положительных клеток в почках, очевидно, снижались после приема ДМИ. Кроме того, ДМИ также оказывает антиоксидантное действие на почки. Таким образом, ДМИ предотвращал вызванное эндоксемией острое повреждение почек (ОПП) за счет снижения агрегации кальция и ингибирования генерации АФК 66). Цисплатин является основным противоопухолевым препаратом с тяжелыми побочными эффектами. Высокая доза цисплатина, вероятно, вызовет нефротоксичность или даже постоянное снижение функции почек. Прием ДМИ значительно снизил концентрацию азота мочевины в крови (BUN) и сывороточного креатинина (SCr), улучшил структурные повреждения и функциональные нарушения почек, вызванные цисплатином 67). Таким образом, ДМИ может быть полезен при лечении ОПП.
Трансплантация мезенхимальных стволовых клеток костного мозга (bmMSC) является перспективной новой стратегией для лечения ряда заболеваний. Исследования показали, что ДМИ повышает жизнеспособность мезенхимальных стволовых клеток с OH-стимуляцией, что может быть связано с антиоксидантным эффектом ДМИ. В точных механизмах его действия может быть задействована прямая очистка от свободных радикалов и Fe2+-хелатирование 68). Этот защитный эффект указывает на то, что ДМИ может быть перспективным средством для клеточной трансплантационной терапии.
Заключительные замечания и перспективы на будущее
Биодоступность полифенольных соединений зависит от их трансмембранной способности и структуры. Эксперименты показали, что полифенолы имеют низкую биодоступность 69). Флавоноиды широко используются в нашем ежедневном диетпитании, например, они содержатся во фруктах, какао и чае 70). В пище, флавоноиды чаще всего присутствуют в гликозилированных формах, и гликозилирование может влиять на их абсорбцию 71). ДМИ – это флавоноид из растения А. grossedentata, который также является полифенольной смесью. Плохая стабильность, низкая растворимость, быстрый метаболизм и всасывание обычно приводят к слабой биодоступности и неэффективной лекарственной способности ДМИ, что ограничивает его потенциальные лекарственные применения. Есть еще несколько конкретных механизмов его действия, которые не были четко определены. Однако, ДМИ обладает различными фармакологическими эффектами и имеет множество видов применения для лечения заболеваний сердечнососудистой системы, печени, нервной системы, кожи, а также, может влиять на улучшения при метаболических заболеваниях, таких как диабет. Большое количество исследований подтвердили, что ДМИ проявляет защитное или профилактическое влияние через антиоксидантное, противовоспалительное, противоапоптозное действие и др. Точные механизмы его действия могут быть связаны с несколькими различными молекулами, которые влияют на клеточный апоптоз, оксидативный стресс и воспаление, такими как AMPK, MAPK, Akt, NF-κB, Nrf2, ABCA1, PPARγ и так далее. Во всяком случае, с точки зрения фармакологии, ДМИ является перспективным флавоноидным соединением для профилактики начала и прогрессирования ряда заболеваний. Несмотря на представленные гипотезы о механизмах его действия, необходимы дальнейшие исчерпывающие механистические и токсикологические исследования ДМИ для ускорения экспериментальных исследований или доклинических исследований коммерческих лекарств в ближайшем будущем.










