Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Гипопитуитаризм
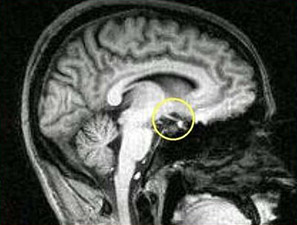 Гипопитуитаризм представляет собой пониженную (гипо) секрецию одного или более из восьми гормонов, обычно вырабатываемых гипофизом на уровне головного мозга.1) Если наблюдается пониженная секреция большинства гипофизарных гормонов, используется понятие «пангипопитуитаризм» («пан» означает «все»).
Признаки и симптомы гипопитуитаризма варьируются в зависимости от того, какие гормоны секретируются в недостаточном количестве и какова основополагающая причина нарушения. Диагностика гипопитуитаризма осуществляется с помощью анализов крови, но часто требуются специфическое сканирование и другие исследования для выявления основополагающей причины, такой как опухоли гипофиза, и оптимального лечения. Большинство гормонов, контролируемых секрецией гипофиза, могут быть замещены таблетками или инъекциями. Гипопитуитаризм представляет собой редкое заболевание, но может значительно редко диагностироваться у людей с предшествующим травматическим повреждением головного мозга. Первое описание состояния было сделано в 1914 г. немецким врачом доктором Моррисом Симмондсом.2)
Гипопитуитаризм представляет собой пониженную (гипо) секрецию одного или более из восьми гормонов, обычно вырабатываемых гипофизом на уровне головного мозга.1) Если наблюдается пониженная секреция большинства гипофизарных гормонов, используется понятие «пангипопитуитаризм» («пан» означает «все»).
Признаки и симптомы гипопитуитаризма варьируются в зависимости от того, какие гормоны секретируются в недостаточном количестве и какова основополагающая причина нарушения. Диагностика гипопитуитаризма осуществляется с помощью анализов крови, но часто требуются специфическое сканирование и другие исследования для выявления основополагающей причины, такой как опухоли гипофиза, и оптимального лечения. Большинство гормонов, контролируемых секрецией гипофиза, могут быть замещены таблетками или инъекциями. Гипопитуитаризм представляет собой редкое заболевание, но может значительно редко диагностироваться у людей с предшествующим травматическим повреждением головного мозга. Первое описание состояния было сделано в 1914 г. немецким врачом доктором Моррисом Симмондсом.2)
Признаки и симптомы
Гормоны гипофиза обладают различным воздействием на организм, и, таким образом, симптомы гипопитуитаризма зависят от того, какой гормон находится в состоянии дефицита. Симптомы могут быть малозаметными и часто изначально объясняются другими причинами.3) В большинстве случаев дефицитны три или более гормона. Наиболее распространенная проблема заключается в нехватке фолликулостимулирующего гормона (ФСГ) и/или лютеинизирующего гормона (ЛГ), которая ведет к отклонению от нормы уровня половых гормонов. Дефицит гормона роста наиболее распространен у людей, у которых заболевание скорее связано с опухолью, чем с другими причинами.4) В некоторых случаях наблюдаются дополнительные симптомы, которые берут начало из исходной причины; например, если гипопитуитаризм связан с вырабатывающей гормон роста опухолью, симптомы могут заключаться в акромегалии (увеличение кистей рук и ступней, грубые черты лица), а если опухоль распространяется на зрительный нерв или перекрест зрительных нервов, могут возникнуть дефекты поля зрения. Головные боли также могут сопровождать гипофизарные опухоли, а также гипофизарная апоплексия (инфаркт или кровоизлияние гипофизарной опухоли) и лимфоцитарный гипофизит (аутоиммунное воспаление гипофиза). Апоплексический удар, в дополнение к внезапным головным болям и быстрому ухудшению потери зрения, также может быть связан с раздвоением зрения, причина которого заключается в сжатии нервов в сопредельном пещеристом синусе, который контролирует глазные мышцы.5) Гипофизарная недостаточность приводит к множеству изменений кожи, волос и ногтей как результат отсутствия действия гипофизарных гормонов в этих местах.
Передняя доля гипофиза
Дефицит всех гормонов передней доли гипофиза более распространен, чем дефицит отельного гормона. Дефицит лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона, в совокупности носящих название «гонадотропины», вызывает у мужчин и женщин различные симптомы. Женщины демонстрируют олиго- или аменорею (нечастые/легкие или отсутствующие менструальные периоды соответственно) и бесплодие. Мужчины теряют волосы на лице, мошонке и туловище, а также страдают от снижения мышечной массы и анемии. У обоих полов может наблюдаться снижение либидо и потеря половой функции, также они находятся в группе повышенного риска развития остеопороза (хрупкость костей). Нехватка ЛГ/ФСГ у детей связывается с задержкой полового созревания. Дефицит гормона роста ведет к снижению мышечной массы, центральному ожирению (увеличение количества телесного жира вокруг талии), а также нарушению внимания и памяти. У детей наблюдается замедление роста и низкий рост. Дефицит адренокортикотропного гормона (АКТГ) ведет к недостаточности надпочечников, недостаточной выработке глюкокортикоидов, таких как кортизол, надпочечниками. Если проблема носит хронический характер, симптомы включают утомляемость, потерю веса, отставание в физическом развитии (у детей), задержку полового созревания (у подростков), гипогликемию (низкий уровень сахара в крови), анемию и гипонатремию (низкий уровень натрия). Если начало внезапное, могут наблюдаться коллапс, удар и рвота. Дефицит АКТГ в значительной степени имеет сходство с болезнью Аддисона, при которой наблюдается дефицит кортизола как результат непосредственного повреждения надпочечников; последняя форма, тем не менее, часто ведет к гиперпигментации кожи, которая не возникает при дефиците АКТГ. Дефицит тиреотропного гормона (ТТГ) вызывает гипотиреоз (недостаточная выработка тироксина (T4) и трийодотиронина (T3) щитовидной железой). Обычные симптомы включают усталость, непереносимость холода, запор, набор веса, потерю волос и замедленное мышление, а также замедленное сердцебиение и пониженное кровяное давление. У детей гипотиреоз приводит к замедлению роста, а в критических врожденных формах к синдрому под названием кретинизм. Пролактин играет роль при грудном вскармливании, и неспособность кормить грудью может указывать на патологически низкий уровень пролактина.
Задняя доля гипофиза
Дефицит антидиуретического гормона (АДГ) приводит к синдрому несахарного диабета (не имеет отношения к сахарному диабету): неспособность концентрировать мочу, которая ведет к полиурии (выработка больших количеств чистой мочи), что ведет к низкому уровню растворенных веществ, обезвоживанию и, в качестве механизма компенсации, к чрезмерной жажде и постоянной потребности в приеме жидкости (полидипсия), а также гипернатремии (высокий уровень натрия в крови). Дефицит АДГ может быть латентным, если также имеется дефицит АКТГ, при этом симптомы исчезают только при замещении кортизола. Дефицит окситоцина, как правило, вызывает несколько симптомов, которые проявляются только во время рождения ребенка и грудного вскармливания.
Причины
- Опухоли: большинство случаев гипопитуитаризма связано с гипофизарными аденомами, сдавливающими здоровую ткань железы, а в редких случаях - с другими опухолями головного мозга за пределами гипофиза — краниофарингиомой, менингиомой, хордомой, эпендимомой, глиомой или метастазом рака в других частях организма.
- Инфекция,воспаление и инфильтрация: гипофиз также может подвергаться воздействию инфекций головного мозга (абсцесс головного мозга, менингит, энцефалит) или самой железы, либо в него могут просачиваться атипичные клетки (нейросаркоидоз, гистиоцитоз) и избыточное количество железа (гемохроматоз). Синдром пустого турецкого седла представляет собой необъяснимое исчезновение гипофизарной ткани, предположительно связанное с давлением извне. Аутоиммунный или лимфоцитарный гипофизит возникает, когда иммунная система напрямую атакует гипофиз.
- Сосудистые: на определенных сроках беременности гипофиз беременной женщины чувствителен к низкому кровяному давлению, такому как возникающее в результате кровоизлияния; повреждение гипофиза, связанное с кровотечением после рождения ребенка, носит название синдром Шихана. Гипофизарная апоплексия представляет собой кровоизлияние или инфаркт (прекращение подачи крови) гипофиза. Другие формы инсульта в значительной степени определяются как причина гипопитуитаризма.
- Излучение: вызванный излучением гипопитуитаризм главным образом воздействует на гормон роста и половые гормоны.6) Наоборот, дефицит адренокортикотропного гормона (АКТГ) и тиреотропного гормона (ТТГ) менее распространен среди людей с вызванным излучением гипопитуитаризмом. Изменения секреции пролактина обычно незначительны, а дефицит вазопрессина достаточно редко встречается в качестве последствия излучения.
- Другие физические причины: дополнительные физические причины гипопитуитаризма включают травматическое повреждение головного мозга, субарахноидальное кровоизлияние, нейрохирургию и ионизирующее изучение (например, лучевая терапия имевшейся ранее опухоли мозга).
- Врожденные: врожденный гипопитуитаризм (уже имеется при рождении) может быть результатом осложнений во время родов либо недостаточного развития (гипоплазия) железы, иногда в контексте специфических генетических патологических отклонений. Мутации могут вызывать либо недостаточное развитие, либо пониженную функцию. Формы смешанного дефицита гипофизарных гормонов («CPHD») включают: синдром Кальмана вызывает только дефицит гонадотропинов. Синдром Барде-Бидля и синдром Прадера-Вилли связываются с дефицитом гипофизарных гормонов.
Патофизиология
Гипофиз расположен на уровне головного мозга и тесно связан с гипоталамусом. Он состоит из двух долей: задней доли, которая состоит из нервной ткани, ответвляющейся от гипоталамуса, и передней доли, которая состоит из вырабатывающего гормоны эпителия. Задняя доля секретирует антидиуретический гормон, который регулирует осмолярность крови, и окситоцин, который вызывает сокращения матки при родах и имеет отношение к вскармливанию грудью. Гипофиз развивается на третьей неделе эмбриогенеза за счет взаимодействия между промежуточной частью головного мозга и носовой полостью. Клетки головного мозга выделяют FGF-8, Wnt5a и BMP-4, а полость рта – BMP-2. Вместе данные клеточные сигналы стимулируют группу клеток из полости рта к образованию кармана Ратке, который становится независимым от носовой полости и развивается в переднюю долю гипофиза; данный процесс включает подавление выработки белка под названием соник еж-белок клетками кармана Ратке. Клетки в дальнейшем дифференцируются в различные вырабатывающие гормоны клетки гипофиза. Для этого требуются определенные транскрипционные факторы, которые вызывают выраженность определенных генов. Некоторые из данных транскрипционных факторов находятся в состоянии дефицита при определенных формах редкого смешанного дефицита гормонов гипофиза (CPHD) в детстве. Они включают HESX1, PROP1, POU1F1, LHX3, LHX4, TBX19, SOX2 и SOX3. Каждый транскрипционный фактор действует в определенных группах клеток. Отсюда следует, что различные генетические мутации связываются с дефицитом специфического гормона. Например, мутации POU1F1 (также известного как Pit-1) вызывают специфический дефицит гормона роста, пролактина и ТТГ. В дополнение к гипофизу, некоторые транскрипционные факторы также необходимы для развития других органов; некоторые из данных мутаций, таким образом, также связываются со специфическими дефектами рождения.7) Большинство гормонов передней доли гипофиза представляет собой часть оси, которая регулируется гипоталамусом. Гипоталамус выделяет несколько рилизинг-гормонов, часто в соответствии с циркадным ритмом, в кровеносные сосуды, которые питают переднюю долю гипофиза; большинство из них является стимулирующими (тиреотропин-рилизинг гормон, кортикотропин-рилизинг гормон, гонадотропин-высвобождающий гормон и гормон, высвобождающий гормон роста), за исключением дофамина, который подавляет выработку пролактина. В зависимости от темпа высвобождения гормонов, передняя доля гипофиза вырабатывает свои гормоны (ТТГ, АКТГ, ЛГ, ФСГ, гормон роста), которые, в свою очередь, стимулируют эффекторные гормональные железы в организме, в то время как пролактин действует непосредственно на молочную железу. Как только железа-эффектор вырабатывает достаточное количество гормонов (тироксин, кортизол, эстрадиол или тестостерон и ИФР-1), клетки гипоталамуса и гипофиза чувствуют их количество и снижают секрецию стимулирующих гормонов. Гормоны задней доли гипофиза вырабатываются в гипоталамусе и переносятся посредством нервных окончаний в заднюю долю; их система обратной связи, таким образом, расположена в гипоталамусе, но повреждение нервных окончаний всего лишь приведет к недостаточному высвобождению гормонов. За исключением случаев, когда повреждение гипофиза вызвано опухолью, которая в избыточном количестве вырабатывает конкретный гормон, недостаточность гормонов гипофиза приводит в описанным выше симптомам, а избыток конкретного гормона свидетельствует о наличии опухоли. Исключением в данном случае является пролактин: если опухоль давит на воронку гипофиза, сниженная подача крови означает, что лактотропные клетки, которые вырабатывают пролактин, не получают допамин и, таким образом, вырабатывают избыточное количество пролактина. В результате, умеренное повышение уровня пролактина связывается с давлением на воронку. Чрезвычайно высокий уровень пролактина, все-таки, в большей степени свидетельствует о наличии пролактиномы (вырабатывающей пролактин опухоли).8)
Диагностика
Диагностика гипопитуитаризма выполняется посредством анализов крови. Для подтверждения дефицита гормонов применяется два типа анализов крови: базальный уровень, когда забираются образцы крови–обычно утром–в отсутствие какой-либо формы стимуляции, и динамические анализы, когда анализы крови выполняются после введения стимулирующего вещества. Измерение АКТГ и гормона роста обычно требует динамического анализа, в то время как другие гормоны (ЛГ/ФСГ, пролактин, ТТГ) обычно тестируются с помощью базального уровня. Не существует соответствующего прямого анализа уровня АДГ, но уровень АДГ может быть подтвержден косвенно; уровень окситоцина обычно не измеряется. Как правило, обнаружение сочетания низкого уровня гормона гипофиза с низким уровнем гормона железы-эффектора свидетельствует о гипопитуитаризме. В редких случаях, гипофизарный гормон может быть на нормальном уровне, но уровень гормона железы-эффектора понижен; в данном случае гипофиз надлежащим образом не реагирует на изменения эффекторного гормона, а сочетание показателей также свидетельствует о гипопитуитаризме.
Базальные анализы
Уровни ЛГ/ФСГ могут быть подавлены повышенным уровнем пролактина, и, таким образом, не интерпретируются, за исключением случаев, когда уровень пролактина низкий или нормальный. У мужчин низкий уровень ЛГ и ФСГ в сочетании с низким уровнем тестостерона подтверждает дефицит ЛГ/ФСГ; высокий уровень тестостерона будет свидетельствовать об источнике в другом месте организма (например, выделяющей тестостерон опухоли). У женщин диагноз дефицита ЛГ/ФСГ зависит от того, находится ли женщина в состоянии менопаузы. До менопаузы отклоняющиеся от нормы периоды менструации наряду с низким уровнем эстрадиола и ЛГ/ФСГ подтверждает проблему с гипофизом; после менопаузы (когда уровни ЛГ/ФСГ естественно повышены и яичники вырабатывают меньшее количество эстрадиола), необычно низкого уровня ЛГ/ФСГ в отдельности не достаточно. Стимуляционные анализы с использованием ГнВГ возможны, но их применение не поощряется. Что касается ТТГ, обычно достаточно базальных измерений, а также измерения тироксина с целью подтверждения, что гипофиз не подавляет выработку ТТГ всего лишь в ответ на гипертиреоз (гиперфункцию щитовидной железы). Стимуляционный анализ с использованием тиреотропин-рилизинг гормона (ТРГ) не рассматривается в качестве целесообразного. Пролактин может быть измерен посредством базального анализа и необходим для интерпретации результатов в отношении ЛГ и ФСГ для подтверждения гипопитуитаризма или наличия вырабатывающей пролактин опухоли.
Стимуляционные пробы
Дефицит гормона роста практически известен, если все другие анализы гормонов гипофиза дали отклоняющиеся от нормы результаты, а уровень инсулиноподобного фактора роста1 (ИФР-1) понижен. В ином случае, уровень ИФР-1 является плохим прогностическим фактором наличия дефицита гормона роста; в таком случае требуется стимуляционная проба с использованием теста толерантности к инсулину. Он выполняется посредством приема инсулина с целью снижения уровня сахара в крови до значения ниже 2,2 ммоль/л. Как только это произойдет, измеряется уровень гормона роста. Если его уровень низкий, несмотря на стимулирующее действие низкого уровня сахара в крови, дефицит гормона роста считается подтвержденным. Тест не исключает рисков, особенно у предрасположенных к пароксизмам или имеющих сердечные заболевания, и вызывает неприятные симптомы гипогликемии. Альтернативные анализы (такие как стимуляционная проба на гормон, высвобождающий гормон роста) в меньшей степени полезны, хотя для диагностики может применяться стимуляционный анализ с использованием аргинина, особенно в случаях, когда тест толерантности к инсулину может быть слишком опасен.9) Если подозревается дефицит гормона роста, а все остальные гипофизарные гормоны находятся на нормальном уровне, для подтверждения требуется две разные стимуляционные пробы. Если утренний уровень кортизола выше 500 нмоль/л, дефицит АКТГ маловероятен, в то время как уровень ниже 100 свидетельствует о дефиците. Уровень в диапазоне 100-500 требует стимуляционной пробы. Она, более того, выполняется с использованием теста толерантности к инсулину. Уровень кортизола выше 500 после достижения низкого уровня сахара в крови исключает дефицит АКТГ, в то время как более низкий уровень подтверждает диагноз. Аналогичная стимуляционная проба с использованием кортикотропин-рилизинг гормона недостаточно чувствительна для целей исследования. Если тест толерантности к инсулину дает отклоняющийся от нормы результат, для подтверждения диагноза в дальнейшем может быть выполнен тест, определяющий реакцию надпочечников на синтетический АКТГ (стимуляционная проба АКТГ).10) Альтернативой может служить стимуляционный анализ с использованием метирапона. Некоторые утверждают, что стимуляционной пробы АКТГ достаточно в качестве исследования первой линии и что тест толерантности к инсулину требуется только в том случае, если результаты пробы АКТГ неоднозначны. Использование теста толерантности к инсулину у детей не рекомендуется. Ни один из анализов относительно дефицита АКТГ не совершенен, и по прошествии времени могут потребоваться дальнейшие тесты, если первоначальные результаты не заключительны. Симптомы несахарного диабета требуют формального теста лишения жидкости для оценки реакции организма на обезвоживание, которое обычно вызывает концентрацию мочи и повышает осмолярность крови. Если данные параметры неизменны, принимается дезмопрессин (аналог АДГ). Если моча затем становится концентрированной, а осмолярность крови падает, это свидетельствует о нехватке АДГ в связи с недостаточностью функции гипофиза («краниальный несахарный диабет»). Наоборот, изменения отсутствуют, если почки невосприимчивы к АДГ в связи с другой проблемой («нефрогенный несахарный диабет»).
Дальнейшие исследования
Если один из данных анализов выявил дефицит гормонов, вырабатываемых гипофизом, магнитно-резонансная томография (МРТ) гипофиза представляет собой первый шаг в выявлении лежащей в основе нарушения причины. МРТ может показать различные опухоли и способствовать определению других причин. Опухоли, по размеру меньше 1 см, называются микроаденомами, а более крупные повреждения носят название макроаденомы. Компьютерная томография с радиоконтрастным веществом может применяться, если МРТ не доступна. Рекомендуется формальное тестирование поля зрения посредством периметрии, поскольку это может показать наличие опухоли, сдавливающей зрительный нерв. Другие тесты, которые могут способствовать диагностике гипопитуитаризма, особенно если на скане МРТ не было обнаружено опухолей, включают уровень ферритина (повышен при гемохроматозе), ангиотензин-превращающего фермента (ACE) (часто повышен при саркоидозе) и хорионического гонадотропина человека (часто повышен при опухолях герминогенного происхождения). Если подозревается генетическая причина, может быть выполнено генетическое тестирование.
Лечение
 Лечение гипопитуитаризма включает в себя три составляющие: устранение исходной причины, лечение дефицита гормонов и обращение к другим реперкуссиям, которые берут начало из дефицита гормонов.
Лечение гипопитуитаризма включает в себя три составляющие: устранение исходной причины, лечение дефицита гормонов и обращение к другим реперкуссиям, которые берут начало из дефицита гормонов.
Исходная причина
Опухоли гипофиза требуют лечения, когда они вызывают специфические симптомы, такие как головные боли, дефекты поля зрения и избыточная секреция гормонов. Транссфеноидальная хирургия(удаление опухоли посредством хирургической операции через нос и клиновидную пазуху) может, за исключением обращения к симптомам, связанным с опухолью, улучшить функцию гипофиза, хотя в некоторых случаях в результате хирургической операции может быть повреждена сама железа. Когда опухоль удаляется с помощью краниотомии (трепанации черепа), восстановление менее вероятно, но в некоторых случаях это единственный возможный способ доступа к опухоли. После хирургической операции может пройти некоторое время, пока уровни гормонов значительно изменятся. Повторные анализы уровня гормонов гипофиза проводятся по прошествии от 2 до 3 месяцев. Пролактиномы могут реагировать на лечение агонистами допамина –лекарственными препаратами, которые подражают действию допамина на лактотропные клетки, обычно бромокриптин или каберголин. Данный метод лечения может улучшить секрецию гормонов гипофиза в более чем половине случаев, а также устранить потребность в лечении добавками.11) Другие специфические исходные причины лечатся в обычном порядке. К примеру, гемохроматоз лечится с помощью веносекции, регулярного извлечения определенного количества крови. В конечном итоге это снижает уровень железа в организме и улучшает функционирование органов, в которых аккумулировалось железо.
Замещение гормона
Большинство гормонов гипофиза могут быть косвенно замещены посредством приема продуктов желез-эффекторов: гидрокортизона (кортизола) при недостаточности надпочечников, левотироксина при гипотиреозе, тестостерона при мужском гипогонадизме и эстрадиола при женском гипогонадизме (обычно с использованием прогестерона с целью ингибирования нежелательного воздействия на матку). Гормон роста доступен в синтетической форме, но требует парентерального приема (посредством инъекции). Антидиуретический гормон может быть замещен дезмопрессином (DDAVP) в форме таблеток или назального спрея. Как правило, минимальная доза замещающего лекарственного препарата применяется с целью восстановления хорошего самочувствия и корректировки отклоняющихся от нормы результатов, поскольку избыточные дозы могут вызвать побочные действия или осложнения. Тем, кому необходим гидрокортизон, обычно даются инструкции по повышению дозы в физически стрессовых ситуациях, таких как травма, госпитализация и лечение зубов, поскольку в данных случаях нормальной добавочной дозы может быть недостаточно, что подвергает пациента риску острой недостаточности функции коры надпочечников. Людям с гипопитуитаризмом, как правило, требуется долгосрочное наблюдение у эндокринолога. За исключением случаев уверенности, что было предпринято правильное лечение с правильной дозой, это также обеспечивает возможность своевременно реагировать на новые симптомы и работать с осложнениями в результате лечения. Сложные случаи возникают в результате дефицита гипоталамической-гипофизарной-гонадальной оси у людей (как у мужчин, так и женщин), которые страдают бесплодием; бесплодие при гипопитуитаризме может быть вылечено с помощью подкожных инъекций ФСГ, хорионического гонадотропина человека–которые имитируют действие ЛГ–и временами ГнВГ.
Осложнения
Дефицит нескольких гормонов, связанный с гипопитуитаризмом, может привести к вторичным заболеваниям. Например, дефицит гормона роста связывается с ожирением, повышенным уровнем холестерина и метаболическим синдромом, а дефицит эстрадиола может привести к остеопорозу. В то время как эффективное лечение исходного дефицита гормона может снизить данные риски, часто имеется необходимость осуществлять их лечение напрямую.
Прогноз
Несколько исследований показали, что гипопитуитаризм связан с повышенным риском сердечно-сосудистых заболеваний и также в некоторой степени с повышенным риском смерти приблизительно от 50% до 150% нормальной популяции. Сложно определить, дефицит какого гормона отвечает за данный риск, поскольку практически все пациенты, подвергавшиеся исследованию, имели дефицит гормона роста. Исследования также не дали ответа на вопрос, вызывает ли гипопитуитаризм сам по себе повышенную смертность или определенный риск связан с лечением, некоторые формы которого (такие как прием половых гормонов) продемонстрировали неблагоприятное действие на сердечно-сосудистые риски. Крупнейшее на сегодняшний день исследование проводилось на тысяче людей в течение восьми лет; оно показало на 87% повышенный риск смерти по сравнению с нормальным населением. Прогностическими факторами повышенного риска были: женский пол, отсутствие лечения дефицита половых гормонов, молодой возраст во время диагноза и краниофарингиома. Помимо сердечно-сосудистых заболеваний, данное исследование также выявило повышенный риск смерти от легочных заболеваний. Качество жизни может быть в значительной степени снижено, даже у людей на оптимальной медицинской терапии. Многие сообщают о физических и психологических проблемах. Вероятно, что широко применяемые терапии замещения все же не в полной мере имитируют естественный уровень гормона в организме. Расходы на здравоохранение остаются приблизительно в два раза выше, чем у нормального населения.
Эпидемиология
Существует только одно исследование, которое оценивало распространенность (общее число случаев среди населения) и частоту возникновения (ежегодное количество новых случаев) гипопитуитаризма. Данное исследование было проведено в Северной Испании и использовало больничные записи в отношении четко определенной совокупности людей. Исследование показало, что 45,5 людям из 100000 был поставлен диагноз гипопитуитаризм, при этом наблюдалось 4,2 новых случаев в год. 61% случаев был связан с опухолями гипофиза, 9% - с другими типами повреждений, а 19% - с другими причинами; в 11% случаев причина не была выявлена. Недавние исследования показали, что люди с полученным ранее травматическим повреждением головного мозга, спонтанным субарахноидальным кровоизлиянием (тип инсульта) или лучевой терапией, охватывающей голову, находятся в группе повышенного риска возникновения гипопитуитаризма. После травматического повреждения головного мозга до четверти имеют устойчивый дефицит гормонов гипофиза.12) Многие из этих людей могут иметь малозаметные или неспецифические симптомы, которые не связаны с проблемами гипофиза, но объясняются их предыдущим состоянием. Таким образом, возможно, что многие случаи гипопитуитаризма остаются недиагностированными и что ежегодная частота возникновения возрастет до 31 на 100000 ежегодно, если будут протестированы люди из данной группы риска.
История
Гипофиз был известен античным людям, таким как Гален, и было предложено множество теорий о его роли в организме, но основные догадки о действительной роли железы не были близки к истине до конца XIX века, когда была описана акромегалия, связанная с опухолями гипофиза.13) Первое известное сообщение о гипопитуитаризме было сделано немецким врачом и патологоанатомом доктором Моррисом Симмондсом. Он описал аутопсию 46-летней женщины, которая страдала от тяжелого послеродового сепсиса за одиннадцать лет до этого и впоследствии страдала аменореей, слабостью, признаками быстрого старения и анемией. Гипофиз был достаточно мелким с небольшим количеством остатков передней и задней доли гипофиза. Эпоним синдром Симмондса не часто используется в отношении приобретенного гипопитуитаризма, особенно когда преобладает кахексия (общая болезненность и недостаточность питания). Большинство классических случаев гипопитуитаризма было описано в XX веке; в раннем XXI веке было обнаружено, насколько может быть распространен гипопитуитаризм у при полученном ранее повреждении головы. До 1950-х диагностика заболеваний гипофиза основывалась на клинических характерных особенностях и исследовании зрительного поля, в некоторых случаях сопровождалась пневмоэнцефалографией и рентгенографией. Тем не менее, в это время была разработана хирургия гипофиза. Основному прорыву в диагностике поспособствовало открытие радиоиммунологического анализа Розалиной Ялоу и Соломоном Берсоном в конце 1950-х. Это дало возможность непосредственного измерения уровня гормонов гипофиза, низкую концентрацию в крови которых ранее было сложно измерить.[25] Стимуляционные пробы были разработаны в 1960-х, а в 1973 г. было введено динамическое тестирование функции гипофиза, которое объединило стимуляционный анализ с использованием инсулина, ГнВГ и ТРГ.14) Визуализация гипофиза и, следовательно, выявление опухолей и других структурных причин было радикально усовершенствовано с открытием компьютерной томографии в конце 1970-х и магнитно-резонансной томографии в 1980-х.
:Tags
Читать еще: Ликофелон , Синдром Кальмана , Теафлавины , Флутиказон (флутиказона пропионат) , Элеутерококк (Элеутерококк колючий) ,










