Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
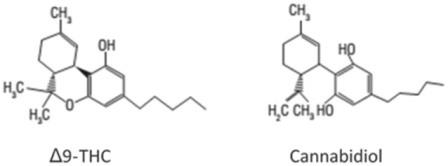
Каннабидиол
 Растение Cannabis sativa (каннабис) содержит более 100 химических соединений, имеющих сходную химическую структуру и известных как каннабиноиды.1) Основное психоактивное соединение в каннабисе – Δ-9-тетрагидроканнабинол (Δ9-ТГК), отвечающий за основные эффекты растения. Среди многих каннабиноидов, содержащихся в растении, мы сосредоточимся на каннабидиоле (КБД), соединении, которое не вызывает типичных субъективных эффектов марихуаны 2).
Начиная с 1970-х годов, был опубликован ряд научных статей, демонстрирующих потенциальные терапевтические эффекты КБД на различных моделях нейропсихиатрических заболеваний у животных, а также в клинических испытаниях с участием людей. В 1970-х и 1980-х годах были впервые продемонстрированы анксиолитические и антипсихотические эффекты КБД у животных, а позднее – и у людей, с довольно многообещающими результатами 3). Помимо эффективности КБД при тревоге и психозе, были проведены исследования других терапевтических возможностей применения КБД. Кроме того, недавно были разработаны патентоспособные синтетические аналоги КБД, имеющие потенциал для создания эффективных препаратов для лечения множества заболеваний 4)).
Цель настоящего обзора состоит в том, чтобы сообщить об исследованиях терапевтического потенциала КБД в нейропсихиатрии, особенно – о вкладе бразильских исследователей, которые помогли трансформировать взгляд на КБД (который считался неактивным каннабиноидом), заявив, что это – лекарство с несколькими механизмами действиями. Приведенные здесь исследования были выбраны на основе поиска в онлайн-базах данных PubMed, Web of Science и ScieELO для документов, посвященных терапевтическим применениям КБД (слово «каннабидиол» использовалось как ключевое).
Растение Cannabis sativa (каннабис) содержит более 100 химических соединений, имеющих сходную химическую структуру и известных как каннабиноиды.1) Основное психоактивное соединение в каннабисе – Δ-9-тетрагидроканнабинол (Δ9-ТГК), отвечающий за основные эффекты растения. Среди многих каннабиноидов, содержащихся в растении, мы сосредоточимся на каннабидиоле (КБД), соединении, которое не вызывает типичных субъективных эффектов марихуаны 2).
Начиная с 1970-х годов, был опубликован ряд научных статей, демонстрирующих потенциальные терапевтические эффекты КБД на различных моделях нейропсихиатрических заболеваний у животных, а также в клинических испытаниях с участием людей. В 1970-х и 1980-х годах были впервые продемонстрированы анксиолитические и антипсихотические эффекты КБД у животных, а позднее – и у людей, с довольно многообещающими результатами 3). Помимо эффективности КБД при тревоге и психозе, были проведены исследования других терапевтических возможностей применения КБД. Кроме того, недавно были разработаны патентоспособные синтетические аналоги КБД, имеющие потенциал для создания эффективных препаратов для лечения множества заболеваний 4)).
Цель настоящего обзора состоит в том, чтобы сообщить об исследованиях терапевтического потенциала КБД в нейропсихиатрии, особенно – о вкладе бразильских исследователей, которые помогли трансформировать взгляд на КБД (который считался неактивным каннабиноидом), заявив, что это – лекарство с несколькими механизмами действиями. Приведенные здесь исследования были выбраны на основе поиска в онлайн-базах данных PubMed, Web of Science и ScieELO для документов, посвященных терапевтическим применениям КБД (слово «каннабидиол» использовалось как ключевое).
Древняя история: неактивный каннабиноид (1940-1960-е годы)
Adams и коллеги выделяли каннабидиол из экстрактов каннабиса 5). Однако, в течение почти 25 лет не проводилось никаких дальнейших исследований КБД, за исключением нескольких исследований об его выделении в чистом виде. Точная химическая структура КБД была выяснена только в 1963 году группой профессора Рафаэля Мечулама из Еврейского университета Иерусалима в Израиле. На протяжении 1960-х годов, одна и та же группа отвечала за определение точной структуры и стереохимии Δ9-ТГК и других крупных каннабиноидов. Эти результаты открыли новую область исследований по фармакологической активности компонентов каннабиса. До 1970-х годов было проведено лишь несколько фармакологических исследований КБД, в которых был сделан вывод о том, что КБД, в отличие от Δ9-ТГК, не обладает каннабисподобной активностью.
Средние века: неактивный каннабиноид, который взаимодействует с Δ9-ТГК (1970-е годы)
В начале 1970-х годов, в нескольких исследованиях сообщалось, что КБД не способен имитировать эффекты марихуаны, что привело к убеждению, что это – неактивный каннабиноид. Однако, эта точка зрения начала меняться с учетом того, что активность различных экстрактов каннабиса широко варьировалась, и что это изменение не могло быть связано с разными уровнями Δ9-ТГК в образцах (8, 9). Это открытие привело к гипотезе о том, что другие каннабиноиды в целом и КБД в частности, могут влиять на эффекты Δ9-ТГК. В течение этого периода, бразильская исследовательская группа во главе с профессором Элисальдо Карлини внесла важный вклад в эту область благодаря своим ранним исследованиям о влиянии КБД, Δ9-ТГК и других каннабиноидов. В этом контексте началось исследование взаимодействия между Δ9-ТГК и КБД. Исследования показали, что КБД обладает собственными фармакологическими эффектами, которые были исследованы в дальнейшем, что и привело к нынешнему мнению о том, что КБД в действительности имеет широкий спектр действий. В первом исследовании в этой линии сравнивались образцы уличного каннабиса и синтетического экстракта, содержащего те же концентрации Δ9-ТГК, КНБ и КБД. Авторы обнаружили, что эффекты образцов были не одинаковыми у тестируемых животных, что согласуется с более ранними доказательствами того, что воздействие растения было связано не только с содержанием в нём Δ9-ТГК. Более поздние исследования взаимодействия каннабиноидов показали, что КБД одновременно блокировал и потенцировал эффекты Δ9-ТГК в тестах на животных, в зависимости от отношения коэффициента и дозы двух каннабиноидов. В настоящее время, у нас есть доказательства того, что фармакокинетическое взаимодействие, которое приводит к блокаде цитохромов P-450 с помощью КБД и ингибирует метаболизм Δ9-ТГК, может быть вызвано фармакодинамическим взаимодействием, когда отношение КБД / Δ9-ТГК является высоким и / или когда введение двух каннабиноидов происходит одновременно или очень близко по времени 6). При изучении взаимодействия между КБД и Δ9-ТГК у здоровых людей, высокие пероральные дозы Δ9-ТГК вызывали тревогу и психотические симптомы, которые ослаблялись, когда КБД вводили вместе с Δ9-ТГК. Эти результаты способствовали поддержке включения этих двух каннабиноидов в препарат Sativex® (GW-Pharm, Великобритания), препарат, используемый во всем мире для лечения боли и спастичности при рассеянном склерозе. Кроме того, эти наблюдения способствовали пониманию различных эффектов марихуаны на разные популяции, объясняемых различными концентрациями компонентов растения. В то же время, описанные здесь выводы показали, что КБД может обладать анксиолитическими и антипсихотическими свойствами, что породило новую линию исследований, осуществляемых и по сей день.
Современная история: воздействие КБД на беспокойство, депрессию и психоз (1980- 1990-е годы)
После бума 1970-х годов, число исследований КБД за последующие два десятилетия «стабилизировалось», что свидетельствует о падении интереса к изучению терапевтических действий этого каннабиноида. Несмотря на то, что некоторые научные группы продолжали предоставлять редкие вклады по этому вопросу, большая часть интереса в этой области была ограничена исследованиями анксиолитических, антидепрессантных и антипсихотических свойств КБД, проведенными бразильскими исследователями.
Исследования анксиолитического действия
Исследования на животных
Как упоминалось выше, ранние исследования на грызунах в начале 1980-х годов показали, что КБД может влиять на эффекты Δ9-ТГК и, более конкретно, что КБД ослабляет анксиогенные эффекты ТГК на условные эмоциональные реакции. В подтверждение этих результатов, та же группа обнаружила, что КБД способен предотвращать анксиогенные и психозоподобные эффекты, вызванные повышенными дозами Δ9-ТГК. Несмотря на то, что механизмы действия Δ9-ТГК и КБД были в то время неизвестны, Зуарди и его коллеги показали, что КБД может усиливать некоторые нейроэндокринные эффекты Δ9-ТГК 7). Это открытие показало, что КБД не является простым антагонистом рецептора Δ9-ТГК. Вместе, эти результаты показали, что КБД может вызывать физиологический антагонизм эффектов Δ9-ТГК с его анксиолитическими и антипсихотическими свойствами. Как показано ниже, эти свойства были подтверждены как у лабораторных животных, так и у людей. Первоначальные исследования в этой области дали противоречивые результаты. В то время как Zuardi и Karniol с коллегами обнаружили, что КБД (10 мг / кг) был способен ослаблять условные эмоциональные реакции у крыс, Silveira Filho и Tufik 8) не смогли обнаружить каких-либо эффектов КБД (100 мг / кг) в тесте Геллера-Сейфтера, который в то время считался «золотым стандартом» для тестирования животных моделей беспокойства. Эти явно противоречивые результаты были объяснены Guimarães et al. 9) с использованием недавно введенного теста, который был чувствителен к анксиолитическим препаратам, теста «приподнятый крестообразный лабиринт» (elevated plus maze, или EPM). Используя эту модель и покрывая полную кривую доза-реакция, они показали, что у крыс КБД индуцирует анксиолитические эффекты при более низких дозах (2,5-10 мг / кг), и что эти эффекты полностью исчезают при использовании более высоких доз. Как обсуждалось ниже, эта колоколообразная кривая доза-реакция была недавно подтверждена у людей, прошедших тестирование в клинической модели экспериментальной тревоги. После этой начальной работы, несколько исследований подтвердили, что КБД снижает тревогу у грызунов после однократного или повторного введения. Тест EPM основан на врожденном страхе перед открытыми и приподнятыми пространствами, и обычно ассоциируется с генерализованной тревожностью у людей. Поэтому, эти исследования были расширены на основе влияния КБД на модели, связанные с другими тревожными расстройствами, такими, как паника, посттравматическое стрессовое расстройство (ПТСР) и обсессивно-компульсивное расстройство (ОКР). Было также обнаружено, что КБД обладает явным антистрессовым эффектом после единоразового или повторного введения, ослабляя поведенческие и вегетативные последствия острого стресса ограничения и анксиогенные эффекты хронического непредвиденного стресса (CUS). Эти эффекты могут быть связаны с антидепрессантоподобными эффектами КБД, наблюдаемыми при стрессе в тесте принудительного плавания, в моделях Вистар-Киото и модели бульбэктомии 10).
Механизмы и возможные участки головного мозга, которые активизируются при помощи анксиолитических и антидепрессантных эффектов КБД
КБД имеет сложную фармакологию, и для объяснения его действия предлагается несколько механизмов. Большинство исследований, посвященных изучению механизмов действия КБД, были сделаны in vitro, но уже более 10 лет в исследованиях in vivo с использованием моделей на животных изучается вопрос о том, как КБД оказывает благоприятное воздействие на нейропсихиатрические расстройства. Чтобы обнаружить возможные участки, лежащие в основе эффектов КБД, была проведена серия исследований на грызунах с использованием внутримозгового введения лекарственного средства в области мозга, связанные с механизмами защиты, такие как медиальная префронтальная кора (mPFC), дорсальное околоводопроводное серое вещество (dPAG), опорное ядро краевой полоски (BNST), миндалина и гиппокамп. КБД индуцировал кратковременные анксиолитические эффекты при инъекции в dPAG и BNST. КБД также модифицировал поведение, напоминающее тревогу, в mPFC, предотвращая выработку условного рефлекса в связи с переживанием чувства страха. Однако, когда КБД был протестирован в тесте EPM, картина оказалась более сложной, так как он вызывал противоположные эффекты при введении в предлимбические или инфралимбические области mPFC. В этих областях, сообщаемые эффекты варьировались в зависимости не только от используемой модели животных, но и от предыдущего стрессового опыта 11). Непоследовательные результаты были обнаружены после инъекций КБД в миндалину после перорального приёма КБД (неопубликованные данные). Что касается гиппокампа, хотя кратковременный эффект КБД на эту структуру до сих пор неизвестен, повторное введение препарата предотвращало анксиогенный эффект хронического стресса, способствуя нейрогенезу гиппокампа. Острый антистрессовый эффект КБД также включает BNST, тогда как его антидепрессивное действие может быть опосредовано гиппокампом и mPFC. Недавно были исследованы фармакологические механизмы, связанные с анксиолитическими / антидепрессантными свойствами КБД. Кратковременные эффекты КБД явно зависят от облегчения серотонин-5HT1A-опосредованной нейропередачи в областях, связанных с защитой 12). Однако, не все эффекты КБД связаны с этим механизмом (46). Поскольку КБД может снизить метаболизм / поглощение анандамида, основного эндоканнабиноида, он также может действовать через эту систему. Действительно, краткосрочные эффекты КБД в тестах «закапывание шариков» и реконсолидации неприятных воспоминаний предотвращались антагонистами CB1-рецепторов. Усиление CB1- и CB2-опосредованных ответов, вероятно, из-за ингибирования метаболизма анандамида, также связано с пронейрогенным эффектом КБД. Наконец, также было показано, что инвертированная колоколообразная кривая доза-реакция на КБД в нескольких моделях тревоги / депрессии у животных, связана с активацией рецепторов TRPV1, которая возникает при более высоких дозах. Эти рецепторы могут увеличивать высвобождение глутамата, что будет противодействовать 5HT1A- или CB1-опосредованным анксиолитическим / антидепрессантным эффектам.
Исследования на людях
Согласно всесторонним обзорам, краткосрочное и длительное введение КБД различными способами (перорально, ингаляционно, внутривенно) у здоровых добровольцев и пациентов с различными клиническими состояниями, не вызывает значительных побочных эффектов 13), особенно, потому что у людей, по-видимому, не происходит превращения перорального каннабидиола в ТГК (52). Эти результаты подтверждают предыдущие наблюдения из исследований на животных, согласно которым, КБД является безопасным соединением для использования людьми в широком диапазоне доз. Потенциальный анксиолитический эффект КБД был впервые изучен у здоровых добровольцев с использованием теста имитационного публичного выступления (SPST). В этой модели, испытуемым предлагается в течение нескольких минут говорить перед видеокамерой, в то время как регистрируется его субъективное состояние тревоги и его физиологические симптомы (изменения сердечного ритма, кровяного давления, проводимости кожи). Было показано, что SPST эффективен в том, чтобы вызывать беспокойство, и чувствителен ко многим анксиогенным и анксиолитическим соединениям. В этом тесте, эффекты КБД (300 мг) сравнивали с эффектами двух анксиолитических соединений, ипсапирона (5 мг) и диазепама (10 мг), в двойной слепой плацебо-контролируемой процедуре. Полученные данные показали, что КБД и два других анксиолитических соединения ослабляют беспокойство, вызванное SPST. Боязнь публичных выступлений и её физиологические спутники считаются фундаментальными аспектами социального тревожного расстройства (СТР). Тем не менее, на настоящий момент в исследованиях не рассматривались анксиолитические эффекты КБД при патологической тревожности. Таким образом, этот вопрос был изучен на 12 пациентах с СТР, получавших 600 мг КБД, 12 пациентах с СТР, которые получали плацебо, и 12 здоровых добровольцах, которые прошли курс SPST без приема каких-либо лекарств 14). Группа пациентов с СТР, получавших КБД, имела более низкие уровни тревожности в показательных и предварительных этапах теста, более низкие отрицательные показатели самооценки и меньшее количество соматических симптомов, по сравнению с пациентами с СТР, которые получали плацебо. Кроме того, не было обнаружено существенных различий между пациентами с СТР, получавшими КБД, и здоровым контролем, в отличие от пациентов с СТР, принимавших плацебо. Было оценено влияние различных доз КБД на SPST у 57 здоровых добровольцев-мужчин, разделенных на четыре группы (плацебо, n = 15, КБД 150 мг, n = 15, КБД 300 мг, n = 15 и КБД 600 мг, n = 12) (55). Результаты подтвердили анксиолитический эффект КБД и ожидаемую инвертированную «колоколообразную» кривую доза-реакция, что согласуется с результатами исследований на животных, описанными выше. Совсем недавно был подтвержден и расширен этот вывод с испытуемыми, которые были разделены на пять групп: получающие КБД (100, 300 и 900 мг), бензодиазепин клоназепам (1 мг), и плацебо, и прошли тест на публичные выступления в реальной ситуации (TPSRS), где каждый волонтер должен был выступать перед группой, составленной из других участников. Опять же, краткосрочное введение КБД вызывало анксиолитические эффекты с дозозависимой колоколообразной кривой у здоровых добровольцев, поскольку уровень личного беспокойства уменьшался при введении 300 мг КБД, но не при приеме других доз КБД (100 и 900 мг) 15). Таким образом, эти результаты подчеркивают необходимость установления точных диапазонов терапевтических доз КБД для каждого клинического состояния.
Визуализация анксиолитических эффектов КБД в мозге
Первое исследование нейровизуализации, проведенное для изучения центральных эффектов КБД у людей, использовало однофотонную эмиссионную компьютерную томографию (SPECT) для оценки здоровых добровольцев, которые получали КБД (400 мг) или плацебо, в ходе двух лабораторных сеансов в течение 1 недели, в перекрёстной двойной слепой процедуре. Эта процедура связана с беспокойством, что позволяет исследовать потенциальные анксиолитические эффекты КБД. Результаты SPECT показали увеличение активности левой извилины гиппокампа и уменьшение левого комплекса миндалина-гиппокамп, распространяющегося на левую заднюю конусообразную кору и гипоталамус. Эта картина активности мозга, связанная с использованием КБД, считалась совместимой с центральным анксиолитическим эффектом в этих областях.
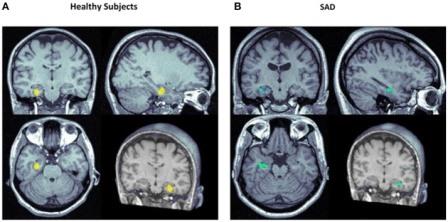 В серии исследований нейровизуализации, функциональная магнитно-резонансная томография (МРТ) использовалась для исследования нейронных коррелятов анксиолитических эффектов КБД у 15 здоровых испытуемых 16). Этот метод позволил получить большее количество изображений с лучшим пространственным и временным разрешением. КБД (600 мг) модулировал паттерны активности мозга, в то время как испытуемые наблюдали изображения страшных лиц, при этом ослаблялись реакции в передней и задней части поясной извилины и миндалине. Более того, этот вывод имел прямую корреляцию с сопутствующим эффектом КБД в модуляции ответов на проводимость кожи в зависимости от пугающих стимулов. В последующем исследовании было также продемонстрировано, что КБД производит свои анксиолитические эффекты, изменяя префронтально-подкорковое связывание через миндалину и переднюю поясную кору. Недавно было проведено первое исследование для изучения нейронных коррелятов анксиолитических эффектов КБД в клиническом образце, с использованием того же протокола, дизайна и дозы (400 мг), как в исследовании SPECT со здоровыми добровольцами, описанном выше. Было обнаружено, что, по сравнению с плацебо, КБД смог уменьшить субъективные показатели тревоги, не вызывая седативного эффекта у пациентов с СТР без лечения. Анксиолитический эффект был связан с уменьшенной активностью в гиппокампе, извилине гиппокампа и левой височной извилине, и повышенной активностью в коре задней части поясной извилины. Эти результаты показывают, что модулирующие эффекты КБД в лимбической и паралимбической областях совместимы с эффектами анксиолитических соединений у здоровых испытуемых и пациентов с тревожными расстройствами 17).
В серии исследований нейровизуализации, функциональная магнитно-резонансная томография (МРТ) использовалась для исследования нейронных коррелятов анксиолитических эффектов КБД у 15 здоровых испытуемых 16). Этот метод позволил получить большее количество изображений с лучшим пространственным и временным разрешением. КБД (600 мг) модулировал паттерны активности мозга, в то время как испытуемые наблюдали изображения страшных лиц, при этом ослаблялись реакции в передней и задней части поясной извилины и миндалине. Более того, этот вывод имел прямую корреляцию с сопутствующим эффектом КБД в модуляции ответов на проводимость кожи в зависимости от пугающих стимулов. В последующем исследовании было также продемонстрировано, что КБД производит свои анксиолитические эффекты, изменяя префронтально-подкорковое связывание через миндалину и переднюю поясную кору. Недавно было проведено первое исследование для изучения нейронных коррелятов анксиолитических эффектов КБД в клиническом образце, с использованием того же протокола, дизайна и дозы (400 мг), как в исследовании SPECT со здоровыми добровольцами, описанном выше. Было обнаружено, что, по сравнению с плацебо, КБД смог уменьшить субъективные показатели тревоги, не вызывая седативного эффекта у пациентов с СТР без лечения. Анксиолитический эффект был связан с уменьшенной активностью в гиппокампе, извилине гиппокампа и левой височной извилине, и повышенной активностью в коре задней части поясной извилины. Эти результаты показывают, что модулирующие эффекты КБД в лимбической и паралимбической областях совместимы с эффектами анксиолитических соединений у здоровых испытуемых и пациентов с тревожными расстройствами 17).
Антипсихотические эффекты КБД
Исследования на животных моделях
Используя классические животные модели для оценки антипсихотических эффектов, Zuardi и др. провели новаторское исследование и показали, что КБД уменьшает стереотипию (непроизвольное повторение слов, движений и т.п.), вызванную допаминергическими агонистами, что аналогично эффекту галоперидола. Однако, в отличие от последнего, КБД не вызывал каталепсии, моторного нарушения, связанного с антипсихотическими экстрапирамидальными побочными эффектами у людей. Более того, КБД только увеличивал уровни пролактина при высоких дозах (более 120 мг / кг). Эти эффекты были сходны с эффектами клозапина, что предполагает, что КБД может иметь атипичный антипсихотический профиль 18). Позже было продемонстрировано, что КБД также способен снижать гиперлокомоцию и преимпульсное ингибирование (PPI), вызванное амфетамином у мышей и крыс. Исследования были распространены на животные глутаматергические модели шизофрении, которые показали, что КБД уменьшает гиперлокомоцию и ухудшение преимпульсного ингибирования (PPI) , вызванное неконкурентными антагонистами глутаматного NMDA рецептора, кетамином и MK801, соответственно. В первом исследовании, КБД вводили длительно (в течение 21 дня), при этом наблюдалось снижение социальных нарушений и дефицита памяти, вызванного повторным введением MK801. Опять же, эти эффекты были аналогичны эффектам антипсихотического препарата клозапина. Фактически, отражая более ранние клинические данные (см. ниже), дозы КБД, которые производят антипсихотические эффекты, обычно выше, чем дозы препаратов с анксиолитическим действием. Интересно отметить, что в ходе недавнего многообещающего исследования было обнаружено, что препубертатное введение КБД ингибирует развитие гиперлокомоции, вызванное пренатальным приемом полиинозиновой: полицитидиловой кислоты, что указывает на то, что этот каннабиноид может иметь длительный эффект при препубертатном применении в качестве средства для предотвращения проявления психоза в зрелом возрасте. В настоящее время ведутся исследования этих результатов на людях с высоким уровнем риска психоза и людях с ранними продромальными фазами шизофрении. КБД не вызывал каталепсии ни в одном из исследований. Фактически, КБД предотвратил и частично обратил каталепсию, вызванную галоперидолом. Как обсуждается ниже, этот результат согласуется с клиническим заключением о том, что КБД, помимо блокирования психотических симптомов, индуцированных L-дигидроксифенилаланином (L-ДОФА), также может улучшить двигательные нарушения у пациентов с болезнью Паркинсона 19).
Механизмы и возможные очаги поражения при антипсихотических эффектах КБД
Ранее было обнаружено, что КБД продуцирует картину активации нейронов (измеренную экспрессией протоонкогена cFos), аналогично клозапину, но отлично от галоперидола. В то время как все три препарата увеличивали активацию в лимбических областях, только КБД и клозапин увеличивали активацию в mPFC. С другой стороны, галоперидол вызывал значительное увеличение экспрессии cFos в полосатом теле. Было подтверждено участие лимбических участков в антипсихотических эффектах КБД. КБД блокировал нарушение PPI, вызванное амфетамином после прямой инъекции в прилежащее ядро 20). В отношении участия mPFC в антипсихотическом действии КБД, было показано, что КБД, а также атипичный антипсихотический препарат клозапин, предотвращали снижение экспрессии парвальбумина (кальцийсвязывающего белка, экспрессируемого в подмножестве ГАМКергических интернейронов), и увеличивали экспрессию FosB / ΔFosB в mPFC после длительных инъекций антагониста NMDA MK-801. Хотя этот последний результат, по-видимому, контрастирует с приведенными выше свидетельствами о cFos, FosB / ΔFosB является маркером активации нейронов после повторной, а не кратковременной, стимуляции. Наконец, как КБД, так и клозапин, предотвращали увеличение числа GFAP-положительных астроцитов в mPFC и в процентах от Iba-1-положительных клеток микроглии с реактивным фенотипом в дорсальном гиппокампе и mPFC после повторного введения MK-801. Этот результат свидетельствует о том, что противовоспалительное действие КБД может быть связано с его антипсихотическими свойствами и согласуется с недавними выводами о том, что противовоспалительные лекарственные средства, такие как миноциклин, могут быть полезны при лечении шизофрении.
Исследования на человеке
В 1995 году Зуарди и его коллеги опубликовали первый отчет о пациенте с шизофренией, получавшем КБД. Пациентка с тяжелыми побочными эффектами от обычных антипсихотических препаратов принимала КБД в дозе до 1500 мг / день в течение 4 недель. Наблюдалось значительное снижение показателей симптомов по шкале психических расстройств Brief Psychiatric Rating Scale (BPRS). В более позднем исследовании, трем мужчинам-пациентам с резистентной к лечению шизофренией давали КБД (до 1280 мг / сут) в течение 30 дней, но только у одного из них наблюдалось частичное улучшение. Полученные результаты может оправдать тот факт, что из двух пациентов с шизофренией, которые не отвечали на лечение, у одного снижение психотических симптомов произошло только при приеме клозапина, а другой был резистентен даже к этому препарату. Ни у одного из пациентов не наблюдалось побочных эффектов при приеме КБД, что ранее наблюдалось у пациентов с шизофренией, которые принимали КБД, при этом их оценивали с помощью электродермальной реакции на аудиостимуляцию и в словесно-цветовом тесе Струпа. Позднее, три двойных слепых контролируемых клинических испытания, которые исследовали эффективность и переносимость КБД у пациентов с шизофренией, подтвердили предварительные результаты. В одном исследовании сравнивали влияние КБД (до 800 мг / сут) при приеме амисульприда у 42 пациентов с шизофренией в течение 4 недель. Оба средства значительно уменьшали психотические симптомы, без каких-либо различий между ними; однако, КБД вызывал меньше побочных эффектов по сравнению с амисульпридом. Антипсихотические эффекты КБД также были исследованы у пациентов с первым эпизодом шизофрении, которые лечились в течение 14 дней в перекрестном плацебо-контролируемом исследовании 21). КБД значительно снизил психотические симптомы через 2 недели по сравнению с исходным уровнем, хотя различия с плацебо не смогли достичь статистической значимости. Недавно было проведено двойное слепое исследование пациентов с шизофренией. Пациенты были рандомизированы на группы, получавшие, помимо антипсихотических препаратов, в течение 6 недель КБД (1000 мг / день , N = 43) или плацебо (N = 45). После лечения, группа КБД представила более низкие положительные психотические оценки. Наблюдалось улучшение когнитивных функций и снижение общих симптомов болезни. Побочные эффекты КБД и плацебо были эквивалентны. Поскольку антипсихотические эффекты КБД, по-видимому, не зависят от антагонизма рецептора дофамина, это соединение действительно может представлять собой новый класс препаратов для лечения психотических расстройств в целом и шизофрении в частности. То, что КБД может иметь антипсихотические эффекты, было дополнительно подтверждено исследованиями у здоровых людей с искусственно индуцированным психозом. В двойном слепом плацебо-контролируемом исследовании было показано, что КБД (600 мг) ослабляет симптомы деперсонализации, вызванные антагонистом рецептора N-метил-D-аспартата (NMDA), который увеличивает высвобождение глутамата при низких дозах 22). Этот эффект на диссоциативные симптомы также вызвал гипотезы о потенциальном терапевтическом использовании КБД при таких заболеваниях, как посттравматическое стрессовое расстройство (ПТСР), интоксикация каннабиса и некоторые расстройства личности. Лечение частых психотических симптомов у пациентов с болезнью Паркинсона (БП) считается главной проблемой для врачей. Это особенно касается того, что (1) уменьшение доз антипаркинсонических препаратов или добавление обычных антипсихотиков ухудшает моторную функцию; и (2) атипичные антипсихотики могут иметь значительные побочные эффекты (особенно в неврологических и гематологических областях). Таким образом, учитывая уместность возможного антипсихотического эффекта КБД и отсутствие эффективного и безопасного фармацевтического средства для лечения психоза при БП, была изучена эффективность и безопасность этого каннабиноида у пациентов с БП, у которых наблюдались психотические симптомы. В открытом клиническом исследовании шести пациентов с БП было обнаружено значительное снижение по шкалам BPRS и паркинсоновских анкетных опросов (PPQ) при приеме КБД (150-600 мг / сут), помимо обычного лечения. Интересно отметить, что во время лечения КБД наблюдалось снижение как психотических, так и моторных симптомов, без ухудшения познавательной способности. Эти предварительные результаты свидетельствуют о том, что КБД может иметь потенциальные положительные эффекты при БП.
Нейровизуализация антипсихотических эффектов КБД
В серии совместных исследований с использованием функциональной магнито-резонансной томографии , было исследовано влияние КБД на поведение и местную активность мозга в нескольких областях, что обеспечило первоначальные сведения о его механизмах и участках действия. Интересно отметить, что наблюдались противоположные схемы активации мозга после введения КБД (600 мг) и Δ9-ТГК (10 мг) (62, 83). В отличие от плацебо, психозоподобные эффекты, вызванные Δ9-ТГК, были связаны с уменьшением активации (1) дорсального полосатого тела во время обработки «странных» раздражителей (84); (2) вентрального стриатума и передней ресничной извилины во время вспоминания слов (85); и (3) правой височной доли головного мозга во время обработки слуховой информации. Во всех этих областях (традиционно связанных с психозом), эффекты КБД на активацию мозга были противоположны эффектам Δ9-ТГК, что указывает на то, что они могут принимать участие в антипсихотических свойствах КБД. В последующем эксперименте, внутривенное предварительное введение КБД (5 мг) предотвращало психотические симптомы, вызванные внутривенным Δ9-ТГК (1,25 мг) (85). Таким образом, можно было предположить, что противоположные эффекты этих двух каннабиноидов на модуляцию мозга могут быть связаны как с их антагонизмом, так и с собственным антипсихотическим эффектом КБД. Эти данные согласуются с наблюдением, что люди, употребившие образцы марихуаны, содержащие более высокие концентрации КБД в дополнение к Δ9-ТГК, с меньшей вероятностью испытывали психотические симптомы, чем люди, курившие образцы без КБД 23).
Современные дни: КБД в качестве соединения с широким спектром действия (2000-2010-е годы)
Клонирование и описание каннабиноидных рецепторов CB1 и CB2 в центральной системе и последующая изоляция эндоканнабиноидов в начале 1990-х годов вновь вызвали интерес к исследованию каннабиноидных соединений (2). В результате, с тех пор наблюдается постоянное увеличение числа исследований по КБД, что, в основном, стимулируется открытием новых терапевтических возможностей препарата.
Антипаркинсонические, антиокислительные и нейропротективные действия
Хотя эндоканнабиноидная система считается многообещающей целью в области исследования нейропротекции, на сегодняшний день не было проведено никаких исследований нейропротекторного действия КБД при БП. Таким образом, после открытого исследования, оценивающего антипсихотические эффекты КБД при БП с психотическими особенностями, этот каннабиноид был протестирован у пациентов с БП без сопутствующих психиатрических заболеваний или деменции (88). Был отобран 21 пациент с ПД, которых разделили на три группы, получавшие плацебо (n = 7), КБД (75 мг / день) (n = 7) и КБД в дозе 300 мг / день (n = 7). Участники оценивались на исходном уровне и после лечения в отношении моторных и общих симптомов (UPDRS), качества жизни и благополучия (PDQ-39) и нейропротекторных эффектов (уровни нейротрофического фактора головного мозга, BDNF и H1-MRS). Группа, получавшая КБД в дозе 300 мг / день, представила значительно более низкие показатели PDQ-39. Результаты показывают, что КБД может улучшить состояние пациентов с паркинсонизмом без сопутствующих психиатрических заболеваний. В серии совместных исследований на животных, КБД не смог предотвратить или отменить гиперлокомоцию, вызванную длительными инъекциями D-AMPH (2 мг / кг). Однако, было обнаружено, что КБД, по-видимому, обладает антиоксидантными и нейропротекторными свойствами, поскольку он увеличивает уровни нейротрофического фактора мозга. Кроме того, КБД увеличил митохондриальный комплекс и активность креатинкиназы, изменил параметры окислительного стресса (образование TBARS и белковых карбонил) и предотвратил когнитивные нарушения. В другом исследовании, кратковременное и длительное введение КБД (10,0 мг / кг) позволило спасти память у крыс, предварительно обработанных железом. Совсем недавно было обнаружено, что КБД обращает железо-индуцированные эффекты, нормализуя DNM1L в гиппокампе, а также уровни синаптофизина и каспазы 3 у крыс, что еще раз указывает на то, что КБД следует рассматривать как соединение с нейропротекторными и восстанавливающими память свойствами 24).
Нейропротекторное и нейропластичное действие
В течение нашей жизни, наш мозг постоянно изменяется, а исследование механизма, включающего нейропластичность, дает прекрасную возможность для изучения механизмов дезадаптации, которые приводят к психическим заболеваниям. Нейропсихиатрические расстройства могут быть результатом глубоких изменений в механизмах, связанных с функциями мозга, которые, вероятно, связаны с нейропластичностью. Например, уменьшенный объем гиппокампа наблюдается у пациентов с диагнозом расстройства настроения, посттравматического стрессового расстройства (ПТСР), шизофрении и болезни Альцгеймера 25). У грызунов, воздействие хронических стрессоров, моделирующих некоторые особенности психических расстройств , индуцирует изменения в дендритном ремоделировании и снижает уровень нейрогенеза гиппокампа взрослых (38, 44, 99). Взрослый нейрогенез гиппокампа представляет собой сложный многоступенчатый процесс, который охватывает деление, выживание (не все нейроны, которые делятся, выживают), миграцию и дифференциацию новых клеток в зубчатой извилине гиппокампа 26). В гиппокампе этот процесс считается определяющим в, по меньшей мере, некоторых формах обучения и памяти. Нарушение нейрогенеза гиппокампа у взрослых было признано одним из центральных механизмов, связанных с уменьшением объема гиппокампа, зарегистрированного у пациентов, страдающих расстройствами настроения и шизофренией. Более низкие показатели нейрогенеза гиппокампа были обнаружены в посмертных тканях пациентов с шизофренией и у депрессивных пациентов. Производные каннабиса были исследованы на предмет их потенциального влияния на нейропластичность. В 2005 году Jiang и его коллеги отметили, что длительное применение синтетического каннабиноида (HU210) усиливает нейрогенез у крыс. Что касается КБД, Wolf и др. заметили, что после 6 недель диеты с высоким содержанием КБД, у мышей наблюдалось увеличение числа нейронов, положительных для аналога тимидина, бромдезоксиуридина (BrdU), в гиппокампе. Результаты других исследований показали, что, помимо усиления взрослого гиппокампального нейрогенеза, у мышей (при сохранении базовых состояний), КБД (вводимый внутрибрюшинно в течение 15 дней) предотвращал нейрогенные нарушения в генетической мышиной модели болезни Альцгеймера через механизм, зависимый от рецептора, активируемого пролифератором пероксисом γ (PPARγ) 27). Результаты показали, что у пациентов с хроническим стрессом КБД предотвращает индуцированный стрессом сниженный гиппокампальный нейрогенез и стресс-индуцированный анксиогенез. Однако, у трансгенных мышей с GFAP / тимидинкиназой, обработанных ганцикловиром (модель нарушенного нейрогенеза взрослых), КБД не смог предотвратить эффекты стрессовой реакции. Эти результаты показали, что поведенческий эффект КБД у подверженных стрессу мышей частично зависел от целостности нейрогенной способности гиппокампа. Недавно Schiavon и его команда 28) показали, что КБД усиливает поведение, связанное со стрессом, в поведенческом тесте, в значительной степени используемом для скрининга антидепрессантов. Предположительно, КБД индуцирует увеличение числа клеток Ki67, BrdU и двойных кортин-положительных клеток в гиппокампе. Что интересно, Demirakca и коллеги предположили, что у лиц, принимающих каннабис постоянно, наблюдаются более высокие уровни ТГК и более низкие концентрации КБД, что было связано с уменьшением уровня серого вещества в гиппокампе и снижением познавательной способности, тогда как более высокие уровни КБД в потребляемых образцах каннабиса предотвращали нейротоксические эффекты ТГК. В ходе обсуждения, авторы предположили, что возможным механизмом, связанным с нейропротекторным эффектом КБД, является его влияние на облегчение нейрогенеза гиппокампа. Исследования также показали, что КБД оказывает положительное влияние на синаптическое ремоделирование. У крыс, которым давали повышенные уровни железа, что индуцировало повреждения головного мозга, КБД нормализовал экспрессию синаптофизина, важного везикулярного белка, связанного с правильным синаптическим функционированием. Кроме того, подобно нейротрофическому фактору, фактору роста нервов, нейрогенез КБД в клетках PC12 увеличивает экспрессию синаптофизина и синапсина I. КБД может модулировать внутриклеточные пути, непосредственно связанные с синаптическим ремоделированием, такие как Erk1 / 2 и Akt, в различных типах линий раковых клеток. Однако, его точные эффекты в разных областях мозга все еще неизвестны. Например, повторное введение КБД (в течение 14 дней) уменьшало фосфорилированные формы уровней Erk1 / 2 в PFC и улучшало условные реакции обусловленного страха 29). У мышей с хроническим стрессом, длительное введение КБД также способствовало дендритному ремоделированию и увеличивало экспрессию синапсина I / II, PSD95 и p-GSK3β в гиппокампе грызунов. КБД также обладает антиоксидантной активностью, действуя против усиленного производства кислорода / азота (ROS / RNS) и, соответственно, окисления ДНК, перекисного окисления полиненасыщенных жирных кислот и нитрования / карбонилирования белков, приводящего к повреждению или смерти клеток. В крысиных кортикальных нейронах, КБД предотвращал NMDA-опосредованную нейротоксичность и окислительное повреждение через независимый от каннабиноидного рецептора механизм 30). КБД уменьшает повреждение нейронов, вызванное осаждением β-амилоидного белка; и ослабляет истощение уровней тирозингидроксилазы, ГАМК и дофамина путем модуляции экспрессии индуцибельной изоформы NO-синтазы и уменьшения продуцирования ROS-генерирующих оксидаз NADPH 31). Кроме того, КБД проявляет антиоксидантную активность против токсичности, индуцированной различными веществами, такими как амфетамин, и ослабляет индуцированное глюкозой производство митохондриального ROS и экспрессию провоспалительных молекул (122). У новорожденных мышей с гипоксически-ишемическим повреждением головного мозга, КДБ уменьшает повреждение нейронов, снижая вредные эффекты глутамата, IL-6, TNFα, COX-2 и iNOS. Используя окклюзию средней мозговой артерии как метод оценки ишемической реперфузионной травмы, было показано, что КБД подавляет снижение мозгового кровотока после реперфузии, ингибирует активность миелопероксидазы (МПО) в нейтрофилах и уменьшает количество иммуноположительных клеток MPO. Недавно Mori и коллеги 32) продемонстрировали, что у мышей, перенесших двустороннюю общую окклюзию сонной артерии, КБД стимулирует нейрогенез и восстанавливает дендритное разветвление и уровни BDNF в гиппокампе. В культивируемых нейронах гиппокампа, в условиях кислородно-глюкозной депривации / реперфузии, этот фитоканнабиноид усиливал митохондриальную функцию и уменьшал окислительный стресс. КБД улучшает когнитивные способности, двигательную активность и уровни BDNF у мышей, которым вводили тиоацетамид, препарат, который индуцирует печеночную энцефалопатию. В животных моделях болезни Паркинсона, КБД защищает нейроны, предотвращая снижение активности тирозингидроксилазы и истощение дофамина в черной субстанции 33). КБД, по-видимому, защищает нейроны от смерти, улучшая рециркуляцию старых / поврежденных клеточных компонентов посредством облегчения аутофагического действия. Аутофагия, особенно макроаутофагия, представляет собой лизосомальный путь деградации, имеющий решающее значение для рециркуляции поврежденных органелл и повышения выживаемости клеток, защиты от нарушения клеток или их смерти в условиях стресса. Hosseinzadeh и коллеги 34) продемонстрировали, что в модели вызванной пилокарпином судороги, антиконвульсантное действие КБД может включать активацию гиппокампального аутофагического аппарата. Недавние результаты свидетельствуют о том, что длительное введение КБД увеличивает аутофагию у животных, подвергшихся хроническому непредвиденному стрессу (CUS), как это видно из его влияния на фосфорилированную форму mTOR, Beclin-1 и LC3, сигнальные белки, участвующие в индукции аутофагии.
Антиэпилептическое действие
В 1970-е годы , противосудорожное действие КБД было одним из первых описанных фармакологических свойств препарата как у животных, так и в предварительном клиническом исследовании у пациентов, возглавляемом той же бразильской группой. В недавнем совместном исследовании на животных было обнаружено, что КБД оказывает защитные эффекты не только на контроль судорог, но также и на гибель нейронов в модели мезиальной височной эпилепсии, вызванной внутригиппокампальным пилокарпином. Недавно было исследовано два случая у детей с устойчивой к лечению эпилепсией, где наблюдалась полная ремиссия припадка, но имели место симптомы интоксикации Δ9-ТГК и возможность рецидива эпилепсии с использованием экстракта, обогащенного каннабидиолом 35). Когда экстракт был заменен чистым КБД фармацевтического качества, признаки интоксикации исчезли, как и припадки у обоих пациентов. Эти наблюдения подчеркивают важность GMP / GLP для обеспечения разработки препаратов, которые последовательно производятся и контролируются в соответствии с международными нормативными стандартами. В последнее время, в открытых и двойных слепых контролируемых клинических испытаниях исследуется эффективность, безопасность и переносимость КБД у детей и подростков с устойчивой к лечению эпилепсией (особенно синдромы Дравета и Леннокса-Гасто). Исследования подтверждают и расширяют эти предварительные результаты. В настоящее время проводится еще одно крупное рандомизированное клиническое исследование у детей с устойчивыми к лечению эпилептическими синдромами с использованием высококачественного КБД.
Нарушения сна
Одним из наиболее часто наблюдаемых эффектов КБД при более высоких дозах является седация. Поведенческое расстройство REM сна (RBD) – это парасомния, отличающаяся нарушениями, связанными с вялостью мышц во время REM сна, сна с двигательной активностью. В настоящее время, варианты фармакологического лечения RBD ограничены. Имея это в виду, было проведено открытое исследование с участием четырех пациентов с болезнью Паркинсона и расстройством REM сна (RBD), что считается распространенной проблемой при этом двигательном расстройстве 36). У всех пациентов наблюдалось эффективное и существенное сокращение частоты событий, связанных с RBD. Перекрестное исследование кратковременного эффекта 300 мг КБД на архитектуру сна у здоровых добровольцев показало, что это соединение не вмешивается в цикл сна. Это особенно важно, поскольку, в отличие от анксиолитических препаратов и антидепрессантов, таких как бензодиазепины и СИОЗС, краткосрочное введение анксиолитической дозы КБД является безопасным и, по-видимому, сохраняет архитектуру сна. Таким образом, КБД может быть потенциально полезным терапевтическим вариантом для лечения широкого спектра расстройств.
Аддикция
На сегодняшний день, не существует официально одобренной фармакологической терапии, связанной с использованием каннабиса 37). Основываясь на результатах исследований на животных, пациенту стационара с тяжелой зависимостью от каннабиса и эпизодами синдрома отмены каннабиса давали КБД, с положительными результатами. Это было описано в Nature Medicine (ст. 20, п. 2, стр. 107) в качестве примера потенциального успеха такого лечения. Аналогичным образом, отсутствие эффективных лекарств для лечения кокаиновой зависимости является явным свидетельством необходимости дальнейших исследований в этой области. В совместном исследовании на животных было обнаружено, что КБД защищает от приступов, вызванных кокаином, возможно, путем активации пути mTOR, при одновременном снижении высвобождения глутамата.
Стабилизация настроения
 Учитывая противосудорожные, противотревожные, антидепрессантные и антипсихотические действия КБД, описанные выше, предполагалось, что КБД может иметь фармакологический профиль, сопоставимый с профилем стабилизаторов настроения. В совместном исследовании на животных, первоначально эта идея была протестирована на животной модели мании, вызванной длительными инъекциями D-амфетамина (D-AMPH) в дозе 2 мг/кг. Однако, в этой модели КБД не смог предотвратить или обратить гиперлокомоцию, вызванную D-AMPH. Параллельно, была исследована непосредственная эффективность КБД у двух пациентов с биполярным аффективным расстройством (БАР) при острых маниакальных эпизодах 38). У пациентов, принимавших КБД, не наблюдалось улучшения, что согласуется с отрицательными данными в животной модели мании. Предполагается, что препарат неэффективен при лечении маниакальных эпизодов у пациентов с БАР. Тем не менее, новые клинические испытания, оценивающие эффективность КБД при депрессии и тревоге у пациентов с БАР, по-прежнему необходимы.
Учитывая противосудорожные, противотревожные, антидепрессантные и антипсихотические действия КБД, описанные выше, предполагалось, что КБД может иметь фармакологический профиль, сопоставимый с профилем стабилизаторов настроения. В совместном исследовании на животных, первоначально эта идея была протестирована на животной модели мании, вызванной длительными инъекциями D-амфетамина (D-AMPH) в дозе 2 мг/кг. Однако, в этой модели КБД не смог предотвратить или обратить гиперлокомоцию, вызванную D-AMPH. Параллельно, была исследована непосредственная эффективность КБД у двух пациентов с биполярным аффективным расстройством (БАР) при острых маниакальных эпизодах 38). У пациентов, принимавших КБД, не наблюдалось улучшения, что согласуется с отрицательными данными в животной модели мании. Предполагается, что препарат неэффективен при лечении маниакальных эпизодов у пациентов с БАР. Тем не менее, новые клинические испытания, оценивающие эффективность КБД при депрессии и тревоге у пациентов с БАР, по-прежнему необходимы.
Другие действия
За последние 10 лет наблюдалось экспоненциальное увеличение числа публикаций, посвященных эффектам КБД, чему способствовало открытие дополнительных эффектов этого каннабиноида. Бразильские исследователи сформулировали идею создания Национального института науки и техники для трансляционной медицины (INCT-TM), финансируемого Бразильским национальным советом по научно-техническому развитию (CNPq). В результате работы этой структуры, были внесены дополнительные доказательства о действиях КБД в качестве нейропротектора, противовоспалительного и лекарственного средства, способного, кроме всего прочего, увеличить периоды сна 39).
Новая эра: от клинических испытаний КБД и его аналогов, к молекулярно-ориентированной терапии
Чтобы оценить имеющиеся данные о КБД, полезность и безопасность его терапевтического использования при нейропсихиатрических расстройствах, по всему миру ведутся открытые обсуждения и обзоры литературы в форме форумов и публикаций. Кроме того, профессор Рафаэль Мечулам из Еврейского университета в Иерусалиме, ответственный за выделение в чистом виде и синтез основных каннабиноидов (включая Δ9-ТГК в 1964 году и КБД в 1963 году) и за открытие эндоканнабиноидной системы (CB1 рецептора в 1989 году и анандамида в 1992 году), недавно связался с группой ученых с целью разработки синтетических фторированных аналогов КБД 40). Эти соединения могут обеспечить мощный толчок в распространении знаний о пользе КБД, что может позволить коммерциализировать продукты на основе КБД и предложить возможность для лечения многих заболеваний.
Борьба за определение будущего: медицинское использование КБД и нормативные правовые акты
В течение последних 3 лет, в Бразилии была расширена законодательная база, связанная с исследованиями КБД на людях и медицинским использованием КБД. В январе 2015 года, бразильское регулирующее агентство ANVISA приняло решение переклассифицировать КБД из списка I (запрещенные вещества, такие как ТГК), в список контролируемых веществ, в такую же категорию, как, например, антидепрессанты. В настоящее время, продукты, содержащие КБД, доступны в качестве рецептурных средств. В Бразилии доступны для продажи препараты GW (Sativex® и Epidioloex®). Однако, доступ к этим продуктам для бразильских пациентов остается низким из-за высокой стоимости лечения. Однако, в некоторых странах медицинское использование КБД вполне реально. В Соединенных Штатах, каннабидиол является контролируемым веществом из Списка I Кодекса федеральных правил, описанный как «производное» или «компонент» марихуаны (21 USC 802-Mead et al., 41) - Epilepsy and Behavior), однако, с 2012 года стало возможным медицинское использование каннабиса, включая КБД. В некоторых штатах США, закон включает «рекреационное» использование каннабиса. В Канаде, каннабис (марихуана) и продукты из него остаются в Списке II, в соответствии с Законом о контролируемых наркотиках и веществах. Его производство и распределение для медицинских целей регулируются. Однако, медицинское использование КБД разрешено при наличии медицинского рецепта. В Европе, последняя версия Закона о каннабисе показала, что использование препаратов на основе каннабиса достаточно тщательно регулируется. Ни в одной из стран Европейского союза не разрешается курение каннабиса в медицинских целях. Sativex® и Epidioloex® - это препараты на основе каннабиса, содержащие КБД, которые могут быть назначены пациентам 1).
Заключение
Экспериментальное и клиническое использование КБД, соединения, которое не вызывает типичных субъективных эффектов марихуаны, в отличие от Δ9-ТГК, четко продемонстрировало анксиолитические, противоэпилептические и антипсихотические свойства КБД, помимо прочих. С 1970-х годов был опубликован ряд научных статей, демонстрирующих потенциальные терапевтические эффекты КБД на различных моделях нейропсихиатрических заболеваний у животных и в некоторых клинических испытаниях. Появились недавние исследования новых эффектов КБД и его синтетических аналогов, а также возникло понимание механизмов действия этих соединений и улучшилось понимание эндоканнабиноидной системы. Однако, появились новые вопросы относительно свойств КБД и его синтетических аналогов, которые в настоящее время находятся на стадии исследования, такие как безопасность и точные диапазоны доз при каждом расстройстве. Поэтому необходимо провести множество других контролируемых клинических испытаний с различными и более крупными нейропсихиатрическими популяциями, которые в ближайшем будущем дадут важные ответы на существующие вопросы.










