Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Малярия
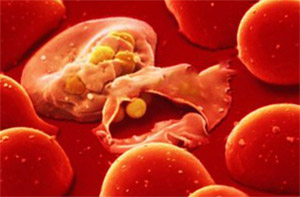 Малярия (от итальянского «mal'aria», «плохой воздух») – это инфекционное заболевание, вызываемое паразитом из рода Плазмодии и распространяемое через укусы некоторых видов малярийных комаров.
Малярия – наиболее серьёзное паразитарное заболевание в мире, в 2012 году поразившее 207 миллионов человек и унёсшее жизни 627000 человек. В основном малярия поражает детей в возрасте до пяти лет и беременных женщин. 80% случаев малярии наблюдается в странах Африки южнее Сахары (см. раздел «Эпидемиология»).
Малярийный паразит передается, главным образом, ночью, через укус самки комара из рода Малярийных комаров, которая заражается после укуса человека, больного малярией. Паразит поражает клетки печени жертвы, а затем циркулирует в крови, колонизуя эритроциты и разрушая их. Плазмодии паразитируют на многих видах теплокровных животных; только один вид плазмодиев может паразитировать на человеке – Plasmodium knowlesi. Из ста двадцати трех видов рода Плазмодии, только четыре вида «специализируются» на человеке, а именно: Plasmodium falciparum, ответственная за наибольшее количество смертей, и три других, вызывающих «доброкачественные» формы малярии, которые чаще всего не являются смертельными – Plasmodium vivax, Plasmodium ovale и Plasmodium malariae. Plasmodium knowlesi до недавнего времени считалась специфичной для видов обезьян, а теперь считается одной из плазмодий, также влияющих на человека и являющихся доброкачественными (см. раздел «Причины»).
Причина болезни была открыта 6 ноября 1880 года в военном госпитале Константина (Алжир) врачом французской армии Альфонсом Лавераном, который получил Нобелевскую премию по физиологии и медицине в 1907 году. В 1897 году английский врач Рональд Росс (получивший Нобелевскую премию в 1902 году) доказал, что малярийный комар является переносчиком малярии (до той поры, причиной заболевания считался «плохой воздух», идущий из болот).
Малярия (от итальянского «mal'aria», «плохой воздух») – это инфекционное заболевание, вызываемое паразитом из рода Плазмодии и распространяемое через укусы некоторых видов малярийных комаров.
Малярия – наиболее серьёзное паразитарное заболевание в мире, в 2012 году поразившее 207 миллионов человек и унёсшее жизни 627000 человек. В основном малярия поражает детей в возрасте до пяти лет и беременных женщин. 80% случаев малярии наблюдается в странах Африки южнее Сахары (см. раздел «Эпидемиология»).
Малярийный паразит передается, главным образом, ночью, через укус самки комара из рода Малярийных комаров, которая заражается после укуса человека, больного малярией. Паразит поражает клетки печени жертвы, а затем циркулирует в крови, колонизуя эритроциты и разрушая их. Плазмодии паразитируют на многих видах теплокровных животных; только один вид плазмодиев может паразитировать на человеке – Plasmodium knowlesi. Из ста двадцати трех видов рода Плазмодии, только четыре вида «специализируются» на человеке, а именно: Plasmodium falciparum, ответственная за наибольшее количество смертей, и три других, вызывающих «доброкачественные» формы малярии, которые чаще всего не являются смертельными – Plasmodium vivax, Plasmodium ovale и Plasmodium malariae. Plasmodium knowlesi до недавнего времени считалась специфичной для видов обезьян, а теперь считается одной из плазмодий, также влияющих на человека и являющихся доброкачественными (см. раздел «Причины»).
Причина болезни была открыта 6 ноября 1880 года в военном госпитале Константина (Алжир) врачом французской армии Альфонсом Лавераном, который получил Нобелевскую премию по физиологии и медицине в 1907 году. В 1897 году английский врач Рональд Росс (получивший Нобелевскую премию в 1902 году) доказал, что малярийный комар является переносчиком малярии (до той поры, причиной заболевания считался «плохой воздух», идущий из болот).
История
Древние времена
Малярия – это болезнь, которая поражает человечество уже более 50000 лет. Возбудитель болезни существовал уже с самого начала истории нашего вида1). У шимпанзе (ближайший к человеку вид обезьян) имеются паразиты, похожие на возбудителя малярии. Малярийный паразит Plasmodium reichenowi, ближайший «родственник» Plasmodium falciparum, поражает шимпанзе; горилл поражает Plasmodium falciparum, от которого может происходить человеческий паразит (секвенирование ДНК Plasmodium falciparum в фекалиях инфицированных горилл при помощи филогенетического анализа, показывает, что этот паразит является предком штамма, который встречается у человека). Примерно через 10000 лет малярия начинает оказывать существенное влияние на выживаемость человека, что совпадает с началом развития сельского хозяйства (неолитической революцией) и переходом на оседлый образ жизни. Одним из последствий (воздействие + изменения в образе жизни) является естественный отбор генов дрепаноцитоза, талассемии, дефицита глюкозо-6-фосфат-дегидрогеназы, наследственного овалоцитоза. Эти заболевания, влияющие на клетки крови, дают селективное преимущество против малярии (см. раздел «Генетические факторы»). Смертельные лихорадки, в число которых, вероятно, входила малярии, были описаны в первых письменных свидетельствах. Первым письменным свидетельством об инфекции, вызванной паразитом, является папирус Эберса, написанный в Луксоре в 1500 году до нашей эры; справедливость наблюдений подтверждает мумия этого периода, кальцинированная яйцами гельминтов. В январе 2010 года команда учёных из Египта и Америки доказала, при помощи анализа ДНК, что, к моменту своей кончины, Тутанхамон страдал от малярии (около -1327 года)2). В Индии, начиная с древних времен, в Ведах («Текстах знаний») описываются случаи малярийной лихорадки; врачи Чарака и Сушрута (вероятно, в пятом веке до нашей эры) сделали описание болезни и связали её с укусом комара. Симптомы перемежающейся лихорадки были описаны Гиппократом; он связывал лихорадку с определенными климатическими и экологическими условиями. Гиппократ выделил три типа лихорадки: febris tertiana (трехдневная), quartana (четырехдневная) и продолжительная (носящая в настоящее время название «тропическая»). Около 186 года до нашей эры в некоторых регионах Китая начинают использовать травяной отвар из Цин Хао Су (青蒿素), вещества, впоследствии получившем на Западе название «артемизинин». Экстракт из лекарственных растений, используемых в качестве жаропонижающих средств, называется Цин Хао (青 蒿) (однолетняя полынь). Ещё раньше использовались корни Changshan (常山) (Dichroa febrifuga), которые также обладают лечебными эффектами. Времена малярийной лихорадки в Китае и симптомы этого заболевания описываются в Huangdi Neijing («Каноны медицины»), датируемые примерно первым веком нашей эры.3) Малярия была распространена в регионах мира, где в настоящее время её не наблюдается, например, в большинстве стран Европы (болезни африканского происхождения, в частности, были распространены в Римской империи) и Северной Америке. В некоторых районах Англии смертность из-за малярии была сравнима со смертностью от малярии в Чёрной Африке сегодня. Хотя Уильям Шекспир родился в начале холодного периода, называемого «малый ледниковый период», он смог описать разрушительные последствия этого заболевания в восьми своих пьесах. Трехдневная лихорадка бушевала вплоть до 1958 года в польдерах Бельгии и Нидерландов. Считается, что на американский континент малярию «завезли» европейские поселенцы и их рабы в 1500-х годах (известно, что Христофор Колумб страдал от этой болезни до приезда на новые земли). Испанские иезуиты-миссионеры увидели, что индейцы, живущие на границе с озером Лоха в Перу, использовали порошок коры хинного дерева для лечения лихорадки. Тем не менее, в медицинской литературе майя или ацтеков нет ни одной ссылки на малярию. Использование коры «дерева лихорадки» было введено в европейскую медицину благодаря миссионерам-иезуитам, например, Барбаром Кобо, проводившем в 1632 году эксперименты с порошком и занимавшемся его экспортом; «драгоценный» порошок также называли «порошок иезуитов».4) Исследование, проведенное в 2012 году на генетических маркерах тысяч образцов малярийного плазмодия, подтверждает африканское происхождение паразита в Южной Америке (сами европейцы также пострадали от этой болезни из-за Африки). Заболевание распространялось в середине шестнадцатого века и середине девятнадцатого века через два основных маршрута работорговли, первый из которых вёл к северной части Южной Америки (Колумбия) и связан с испанцами, а второй ведёт дальше на юг (Бразилия) и связан с португальцами.
XVIIIe и XIXe века: первые научные исследования
В 1717 году Джованни Мария Лансизи, врач папы Климента XI, в книге «De noxiis paludum effluviis eorumque remediis», представил доказательства того, что болезнь передается от мух. Лансизи впервые использовал слово «mal'aria» в значении «плохой воздух». В 1820 году Пьер Жозеф Пеллетье и Жозеф Бьенеме Каванту выделили хинные алкалоиды и хинин из порошка коры «дерева лихорадки». Их открытие позволило использовать стандартизированные дозы активных компонентов. Около 1832 года Франсуа Клеман Майо усовершенствовал использование хинина для лечения и профилактики малярии. Однако, его вклад был официально признан только в 1881 году, на конференции по борьбе с малярией в Алжире. В 1848 году, Иоганн Фридрих Меккель фон Хельмсбах (Меккель Младший) отметил наличие большого количества черно-коричневых гранул в крови и селезенке пациента, умершего в психиатрической больнице. Меккель не понимал тогда, что гранулы эти были ничем иным, как малярийными паразитами, потому что в своем докладе он назвал гранулы пигментами меланина. В 1878 году д-р Патрик Мэнсон впервые высказывает гипотезу о том, что малярия передается комаром из рода Кулексы (Culex), который поглощает паразита и откладывает яйца в воде, которую затем поглощает человек5). В 1879 году немец Эдвин Клебс и итальянец Этторе Маркиафавы объявили, что они обнаружили возбудителя малярии, Bacillus malariae. В 1880 году Луи Альфонс Чарльз установил связь между замечаниями, сделанными Мекелем младшим и его открытием – паразитом, который он впервые обнаружил в красных кровяных клетках 44 человек, страдающих от малярии. Наблюдая эксфлагелляцию (образование микрогамет у малярийного плазмодия), он убедился, что мобильные жгутики являются паразитарными микроорганизмами (одноклеточные живые крошечные организмы, размножающиеся вегетативно путем митоза). Но многие врачи той эпохи всё ещё думали, что простейшие на самом деле всего лишь изменяли красные кровяные клетки. Лаверан боролся за то, чтобы его теорию приняли. Учёный должен был установить, каким образом эти организмы проникают в организм человека. Потерпев неудачу в попытке получить должность, позволяющую ему продолжать свои исследования, Лаверан продолжает исследования простейших организмов в Институте Пастера в качестве волонтера. В 1898 году он опубликовал свой «Трактат о малярии». Учёный также наблюдал эффект хинина, вещества, способного бороться с этими паразитами. Он предположил, что малярия вызывается этими простейшими организмами. Впервые простейшие были идентифицированы в качестве причины болезни. Это открытие принесло Лаверану Нобелевскую премию по медицине 1907 года. Благодаря ему, научные исследования по малярии сделали свой первый значительный шаг вперед. В 1880 году, Эттор Маркиафава и Анджело Челли, по просьбе Альфонса Лаверана, изучают под микроскопом репродуктивный цикл простейших в крови человека. Учёные отметили, что организмы делятся с регулярными интервалами и почти одновременно, и что это деление совпадает с приступами лихорадки. В 1885 году учёные назвали эти протозойные микроорганизмы плазмодиями. В 1881 году Карлос Финлей, кубинский врач, занимавшийся лечением больных желтой лихорадкой в Гаване, заявил, что заболевание передается человеку после укуса комара. В 1886 и 1892 годах, Камилло Гольджи опубликовал свои исследования о частоте и периодичности малярийной лихорадки. Он доказал, что существует несколько типов малярии, вызываемых различными простейшими организмами. В 1891 году Пол Эрлих и Пол Гутман отметили противомалярийные свойства метиленового синего. Этому открытию предшествовало открытие Челли и Гварнери, которое было основано на предыдущих работах Эрлиха, показывающих сродство этого вещества в определенных клетках. Эрлих хотел создавать препараты, используя их биохимические различия. Впервые было создано синтетическое вещество, активное против малярии (в 1849 году Август фон Гофман, однако, уже подчеркивал важность синтеза хинина из каменноугольной смолы). В 1895 году французская экспедиция на Мадагаскар окончилась катастрофой: из 21600 высадившихся на остров мужчин, 5731 умерло от малярии и 25 – в бою. Обратите внимание, что такие «катастрофы» часто происходили во время Вьетнамской войны среди солдат Северного Вьетнама. В 1898 году Амико Бигнами удалось экспериментально передать малярию через комаров. В своём эксперименте, учёный подставил своё собственное тело укусам комаров, благодаря чему заразился малярией. В 1898 году британец Рональд Росс, работая в Индии и регулярно переписываться с Лавераном и Мэнсоном, доказал, что малярия передается через укус насекомого. Чтобы подтвердить свою теорию, в течение двух лет учёный делает вскрытие малярийных птиц, укушенных сотнями разновидностей комаров. Только через два года, почти отчаявшись, он замечает вид комаров, который развивается только в поверхностных водах и который можно увидеть только ночью: Anopheles (малярийный комар). Учёный продолжил свои исследования; собирая личинки простейших, Лаверан обнаружил в желудке малярийного комара простейший организм. Доказательство было установлено: насекомое передаёт паразита, живущего за его счет. Учёный обнаружил, что инкубационный период (время между укусом и появлением паразитов в крови) составляет 10-14 дней. Россу предстояло доказать, что некоторые виды комаров являются переносчиками малярии среди птиц, изолируя паразитов из слюнных желез комаров, которыми питаются заражённые птицы.6) Благодаря этому учёный получил Нобелевскую премию в области медицины в 1902 году. После отставки с индийской медицинской службы, Росс работал в Ливерпульской школе тропической медицины, направляя усилия на искоренение малярии в Египте, Панаме, Греции и на Маврикии. До 1930-х годов, исследователи говорят об Anopheles maculipennis в целом, не делая четкого различия между конкретными видами насекомых. В 1899 году итальянский биолог Джованни Баттиста Грасси, на основе работы Росса (на птицах) проделал то же самое относительно вектора в организме человека, и доказал, что важную роль в заражении играет жизненный цикл плазмодия в организме комара. Грасси, Джузеппе Бастианелли и Амико Бигнами описали цикл развития Plasmodium falciparum, Plasmodium vivax и Plasmodium malariae у малярийного комара Anopheles claviger. В следующем году, исследования Финлей и Росса были подтверждены командой врачей во главе с Уолтером Ридом; их рекомендации были реализованы Уильямом Горгасом при строительстве Панамского канала. Были приняты меры по обеспечению общественного здравоохранения, спасшие жизнь тысячам работников (ранее тысячи работников умирали от этой страшной болезни) и ставшие основой для дальнейшей разработки методов борьбы с этой болезнью.
XX век: поиск методов лечения
Этот период связан с ростом информации о заболевании, особенно в связи с практикой малярия-терапии (устаревший в настоящее время метод лечения сифилиса), развитием противомалярийных препаратов и использованием инсектицидов в борьбе с вектором паразитов. Благодаря этим открытиям, в 1955 году ВОЗ запускает глобальную программу по искоренению малярии. На тот момент, пока программа ещё не достигла своей цели, была обнаружена скрытая форма паразита, и исследования концентрировались на разработке вакцины против малярии.
Малярия-терапия и научные открытия
В начале ХХ века, до появления антибиотиков, больных сифилисом добровольно «лечили», заражая их малярией, чтобы вызвать у них лихорадку. В 1920-е годы Юлий Вагнер-Яурегг начинает лечить больных нейросифилисом при помощи малярии, вызванной P. vivax. Три или четыре приступа лихорадки были достаточны для того, чтобы убить бактерии сифилиса, а инфекцию малярии можно остановить при помощи хинина. Контролируя лихорадку при помощи хинина, можно умело побороть оба заболевания. Несмотря на то, что некоторые пациенты умерли из-за малярии, малярия-терапия была более предпочтительна, чем верная смерть от сифилиса. Прививка паразитом осуществлялась при помощи инъекции крови зараженного человека или обезьяны, при этом имелась большая вероятность передачи инфекций. Чтобы свести к минимуму риски, связанные с летальным исходом, на обезьянах были проведены испытания плазмодиев видов Plasmodium richenowi, Plasmodium schwetzi и Plasmodium rodhaini. Малярия-терапия также использовалась для лечения шизофрении, олигофрении, осложнённой шизофренией, сильной тревожности, аффективных психозов и хореи Хантингтона.7) Терапевтическое лечение при помощи малярии также дало возможность значительно расширить наши знания о малярии, а также открыло путь для исследования химиотерапии и практиковалось примерно до 1950 года. В 1974 году малярия-терапия практиковалась в двух центрах – один находился в Яссы, Румыния, другой – в Атланте, штат Джорджия, США. В 1922 году Стивенс определил четвертого из известных малярийных паразитов в организме человека, P. ovale. В тридцатых годах исследователи отметили, что черное население менее чувствительно к малярии. В 1949 году, Эмиль Брюмт был удивлен, не обнаружив ни одного случая малярии в Либерии и Габоне, в Лагосе или Стэнливиле, несмотря на наличие в этих регионах векторов P. vivax8). В 1949 Джон Бёрдон Сандерсон Хо́лдейн предполагает, что гетерозиготные талассемии более устойчивы к малярии. В ноябре, Лайнус Полинг, Харви Итано, С.Дж. Сингер и и Ибер Уэллс опубликовали в журнале Science первое доказательство того, что заболевание у человека вызывается белковой аномалией9). Используя электрофорез, они продемонстрировали, что люди, страдающие серповидно-клеточной анемией, имеют модифицированный гемоглобин, и что гетерозиготы, имеющие обе формы гемоглобина – нормальную и анормальную, более устойчивы к инфекциям малярии. В то же время было показано, что законы Менделя определяют физические свойства белков, а не только их наличие или отсутствие, что положило начало молекулярной генетике.
Противомалярийные препараты
Несмотря на свои исключительные качества, хинин, импортируемый из-за границы, был доступен лишь в ограниченных количествах и иногда производил побочные эффекты; кроме того, лечение хинином требует его ежедневного применения: Вильям Генри Перкин безуспешно пытался найти заменитель хинину в 1856 году. Первая мировая война отрезала Германию от Индии и Явы – ведущих мировых поставщиков хинина, что побудило немцев заняться поиском его заменителей, чему во многом способствовали исследования метиленового синего, проводимые Эрлихом. Таким образом, последовательно были обнаружены плазмохин (1926), мепакрин (1930), родохин (1931) и certuna (1935). Немецкие исследователи использовали животные модели, разработанные Роллем в 1926 году. В 1926 году немецкие исследователи открыли противомалярийные свойства памахина/ плазмохина/ парахина. Структура этих первых противомалярийных препаратов, производных от аминохинолинов, было открыта лишь в 1928 году. Английские, французские и русские исследователи уже отметили противомалярийное действие молекул из серии амино-8 хинолинов и занялись поиском других активных соединений. В 1930 году Эрнест Фурно и его команда из Института Пастера разработали родохин, эффективный при гораздо меньших дозах, чем плазмохин. В межвоенный период существовало две животных модели, поддерживающих исследования синтетических противомалярийных препаратов; одна из них была основана на малярии у обезьян, непрактичной в крупных масштабах, а другая (более часто используемая) – на птичьей малярии, особенно с использованием канареек. Также в 1930х годах в лаборатории IG Farben в Эльберфельде, Германия, Ханс Андерсаг и коллеги синтезировали и протестировали примерно 12000 различных компонентов и, в конечном итоге, произвели хлорохин, заменитель хинина. Это вещество связано с хинином, потому что оно имеет хинолиновое ядро. Хлорохин и аналогичное вещество, сонтохин, были синтезированы в 1934 в сотрудничестве с американскими компаниями, благодаря более чем 2000 договорам между IG Farben и зарубежными компаниями, такими как Standard Oil в Нью-Джерси, DuPont, Alcoa, Dow Chemical, Agfa, Winthrop Chemical Company и другими. Хлорохин является ингибитором биокристаллизации пигментов и одним из лучших антимикробных средств. Хинин, как и хлорохин, влияет на малярийного паразита в начале его жизненного цикла, когда паразит формирует пигменты гематина, полученные в результате распада гемоглобина. Прогуанил был открыт в 1944 году Курдом, Дэви и Роузом, британскими исследователями из Imperial Chemical Industries. Пириметамин окончательно был разработан в 1950-1952 годах в лаборатории Burroughs-Wellcome. В 1970 годах было создано лекарство Фальсидар, смесь пириметамина и сульфадоксина. В 1950-х и 1960-х годах хинин заменили синтетические противомалярийные препараты, чья себестоимость, как правило, была очень низкой. Во время войны во Вьетнаме, в ответ на просьбу «Вьетконга», в 1972 году в Пекине началось систематическое изучение более двухсот китайских лекарственных растений под руководством фармаколога Ту Юю и её исследовательской группы. Цин Хао Су (青蒿素), называемый на Западе артемизинином, экстрагируется при низкой температуре в нейтральной среде (рН 7) из сушеных растений цин хао (青蒿), в соответствии с инструкциями от Гэ Хун. В своем трактате «Руководство по скорой медицинской помощи» (четвертый век нашей эры), Гэ Хун впервые в истории рекомендует использование Цин Хао для лечения перемежающейся лихорадки. Он рекомендует замачивание листьев и ветвей полыни в течение ночи, после чего из растения выделяют сок, который затем дают непосредственно больному. Впервые культура паразита in vivo в крови была представлена в 1976 году Трагером и Дженсеном, что значительно ускорило разработку новых противомалярийных медикаментов.
ДДТ
Инсектицидные свойства ДДТ (дихлор-дифенил трихлорэтана) были установлены в 1939 году Полом Германом Мюллером из компании Geigy Pharmaceutical, Базель, Швейцария, благодаря измельченному пиретруму из ромашника пепельнолистного (растения из семейства хризантем). Применение ДДТ является стандартным методом защиты от насекомых. Тем не менее, из-за воздействия ДДТ на окружающую среду и того факта, что у комаров развилась резистентность к этому веществу, ДДТ применяется все меньше и меньше, особенно в районах, где малярия не является эндемичной. В 1948 году Поль Мюллер получил Нобелевскую премию по медицине.
Малярия у человека и обезьян
В 1920-х годах, американские исследователи вводили людям кровь различных видов обезьян, чтобы определить потенциал для передачи малярии от обезьяны к человеку. В 1932-33 годах, Синтон и Маллиган выделили наличие Plasmodium gonderi среди обезьян из семейства Мартышковые. До 1960х годов естественное инфицирование обезьян в Индии было редкостью, тем не менее, живтоных уже использовали в исследовательских целях. Тем не менее, уже с 1932 года было известно, что P. knowlesi может передаваться человеку через зараженную кровь обезьяны. Вопрос заражения человека обезьяньей малярией, особенно важный в контексте программы ликвидации малярии, встал на повестку для в 1960 году, когда, случайно, выяснилась возможность передачи (через комаров) малярии от обезьяны к человеку10). В 1969 году, штамм Chesson Plasmodium vivax был впервые адаптирован для нечеловеческого примата. Начиная с 2004 года, было установлено, что P. Knowlesi, который, как известно, связан с обезьяньей малярией, связан также с малярийными инфекциями у людей.
Латентный паразит
Несмотря на то, что различные этапы в крови и вектор малярии (Anopheles) были определены в девятнадцатом веке, лишь в 1980 году была обнаружена латентная форма паразита в печени (вторичные эксо-эритроцитарные циклы поддерживают паразита P. vivax в печени в течение 3-5 лет или более, P. ovale в течение 2-3 лет и P. Malariae – в течение всей жизни). Открытие скрытой формы паразита, наконец, объяснило, почему у людей, которые, казалось, излечились от малярии, через несколько лет случается рецидив, несмотря на то, что паразит исчез из их крови.
Исследования и перспективы
Фармакология
- В 2004 году команда доктора Джонатана Веннерстрома из университета Небраски, Омаха, смогла синтезировать артемизиновую кислоту, которая может быть преобразована в более эффективный артемизинин (in vitro), вырабатываемый естественным образом. Plasmodium не имеет никакой известной резистентности по отношению к этой молекуле (ОЗ-277 или RBx11160) по состоянию на апрель 2011 года.
- В марте 2006 года, две международные команды11) исследовали эффективность различных растений из рода Квассия. В это же время, исследователи из университета Лилля I разработали молекулу «феррохин», пересаживая прививкой к определенному месту молекулы хлорохина ферроцен. Феррохин оказался в 30 раз более эффективным, чем хлорохин. Ни одного случая резистентности P. falciparum не наблюдалось (апрель 2011 года).
- В сентябре 2006 года, французская команда учёных выделила основное противомалярийное соединение (сималикалактон D) из травяного чая из дерева кассия, используемого в Гайане для лечения малярии.
- В 2008 году биологи из Технологического Института Джорджии, Атланта, показали, что некоторые натуральные фунгицидные соединения красных водорослей Callophycus Serratus ингибируют действие Plasmodium; хотя связь между противогрибковыми, противомалярийными и антибактериальными активными ингредиентами до сих пор до конца не установлена.
- В 2009 году, исследователи из Технологического Института Атланты идентифицировали так называемые противоинфекционные соединения «бромофиколиды», эффективные in vitro против грибковых инфекций и малярийного плазмодия.
- В январе 2010 года, GlaxoSmithKline объявила о свободном доступе для научного сообщества списка из более чем 13500 молекул и их химических структур, потенциально активных в отношении P. falciparum с целью стимулировать развитие новых методов лечения этой болезни.
- В 2010 году исследователи из Школы общественного здравоохранения Джона Хопкинса Блумберга в Балтиморе обнаружили, что бактерия, принадлежащая к роду Enterobacter и обитающая в кишечной флоре комара Anopheles gambiae, убивает малярийный плазмодий посредством свободных радикалов. Около 25% Anopheles, пойманных вблизи Исследовательского института малярии имени Джонса Хопкинса в Махи (южная Замбия), содержали этот бактериальный штамм. Исследование показало, что бактерии до 99% ингибируют рост P. falciparum в культуре человеческого происхождения in vitro, как и в пищеварительной системе Anopheles12).
- В 2010 и 2011 году было обнаружено два новых класса противомалярийных препаратов, которые уже проходит клинические испытания: спироиндолоны и имидазолепиперазины.
- В сентябре 2012 года был осуществлен синтез артемизинина, что позволило осуществлять производство лекарств, не ограничиваясь использованием полыни.
Нобелевская премия по медицине 2015 года была присуждена ирландцу Уильяму Компбеллу, японцу Сатоши и китаянке Ту Юю за вклад в исследования по лечению паразитарных заболеваний, включая малярию.
Вакцины
 В январе 1986 Мануэль Елкин Патарройо разработал первую противомалярийную вакцину SPf6658 на основе синтетического пептида. Её эффективность, в сравнении с P. falciparum, однако, была довольно низкой или вообще отсутствовала.
Начиная с 1992 года, компания GlaxoSmithKline (Бельгия) разрабатывает актимерозоитную вакцину под названием S/AS02A59. В декабре 2005 года, профессор Алонсо из Университета Барселоны опубликовал обнадеживающие результаты, согласно которым вакцина оказывалась эффективной в 30% случаев при одной инъекции, а в половине случаев позволила избежать серьезных приступов болезни. С 26 мая 2009 года, вакцина находится на стадии III клинических испытаний. Испытания показывают, что ее эффективность будет превышать прогнозы. Вакцина изготовляется из паразитических синтетических пептидов и рекомбинантных белков (с возможностью обмена информацией с другим белком) или ДНК (из митохондрий и пластид плазмодия). Зная, что паразит, чтобы проникнуть в эритроциты, принимает форму белка и способен к мутации до шестьдесяти раз, чтобы обмануть иммунную систему, в вакцине используются два рекомбинантных белка:
В январе 1986 Мануэль Елкин Патарройо разработал первую противомалярийную вакцину SPf6658 на основе синтетического пептида. Её эффективность, в сравнении с P. falciparum, однако, была довольно низкой или вообще отсутствовала.
Начиная с 1992 года, компания GlaxoSmithKline (Бельгия) разрабатывает актимерозоитную вакцину под названием S/AS02A59. В декабре 2005 года, профессор Алонсо из Университета Барселоны опубликовал обнадеживающие результаты, согласно которым вакцина оказывалась эффективной в 30% случаев при одной инъекции, а в половине случаев позволила избежать серьезных приступов болезни. С 26 мая 2009 года, вакцина находится на стадии III клинических испытаний. Испытания показывают, что ее эффективность будет превышать прогнозы. Вакцина изготовляется из паразитических синтетических пептидов и рекомбинантных белков (с возможностью обмена информацией с другим белком) или ДНК (из митохондрий и пластид плазмодия). Зная, что паразит, чтобы проникнуть в эритроциты, принимает форму белка и способен к мутации до шестьдесяти раз, чтобы обмануть иммунную систему, в вакцине используются два рекомбинантных белка:
- Белок циркумспорозоита P. falciparum (RTS);
- Адъювант, состоящий из 250 мкм водно-масляной эмульсии, 50 мкг сапонина QS21 и 50 мкг липидного монофосфорического иммуностимулятора A (AS02A).
Эта вакцина – самая передовая вакцина второго поколения. При условии, если все исследования и испытания будут продолжать вестись в нормальном режиме, вакцина может появиться на рынке в начале 2012 года, в соответствии со статьей 58 Европейского агентства лекарственных средств, и войти в IV фазу клинических испытаний. Другие исследования, связанные с поиском вакцины:
- С 2002 года, факультет биологии и медицины (FBM) из Университета Лозанны в Швейцарии занимается изучением антимерозоитной вакцины под названием PfCS102/ AS02A64 на основе пептида циркумспорозоитарного синтеза P. falciparum, усиленного адъювантом. С 2005 года вакцина находится на второй стадии клинических испытаний.
- В ноябре 2005 года Институт Пастера объявил о начале первого этапа клинических испытаний прототипа антимерозоитной вакцины на основе антигенов, на людях, под названием MSP365. Для её разработки, исследователи занимались изучением механизмов естественной иммунной защиты организма.
- В 2006 году Министерство обороны США попросило Институт медицины Национальной академии наук возобновить программу исследований, начатую в 1986 году по разработке вакцины для военных против P. falciparum66.
- С ноября 2006 года по декабрь 2007 года, на медицинском факультете Университета штата Мэриленд и в Университете Бамако проходила фаза I клинических испытаний вакцины FMP2.1/AS02A. Активное вещество представляет собой белок P. falciparum (FMP2.1), который усиливается адъювантом AS02A. Испытание проводилось в Бандиагара, Мали, на 100 детях в возрасте от 1 года до 6 лет. Испытание показало, что развитие фармакодинамической толерантности к активному веществу не представляет опасности и что иммунные реакции через один год после вакцинации остаются высокими. Та же команда исследователей проводила фазу II клинических испытаний с мая 2007 по июль 2009 года при участии более 400 детей13).
- В январе 2010 года, Университет Центральной Флориды в Орландо объявил о создании пероральной или инъекционной вакцины-кандидата, одновременно эффективной против малярии и холеры. Вакцина нацелена на системный иммунитет и слизистую оболочку, воздействуя на токсин при помощи антигенов апикальной мембраны (AMA1) и поверхностного белка (MSP1) из P. falciparum.
Транспластомные хлоропласты табака и салата исследовались в качестве реакторов для производства этих белков. По данным исследования, последние, экстрагированные и введенные мышам, были способны защищать их в течение 300 дней от проникновения паразита в эритроциты, и против холерного токсина. Иммунный ответ был типа TR1/Th2. Этот процесс был запатентован и может позволить (если будет доказана его эффективность на человеке) получить недорогую вакцину, не требующую холодного хранения в случае перорального применения.
- В октябре 2011 года, результаты масштабного исследования вакцины РТС S / AS01 (см. выше), проводившегося в Африке с марта 2009 года с участием 15540 маленьких детей (в возрасте от 6-12 недель до 5-17 месяцев), показали 50% снижение количества клинических эпизодов малярии14). Результаты очередного этапа этого исследования ожидаются в 2014 году. ВОЗ сообщила, что, если ближайшие испытания окажутся обнадеживающими, в 2015 году организация будет рекомендовать широкое применение вакцины в сочетании с другими существующими средствами.
Генетика
В 2000 году команда профессора Андреа Кризанти из Имперского колледжа в Лондоне смогла создать первого генетически модифицированного комара. В 2003 году было показано, что, если ген-маркер сохраняется в течение тридцати поколений в процессе оплодотворения между модифицированными комарами, остается всего около 4-16 поколений с одним оплодотворением с одним не модифицированным комаром. С апреля 2001 года, международный консорциум решил провести полное секвенирование генома Anopheles gambiae. Его патронажем занимается Центр Исследования Тропических Болезней. Это секвенирование было поручено центру Genoscope и Celera Genomics в Аламеда. Цель заключается в выявлении генов, участвующих в иммунной реакции комара против паразита Plasmodium или находящихся в его обонятельных и вкусовых рецепторах, чтобы, в конечном счете, выявить протеазы, участвующие в иммунной реакции.15) 15 июля 2010 года, профессор энтомологии Михаил Риэль и его команда из Университета Аризоны, объявили о создании генетически модифицированной самки комара Anopheles stephensi, способной уничтожать паразитов в своем организме и не способной передавать заболевание. Исследователи в настоящее время изучают способы замены естественной популяции Anopheles лабораторными комарами, надеясь, что эти комары не станут инвазивными, начав передавать другие заболеваний, или что паразит не разовьёт разистентности.
Эпидемиология
Распространённость малярии в мире
В 1990-е годы, малярия вызывала 400-900 миллионов случаев лихорадки и 700000-2,7 миллиона смертей, то есть, в среднем, каждые 30 секунд от малярии умирал один человек16). В 2012 году, от малярии умерло 473000-789000 человек. Подавляющее большинство жертв составляют дети в возрасте до 5 лет и беременные женщины, так как плацента является мишенью, в которой может накапливаться паразит (малярийный плазмодий). Несмотря на усилия по сокращению передачи болезни и улучшению методов лечения, с начала 1990-х годов произошло мало изменений. Похоже на то, что смертность начала снижаться с конца 2000-х годов, и в 2010 году смертность составила 1,2 млн. человек.17) Со-инфекция ВИЧ не приводит к увеличению смертности, и связана с меньшим числом сопутствующих проблем по сравнению с инфекцией/туберкулезом, заболеваниями, как правило, атакующими разные возрастные группы: малярия более распространена среди молодых людей, а туберкулез – среди более пожилых. Тем не менее, малярия и ВИЧ способствуют взаимному распространению друг друга: малярия увеличивает вирусную нагрузку, а ВИЧ-инфекции увеличивает вероятность заражения малярией. Малярия является эндемическим заболеванием в тропических районах Америки, во многих частях Азии и в большинстве стран Африки. Тем не менее, к югу от Сахары происходит 85-90% смертей от малярии. Географическое распределение болезни в больших регионах является сложным, и малярийные и немалярийные области могут располагаться очень близко друг к другу. В засушливых районах, периоды малярии можно предсказать с большим процентом вероятности, с использованием карты осадков. В отличие от лихорадки денге, малярия чаще наблюдается в сельской местности, чем в городах. Например, города Вьетнама, Лаоса и Камбоджи, по существу, свободны от малярии, однако болезнь присутствует в сельской местности. В Африке, однако, малярия присутствует и в сельских, и в городских районах, хотя в городах риск значительно ниже18). Глобальные эндемичные уровни заболевания не были картографированы с 1960х годов, однако, британский Wellcome Trust финансирует Malaria Atlas Project с целью исправить этот факт и оценить влияние этого заболевания в будущем.19) Наконец, малярия является самым распространенным паразитарным заболеванием в мире. Она является одним из основных приоритетов ВОЗ, потому что оказывает прямое разрушительное воздействие на социально-экономическую сферу жизни общества. Человек – далеко не единственное существо на Земле, страдающее малярией. Например, многие птицы являются носителями этих паразитов.
Европа
До девятнадцатого века, эпидемии малярии могли происходить даже в Северной Европе. Регресс малярии в Европе, главным образом, связан с осушением болот20). Исчезновение малярии во Франции настолько удивило исследователей, что о нём говорили как о «спонтанном» или даже «таинственном» исчезновении. Похоже, что это исчезновение имело несколько причин. В таких регионах, как Солонь, например, различные агрономические новшества, связанные, в том числе, с практикой возделывания земли, могли сыграть важную роль в искоренении болезни. Заболевание начало снижаться, как и везде в Европе, до того, как стали использовать хинин, который поначалу применяли неправильно, давая его больным слишком поздно или в слишком малых дозах. Применение хинина, однако, способствовало ускорению исчезновения болезни в тех регионах, где она уже начинала исчезать.
Во Франции
В столице Франции, малярия исчезла сравнительно недавно. В 1931 году она ещё присутствовала в Marais poitevin, в Brenne, на равнинах Эльзаса, во Фландрии, в Ландах, Солони, в регионе Puisaye, в заливе Морбиан, в Камарге… В средние века и до XV-XVI веков, малярия в основном была распространена в деревнях; ситуация не изменилась, даже когда реки во многих городах стали использоваться в качестве транспортных узлов, даже несмотря на периодическое затопление этих рек во многих местах. Времена Ренессанса связаны с возрождением лихорадки, религиозными войнами, заставляющими жителей городов запираться в стенах, окруженных рвами со стоячей водой. Кроме того, в Париже в конце девятнадцатого века проходила перестройка, и работы были в значительной степени связаны с раскопками. Вода в лужах, прудах и других источниках застаивалась, что способствовало увеличению популяции комаров и вспышкам малярии. Кроме того, большое количество работников переносили плазмодии из инфицированных районов. Необычайно тяжелая эпидемия в Питивие в 1802 году повлекла за собой визит комиссии факультета медицины; она было связана с очень крупным наводнением, во время которого окружающие луга оказались покрыты водой на несколько недель. Заболевание было искоренено на Корсике в 1973 году. Малярия появилась в этих местах после рейдов вандалов. Последняя эпидемия на Корсике, вызванная не привезённой инфекцией Plasmodium vivax, наблюдалась в 1970-1973 годах. Примечательно, что в 2006 году на острове наблюдался один местный случай заражения Plasmodium vivax. С тех самых пор, почти все случаи малярии, наблюдаемые во Франции, были завезёнными.
Зоны риска
После ряда свирепых эпидемий, поразивших практически весь обитаемый мир, малярия влияет на 90 стран мира (99 стран в соответствии с докладом ВОЗ 2011 года), в основном – на беднейшие страны Африки, Азии и Латинской Америки. В 1950 году малярия была ликвидирована в большинстве стран Европы и многих странах Центральной и Южной Америки благодаря распылению ДДТ и осушению болот. Этому, возможно, также способствовало вырождение лесов; «исследование, проведенное в Перу в 2006 году, показывает, что количество укусов москитов с 278 раз ниже в малонарушенных лесах, чем где-либо еще»21). В 2006 году в Европе были распространены случаи завозной малярии, в основном, во Франции (5267 случаев), Великобритании (1758 случаев) и Германии (566 случаев)22). Во Франции, 558 случаев было связано с военными, однако болезнь также поражает туристов, из ста тысяч туристов, побывавших в малярийных областях, три тысячи вернулись домой инфицированными одной из известных форм плазмодия, остальные случаи связаны с импортом заболевания иммигрантами.
- Африканский континент особенно подвержен малярии; 95% завозных случаев малярии во Франции связаны с африканскими мигрантами. В Северной Африке опасность заражения близка к нулю, но в Восточной Африке, к югу от Сахары и в Экваториальной Африке (как в аграрных, так и в городских районах) риск достаточно высок.
- В Азии, малярия отсутствует в крупных городах и редко наблюдается в районах прибрежных равнин. Опасность высока в сельскохозяйственных районах Камбоджи, Индонезии, Лаоса, Малайзии, Филиппин, Таиланда, Бирмы (Мьянмы), Вьетнама и Китая (в провинциях Юньнань и Хайнань).
- В Карибском бассейне, малярия распространена рядом с Гаити и на границе Доминиканской Республики.
- В Центральной Америке, существуют микро-зоны заражения, однако риск является относительно низким.
- В Южной Америке, риск заражения низок в крупных городах, однако он увеличивается в сельской местности Боливии, Колумбии, Эквадора, Перу и Венесуэлы, а также в амазонских областях.
- Важными факторами распространения малярийной инфекции являются высота над уровнем моря и температура окружающей среды.
- Некоторые виды комаров (таких как Anopheles gambiae) не способны выжить на высоте, превышающей 1000 метров над уровнем моря, однако другие (например, Anopheles funestus) прекрасно приспособлены к жизни на высоте до 2000 м.
- Созревание Plasmodium внутри комара может быть обеспечено только в диапазоне температур окружающего воздуха от 16 до 35°C.
Борьба ВОЗ с малярией
Глобальной программе по искоренению ВОЗ предшествовали проекты Международного совета по вопросам здравоохранения, а затем – Фонда Рокфеллера с 1915 года, но особенно – после 1920х годов. Эти две организации, созданные благодаря Джону Д. Рокфеллеру, уже имели опыт проведения кампаний по искоренению анкилостомоза и желтой лихорадки. Стратегия Рокфеллеров 1924 года была основана на разрыве с традицией массового введения хинина и регуляцией популяций комаров – в частности, через дренажные работы, и была связана только с искоренением комаров. Затем был изготовлен Парижский Зелёный, очень токсичное для комаров вещество, однако неэффективное для взрослых комаров. Основные программы с конца 1920-х годов были проведены в Италии и других странах Фонда в средиземноморском регионе и на Балканах. Несмотря на смешанные результаты, такая же политика была проведена в Индии с 1936 по 1942 годы. Здесь, в сочетании с другими подобными мерами, удалось добиться впечатляющих, но временных, результатов: в 1941 году наблюдалась ситуация, аналогичная ситуации до начала проведения программы. Вторая мировая война приостановила проведение некоторых программ, однако способствовала расширению нескольких других: в 1942 году была создана комиссия здравоохранения Фонда Рокфеллера для поддержки усилий вооруженных сил и защиты солдат в прифронтовых районах. Развитие ДДТ, в котором принимала участие команда Рокфеллера, и распыление этого инсектицида с самолетов в затопленном районе к западу от Рима способствовало запуску кампании по искоренению малярии в Италии в 1946 году. Самая известная из проведенных программ была осуществлена в Сардинии с 1946 по 1951 годы. Программа основывалась на массовом использовании ДДТ, и, несмотря на спорные экологические последствия, способствовала ликвидации комаров и, как следствие, малярии. Фонд Рокфеллера завершил свою программу по общественному здравоохранению, и противомалярийную программу в 1952 году. В 1948 году была создана ВОЗ. Глобальная программа по ликвидации малярии была запущена в 1955 году (на тот момент программа охватывала Южную Африке и Мадагаскар). После первых заметных успехов (Испания стала первой страной, которую ВОЗ официально объявила свободной от малярии в 1964 году), программа встретилась с трудностями. В 1969 году XXIIя Всемирная ассамблея подтвердила свои неудачи, но подтвердила Глобальные цели по искоренению малярии. В 1972 году группировка стран в Браззавиле решила отказаться от цели искоренения и заняться вместо этого миссией по контролю заболевания. На 31-й сессии Всемирной ассамблеи здравоохранения в 1978 году ВОЗ согласилась с этим изменением: она отказалась от глобальной ликвидации и от искоренения малярии, сконцентрировавшись только над её контролем. В 1992 году в Амстердаме Конференция министров приняла глобальную стратегию пересмотра методов борьбы против малярии. В 2001 году эта стратегия была принята ВОЗ. ВОЗ отказалась от процедур по сертификации ликвидации малярии в 1980-х годах и возобновила их в 2004 году. В 1998 году было создано партнёрство RBM (Roll Back Malaria), объединяющее ВОЗ, ЮНИСЕФ, Программу развития ООН (ПРООН) и Всемирный банк. С момента своего основания в 1955 году, Соединенные Штаты стремились защититься от ввоза малярии через Южную Америку и были основным игроком в глобальной программе ликвидации; кроме того, они также были мотивированы политическими соображениями – борьбой с коммунизмом.23) Считается, что глобальные усилия по борьбе с малярией и по её искоренению с 2000 года спасли 3,3 млн жизней благодаря сокращению смертности из-за этого заболевания на 45% во всем мире и на 49% в Африке.
Социально-экономическое воздействие
Малярия не только обычно ассоциируется с бедностью, но и представляет собой основную причину бедности и является серьезным препятствием на пути экономического и социального развития. Болезнь имеет негативные экономические последствия для тех регионов, где она широко распространена. Сравнение ВВП на душу населения в 1995 году, с поправкой на соотношение покупательной способности между странами, пострадавшими от малярии и не пострадавшими странами, показало отклонения от 1 до 5 (1 526 USD против 8 268 долларов США). Кроме того, в странах, где малярия является эндемическим заболеванием, рост ВВП на душу населения страны составлял 0,4% в год в среднем с 1965 по 1990 годы против 2,4% для других стран24). Эта корреляция не означает, однако, что причинно-следственная связь и распространенность малярии в этих странах также частично связана со снижением экономического потенциала для борьбы с болезнью. Затраты на малярию оцениваются в 12 миллиардов долларов США в год только для Африки. Хорошей иллюстрацией является Замбия. Если бюджет, который страна тратила на борьбу с этим заболеванием в 1985 году, составлял 25 000 долларов США, то с 2008 года, благодаря международной помощи и PATH (Программа оптимальных технологий в здравоохранении), бюджет стал составлять 33 миллиона в течение девяти лет. Основная цель бюджетного обеспечения – это предоставление москитных сеток всему населению страны. На индивидуальном уровне, экономические последствия включают в себя расходы на здравоохранение и госпитализацию, потерянные рабочие дни, потерянные дни присутствия в учебном заведении, снижение производительности из-за повреждения головного мозга, вызванного болезнью. Для государств, дополнительными последствиями являются снижение инвестиций, в том числе, от туристической отрасли. В некоторых странах, особенно страдающих от малярии, расходы на малярию могут достигать 40% от общих расходов на здравоохранение, 30-50% пациентов поступают в больницы, и до 50% - посещают медицинские консультации.
Причины малярии
 Малярия вызывается паразитами рода Plasmodium, которые, сами по себе, передаются комарами из рода Anopheles.
Малярия вызывается паразитами рода Plasmodium, которые, сами по себе, передаются комарами из рода Anopheles.
Plasmodium, паразит, передающий малярию
Малярия вызывается паразитом из рода Plasmodium (Phylum apicomplexa). У человека, малярия, по существу, вызывается P. falciparum (преобладающим в тропических регионах), P. malariae, P. ovale (редкими видами, обитающими в Западной Африке) и P. vivax (видом, менее требовательным к температуре). P. falciparum является наиболее распространенной причиной инфекций (вызывает около 80% всех случаев заболевания малярией и 90% смертей)25). Плазмодии также могут инфицировать птиц, рептилий, обезьян, шимпанзе и грызунов (теплокровных животных). Известны случаи заражения людей обезьяньими видами малярии, в том числе P. knowlesi (en), P. inui (en), P. cynomolgi115, P. simiovale, P. brazilianum, P. schwetzi et P. simium. Тем не менее, эти инфекции являются ограниченными и не имеют существенного значения в рамках общественного здравоохранения, за исключением P. knowlesi. Птичья малярия может убивать кур и индеек, но эта болезнь не наносит значительного экономического ущерба сельскому хозяйству. Тем не менее, малярия, занесённая человеком, нанесла крупный урон видам эндемичных птиц на Гавайях. Plasmodium – это вид крошечных простейших (1-2 мкм), состоящих из бледно-голубого цитоплазма, окружающего питательную вакуоль, содержащую красное ядро и золотисто-коричневый или черный пигмент (гемозоин). Жизненный цикл плазмодия является сложным и требует присутствия двух хозяев – промежуточного хозяина (человека) и окончательного хозяина (кровососущей самки комара Anopheles). (Anopheles с греческого переводится как «бесполезный»). С чисто биологической точки зрения, истинным конечным хозяином вируса является комар. Человеческий организм является лишь посредником в его цикле репликации. Тем не менее, по антропоцентрическим причинам считается, что переносчиком заболевания является не человек, а комар и, следовательно, что этот зооноз (заболевание) входит в группу зооантропонозов.
Anophele, переносчик малярии
Взаимодействия между Anophele и plasmodium
Только самки Anopheles являются кровососущими. Самцы занимаются только тем, что оплодотворяют самок и питаются нектаром и соками растений, таким образом, они не могут передавать заболевание. Самки Anopheles предпочитают кормиться на ночь, они начинают искать пищу в сумерках, и могут продолжать заниматься этим до ночи. Дыша и потея, люди и животные выделяют СО2. Их организмы постоянно производят тепло и влагу (пот), а также коктейль потенциальных аттрактантов (например, молочную кислоту), присутствующих в дыхании, поте или кожном жире. Самки комаров (и других насекомых) могут обнаружить некоторые из этих телесных эманаций с большого расстояния (например, ± 20 м для CO2) и незамедлительно отправиться к их источнику. Комаров также привлекают пары алкоголя и тёмные цвета, особенно черный (который также собирает тепло). Комары передвигаются (на расстояния до 2 км), используя свои датчики (хеморецепторы). Раньше считалось, что некоторые люди «привлекают» к себе больше комаров, чем другие, и в 2011 году исследователи также подтвердили, что самки и самцы малярийных комаров по-разному реагируют на одни и те же химические стимулы и отдушки26). С экологической и эволюционной или эпидемиологической точек зрения, для наилучшего распространения, паразиту выгодно привлекать самок малярийных комаров, а не человека или животных, страдающих от малярии. В настоящее время признано, что многие паразиты могут в какой-то степени манипулировать поведением своего хозяина, что особенно заметно среди видов, представляющих угрозу для здоровья человека.27) Несколько недавних исследований показали, что в ходе процессов коэволюции хозяин-паразит, паразиты действительно приобрели способность изменять запах хозяина в своих интересах, привлекая переносчиков. В 2004 и 2005 годах было подтверждено, что пациенты, больные малярией, привлекают больше комаров, чем здоровые люди (ребенок, больной малярией, привлекает в два раза больше малярийных комаров, чем здоровый ребёнок)28). Это было также продемонстрировано в 2013 году на животных (птицы)29). Одно исследование, проведенное в 2014 году, показало, что запах тела лабораторных мышей, зараженных Plasmodium (в данном случае Plasmodium chabaudii), значительно меняется (до тех пор, пока мышь остается заразной), и такие мыши привлекают больше малярийных комаров, чем неинфицированные мыши. В 2015 году было проведено еще одно исследование, которое дает возможное объяснение этого явления. В лаборатории, в зараженных клетках, паразиты (малярийный плазмодий) были способны синтезировать терпеновый запах, привлекательный для самок малярийного комара; благодаря их апикопласту (наследуемая органелла путем эндосимбиоза в организме растений; водоросль или промежуточный орган между водорослями и бактериями: цианобактерия). Эта органелла, близкая к хлоропластам, потеряла свою способность к фотосинтезу, но по-прежнему способна метаболизировать терпены. Это показал Одри Р. Од из школы медицины при Университете Вашингтона в Сент-Луисе в сотрудничестве с коллегами (из Йельского университета), в исследовании, опубликованном в журнале MBIO. Часть команды работала с апикомплексами и продемонстрировала способность апикопластов биосинтезировать изопреноиды30). В предыдущем исследовании не было обнаружено производства терпенов, однако в нём исследовалось небольшое количество плазмодиев. Команда из Сент-Луиса выступила с идеей культивировать на этот раз большее количество плазмодиев, сравнимое с количеством, которое присутствует в инфицированном организме. Культуры были произведены в сериях красных кровяных клеток инфицированного человека, чьи газообразные выбросы сравнивались с такими же сериями неинфицированных клеток. Результаты этого исследования, опубликованного в 2015 году, показали, что терпены содержались только в серии зараженных клеток. Авторы показали, что для того, чтобы биосинтезировать два терпена (лимонен и пинандиол, которые, соответственно, имеют лимонный и сосновый ароматы) и две другие молекулы (роль которых ещё не определена), P. falciparum мобилизует биохимические реакции под названием «пластидиальный изопреноидный путь биосинтеза». Каждый образец газа из культуры клеток крови, содержащих клетки-носители паразитов, содержал, по меньшей мере, один из этих двух терпенов. Уже было известно (в 2012 году), что два этих терпена (производимые цветами, которые производят наиболее привлекательный для самцов малярийного комара нектар) привлекают самцов малярийного комара (даже в очень малых количествах. Дальнейшие тесты подтвердили, что самки малярийного комара, которые передают малярию (Anopheles gambiae), вполне способны обнаружить эти терпены, и реагировать на них, благодаря тому, что они имеют «клеточный аппарат, необходимый для обнаружения этих соединений и реагирования на них», согласно Одому (хотя известны и другие молекулы, также привлекающие этих комаров); СО2 считается основным фактором привлечения комаров, однако было показано (2014 г.), что штаммы Anopheles gambiae лишены рецептора для CO2, тепла и молочной кислоты, однако они способны определить местонахождение человека-хозяина с целью прокормиться его кровью. Таким образом, комары также «отслеживают» другие молекулы при выборе хозяина. Это говорит о том, что люди (или животные), инфицированные малярией, больше всего рискуют быть укушенными комаром, и даже больше, чем один раз, что будет способствовать распространению эпидемии, но после этой демонстрации in vitro осталось продемонстрировать in vivo в организме человека или животных, что эти терпены фактически выпускаются кожей или при дыхании и в таком или в измененном виде привлекают комаров, что незамедлительно и было сделано в Лаборатории в Сент-Луисе31). Эта информация открыла дорогу для новых неинвазивных диагностических тестов на малярию, основанных, например, на анализе запаха кожи, дыхания (как в алкотестере) или пота. Также используются новые способы борьбы против распространения паразита (манипулируя запахом, который воспринимает комар, можно было бы ограничить привлечение комара к людям, больным малярией или, наоборот, устроить приманку для самок малярийного комара.
Цикл жизни паразита в организме комара
Переносчиком паразита и его первичным хозяином является самка малярийного комара (Anopheles). Паразит попадает в организм комара через кровь инфицированного человека, которой они питаются (кровь необходима самкам для производства яиц). Попав в организм, гаметоциты Plasmodium дифференцируются на мужские и женские половые клетки, а затем формируют мобильную зиготу, называемую оокинет, которая проникает через стенки желудка комара, становясь сферическим ооцистом, ядро которого будет несколько раз делиться, формируя спорозоиты. Продолжительность этого созревания тесно зависит от температуры наружного воздуха. Например, у P. falciparum созревание проходит при температуре не ниже 18°С и не выше 35°C, максимальная скорость созревания наблюдается при 24°С. Когда ооцист разрывается, высвобождаются спорозоиты, которые мигрируют через тело комара в слюнные железы, через которые они могут, при поступления новой крови в виде пищи, заразить нового человека-хозяина, поступив в его кожу со слюной.32)
Цикл жизни паразита в организме человека
Печёночная фаза
Инфекционные спорозоиты, длиной 12 мкм и шириной 1 мкм, попадают в организм человека через укус зараженной самки малярийного комара, и быстро поступают (менее чем через полчаса) из крови в печень, где они изолируются в значительной степени благодаря адгезии большей части окружающего его белка, белка циркумспорозоита, после чего заражаются гепатоциты. Этот преэритроцитарный печёночный криз длится 7-15 дней для P. falciparum, от 15 дней до девяти месяцев для P. vivax, от 15 дней до нескольких месяцев для P. ovale и 3 недели для P. malariae, после чего паразит может продолжить свой жизненный цикл. Спорозоиты, которые не достигают печени, будут устранены фагоцитами или не смогут продолжить свое развитие, если они достигнут других органов. В ходе первого этапа преобразования образуется «криптозоит» (от греческого κρυπτός (Kruptos), что означает «скрытый») и одноядерный элемент под названием «трофозоит», благодаря которому паразит имеет возможность непосредственного размножения при помощи шизогонии, за неделю до пятнадцати дней образуя огромный шизонт (этим названием обозначают простейших, становящихся активными после фазы инкубации) размером 40-80 микрон. Это синее тело (состоящее из бледно-голубого цитоплазма) отпочковывается, теряя свою подвижность, испуская пузырьки, состоящие из молодых мерозоитов, которые впоследствии попадут в кровь, таким образом, знаменуя эритроцитарный этап, то есть, заражение эритроцитов. Тем не менее, некоторые мерозоиты P. ovale или P. vivax могут оставаться скрытыми в печени на протяжении нескольких лет или даже всей жизни (P. malariae), перед тем, как волнообразно активироваться. Эта фаза цикла жизни паразита называется «спящей» фазой, в ходе которой плазмодий не реплицируется, а спит, поэтому в этой фазе его называют «гипнозоитом» (греч. Ὕπνος, или древнегреческий бог сна Гипнос).
Фаза трансфера
Пузырьки высвобождаются в синусоидах печени (капилляры печени на стыке между печенью и кровотоком), а затем достигают кровотока и распространяют там поток молодых «преэритроцитарных» мерозоитов, готовых заразить красные кровяные клетки. Каждая инфицированная клетка печени содержит около 100000 мерозоитов (каждый шизонт способен производить 20000 мерозоитов). Для передачи клеток печени в кровь здесь используется настоящая техника «троянского коня». Изображения in vivo, полученные в 2005-2006 годах, показали, что у грызунов мерозоиты могут производить мертвые клетки, что позволяет им покидать печень и попадать в кровоток, избегая тем самым иммунную систему). Похоже на то, что они руководят этим процессом, что позволяет им скрывать биохимические сигналы, которые обычно помогают оповещать макрофаги. Возможно, в будущем будут созданы новые активные препараты или вакцины против экзоэритроцитарной стадии до стадии вторжения в красные кровяные клетки.
Кровяная фаза
В 2011 году международная команда учёных обнаружила, что среди рецепторов поверхности красных клеток крови, позволяющих паразиту проникать в клетки, существует один, который играет важное значение в этом проникновении (подтверждено со всеми протестированными штаммами в отношении P. falciparum); этот рецептор, следовательно, будет мишенью для дальнейших исследований вакцин. В ходе диффузии, мерозоиты разрушают эритроциты (этот процесс называется гемолизом). Во время этих сильных синхронных всплесков наблюдаются приступы лихорадки. Время, которое проходит между проникновением паразита в красную клетку крови и его расщеплением, довольно постоянно и достигает у человека 48 часов для P. vivax, P. ovale и P. falciparum (трёхдневная малярия) и 72 часа для P. malariae (четырехдневная малярия). Эритроцитарная фаза P. knowlesi составляет всего 24 часа33). Разрушение эритроцитов приводит к анемии и, в случае церебральной малярии, смерть наступает в результате закупорки кровеносных сосудов головного мозга инфицированными эритроцитами. Это разрушение красных кровяных клеток сопровождается выделением гемозоина, нарушающего функционирование гипоталамуса (производство цитокинов, таких как TNF-альфа) и провоцирующего большое увеличение температуры, вплоть до гиперпирексии. Разрыв стенок шизонтов или «розеток» завершает первый цикл шизогонии эритроцитов, выпуская в кровь, с отходами метаболизма плазмодиев (пигментами и остатками от красных кровяных клеток), новое поколение плазмодия, «эритроцитарные» мерозоиты, способные повторно заражать другие красные кровяные клетки. Закономерность подобных циклов постепенно будет заменена (иммунная организация) эритроцитарными гамогоническими циклами, предваряющими половые формы. Трофозоиты перестают делиться и изменяют свое ядерно-плазменное соотношение. Эти формы трофозоитов с большим ядром и уплотненной цитоплазмой являются мужскими и женскими гаметоцитами, которые останутся в резерве в крови. Паразиты на этом этапе не имеют шансов на выживание в человеческом организме: они остаются живыми в течение примерно двадцати дней, а затем исчезают. Они могут продолжить свое развитие в организме комара. В этот момент, если самка малярийного комара кусает больного, он поглощает гаметоциты, и начинается новый цикл, в этот раз половой, в организме комара. Спорозоиты, полученные при помощи этого воспроизводства, проникают в слюну комара, которая может заразить нового хозяина, и так далее.
Другие способы передачи инфекции
Паразиты также могут быть переданы через плаценту от матери к плоду (врожденная малярия), путем заражения через загрязненный шприц или через переливание крови, хотя последний способ встречается крайне редко.
Диагностика
Симптомы
- Общая усталость
- Потеря аппетита
- Головокружение
- Головная боль
- Проблемы с пищеварением (расстройство желудка), тошнота, рвота, боль в животе
- Понос
- Мышечная боль
Клинические признаки
- Лихорадка
- Периодический тремор
- Боль в суставах
- Признаки анемии, вызванные гемолизом
- Гемоглобинурия
- Судороги
- Желтуха
На коже могут возникнуть ощущения покалывания, особенно в том случае, если причиной малярии является P. falciparum. Наиболее классическим симптомом малярии является циклическое повторение внезапного ощущения холода и жара, озноба и гипергидроза в течение от четырех до шести часов, каждые 48 часов, при инфекции P. malariae (однако, P. falciparum может вызывать лихорадку каждые 36-48 часов или непрерывную лихорадку, которая будет менее выраженной). Тяжелая малярия вызывается почти исключительно инфекцией P. falciparum и, как правило, начинает проявляться через 6-14 дней после инфицирования. Этот тип малярии при отсутствии лечения может привести к коме и смерти, особенно у маленьких детей и беременных женщин. Сильная головная боль в сочетании с церебральной ишемией представляет собой еще один неспецифический симптом малярии. Другие клинические признаки включают увеличение селезенки, гепатомегалию, гипогликемию и нарушение функции почек. Если почки функционируют, может развиться заболевание, при котором гемоглобин из красных клеток крови будет просачиваться в мочу. Тяжелая малярия может прогрессировать чрезвычайно быстро и может привести к смерти в течение нескольких дней или даже часов, поэтому особенно важно осуществить быструю диагностику заболевания. В наиболее тяжелых случаях, смертность может превышать 20% даже при хорошем медицинском уходе. По причинам, все еще плохо изученным, однако, возможно, связанным с внутричерепным давлением, дети с малярией могут иметь аномалии, связанные с осанкой, указывающие на церебральную малярию. Этот вид малярии может быть связан с задержкой в развитии, потому что обычно вызывает анемию в период быстрого развития мозга, что может быть связано с неврологическими повреждениями и долгосрочными проблемами развития34).
Анамнез
Во многих случаях не представляется возможным даже постановка простого лабораторного диагноза и в качестве показателя необходимости дальнейшего лечения малярии используется наличие или отсутствие лихорадки. Однако этот метод не является самым эффективным: в Малави, использование мазков крови, окрашенных по Романовскому-Гимзе, показало, что ненужное использование противомалярийных методов лечения снижалось, когда вместо истории лихорадки использовались данные клинических показателей (температура прямой кишки, бледность ногтей, спленомегалия) (чувствительность увеличилась на 21-41%)35). Малярия у детей слишком часто неправильно диагностируется (плохой анамнез, плохая интерпретация полевых испытаний) местными фельдшерами (членами общества, получившими основную подготовку, позволяющую им осуществлять основной уход в отсутствии профессионального медицинского персонала).
Диспансеризация
Клинические проявления малярии наблюдаются только во время бесполого размножения плазмодиев в эритроцитах малярии, что приводит к:
- сильным и повторяющимся лихорадкам;
- массивная гибель эритроцитов (прямая и косвенная), которая вызывает гемолитическую анемию и реакцию СРЗ (прогрессивную спленомегалию);
- пигментной желчи и, следовательно, желтухе (гепатомегалия);
- ухудшение общего состояния, которое может привести к кахексии.
Дополнительные испытания
Тесты крови под микроскопом
Метод наименее дорогой диагностики (от 0,40 до 0,70 долларов за пластину), наболее надежным и наиболее распространенным является метод оптического микроскопического исследования мазка крови и капли крови. Мазок может определить уникальные характеристики каждого из четырех видов паразита Homo Sapiens, потому что в этом случае лучше всего сохраняется переносчик паразита. Толстая капля крови позволяет просмотреть больший объем крови для диагностики, чтобы не пропустить наличие Plasmodium. Чувствительность пленки при таком методе в 11 раз выше, чем при использовании метода тонкой пластины (мазок). Оба препарата могут быть сделаны на одной пластине. Более низкие уровни инфекции могут быть обнаружены при использовании более крупной капли крови, но при этом внешний вид паразита искажается, и виды может быть трудно отличить. Оба метода используются для полноценной диагностики. С применением толстой пленки, опытный оператор может, при хороших условиях (электрический прямой свет), обнаружить очень низкие уровни паразитемии (примерно 0,0001% красных кровяных клеток). Были предприняты попытки улучшить микроскопические методы исследования, но ни одна из них не оказалась лучше классического метода окрашивания Романовского-Гимзе и исследования по погружению в масло (переднюю линзу микроскопа погружают в жидкость с индексом преломления, близким к стеклу, как у кедрового масла или синтетического масла). Диагностика при помощи микроскопа может представлять дополнительную трудность, потому что первые трофозоиты («кольцо») четырех видов практически идентичны. Идентификация вида всегда должна основываться на нескольких трофозоитах.
Полевые испытания
При отсутствии микроскопа или при недостатке медицинского персонала, обученного диагностике малярии, можно использовать быстрые тесты для антигенов, которые требуют только капли крови. Эти иммунохроматографические тесты (также называемые быстрыми диагностическими тестами на малярию) могут выглядеть как кассеты, тест-полоски или «измерительные стержни». В этих тестах используются капля крови из пальца или вены. Тест длится от 15 до 20 минут, если пользователь ранее был обучен обрабатывать и интерпретировать результаты, в обратном случае кровь доставляют в охлажденном виде в лабораторию. Предел обнаружения при проведении этих испытаний составляет порядка 100 паразитов на микролитр (мкл) крови, против пяти при использовании скрининга под микроскопом. Первые быстрые тесты применялись с использованием глутаматдегидрогеназы P. falciparum в качестве целевого антигена (PGluDH), однако потом её быстро заменили лактатдегидрогеназой P. falciparum. Это последний фермент в ходе гликолиза (необходимый для создания ATФ) и более обильный, порожденный P. falciparum. Концентрация PLDH крови достаточно тесно коррелирует с наличием паразитов. Исчезновение антигена после лечения позволяет использовать тест pLDH для того, чтобы предсказать успех или неудачу лечения. Существуют десятки TDR, каждый из которых имеет свои специфические характеристики:
- Optimal IT позволяет выделить P. falciparum и P. vivax благодаря антигенным различиям между изоферментами pLDH; этот тест позволяет обнаружить P.falciparum до 0,01% паразитемии и не-falciparum до 0,1%;
- Paracheck Pf может обнаружить 0,002% паразитемию но не различает видов;
- Другие, такие как ICT Malaria или ParaHIT, акцентированы на антиген HRP2164.
Молекулярный лабораторный метод
Молекулярные методы доступны в некоторых лабораториях. Эти методы анализа осуществляются в реальном времени (например, ПЦР в режиме реального времени, на основе полимеразной цепной реакции) и разрабатываются в настоящее время в надежде их реализации в эндемичных районах. Нуклеиновые кислоты паразитов могут быть обнаружены с помощью полимеразной цепной реакции (ПЦР), более точной методики, чем микроскопия, а также более дорогой, потому что требует наличия специализированной лаборатории, совершенного владения методом сбора проб и наличия идеальной холодильной цепи при хранении и транспортировки. Кроме того, уровни паразитемии не обязательно коррелируют с прогрессированием заболевания, в частности, когда паразит может прилипать к стенкам кровеносных сосудов.
Различные типы малярии
Серьезные осложнения могут быть связаны только с Plasmodium falciparum. Хроническая малярия может быть вызвана P. vivax, P. ovale и, в первую очередь, P.malariae, но не P. falciparum. В случае хронической малярии, болезнь может проявиться через несколько месяцев или лет после заражения, из-за скрытого присутствия паразитов в печени. Таким образом, нельзя сказать, что малярия излечена, если паразиты исчезли из крови. Наиболее длинный инкубационный период имеет P. vivax (30 лет)36).
Неосложнённая малярия
Диагноз «малярия» может быть заподозрен после возвращения из эндемичных районов, характеризуется лихорадкой, температурой более 40°С, ознобом, с последующим падением температуры, сопровождаемым потливостью и ощущением холода. Обычно выделяют трёхдневную малярию (т.е., приступ происходит каждые два дня), вызываемую Plasmodium vivax и Plasmodium ovale (доброкачественная трёхдневная малярия) и Plasmodium falciparum (злокачественная трёхдневная малярия) и четырехдневную малярию (то есть, приступ происходит каждые 3 дня) за счет Plasmodium malariae (термин «малярия» обозначает именно четырёхдневную лихорадку). Приступы малярии могут повторяться в течение нескольких месяцев или лет с P. ovale, P. vivax и P. malariae, но не с P. falciparum, если заболевание лечится должным образом и в отсутствии повторного заражения.
Висцеральная прогрессирующая малярия
Малярийной кахексией ранее называли умеренную перемежающуюся лихорадку, анемию и цитопению, умеренную спленомегалию у детей от 2 до 5 лет. При висцеральной прогрессирующей малярии, организм заметно перегружен, и его следует защищать любой ценой, поскольку вирус последовательно оказывает влияние на кровь и ткани организма:
- Хлорохин (Нивахин) 600 мг (2 таблетки 0,30 г) в день в течение первых 2 дней, затем 300 мг (1 таблетка 0,30 г) в день в течение следующих 3 дней,
- Примахин 15 мг (3 таблетки 0,5 мг) ежедневно в течение 15 дней, с 6 по 20-й день включительно.
Следует контролировать признаки непереносимости 8-амино-хинолинов (головокружение, тошнота, диарея, цианоз, гемоглобинурия, агранулоцитоз), хотя это редко наблюдается при этой дозировке.
Тяжелые приступы малярии Plasmodium falciparum
Церебральная малярия
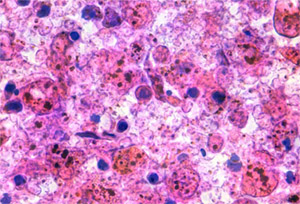 Церебральная малярия так называется из-за засорения капилляров головного мозга мусором из взорванных эритроцитов, связана со значительным увеличением температуры (40°C) и комой (длительностью больше 30 минут). Церебральная малярия имеет обычно плохой прогноз, даже несмотря на лечение. Смертность иногда достигает 20% среди взрослых и 15% среди детей. Развитие такой тяжелой малярии может быть постепенной или резкой.
Церебральная малярия начинается с кратковременных и переходных судорог одной или более мышц, после чего следует расслабление. Эти приступы локализуются или рассредоточиваются по всему телу. Они встречаются преимущественно у детей и беременных женщин и только у 50% взрослых из других групп. Церебральная малярия связана с печеночной недостаточностью и избыточным потреблением сахара паразитом. Беременные женщины особенно восприимчивы к гипогликемии. Перепроизводство молочной кислоты приводит к увеличению кислотности крови.
Дополнительный медицинский осмотр также покажет наличие (полностью или частично) следующих симптомов:
Церебральная малярия так называется из-за засорения капилляров головного мозга мусором из взорванных эритроцитов, связана со значительным увеличением температуры (40°C) и комой (длительностью больше 30 минут). Церебральная малярия имеет обычно плохой прогноз, даже несмотря на лечение. Смертность иногда достигает 20% среди взрослых и 15% среди детей. Развитие такой тяжелой малярии может быть постепенной или резкой.
Церебральная малярия начинается с кратковременных и переходных судорог одной или более мышц, после чего следует расслабление. Эти приступы локализуются или рассредоточиваются по всему телу. Они встречаются преимущественно у детей и беременных женщин и только у 50% взрослых из других групп. Церебральная малярия связана с печеночной недостаточностью и избыточным потреблением сахара паразитом. Беременные женщины особенно восприимчивы к гипогликемии. Перепроизводство молочной кислоты приводит к увеличению кислотности крови.
Дополнительный медицинский осмотр также покажет наличие (полностью или частично) следующих симптомов:
- непрерывный горизонтальный нистагм,
- иногда – ригидность шеи и нарушение рефлексов,
- приблизительно в 15% случаев, кровоизлияния в области сетчатки,
- желтуха
- опистотонус
- моча черного цвета,
- кровавая рвота, вероятно, из-за язвы желудка вследствие стресса.
Лабораторные тесты покажут:
- отек легких, смертность от которого превышает 80%,
- нарушение функции почек (редко наблюдается у детей, но также сопровождается высокой смертностью). Его механизм точно не известен.
- анемия, которая является результатом разрушения и устранения эритроцитов селезенкой, связанных с дефицитом производства этих клеток в костном мозге (аплазия костного мозга). При анемии, как правило, требуется переливание. Анемия очень опасна в детском возрасте и связана с присутствием гемоглобина в крови, почернением мочи и операцией на почках.
Малярийная гемоглобинурия
Другое осложнение, связанное с малярией, - это малярийная гемолобинурия. Это редкое осложнение, наблюдаемое у некоторых лиц, зараженных ранее Plasmodium falciparum в высоко эндемичных странах (где страдает большая часть населения), которое связано с приёмом хинина или других синтетических молекул, таких как Галофантрин (производное фенантрена-метанола) (Halfan). Заболевание связано с разрывом красных кровяных клеток внутри сосудов (внутрисосудистый гемолиз). Клиническое обследование характеризуется:
- высокой температурой,
- шоком с прострацией,
- желтухой
- в образцах мочи содержатся более темные гиалиновые слепки (стекловидные).
Лабораторное обследование покажет:
- анемию,
- гемоглобинурию (наличие гемоглобина в моче, что дает ей цвет портвейна),
и чаще всего
- почечную недостаточность со смертельным исходом из-за разрушения почечных канальцев, называемую острый тубулярный некроз.
Заболевание требует неотложной медицинской помощи, потому что связано с малярийной комой. Лечение направлено на 3 цели:
- освоить олигоанурию (снижение или исчезновение выпуска мочи почками)
- дегельминтизация больного,
- лечение гемолитической анемии.
Против олигоанурии: перитонеальный диализ позволяет переступить через критическую фазу, в ожидании восстановления диуреза. Против паразитемии категорически нельзя принимать хинин из-за гемолиза и сульфаниламиды из-за почечной тубулопатии (заболевание, поражающее нефроны). Достаточно одной инъекции хлорохина (Nivaquine) в объёме 300 мг внутримышечно. Против гемолитической анемии практикуют переливание крови.
Малярия у беременных женщин
Инфицирование плаценты малярийным плазмодием приводит к низкому весу ребёнка при рождении, особенно у первородящих. Если количество паразитов в крови является относительно низким (это имеет место в районах устойчивой передачи), женщины не демонстрируют признаки болезни, в то время как паразиты вторгаются в эритроциты из кровотока, и, более конкретно, из малого круга кровообращения плаценты. В районах, где передача вируса нестабильна (гипо- или мезо-эндемия), беременные женщины демонстрируют тяжелую степень инфицирования, связанную с высоким содержанием паразитов в крови при анемии, гипогликемии и отеке легких. Беременность, таким образом, может быть связана с такими проблемами, как преждевременные роды, самопроизвольный аборт и смертность во время родов. Врожденная малярия затрагивает приблизительно 5% новорожденных инфицированных матерей и напрямую связана с количеством паразитов в плаценте.
Трансфузионная малярия
Трансфузионная малярия передается при переливании крови или после обмена игл среди наркоманов. Во Франции отмечается увеличение риска трансфузионной малярии за 20 лет, предшествовавших 2005 году37). В 2004 году во Франции было зафиксировано уменьшение риска заражения малярией при переливании крови. В эндемичных районах, трансфузионная малярия довольно распространена, но эта малярия считается доброкачественной из-за полу-иммунитета приемников. Трансфузионная малярия чаще всего связана с P. malariae и P. falciparum. В этом случае, инкубационный период является очень коротким из-за отсутствия преэритроцитарного цикла (до вторжения красных кровяных клеток). Трансфузионная малярия выражается теми же признаками, как и Plasmodium. Тем не менее, тяжелое заражение P. falciparum наиболее часто наблюдается среди наркоманов. Лечение с использованием примахина, если речь идёт о P. ovale или P. vivax, является бесполезным из-за разницы в цикле передачи трансфузионной малярии.
Тропическая малярия у детей
Этот вид малярии первоначально был связан с примерно от 1 до 3 миллионов смертей в год. Заболевание поражает, в основном, африканцев и сопровождается:
- неврологическими расстройствами с припадками, в том числе комой,
- гипогликемией,
- увеличением кислотности крови (метаболический ацидоз)
- тяжелой анемией.
В отличие от других форм малярии, детская малярия достаточно редко или почти никогда не сопровождается заболеваниями почек (почечная недостаточность) или накоплением жидкости в легких (отек легких). Лечение этой разновидности малярии, как правило, осуществляется эффективно и быстро.
Тропическая спленомегалия
В настоящее время это заболевание называется гипериммунной малярийной спленомегалией и наблюдается у некоторых лиц, обитающих в регионах, в которых малярия является эндемическим заболеванием. Эти люди демонстрируют неправильный иммунный ответ на инфекцию от малярии, который отражается, помимо спленомегалия, гепатомегалией, увеличением определенного типа иммуноглобулинов в крови (IgM, антитела против малярии), и количеством лимфоцитов синусоидах печени. Биопсии печени и исследование под оптическим микроскопом позволит поставить правильный диагноз. Симптомы:
- рези в животе,
- наличие пальпируемого опухолевидного образования в брюшной полости,
- сильные боли в животе (периспленит: воспаление тканей, окружающих селезенку),
- анемия,
- лабораторные анализы не показывают наличия паразитов в крови.
Периодические инфекции: Осложнения: высокая смертность, пролиферация лимфоцитов с появлением злокачественной лимфопролиферативной болезни, которая может развиваться у лиц с резистентностью к лечения малярии.
Защита хозяина
Иммунитет
После нескольких лет повторных инфекций, хозяин Plasmodium может выработать так называемый нестерильный иммунитет (ослабление симптомов заболевания, что защищает от последующего тяжелого заражения). Существует большая вариабельность в ответах на малярийную инфекцию среди лиц, проживающих в эндемичных районах. В районах с высоким процентом заражения, большинство доля детей часто являются носителями P. falciparum, не демонстрируя при этом каких-либо симптомов; такой иммунитет называется клиническим. С возрастом и при наличии последовательных контактов, человек постепенно приобретает нестерильный иммунитет, который использует механизмы устойчивости к инфекции, включая метаболизм и экскрецию белков «интерферонов», в частности, в печени, которые играют важную роль в борьбе иммунитета с паразитами. Речь идёт о толерантности к инфекции или анти-паразитарном иммунитете. Одна из гипотез состоит в том, что для роста плазмодия требуется железо; дефицит железа в связи с первоначальной инфекцией обеспечит относительную защиту и поможет избежать «суперинфекции»38). Часто говорят, что этот иммунитет не является стерильным, потому что он не связан с полным исчезновением паразитов P. falciparum в отсутствие лечения. Также считается, что этот иммунитет является лабильным, потому что нестерильный иммунитет исчезает в отсутствие частого контакта с паразитом (через 12-24 месяца, если объект покидает эндемичную область) и у беременных женщин. Кроме того, иммунитет против P. falciparum весьма специфичен для паразита или его штаммов. Особенности иммунного ответа против малярии могут вызвать трудности при разработке вакцины.
Генетические факторы
Генетические факторы также могут выступать в качестве средства для защиты против малярии. Большинство из описанных факторов связаны с эритроцитами. Примеры:
- Серповидноклеточная болезнь или серповидно-клеточная анемия: изменение в бета цепи гемоглобина, которое вызывает деформацию эритроцитов, тем самым производя гетерозиготы, которые способны лучше защищать оранизм против малярии. Эритроциты деформируются, а гемоглобин кристаллизуется, что предотвращает введение паразита в эритроциты. Это изменение, однако, приводит к плохой оксигенации органов (удлиненные эритроциты не могут пройти через капилляры или барьер в виде фильтра селезенки, где они разрушаются) и, следовательно, к серьезным осложнениям, включая смерть для гомозиготы (HbS/HbS). Распространенность серповидно-клеточной анемии (HbA/HbS) высока у африканских популяций, подвергшихся сильному влиянию малярии.
- Талассемия или наследственная анемия: субъект, несущий ген SS, в результате изменения скорости синтеза цепей глобина, имеет плохую циркуляцию крови и постоянно чувствует усталость.
- Генетический дефицит Г6ФД (глюкозодегидрогеназы-6-фосфата), антиоксидантного фермента, защищающего от воздействия окислительного стресса в красных кровяных клетках, обеспечивает повышенную защиту от тяжелой малярии.
- Человеческий лейкоцинтарный антиген связан с низким риском развития тяжелой малярии. Молекула главного комплекса гистосовместимости класса I представлена в печени и является антигеном Т-клеток (поскольку находится в тимусе) против стадии спорозоитов. Этот антиген, кодируемый IL-4 (интерлейкином-4) и производимый Т-клетками (тимус), способствует пролиферации и дифференцировке клеток, продуцирующих антитела B. Исследование народа Фульбе из Буркина-Фасо, которые имеют меньше двух приступов малярии и более высокий уровень противомалярийных антител, чем у соседних этнических групп, показало, что аллель IL4-524 Т была связана с повышенным уровнем антител против малярии и устойчивостью к малярии.
Лечение
В эндемичных районах, методы лечения часто являются неудовлетворительными и общий уровень смертности от всех случаев малярии в среднем составляет один к десяти. Массовое использование устаревших методов лечения, подделка лекарств и плохой анамнез – вот основные причины плохой клинической оценки.
Устаревшие методы лечения
Эндопаразит можно побороть с помощью различных молекул, целебных процедур или профилактики. Эти методы являются более или менее эффективным в зависимости от региона и уровня приобретенной резистентности, потому что, как и ДДТ (наиболее часто используемый инсектицид в 1960х годах), лекарства, эффективный тридцать лет назад, такие как хлорохин, не являются эффективными сегодня. Тем не менее, эти устаревшие препараты по-прежнему массово используется в некоторых странах, где распространена малярия. Страны третьего мира не имеют средств, достаточных для использования более дорогих методов лечения, таких, как АКП (артемизинин-комбинированная терапия). В течение долгого времени, лечение малярии осуществлялось с использованием хлорохина, хинина и СП (сульфадоксин-пириметамина), и, в меньшей степени, мефлохина, доксициклина и амодиахина. Эти молекулы были очень эффективны против малярийных паразитов без рецепта, но их неконтролируемое использование способствовало появлению резистентных штаммов. По данным ВОЗ, лечение является эффективным, если коэффициент неудачи меньше 5%; если он превышает 25%, следует изменить протокол лечения. Хлорохин уже давно является приоритетным методом лечения малярии. Питаясь гемоглобином, паразит делит его на аминокислоты, которые высвобождают молекулы гема в гемоглобине, токсичные для паразита и которые он преобразует и сохраняет в своей вакуоли в форме инертных кристаллов. Хлорохин входит в зараженную клетку и прекращает защитную трансформацию гема в инертных кристаллах, осуществляя токсичное накопление железа. Паразит, таким образом, уничтожается при помощи его собственных отходов. Это препарат имеет много преимуществ, в том числе – низкую стоимость и отсутствие побочных эффектов. На сегодняшний день, методы лечения на основе хлорохина являются неэффективными в более 25% случаев в странах к югу от Сахары, пострадавших от малярии. Однако, этот препарат по-прежнему используется. Эта резистентность обусловлена мутантным аллелем PfCRT (хлорохиновый транспортер резистентности Plasmodium falciparum) K76T. Эта мутация вытягивает хлорохин из инфицированной клетки, но, тем не менее, способствует ухудшению адаптации паразита к окружающей среде. Малави – это первая африканская страна, в которой, начиная с 1993 года, отказались от использования хлорохина, что привело к рецидиву высоко чувствительных штаммов, которые сформировали большинство. В регионах, где хлорохин более не является эффективным, используют препарат «второй линии лечения» - СП (например, Fansidar производства Roche). Эта молекула способна преодолевать резистентность к хлорохину. Для появления резистентных штаммов потребовалось всего пять лет. Затем применялись «препараты третьей линии»: хинин, перорально в легких случаях или инфузионно в острых случаях. Но эти процедуры также сталкиваются с новыми видами резистентности паразита.
АКП
Комбинированная терапия на основе артемизинина (АКП), является методом лечения и третичной профилактикой в случаях неосложненной малярии. Используется сочетание двух молекул: одна молекула является полусинтетическим производным артемизинина, а вторая – синтетической молекулой, служащей для усиления эффекта первой молекулы и для сдерживания начала резистентности, что приводит к улучшению исхода болезни. С 2001 года, после проведения III фазы клинических испытаний первой в истории АКП, она стала единственным рекомендованным ВОЗ методом лечения этой болезни. Препараты АКП выпускается в довольно небольших количествах и стоят дороже, чем хлорохин. Лечение хлорохином или СП в настоящее время стоит от 0,2 до 0,5 долларов, в то время как стоимость лечения АКП колеблется между 1,2 и 2,4 долларами, то есть оно в пять-шесть раз дороже. Для многих пациентов, эта разница равноценна цене выживания. АКП в силах позволить себе только несколько человек в Африке. Производство в большем масштабе и финансовая помощь от богатых стран может существенно снизить производственные затраты на создание АКП.
Направления исследований
В настоящее время изучаются новые способы лечения малярии с применением пептидов и новых химических соединений. Спироиндолоны – это новый класс исследуемых препаратов против малярии. Cipargamine (NITD609) – это экспериментальный препарат из этого класса, эффективный при пероральном введении39).
Поддельные лекарства
Предположительно, поддельные противомалярийные лекарства циркулируют в Таиланде, Вьетнаме, Китае и Камбодже; они являются одной из основных причин смертности, которая считается предотвратимой. В августе 2007 года, китайская фармацевтическая компания Holley-Cotec фармацевтическая компания была вынуждена отозвать двадцать тысяч доз препарата артемизинина DUO-COTECXIN в Кении из-за подделки этого лекарства в Азии, содержащий очень мало активных ингредиентов и циркулирующей на рынке по цене в пять раз меньше других препаратов. Не существует простого способа для того, чтобы отличить подделку от реального лекарства без использования лабораторного анализа. Фармацевтические компании пытаются бороться с подделками лекарств с помощью новых технологий для обеспечения защиты своего продукта.
Профилактика
Методы, используемые для предотвращения распространения заболевания и для защиты жителей эндемичных районов, включают профилактику с использованием лекарств, истребление комаров и предотвращение укусов комаров. Поскольку малярия может длительное время существовать в одном месте, она связана с сочетанием нескольких факторов: высокая плотность населения и высокая скорость передачи заболевания от человека к комарам и наоборот. При снижении влияния любого из этих факторов, паразит, в конечном итоге, исчезает, как произошло в Северной Америке и Европе. И наоборот, паразит может вновь попасть в регион и выжить, при соблюдении вышеперечисленных факторов. В настоящее время не существует вакцины против малярии, однако исследования, занимающиеся поиском вакцины, осуществляются очень активно. Некоторые исследователи утверждают, что с финансовой точки зрения профилактика малярии является более эффективной, чем лечение в длительной перспективе; однако стоимость профилактики лишком высока для бедных слоёв населения. Экономист Джеффри Сакс считает, что малярию можно контролировать при затратах в три миллиарда долларов США в год. Для достижения Целей развития тысячелетия, деньги, в настоящее время выделяемые на борьбу со СПИДом, должны быть переведены на профилактику малярии. В некоторых странах, таких как Бразилия, Эритрее, Индии и Вьетнам, удалось снизить негативное воздействие малярии. Анализ проводимых в этих странах программ показывает, что для борьбы с болезнью были объединены многие факторы, включая финансирование, деятельность государства и неправительственных организаций и конкретные действия социальных работников.
Меры для борьбы с комарами или защиты от комаров
 Существует несколько способов борьбы с переносчиком малярии (самкой малярийного комара Anopheles), которые могут быть эффективными при правильной реализации.
Реальной проблемой профилактики малярии является очень высокая стоимость лечения. Профилактика может быть эффективна для путешественников, однако основными жертвами этой болезни являются жители развивающихся стран. Примером может служить остров Реюньон, где, как и на других островах региона (Мадагаскар и Маврикий) свирепствовала малярия. Остров Реюньон был французской колонией, благодаря чему проблемы высокой стоимости не существовало, из-за чего малярию можно было искоренить с острова без особых трудностей.
В странах, где распространена малярия, применяются два метода профилактики. Они направлены, во-первых, на защиту людей от укусов комаров и, во-вторых, на устранение комаров при помощи различных средств. Основная цель профилактики заключается в ограничении количества комаров-переносчиков болезни.
В 1960х годах основным методом, используемым для искоренения самок малярийного комара, заключался в массовом использовании инсектицидов. Наиболее часто применяли ДДТ (дихлор-дифенил-трихлорэтан). Этот подход во многих регионах был эффективным, и в некоторых областях удалось полностью ликвидировать малярию. Интенсивное использование ДДТ благоприятствовало селекции резистентных к нему комаров. Кроме того, ДДТ может вызвать отравления и болезни у человека, как случилось в Индии, где вещество неправильно применялось в сельском хозяйстве.
Несмотря на то, что этот продукт был полностью запрещен для использования в Европе с 1972 года, и на то, что с 1992 года он классифицируется ВОЗ в качестве СОЗ (стойкий органический загрязнитель), похоже на то, что сама ВОЗ готова пересмотреть свою позицию и снова начать рекомендовать использование этого пестицида (специально для борьбы против малярии внутри зданий). Тем не менее, без сомнения, ДДТ:
Существует несколько способов борьбы с переносчиком малярии (самкой малярийного комара Anopheles), которые могут быть эффективными при правильной реализации.
Реальной проблемой профилактики малярии является очень высокая стоимость лечения. Профилактика может быть эффективна для путешественников, однако основными жертвами этой болезни являются жители развивающихся стран. Примером может служить остров Реюньон, где, как и на других островах региона (Мадагаскар и Маврикий) свирепствовала малярия. Остров Реюньон был французской колонией, благодаря чему проблемы высокой стоимости не существовало, из-за чего малярию можно было искоренить с острова без особых трудностей.
В странах, где распространена малярия, применяются два метода профилактики. Они направлены, во-первых, на защиту людей от укусов комаров и, во-вторых, на устранение комаров при помощи различных средств. Основная цель профилактики заключается в ограничении количества комаров-переносчиков болезни.
В 1960х годах основным методом, используемым для искоренения самок малярийного комара, заключался в массовом использовании инсектицидов. Наиболее часто применяли ДДТ (дихлор-дифенил-трихлорэтан). Этот подход во многих регионах был эффективным, и в некоторых областях удалось полностью ликвидировать малярию. Интенсивное использование ДДТ благоприятствовало селекции резистентных к нему комаров. Кроме того, ДДТ может вызвать отравления и болезни у человека, как случилось в Индии, где вещество неправильно применялось в сельском хозяйстве.
Несмотря на то, что этот продукт был полностью запрещен для использования в Европе с 1972 года, и на то, что с 1992 года он классифицируется ВОЗ в качестве СОЗ (стойкий органический загрязнитель), похоже на то, что сама ВОЗ готова пересмотреть свою позицию и снова начать рекомендовать использование этого пестицида (специально для борьбы против малярии внутри зданий). Тем не менее, без сомнения, ДДТ:
- стойкое вещество: период его полураспада составляет пятнадцать лет, то есть, при распылении 10 кг ДДТ в поле, пятнадцать лет спустя останется 5 кг, через 30 лет – 2,5 кг и так далее;
- дисперсионное вещество: было обнаружено в арктических снегах;
- накапливается в окружающей среде: животные, поглощающие его, не умирают, но и не устраняют его. Вещество хранится в жировых тканях животного, и в особо высоких концентрациях – у животных на вершине пищевой цепи. Кроме того, его токсичность является спорным вопросом, потому что прием 35 г ДДТ может быть смертельным для человека весом 70 кг.
С целью замены ДДТ, который считается опасным и всё менее эффективным, создаются новые способы борьбы с переносчиком малярии40):
- осушение болот (без нарушения экологической системы), осушение стоячих вод, в которых развиваются личинки Anopheles;
- борьба с личинками, связанная с распространением бензина или растительного масла, а также широкое использование растворимых инсектицидов на поверхности стоячей воды, для того, чтобы попытаться ограничить или предотвратить рождений личинок Anopheles. Эти меры являются достаточно сомнительными, поскольку наносят урон окружающей среде;
- рассеивание в воде хищников, поедающих личинки Anopheles личинки, таких как некоторые моллюски и рыбы (тилапия, гуппи, гамбузия);
- защита и повторное введение некоторых видов насекомоядных летучих мышей в тех регионах, где они исчезли (летучая мышь за одну ночь может проглотить количество насекомых, составляющее почти половину от её веса)192;
- направления, связанные с последовательностью генома комара. Геном обеспечивает, среди прочего, каталог генов детоксикации и мутантных генов, которые кодируют белки, направленные на инсектициды в качестве изменения отдельных нуклеотидов под названием «нуклеотидные полиморфизмы» в геноме:
- o использование инсектицидови репеллентов, направленных только против малярийного комара,
- o рапространение стерильных самцов малярийного комара в природе,
- o генетическое воздействие на комаров-переносчиков или, в будущем времени, передача с вакцинами, блокирующими передачу вируса, антител, предотвращающих созревание полноценного паразита малярийного комара.
Эти меры могут быть эффективными только на ограниченной территории. Их очень трудно применить в масштабах континента, такого как Африка. Каждый человек в отдельности может избежать укусов малярийного комара при использовании механических, физических и химических средств; прежде всего следует помнить, что Anopheles активен в ночное время суток:
- устновка москитных сеток (с ячейками по 1,5 мм), пропитанных перметрином или пиретроидными соединениями. Все чаще эти сети доступны по очень разумным ценам (до $1,70) или же отпускаются бесплатно людям из эндемичных районов. Эти сети являются эффективными в течение 3-5 лет, в зависимости от модели и условий использования;
- установка москитных сеток на окнах;
- использование инсектицидов (пиретроиды, ДДТ…) в мелком масштабе для распыления в домах (спальнях);
- установка устройства для кондиционирования воздуха в жилых домах, чтобы снизить температуру и обеспечить циркуляцию воздуха (комар ненавидит движения воздуха, которые нарушают его движения и сенсорную способность);
- после захода солнца: свободная, длинная одежда светлых цветов и воздержание от алкоголя (малярийный комар любит темные цвета, особенно черный, и алкогольные пары);
- применения крема-репеллента на коже или одежде во время заката. Среди всех синтетических репеллентов, наиболее эффективными являются те, что содержат ДЭТА (N, N-диэтил-м-толуамид). Диэтилтолуамид не убивает насекомых, но его пары препятствуют желанию комара атаковать человека.
Как правило, продукты, содержащие ДЭТА в концентрации от 25 до 30%, являются наиболее эффективными на более длительный период (± 8 часов против ползающих насекомых и от 3 до 5 часов против Anopheles). Они также считаются безопасными для взрослых и детей старше двух лет, если концентрация не превышает 10%. ДЭТА не следует применять беременным женщинам и детям в возрасте до трех месяцев. Продукты с концентрацией более 30%, не утверждены. Коммерческие продукты наносят на кожу, одежду или москитные сетки. Однако, их следует с осторожностью применять на пластмассах, некоторых синтетических тканях, такие как нейлон, резина, кожа, и окрашенные или лакированные поверхности, поскольку они могут испортить их поверхность. Также следует остерегаться прямого попадания этих веществ в глаза и приёма внутрь. Аппликаторы, оснащенные шариком, являются более предпочтительными. Чрескожная абсорбция составляет 50% за шесть часов и устраняется через мочу. Неудаленная часть (30%) сохраняется в коже и жире.
Репелленты
Исследования показали, что репелленты, содержащие эвкалипт, содержащие натуральное масло эвкалиптола, является эффективной нетоксичный альтернативой ДЭТА. Кроме того, такие растения, как лимонная мята, также оказались эффективными против комаров. Этноботаническое исследование, проведенное в регионе Килиманджаро (Танзания), показало, что наиболее широко используемыми среди местных жителей репеллентами являются растения из семейства Яснотковые рода Базилик Ocimum kilimandscharicum и lOcimum suave. Исследование по использованию эфирных масел, извлеченных из этих растений, показывает, что защита от укусов некоторых видов малярийных переносчиков возрастает в 83-91% случаев, а его желание сосать кровь – в 71,2 – 92,5% случаев. Икарилин, также известный как КБР 3023, является новым репеллентом из химической семьи пиперидинов, по эффективности сопоставимым с ДЭТА, но оказывающим менее раздражающее воздействие и не растворяющим пластмассы. Вещество было разработано немецкой химической компанией Bayer AG и продается под названием SALTIDIN. Форма SALTIDIN в виде геля, содержащего 20% активного продукта, в настоящее время является лучшим вариантом, доступным на рынке. Однако, до сих пор до конца не известны все возможные побочные эффекты препарата для детей. Испытание различных репеллентов, имеющихся на рынке, установило, что синтетические репелленты, в том числе ДЭТА, являются более эффективными, чем репелленты, в состав которых входят натуральные активные вещества. Не распыляйте репелленты непосредственно на кожу. Пропитывайте ими одежду или москитные сети. Используйте их с осторожностью, старайтесь избежать раздражения слизистой оболочки носа или проглатывания. Срок действия репеллентов составляет около 6 месяцев (меньше – при использовании на одежде, поскольку она постоянно испытывает воздействие трения, дождя и т.д.). Повторное использование репеллента проводится после обработки вещи с мылом. Внимание: Не носите одежду, пропитанную перметрином, на коже, которая ранее была обработана ДЭТА.
Беременные женщины
Последний способ применяется у беременных женщин, и предназначается для предотвращения проблем, связанных с беременностью, таких как преждевременные схватки, а также рождение детей с низким весом (особенно у первородящих) и многих болезней, таких как малярия плаценты (врожденная инфекция, напрямую связанная с количеством паразитов в плаценте), тяжелая анемия и пороки развития у ребёнка. Для предотвращения серьезных осложнений, реализуется комплексный уход, включающий предотвращение заражения малярией и охрану здоровья. Эти действия направлены на ограничение инфекций, поскольку инфекции могут быть связаны с очень серьезными последствиями для ребенка и для матери. Уход включает в себя использование обработанных инсектицидами противомоскитных сеток и использование противомалярийных препаратов, либо в качестве первичной профилактики, или же в качестве периодического лечения. Применение беременными женщинами поливитаминов (В, С и Е), железа и фолиевой кислоты (в соответствии с ВОЗ, ЮНИСЕФ и с исследованием университета Джонса Хопкинса) в дозах, превышающих ежедневную норму, может также быть эффективной защитой от инфекций. Ранее проведенное исследование показывает, что витамин А может быть вреден для них, а цинк не приносит никакой пользы, помимо того, что он может помогать предотвратить диарею. К минусам, было неоднократно доказано, что периодическое применение беременными женщинами СП (сульфадоксин-пириметамин) один раз во втором квартале и один раз в третьем квартале снижает риск анемии у матерей, плацентарной паразитемии и недостаточного веса при рождении, а также то, что систематическое применение СП у детей в возрасте 2, 3 и 9 месяцев, в ходе вакцинации, на 60% снижает количество эпизодов клинической малярии и на 50% - риск эпизодов злокачественной анемии. Было доказано, что в эндемичных районах, эффективная профилактика малярии во время беременности может снизить риск аномалий, таких как низкий вес при рождении или тяжелая материнская анемия (снижение концентрации гемоглобина в крови ниже 0,13 г / мл у мужчин и 0,12 г / мл у женщин). Применение этих нескольких правил является достаточным для того, чтобы значительно снизить количество людей, пострадавших от этого заболевания, и, следовательно, число жертв, однако нехватка ресурсов затрудняет их применение. Многие жители не имеют средств даже для того, чтобы купить москитные сетки, которые могут уменьшить риск инфицирования.
Профилактика
Для предотвращения заражения туристов, посещающих страны, где распространена малярия, исследователи разработали профилактическую технику. Этот метод предполагает использование терапевтического арсенала профилактических препаратов (хлорохин, прогуанил, пириметамин-дапсон, в таких сочетаниях, как атовакуон-прогуанил, хлорохин-прогуанил гидрохлорид, мефлокин и доксициклин), чтобы предотвратить инфекцию в случае проникновения паразита в организм. Очень опасно проникать в зону интенсивной передачи малярии без регулярного профилактического лечения, особенно это касается детей и беременных женщин. Но из-за увеличения резистентности паразита к препаратам и собственных побочных эффектов различных веществ, становится все труднее установить руководящие принципы химиопрофилактики. Перед посещением стран, входящих в зону риска, турист должен проконсультироваться со своим врачом по поводу потенциальных эффектов противомалярийных препаратов. И было бы желательно знать национальные и международные руководящие принципы химиопрофилактики. Противомалярийные препараты не гарантируют абсолютную защиту от инфекции, поэтому также важно защитить себя от укусов комаров (противомоскитные сетки, репелленты), потому что, даже при осуществлении соответствующего профилактического лечения, возможно развитие малярии с поздним началом. В Бельгии, ежегодно наблюдаются случаи смерти от малярии среди туристов, возвращающихся в страну.
Профилактические схемы
По состоянию на 9 марта 2006 года, профилактика от малярии проводится на трех уровнях, классифицированных по уровню химиорезистентности. Каждая страна классифицируется по группе риска. До начала путешествия следует проконсультироваться с врачом.
Страны группы 0
Зоны, в которых отсутствует малярия: химиопрофилактика не нужна.
- ФАфрика: Лесото, Ливия, Марокко, Реюньон, Остров Святой Елены, Сейшельские Острова и Тунис;
- Америка: все города, Антигуа и Барбуда, Нидерландские Антильские острова, Багамские острова, Барбадос, Бермудские острова, Канада, Чили, Куба, Доминика, Соединенные Штаты, Гренада, Каймановы Острова, Фолклендские острова, Виргинские острова, Ямайка, Мартиника, Пуэрто-Рико, Сент-Люсия, Тринидад, Тобаго, Уругвай;
- Азия: все города, Бруней, Грузия, Гуам, Гонконг, Остров Рождества, Острова Кука, Япония, Казахстан, Кыргызстан, Макао, Мальдивы, Монголия, Туркменистан, Сингапур и Тайвань;
- Европа: все страны, включая Армению, Азорские острова, Канарские острова, Кипр, Россия, страны Балтии, Украину, Беларусь и европейская Турция;
- Ближний Восток: все города, Бахрейн, Израиль, Иордания, Кувейт, Ливан и Катар ;
- Океания: все города, Австралия, Фиджи, Гавайи, Марианские острова, Маршалловы острова, Микронезия, Новая Каледония, Новая Зеландия, остров Пасхи, Французская Полинезия, Самоа, Тувалу, Тонга.
Особый случай – районы с низкой передачей малярии Учитывая слабость передачи в этих странах, допустимо не предпринимать меры химиопрофилактики, независимо от продолжительности пребывания. Тем не менее, важно иметь возможность, в течение нескольких месяцев после возвращения, незамедлительно обратиться за медицинской помощью в случае лихорадки. Африка: Алжир, Кабо-Верде, Египет, Эритрея и Маврикий;
- Азия: Азербайджан, Северная Корея, Южная Корея и Узбекистан;
- Ближний Восток: Объединенные Арабские Эмираты, Оман, Сирия и Турция.
При посещении остальных стран необходимо использовать химиопрофилактику, адаптированную к области посещения.
Страны группы 1
Зоны без хлорохина: 100 мг хлорохина: одна таблетка каждый день (также можно принимать по 300 мг два раза в неделю) для человека весом 50 кг (с осторожностью у пациентов с эпилепсией, потому что вещество может привести к нарушению зрения или слепоте при длительном применении).
Страны группы 2
Зоны резистентности к хлорохину: 100 мг хлорохина (одна таблетка каждый день) и 100 мг прогуанила (две таблетки каждый день). Хлорохин и прогуанил принимают во время еды, в один прием или по половине дозы утром и вечером, начиная за неделю до отъезда и на протяжении до одного месяца после возвращения для человека весом 50 кг. Атовакуон-прогуанил можно рекомендовать в качестве альтернативы хлорохин-прогуанилу.
Страны группы 3
Зоны повышенной резистентности к хлорохину или мультирезистентности. Доксициклин199 (основное активное вещество) одна таблетка 100 мг в день, за один день до вылета (двойная доза в первый день) и до 28 дней после возвращения или после выезда из эндемичной области (принимать с большим количеством жидкости или во время еды). Дозы для детей старше восьми лет делят надвое. Доксициклин можно принимать в течение нескольких месяцев, однако препарат может привести к фототоксичности (химической реакции, вызванной чрезмерным присутствием фотореакционноспособного вещества в коже, реагирующего с УФ или видимым светом) и развитию грибковых инфекций на губах и половых органах; не рекомендуется для беременных (проблемы с печенью) или кормящих женщин и детей в возрасте до 8 лет (обратимое замедление роста костей и необратимое пожелтение зубов с повышенным риском кариеса). Это – производное тетрациклина (антибиотик, состоящий из четырех конденсированных колец, способный проникать в эукариотические клетки, которые являются частью Plasmodium), иногда используемое против малярии в сочетании с хинином для экстренного лечения внутривенно. Мефлохин или Лариам 200 (Roche) Состав: 250 мг мефлохина Цена упаковки из восьми таблеток составляет € 34.26 (в Бельгии в 2012 году). Принимать по одной таблетке в неделю, начиная за несколько недель до отъезда и до четырех недель после возвращения. Для установления эффективной концентрации препарата Лариам в крови по прибытии, необходимо начинать его применение за 2-3 недели до вылета. Пациентам, никогда не принимавшим ранее этот продукт, рекомендуется начинать лечение за 2-3 недели до вылета, чтобы обнаружить возможные побочные эффекты (головокружение, бессонница, ночные кошмары, волнение, необъяснимое беспокойство, сердцебиение). Препарат не будет выписан врачом, если будут обнаружены противопоказания (желание забеременеть, первый триместр беременности, эпилепсия, депрессия или нарушение ритма сердца, которое лечится такими препаратами, как бета-блокаторы, антагонисты кальция или дигиталис). Следует продолжать лечение в течение четырех недель после возвращения. В случае хорошей переносимости, Лариам можно принимать в течение нескольких месяцев или даже лет. При длительном проживании в стране (более трех месяцев), химиопрофилактику следует проводить как можно дольше. Путешественникам рекомендуется проконсультироваться с врачом на месте пребывания, чтобы оценить актуальность и пользу/риск химиопрофилактики. В качестве альтернативы мефлокину может быть рекомендован препарат Маларон, смесь атовакуона-прогуанила от GlaxoSmithKline. Состав для взрослых: 250 мг атовакуона + 100 мг гидрохлорида прогуанила Коробка из двенадцати таблеток - € 44.14 (Цены в Бельгии в 2012 году) Состав для детей: 62,5 мг атовакуона + 25 мг прогуанил гидрохлорида Коробка из двенадцати таблеток - € 18.48 (Цены в Бельгии в 2012 году) Одна таблетка в день, за один день до отъезда и в течение до семи дней после возвращения. Если приём препарата начинается только в стране пребывания, его следует продолжать в течение до четырех недель после возвращения. Маларон, как правило, очень хорошо переносится во время короткой поездки. Его можно принимать в течение нескольких месяцев (однако следует учитывать его высокую стоимость). Продолжительность непрерывного применения атовакуона-прогуанила, однако, должна быть ограничена тремя месяцами.










