Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Целиакия
 Целиакия – аутоиммунное расстройство, поражающее, главным образом, тонкий кишечник, которое развивается у генетически предрасположенных людей. Классические симптомы включают желудочно-кишечные проблемы, такие как хронический понос, вздутие живота, нарушение всасывания, потерю аппетита, а среди детей – нарушения роста. Заболевание часто начинается в возрасте от шести месяцев до двух лет. Неклассические симптомы являются наиболее распространенными, особенно у людей старше двух лет. 1) Могут наблюдаться легкие желудочно-кишечные симптомы или они могут вовсе отсутствовать, широкий ряд симптомов, связанных с какой-либо частью тела, или отсутствовать какие-либо очевидные симптомы. Целиакия впервые была описана в детском возрасте, тем не менее, она может развиться в любом возрасте. Целиакия связана с другими аутоиммунными заболеваниями, такими как сахарный диабет 1-го типа и тиреоидит.
Целиакия вызывается реакцией на клейковину, то есть, на различные белки, содержащиеся в пшенице и других зерновых культурах, таких как ячмень и рожь. Умеренные количества овса, не загрязненного другими содержащими клейковину зернами, как правило, хорошо переносятся, но проблемы могут зависеть от типа потребляемого зерна. 2) При воздействии клейковины, аномальный иммунный ответ может привести к образованию нескольких различных аутоантител, которые могут повлиять на целый ряд различных органов. В тонкой кишке, это вызывает воспалительную реакцию и может привести к укорочению ворсинок тонкой кишки (атрофии ворсинок). Это влияет на усвоение питательных веществ и часто приводит к анемии.
Диагноз, как правило, производится с помощью комбинации тестов на антитела в крови и кишечной биопсии, в сочетании со специфическим генетическим тестированием. Диагностика может быть затруднительна. Часто, аутоантитела в крови являются отрицательными 3), и у многих людей наблюдаются лишь незначительные изменения в кишечнике с нормальными ворсинками. Могут наблюдаться серьезные симптомы, и некоторыхпациентов исследуют в течение многих лет, прежде чем может быть поставлен диагноз. Все чаще диагностика делается у людей без симптомов при помощи скрининга. В то время как болезнь вызвана постоянной непереносимостью белков пшеницы, обычно она классифицируются как отличающаяся от других форм аллергии на пшеницу. 4)
Единственным известным эффективным методом лечения является строгая пожизненнаябезглютеновая диета, что приводит к восстановлению слизистой оболочки кишечника, улучшению симптомов, а также снижает риск развития осложнений у большинства людей. При отсутствии лечения, это может привести к раковым заболеваниям, таким как кишечные лимфомы, и небольшому увеличению риска преждевременной смерти. Заболеваемость варьируется в различных регионах мира, от всего лишь 1 человека на 300, до 1 человека на 40, в среднем составляя от 1 на 100 и 1 на 170 человек. В развитых странах, по оценкам, пять из шести случаев (83%) остаются недиагностированными, как правило, из-за неклассических, минимальных жалоб или их отсутствия. Целиакия несколько чаще встречается у женщин, чем у мужчин. Термин «целиакия» происходит от греческого слвоаκοιλιακός (koiliakós, «абдоминальный») и был введен в 19-м веке в переводе текста, считающегося древнегреческим описанием болезни Аретея из Каппадокии. 5)
Целиакия – аутоиммунное расстройство, поражающее, главным образом, тонкий кишечник, которое развивается у генетически предрасположенных людей. Классические симптомы включают желудочно-кишечные проблемы, такие как хронический понос, вздутие живота, нарушение всасывания, потерю аппетита, а среди детей – нарушения роста. Заболевание часто начинается в возрасте от шести месяцев до двух лет. Неклассические симптомы являются наиболее распространенными, особенно у людей старше двух лет. 1) Могут наблюдаться легкие желудочно-кишечные симптомы или они могут вовсе отсутствовать, широкий ряд симптомов, связанных с какой-либо частью тела, или отсутствовать какие-либо очевидные симптомы. Целиакия впервые была описана в детском возрасте, тем не менее, она может развиться в любом возрасте. Целиакия связана с другими аутоиммунными заболеваниями, такими как сахарный диабет 1-го типа и тиреоидит.
Целиакия вызывается реакцией на клейковину, то есть, на различные белки, содержащиеся в пшенице и других зерновых культурах, таких как ячмень и рожь. Умеренные количества овса, не загрязненного другими содержащими клейковину зернами, как правило, хорошо переносятся, но проблемы могут зависеть от типа потребляемого зерна. 2) При воздействии клейковины, аномальный иммунный ответ может привести к образованию нескольких различных аутоантител, которые могут повлиять на целый ряд различных органов. В тонкой кишке, это вызывает воспалительную реакцию и может привести к укорочению ворсинок тонкой кишки (атрофии ворсинок). Это влияет на усвоение питательных веществ и часто приводит к анемии.
Диагноз, как правило, производится с помощью комбинации тестов на антитела в крови и кишечной биопсии, в сочетании со специфическим генетическим тестированием. Диагностика может быть затруднительна. Часто, аутоантитела в крови являются отрицательными 3), и у многих людей наблюдаются лишь незначительные изменения в кишечнике с нормальными ворсинками. Могут наблюдаться серьезные симптомы, и некоторыхпациентов исследуют в течение многих лет, прежде чем может быть поставлен диагноз. Все чаще диагностика делается у людей без симптомов при помощи скрининга. В то время как болезнь вызвана постоянной непереносимостью белков пшеницы, обычно она классифицируются как отличающаяся от других форм аллергии на пшеницу. 4)
Единственным известным эффективным методом лечения является строгая пожизненнаябезглютеновая диета, что приводит к восстановлению слизистой оболочки кишечника, улучшению симптомов, а также снижает риск развития осложнений у большинства людей. При отсутствии лечения, это может привести к раковым заболеваниям, таким как кишечные лимфомы, и небольшому увеличению риска преждевременной смерти. Заболеваемость варьируется в различных регионах мира, от всего лишь 1 человека на 300, до 1 человека на 40, в среднем составляя от 1 на 100 и 1 на 170 человек. В развитых странах, по оценкам, пять из шести случаев (83%) остаются недиагностированными, как правило, из-за неклассических, минимальных жалоб или их отсутствия. Целиакия несколько чаще встречается у женщин, чем у мужчин. Термин «целиакия» происходит от греческого слвоаκοιλιακός (koiliakós, «абдоминальный») и был введен в 19-м веке в переводе текста, считающегося древнегреческим описанием болезни Аретея из Каппадокии. 5)
Признаки и симптомы
Классические симптомы целиакии включают бледный, рыхлый и жирный стул (стеаторея) и потерю веса или неспособность набрать вес (у маленьких детей). Чаще всего симптомы являются мало ощутимыми или в основном происходят не в кишечнике, ав других органах. 6) Кроме того, целиакияможетпроявляться вовсе без каких-либо симптомов. Это заболевание составляет, по меньшей мере, 43% случаев у детей. Многие взрослые с мало ощутимой болезньюдемонстрируют только усталость или анемию.
Желудочно-кишечные симптомы
Диарея, характерная для целиакии (хроническая), бледная, объемная и аномально зловонная. Может присутствовать боль в животе и спазмы, вздутие живота (считается, что это связано с ферментативнымпроизводствомкишечныхгазов), и язвы во рту. При увеличении повреждения кишечника, может развиться непереносимость лактозы. Часто симптомы принимают за синдром раздраженного кишечника (СРК), и только потом признают их в качестве целиакии; небольшой процент людей с симптомами СРК имеют целиакию. Для людей с симптомами СРК рекомендуется проводить скрининг на целиакию. 7) Целиакия приводит к повышенному риску аденокарциномы и лимфомы тонкой кишки (Т-клеточная лимфома, ассоциированная с энтеропатией (ЕАТС) или другие не-Ходжкиновские лимфомы). Этот риск также выше у лиц в первой степени родства, таких как братья и сестры, родители и дети. Не ясно, влияет ли безглютеновая диета на снижение этого риска к исходному уровню. Длительная и невылеченная болезнь может привести к другим осложнениям, таким как язвенное воспаление тощей кишки (образование язвы тонкой кишки) и образование стриктур (сужение в результате рубцевания с обструкцией кишечника). 8)
Связанное с энтеропатией
- Неспособность поглощать углеводы и жиры может привести к потере веса (или задержке роста у детей) и усталости или недостатку энергии.
- Анемия может развиваться несколькими путями: мальабсорбцияжелеза может привести к железодефицитной анемии, а мальабсорбция фолиевой кислоты и витамина B12 может привести к мегалобластной анемии.
- Мальабсорбция кальция и витамина D (и компенсаторный вторичный гиперпаратиреоз) могут привести к остеопении (снижению содержания минеральных веществ в костной ткани) или остеопорозу (ослаблению костной ткани и риску переломов).
- Мальабсорбция селена при целиакии, в сочетании с низким содержанием селена во многих безглютеновых продуктах, связаны с риском дефицита селена.
- Недостаток меди и цинка также были связаны с целиакией.
- Небольшая часть аномальной коагуляции происходит вследствие дефицита витамина K и немного – из-за риска аномалий кровотечения.
Разное
Целиакия была связана с рядом условий. Во многих случаях, остается неясным, является ли заболевание кишечника, индуцированное клейковиной, причинным фактором, или же эти условия имеют общую причину.
- Дефицит IgA присутствует у 2,3% людей с целиакией, и в свою очередь, это условие связано с десятикратнымувеличением риска развития целиакии. Другие особенности этого состояния включают повышенный риск инфекционных заболеваний и аутоиммунных заболеваний.
- Герпетиформный дерматит, связанный с кожнымзудом, связан с ферментомтрансглютаминазы в коже, вызывающим изменения, идентичные таковым при целиакии тонкой кишки, и может реагировать на изъятиеглютена из диеты, даже в случае отсутствия желудочно-кишечных симптомов.
- Недостаток роста и / или задержка полового созревания в позднем детстве может произойти даже без очевидных кишечных симптомов или острого недоедания. Оценка недостатка роста часто включает в себя скрининг на целиакию.
- Осложнения при беременности могут возникнуть в случае целиакии как интеркуррентное заболевание во время беременности, со значительными осложнениями, включая выкидыш, внутриутробное ограничение роста, низкий вес при рождении и преждевременные роды.
- Аномальные тесты функции печени (случайно обнаруженные в анализах крови) могут также наблюдаться.
- Целиакия связана с целым рядом других заболеваний, многие из которых являются аутоиммунными: сахарный диабет типа 1, гипотиреоз, первичный билиарный цирроз печени, микроскопический колит, глютеновая атаксия, псориаз, витилиго, аутоиммунный гепатит, герпетиформный дерматит, первичный склерозирующий холангит, и многое другое.
- Более спорной областью является группа заболеваний, при которых иногда обнаруживаются антиглиадиновые антитела (более старый и неспецифический тест на целиакию), но не может быть продемонстрировано заболевание тонкого кишечника. Иногда эти условия улучшаются путем удаления глютена из рациона. Они включают в себя мозжечковую атаксию, периферическую невропатию, шизофрению и аутизм.
Причина
Целиакия вызвана реакцией на глиадин,проламин (глютеновый белок), содержащийся в пшенице, и другие подобные белки, обнаруженные в посевах Пшенициевых (включающих в себя другие зерна, такие как ячмень и рожь).
Другие зерна
Подвиды пшеницы (например, полба, дурум и Камут) и родственные виды (такие как ячмень, рожь и тритикале) также вызывают симптомы целиакии. Небольшое количество людей с целиакией реагируют также на овес. Токсичность овса у людей с целиакией зависит от культурного сорта овса,потребляемого из-за генов проламина, аминокислотной последовательности белка, и иммунореактивов токсичных проламинов, которые отличаются у разновидностей овса. 11) Кроме того, овсяные продукты часто загрязняются злаками,содержащими клейковину. Чистый овес – овес, незагрязненный клейковиной. Долгосрочные эффекты чистого потребления овса до сих пор неясны, и необходимы дальнейшие исследования для идентифицирования культурных сортов, прежде чем делать окончательные рекомендации по их включению в безглютеновую диету. Людям с целиакией, которые хотят потреблять овес, необходимо более строгое пожизненное наблюдение, включающее, возможно, периодическое проведение биопсии кишечника. Другие зерновые, такие как кукуруза, просо, сорго, тэфф, рис и дикий рис, а также незлаковые, такие как амарант, лебеда и гречиха, являются безопасными для людей с целиакией. Незлаковые богатые углеводами продукты, такие как картофель и бананы, не содержат глютен и не вызывают симптомов 12).
Модификаторы риска
Существуют различные теории относительно того, что определяет развитие целиации у генетически предрасположенных индивидов. Основные теории включают ротавирусные инфекции или кишечный аденовирус человека. Некоторые исследования показывают, что курение защищает от развития целиакииу взрослых. 13) Употребление в пищу глютена в начале жизни ребенка не увеличивает риск целиакии, но более позднее введение через 6 месяцев может увеличить его. Существует неопределенность по поводу того, снижает ли грудное вскармливание риск целиакии. Более длительное грудное вскармливание до введения содержащих клейковину зерен в диету, как представляется, связано с 50% снижением риска развития целиакии в младенческом возрасте; не ясно, сохраняется ли это в зрелом возрасте. Эти факторы могут лишь влиять на сроки начала болезни. Факторы, которые могут вызывать симптомы, включают в себя: операции, беременность, инфекции и эмоциональный стресс.
Патофизиология
Целиакия, по-видимому, является многофакторнымзаболеванием, посколькузаболевание может быть вызвано более чем одним генетическим фактором, и поскольку более чем один фактор необходим для того, чтобы болезнь проявилась у человека. Почти все люди (95%) с целиакией имеют либо вариант аллеля HLA-DQ2 или (реже) HLA-DQ8 аллель. Тем не менее, около 20-30% людей, не имеющих целиакии, унаследовали один из этих аллелей. 14) Это наводит на мысль о том, что для развития целиакии необходимы дополнительные факторы; то есть, предрасполагающийаллель человеческого лейкоцитарного антигена является необходимым, но не достаточным, для развития целиакии. Кроме того, около 5% людей, у которых развивается целиакия, не имеют типичной HLA-DQ2 или HLA-DQ8 аллели.
Генетика
Подавляющее большинство людей с целиакией имеют один из двух типов белка HLA-DQ. HLA-DQ является частью класса II антиген-представляющих рецепторов MHC (также называемых антигеном лейкоцитов человека) и отличает свои и чужие клетки в целях иммунной системы. Две субъединицы белка HLA-DQ кодируются генами HLA-DQA1 и HLA-DQB1, расположенными на коротком плече шестой хромосомы. Существует семь HLA-DQ вариантов (DQ2 и DQ4-DQ9). Более 95% людей с целиакией имеют изоформы DQ2 или DQ8, которые передаются по наследству. Причина того, что эти гены приводят к увеличению риска целиакии, связана с тем, что рецепторы, образованные этими генами, связываются с глиадиновыми пептидами более плотно, чем другие формы антигенпрезентирующего рецептора. Таким образом, эти формы рецепторов могут активировать Т-лимфоциты и инициировать аутоиммунный процесс. Большинство людей, страдающих целиакией, имеют два гена HLA-DQ2 гаплотипа, называемого DQ2.5 гаплотип. Этот гаплотип состоит из двух смежных аллелей гена, DQA1 * 0501 и DQB1 * 0201, которые кодируют две субъединицы, DQа 5 и DQ β2. У большинства человек, этот DQ2.5 изоформ кодируется одним из двух хромосом 6, унаследованных от родителей (DQ2.5cis). Большинство больных целиакией наследуют только одну копию этого DQ2.5 гаплотипа, а некоторые наследуют его от обоих родителей; последние особенно подвержены риску целиакии, а также более восприимчивы к серьезным осложнениям. 15) Некоторые люди наследуют DQ2.5 от одного родителя и дополнительную часть гаплотипа (либо DQB1 * 02 или DQA1 * 05) от другого родителя, увеличивая риск. Реже, некоторые люди наследуют DQA1 * 05 аллель от одного родителя и DQB1 * 02 от другого родителя (DQ2.5trans) (так называемый транс-гаплотипная ассоциация), и эти люди имеют подобный риск целиакии, как и люди с однойDQ2.5 несущей хромосомой 6, но при этом заболевание, как правило, не является семейным. Среди 6% европейцев, больных целиакией, которые не имеют DQ2.5 (цис или транс) или DQ8 (кодируемый гаплотипом DQA1 * 03: DQB1 * 0302), 4% имеют DQ2.2 изоформы, а у остальных 2% отсутствует DQ2 или DQ8. Частота этих генов варьируется географически. DQ2.5 имеет высокую частоту у народов Северной и Западной Европы (Страна Басков и Ирландия с высокой частотой). Болезнь распространена в некоторых частях Африки и Индии, но не наблюдается в западной части Тихого океана. DQ8 имеет более широкое глобальное распространение, чем DQ2.5 и особенно часто встречается в Южной и Центральной Америке; до 90% людей в некоторых индейских популяциях имеют DQ8 и, таким образом, могут отображать глютеновый фенотип. Другие генетические факторы неоднократно сообщались прицелиакии; тем не менее, болезнь имеет переменное географическое признание. Только локусы HLA-DQ демонстрируют последовательное вовлечение в глобальных масштабах. Многие из локусов были обнаружены в связи с другими аутоиммунными заболеваниями. Один локус, LPP,или ген партнер, предпочитаемый липомой, участвует в адгезии внеклеточного матрикса к поверхности клетки, и меньший вариант (SNP = rs1464510) увеличивает риск заболевания примерно на 30%. Этот ген ассоциируется с целиакией (р <10-39) в образцах, взятых из широкой области Европы и США. Распространенность генотипов целиакииу современного населения не до конца понятна. Учитывая особенности заболевания и его очевидную сильную наследуемость, можно было бы ожидать, что генотипы будут проходить негативный отбор и отсутствовать в тех обществах, где сельское хозяйство практиковалось дольше всего (сравните с аналогичным условием, непереносимостью лактозы, которая была отрицательно отобрана так сильно, что его распространенность изменилась с ~ 100% в исконных популяциях до менее чем 5% в некоторых европейских странах). Это ожидание впервые было предложено Симоонсом (1981 г.). К настоящему времени, однако, очевидно, что это не так; напротив, есть свидетельства позитивной селекции в генотипах целиакии. Есть подозрение, что некоторые из них могут обеспечивать защиту от бактериальных инфекций. 16)
Проламины
Большинство белков в пище, ответственные за иммунные реакции при целиакии, являются проламинами. Эти запасные белки богаты пролином (prol-) и глутамином (-amin), которые растворяются в спиртах и устойчивы к протеазам и пептидазам кишечника. Проламины встречаются в зерновых, при этом в различных зернах содержатся различные, но взаимосвязанные проламины: пшеница (глиадин), ячмень (гордеин), рожь (секалин), кукуруза (зеин) и в качестве минорного белка, авенин в овсе. Одна из областей альфа-глиадина стимулирует мембранные клетки, энтероциты, в кишечнике, чтобы обеспечить большее количество молекул вокруг уплотнителя между клетками. Нарушение плотных контактов позволяет пептидам с длиной больше трех аминокислот входить в обращение. 17) Протечка мембраны позволяет пептидам глиадина, которые стимулируют два уровня иммунного ответа, обеспечивать врожденное реагирование и адаптивный (опосредованный Т-хелперами) ответ. Один пептид, устойчивый к протеазам из альфа-глиадина, содержит регион, который стимулирует лимфоциты и приводит к высвобождению интерлейкина-15. Этот врожденный ответ на глиадин приводит к передаче сигналов иммунной системы, которые привлекают воспалительные клетки и увеличивают выпуск воспалительных химических веществ. Самый сильный и наиболее распространенный адаптивный ответ на глиадин направлен на фрагмент α2-глиадина из 33 аминокислот в длину. Реакция на 33мер происходит у большинства лиц, больных целиакией, имеющих DQ2 изоформы. Этот пептид, измененный кишечной трансглютаминазой, имеет высокую плотность перекрытия Т-клеточных эпитопов. Это увеличивает вероятность того, что DQ2 изоформы будут связывать и оставаться связанными с пептидом, когда они признаются Т-клетками. Глиадин пшеницы является наиболее известным членом этой семьи, но есть и другие проламины, и гордеин (из ячменя) и секалин (из ржи) могут способствовать развитию целиакии. 18) Однако, не все проламины будут вызывать эту иммунную реакцию, и продолжается спор о способности авенина (проламина, содержащегося в овсе) вызывать этот ответ при целиакии.
Тканевые трансглютаминазы
Анти-трансглутаминазные антитела к трансглютаминазе фермента ткани (tTG) обнаруживаются в крови большинства людей с классическими симптомами и полной атрофией ворсинок, но только в 70% случаев с частичной атрофией ворсинок и 30% случаев с незначительными повреждениями слизистой оболочки. Тканевая трансглутаминаза изменяет клейковину пептидов в форму, которая может более эффективно стимулировать иммунную систему. Эти пептиды модифицированы tTGдвумя способами, деамидированием или трансамидированием. 19) Деамидирование– это реакция, с помощью которой остаток глутамата образуется путем расщепления эпсилон-аминогруппы боковой цепи глутамина. Переамидирование, которое происходит в три раза чаще, чем деамидирование, представляет собой сшивание остатка глутамина от пептида глиадина с остатком лизина tTgв реакции, которая катализируется трансглютаминазой. Сшивание может происходить как внутри, так и вне активного центра фермента. Последний случай дает постоянно ковалентно связанный комплекс между глиадином и tTg. Это приводит к образованию новых эпитопов, которые, как полагают, вызывают первичный иммунный ответ, посредством которого развиваютсяаутоантитела против tTg. Биопсии от людей с подозрением на целиакию показали, что аутоантитела при субклинической целиакии, были обнаружены до клинического заболевания. Эти антитела были обнаружены также у людей с другими аутоиммунными заболеваниями, анемией или мальабсорбцией значительно чаще, по сравнению с нормальным населением. Эндомизиальные компоненты антител (ЭМА) для tTG, как полагают, должны быть направлены на трансглутаминазыклеточной поверхности, и эти антитела все еще используются при подтверждении диагноза целиакии. Тем не менее, в 2006 году исследование показало, что EMA-отрицательные люди с целиакией, как правило, пожилые мужчины с более тяжелыми симптомами брюшной полости и более низкой частотой «нетипичных» симптомов, в том числе аутоиммунных заболеваний. В этом исследовании, анти-tTGантитела не коррелировали с тяжестью разрушения ворсинок. Эти данные, в сочетании с недавней работой, показывают, что глиадин обладает компонентом врожденного ответа, предполагая, что глиадин может быть более ответственным за первичные проявления целиакии, тогда как tTGявляется более значимым фактором во вторичных эффектах, таких как аллергические реакции и вторичные аутоиммунные заболевания. У большого процента людей с целиакией, анти-tTGантитела также признают ротавирусный белок, называемый VP7. Эти антитела стимулируют пролиферацию моноцитов, и ротавирусная инфекция может объяснить некоторые первые шаги в каскаде пролиферации иммунных клеток. 20) Действительно, более ранние исследования ротавирусных повреждений в кишечнике показали, что это вызывает атрофию ворсинок. Это говорит о том, что вирусные белки могут принимать участие в начальном уплощении и стимулируют само-перекрестно-реактивноепроизводствоанти-VP7. Антитела к VP7 могут также медленное заживать до того, как глиадин-опосредованная tTG презентация не предоставляет второй источник перекрестных антител. Другие кишечные расстройства могут иметь биопсию, которая выглядит как целиакия, включая повреждения, вызванные Candida.
Атрофия ворсинок и мальабсорбция
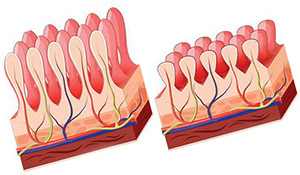 Воспалительный процесс, опосредованный Т-клетками, приводит к нарушению структуры и функции слизистой оболочки тонкой кишки и вызывает мальабсорбцию, так как это снижает способность организма усваивать питательные вещества, минералы и жирорастворимые витамины A, D, Е и К из пищи. Непереносимость лактозы может присутствовать из-за уменьшения поверхности кишечника и сокращения производства лактазы, но это обычно проходит, как толькоболезнь удаетсяизлечить.
Были предложены альтернативные причины этого повреждения тканей, включающиевысвобождение интерлейкина 15 и активацию врожденной иммунной системы более коротким глютеновым пептидом (p31-43 / 49). Это приводит к убийствуэнтероцитов лимфоцитами в эпителии. Атрофия ворсинок на биопсии также может быть связана с не связанными причинами, такими как тропические спру, лямблиоз и радиационный энтерит. В то время как положительная серология и типичная биопсия наводят на мысли оцелиакии, отсутствие реакции на диету может потребовать рассмотрение альтернативных диагнозов.
Воспалительный процесс, опосредованный Т-клетками, приводит к нарушению структуры и функции слизистой оболочки тонкой кишки и вызывает мальабсорбцию, так как это снижает способность организма усваивать питательные вещества, минералы и жирорастворимые витамины A, D, Е и К из пищи. Непереносимость лактозы может присутствовать из-за уменьшения поверхности кишечника и сокращения производства лактазы, но это обычно проходит, как толькоболезнь удаетсяизлечить.
Были предложены альтернативные причины этого повреждения тканей, включающиевысвобождение интерлейкина 15 и активацию врожденной иммунной системы более коротким глютеновым пептидом (p31-43 / 49). Это приводит к убийствуэнтероцитов лимфоцитами в эпителии. Атрофия ворсинок на биопсии также может быть связана с не связанными причинами, такими как тропические спру, лямблиоз и радиационный энтерит. В то время как положительная серология и типичная биопсия наводят на мысли оцелиакии, отсутствие реакции на диету может потребовать рассмотрение альтернативных диагнозов.
Диагноз
Диагностика часто бывает очень затруднительна, так что в большинстве случаев болезнь диагностируется с большим опозданием. Есть несколько тестов, которые могут быть использованы при диагностике. Уровень симптомов может определить порядок проведения тестов, но все тесты теряют свою полезность, если человек уже использует безглютеновую диету. Кишечные повреждения начинают заживать в течение нескольких недель после того, как клейковина удаляется из рациона, и уровни антител снижаются в течение нескольких месяцев. Для тех, кто уже начал безглютеновую диету, может быть необходимо выполнить провокационную пробу, включающую прием содержащей клейковину пищу в один прием в день в течение 6 недель перед повторным исследованием.
Анализы крови
Серологические анализы крови – это исследования первой линии, необходимые для того, чтобы поставить диагноз целиакии. Его чувствительность коррелирует со степенью гистологических повреждений. Люди, которые имеют незначительные повреждения тонкой кишки, могут демонстрировать серонегативные результаты,поэтому много пациентов с целиакией часто упускаются. У больных с атрофией ворсинок, анти-эндомизиальные (EMA) антитела к иммуноглобулину А (IgA) могут обнаружить целиакию с чувствительностью и специфичностью 90% и 99% соответственно. Серологически, анти-трансглутаминазные антитела (анти-tTG),как первоначально сообщалось, имеют более высокую чувствительность (99%) и специфичность (> 90%). Тем не менее, в настоящее время считается, что они имеют сходные характеристики с анти-эндомизиальными антителами. 21) И анти-трансглутаминазные, и анти-эндомизиальные антитела обладают высокой чувствительностью, чтобы диагностировать людей с классическими симптомами и полной атрофией ворсинок, но они встречаются только в 30-89% случаев с частичной атрофией ворсинок и у менее чем 50% людей, которые имеют незначительные повреждения слизистой оболочки двенадцатиперстной кишки (лимфоцитоз) с нормальными ворсинками. Тканевая трансглутаминаза изменяет пептиды клейковины в форму, которая может более эффективно стимулировать иммунную систему. Эти пептиды модифицируютсяtTGдвумя способами, деамидированием или трансамидированием. Современные анти-tTGанализы полагаются на человеческий рекомбинантный белок в качестве антигена. Тестирование tTGдолжно быть проведено в первую очередь, как этот тест является наиболее простым в исполнении. Двусмысленный результат тестирования на tTGдолжен сопровождаться анти-эндомизиальными антителами. Руководства рекомендуют параллельно проверятьобщий уровень сывороточного IgA, так как люди с целиакией с дефицитом IgA могут быть не в состоянии производить антитела, от которых зависят эти тесты («ложноотрицательный результат»). У этих людей, IgG антитела против трансглутаминазы (IgG-TTg) могут быть диагностическим маркером. Если все эти антитела являются отрицательными, то следует определить анти-DGPантитела (антитела против деамидированных глиадиновых пептидов). Анти-DGP антитела класса IgG могут быть полезным маркером у людей с дефицитом IgA. У детей в возрасте до двух лет, анти-DGP антитела являются более полезным маркером, чем анти-эндомизиальные и анти-трансглутаминазные антитела. Из-за основных последствий диагностики целиакии, профессиональные принципы рекомендуют после положительного анализа крови провести эндоскопию / гастроскопию и биопсию. Отрицательный результат теста серологии может все еще сопровождаться рекомендацией для проведения эндоскопии и биопсии двенадцатиперстной кишки, если клиническое подозрение остается на высоком уровне. 22) Исторически,измерялись три других антитела:анти-ретикулин (ARA), анти-глиадин (АГА) и анти-эндомизиальные (EMA) антитела. Тестирование ARA, однако, не является достаточно точным для рутинной диагностики. Серология может быть ненадежной у детей младшего возраста, при этом анти-глиадин является несколько более надежным, чем другие тестыу детей в возрасте до пяти лет. Серологические тесты основаны на непрямой иммунофлюоресценции (ретикулин, глиадинаи эндомизии) или ELISA (глиадин или трансглютаминазы ткани, TTG). Тестирование антител может быть объединено с тестированием HLA, если диагноз неясен. TGA и EMA являются наиболее чувствительными тестамина антитела в сыворотке, но, так как негативный тип HLA-DQ исключает диагноз целиакии, тестирование также для HLA-DQ2 или DQ8 максимизирует чувствительность, и отрицательные результаты расчета прогнозных значений. Тем не менее, широкое использование HLA типирования, чтобы исключить целиакию, не рекомендуется в настоящее время.
Эндоскопия
Верхняя эндоскопия с биопсией двенадцатиперстной кишки (вне луковицы двенадцатиперстной кишки) или тощей кишки выполняется для получения множества выборок (от четырех до восьми) из двенадцатиперстной кишки. Не все регионы могут быть затронуты в равной степени; если биопсия берется из здоровой ткани кишечника, результат будет ложно отрицательным. Даже в том же биопсийном фрагменте, могут присутствовать различные степени повреждения. У большинства людей с целиакией, тонкая кишка будет выглядеть нормально на эндоскопии, прежде чем будут рассмотрены биопсии. Тем не менее, пять результатов были связаны с высокой специфичностью целиакии: вдавления складок тонкой кишки, скудность в складках, мозаичность слизистой оболочки, выраженность подслизистых кровеносных сосудов и узловатость слизистой оболочки. Европейские рекомендации предполагают, что у детей и подростков с симптомами, которые совместимы с целиакией, диагноз может быть сделан без необходимости кишечной биопсии, если титры анти-tTG антител очень высоки (в 10 раз выше верхней границы нормы). До 1970-х годов, биопсии получали с использованием металлических капсул, присоединенных к всасывающему устройству. Капсулу проглатывали и она проникала в тонкий кишечник. После рентгеновской проверки её позиции, применялось всасывание для сбора части кишечной стенки внутри капсулы. Часто использовали такие капсульные системы, как капсула Уотсон и капсула Кросби-Куглера. Этот метод в настоящее время в значительной степени заменен волоконно-оптической эндоскопией, которая является более чувствительной и связана с более низкой частотой ошибок. Капсульная эндоскопия (КЭ) позволяет выявить типичные изменения в слизистых, наблюдаемые при целиакии, но имеет более низкую чувствительность по сравнению с обычной эндоскопией и гистологическим исследованием. Поэтому КЭ не является основным диагностическим инструментом для целиакии. Тем не менее, КЭ может быть использована для диагностики Т-клеточной лимфомы, язвенного еюноилеита и аденокарциномы при резистентной или сложной целиакии. 23)
Патология
Классические патологическиеизменения прицелиакии в тонкой кишке разделяются по классификации Марша: 24)
- Стадия 0: нормальная слизистая оболочка
- Стадия 1: увеличение числа интраэпителиальных лимфоцитов (IELS), как правило, превышающее 20 на 100 энтероцитов
- Стадия 2: распространение криптыЛиберкюна
- Стадия 3: частичная или полная атрофия ворсинок и гипертрофия крипт
- Стадия4: гипоплазияархитектуры тонкой кишки
Классификация Марша, введенная в 1992 году, была изменена в 1999 году,и было введено шесть этапов, при этом предыдущий этап 3 был разбит на три подэтапа. Дальнейшие исследования показали, что эта система не всегда надежна и что изменения, наблюдаемые при целиакии, могут быть описаны в одном из трех этапов:
- А означает лимфоцитарную инфильтрацию с нормальными ворсинками;
- В1 описывает частичную атрофию ворсинок;
- В2 описывает полную атрофию ворсинок.
Изменения классически улучшаются или исчезают после того, как глютен удаляется из рациона. Тем не менее, многие руководства не рекомендуют проводить повторную биопсию, если нет никакого улучшения симптомов после введения диеты. В некоторых случаях, преднамеренное применение глютена, а затем – проведение биопсии, могут подтвердить или опровергнуть диагноз. Нормальная биопсия и нормальная серология после заражения указывает на то, что диагноз может быть неправильным. При необработанной целиакии, атрофия ворсинок чаще встречается у детей в возрасте до трех лет, но у детей старшего возраста и взрослых обычно обнаруживаются незначительные кишечные поражения (лимфоцитоз двенадцатиперстной кишки) с нормальными кишечными ворсинками.
Другие диагностические тесты
На момент постановки диагноза, могут быть проведены дальнейшие исследования, чтобы выявить осложнения, такие как дефицит железа (полный анализ крови и исследования железа), дефицит фолиевой кислоты и витамина B12 и гипокальциемия (низкие уровни кальция, часто из-за снижения уровня витамина D). В ходе анализов крови могут быть исследованы функции щитовидной железы, чтобы определить гипотиреоз, который чаще встречается у людей с целиакией. Остеопения и остеопороз, мягко и сильно сниженная минеральная плотность костной ткани, часто присутствуют у людей с целиакией. Исследования для измерения плотности костной ткани могут быть выполнены на момент постановки диагноза, например,путем сканирования двухэнергетической рентгеновской абсорбциометрии (DXA), чтобы определить риск разрушения и потребность в лечении для защиты костей.
Отмена клейковины
Хотя тесты на антитела в крови, биопсия, и генетические тесты, как правило, обеспечивают четкий диагноз, иногда реакция на отмену глютена при безглютеновой диете необходима для подтверждения диагноза. В настоящее время,проведение теста на выявление чувствительности к глютену больше не требуется для подтверждения диагноза у пациентов с кишечными повреждениями, совместимыми с целиакией и положительным ответом на безглютеновую диету. Тем не менее, в некоторых случаях, такой тест с последующей биопсией может быть полезен для подтверждения диагноза, например, у людей с высоким подозрением на целиакию, без подтверждения биопсии, которое имеют отрицательные антитела в крови и уже находятся на безглютеновой диете. Тест на выявление чувствительности к глютенуне рекомендуется детям в возрасте до 5 лет и во время пубертатного роста. 25) Альтернативный диагнознецелиакическойглютеновойчувствительностиможет быть поставлен, когда есть только симптоматическое свидетельство чувствительности к клейковине. Желудочно-кишечные и внекишечные симптомы у людей с нецелиакической чувствительностью к клейковине могут быть аналогичны симптомам целиакии, и улучшаются, когда глютен удаляется из рациона, после того, как целиакия и аллергия на пшеницу были обоснованно исключены. Необходима тщательная интерпретация симптоматического ответа, так как отсутствие ответа у человека с целиакией может быть связано с продолжающимся приемом небольших количеств глютена, добровольным или непреднамеренным, или же может быть следствием других обычно связанных условий, таких как избыточный бактериальный рост в тонком кишечнике, непереносимость лактозы, фруктозы, сахарозы, и мальабсорбция сорбита и экзокринная недостаточность поджелудочной железы, 26) среди других. При необработанной целиакии, они часто являются переходными условиями, связанными с повреждениями кишечника. Как правило, они возвращаются в норму или улучшаются через несколько месяцев после начала безглютеновой диеты, но могут потребоваться временные вмешательства, такие как прием добавок с ферментами поджелудочной железы, диетические ограничения пищевых продуктов, содержащих лактозу, фруктозу, сахарозу или сорбит, или лечение пероральными антибиотиками в случае избыточного бактериального роста. Помимо отмены глютена, некоторым людям следует придерживаться диеты с низким содержаниемFODMAPs(ферментируемые олиго-, ди-и моносахариды и многоатомные спирты)или избегать потребления коммерческих безглютеновых продуктов, которые обычно содержат большое количество консервантов и добавок (таких как сульфиты, глутаматы, нитраты и бензоаты) и которые могут играть определенную роль в инициировании функциональных желудочно-кишечных симптомов. 27)
Скрининг
 Существует дискуссия относительно преимуществ скрининга. Некоторые исследования предполагают, что раннее обнаружение может уменьшить риск развития остеопороза и анемии. В отличие от этого, групповое исследование предположило, что люди с необнаруженной целиакией имели положительный профиль риска сердечно-сосудистых заболеваний (меньше лишнего веса, снижение уровня холестерина). Существуют ограниченные свидетельства того, что выявленные при скрининге случаи полезны при диагностике с точки зрения заболеваемости и смертности; следовательно, скрининг на уровне общего населения в настоящее время не считается полезным.
В Соединенном Королевстве, Национальный институт здравоохранения и клинического мастерства (NICE) рекомендует проводить скрининг нацелиакию у людей с недавно диагностированным синдромом хронической усталости и синдромом раздраженного кишечника, а также с диабетом 1 типа, особенно у людей с недостаточной прибавкой в весе или необъяснимой потерей веса. Кроме того, скрининг также рекомендуется при аутоиммунных заболеваниях щитовидной железы, герпетиформном дерматите, а также родственникам первой степени родства пациентов с подтвержденной целиакией.
В 2016 году, Целевая профилактическая группа США обнаружила достаточное количество доказательств пользы или вреда от скрининга людей в любом возрасте, которые не имеют симптомов.
Серология была предложена в качестве методадля скрининга, поскольку наличие антител может обнаружить некоторые ранее недиагностированные случаицелиакии и предотвратить его осложнения у этих людей. Тем не менее, серологические тесты имеют высокую чувствительность только у людей с полной атрофией ворсинок и имеют очень низкую способность выявлять случаи с частичной атрофией ворсинок или незначительными кишечными поражениями. Тестирование на целиакию может быть предложено людям со связанными условиями.
Существует дискуссия относительно преимуществ скрининга. Некоторые исследования предполагают, что раннее обнаружение может уменьшить риск развития остеопороза и анемии. В отличие от этого, групповое исследование предположило, что люди с необнаруженной целиакией имели положительный профиль риска сердечно-сосудистых заболеваний (меньше лишнего веса, снижение уровня холестерина). Существуют ограниченные свидетельства того, что выявленные при скрининге случаи полезны при диагностике с точки зрения заболеваемости и смертности; следовательно, скрининг на уровне общего населения в настоящее время не считается полезным.
В Соединенном Королевстве, Национальный институт здравоохранения и клинического мастерства (NICE) рекомендует проводить скрининг нацелиакию у людей с недавно диагностированным синдромом хронической усталости и синдромом раздраженного кишечника, а также с диабетом 1 типа, особенно у людей с недостаточной прибавкой в весе или необъяснимой потерей веса. Кроме того, скрининг также рекомендуется при аутоиммунных заболеваниях щитовидной железы, герпетиформном дерматите, а также родственникам первой степени родства пациентов с подтвержденной целиакией.
В 2016 году, Целевая профилактическая группа США обнаружила достаточное количество доказательств пользы или вреда от скрининга людей в любом возрасте, которые не имеют симптомов.
Серология была предложена в качестве методадля скрининга, поскольку наличие антител может обнаружить некоторые ранее недиагностированные случаицелиакии и предотвратить его осложнения у этих людей. Тем не менее, серологические тесты имеют высокую чувствительность только у людей с полной атрофией ворсинок и имеют очень низкую способность выявлять случаи с частичной атрофией ворсинок или незначительными кишечными поражениями. Тестирование на целиакию может быть предложено людям со связанными условиями.
Лечение
Диета
В настоящее время, единственным эффективным методом лечения целиакии является пожизненная безглютеновая диета. Не существует препаратов, позволяющих предотвратить повреждение или предотвратить атаку организма на кишечник, когда присутствует клейковина. Строгое соблюдение диеты способствует заживлению кишечника, что приводит к исчезновению всех симптомов в большинстве случаев и, в зависимости от того, как скоро начинается диета, также может устранить повышенный риск развития остеопороза и рака кишечника и, в некоторых случаях, бесплодия. Диету может быть трудно соблюдать; несоблюдение диеты может вызвать рецидив. Диетолог должен сделать так, чтобы пациент понял, какие продукты содержат глютен, какие продукты являются безопасными, и как обеспечить сбалансированный рацион питания, несмотря на ограничения. Во многих странах, безглютеновые продукты доступны по рецепту врача и могут быть возмещены планами медицинского страхования. Не содержащие глютен продукты, как правило, дороже и их труднее найти. Так как готовые к употреблению продукты часто содержат следовые количестваглютена, некоторые люди, больные целиакией, могут предпочесть готовить пищу самостоятельно. 28) Термин «безглютеновый» обычно используется, чтобы указать предположительно безвредный уровень клейковины в пище, а не полное её отсутствие. Точный уровень, при котором глютен является безвредным, является неопределенным и спорным. Недавний систематический обзор предварительно показывает, что потребление менее 10 мг глютена в сутки вряд ли вызовет гистологические отклонения, хотя и было отмечено, что было проведено мало качественных исследований. Технологии регулирования этикеток безглютеновых продуктов разные в разных странах. В Европейском Союзе, Европейская комиссия опубликовала в 2009 году правила, ограничивающие использование этикеток «без глютена» для пищевых продуктов, содержащих менее 20 мг / кг глютена и «очень низкое содержание глютена» для продуктов, содержащих менее 100 мг / кг глютена. В Соединенных Штатах, FDA выпустила в 2013 году правила, ограничивающие использование этикеток «без глютена» для пищевых продуктов, содержащих менее чем 20 частей на миллион глютена. 29) Нынешний международный стандарт Кодекс Алиментариус позволяет содержаться 20 частям на миллион глютена в так называемых «безглютеновых» продуктах. Несколько организаций, таких как Организация по сертификации безглютеновой продукции (GFCO), Ассоциация целиакии (CSA) и Национальный фонд осведомленности общественности о целиакии (NFCA), также сертифицируют продукты «не содержащие глютен». Безглютеновая диета улучшает качество жизни, и строгое соблюдение диеты дает больше пользы, чем неполное соблюдение. Тем не менее, безглютеновая диета не может полностью нормализовать качество жизни человека.
Резистентные заболевания
До 5% людей имеют резистентное заболевание, которое не улучшается при безглютеновой диете. Это может быть связано с тем, что болезнь присутствует столь долго, что кишечник уже не в состоянии излечиться самостоятельно, или же с тем, что человек не придерживается диеты, или с тем, что человек потребляет продукты, которые были непреднамеренно «загрязнены» клейковиной. Если альтернативные причины были устранены, может быть рассмотрен прием стероидов или иммунодепрессантов (например, азатиоприна).
Эпидемиология
Во всем мире целиакиейболеют от 1 на 100 до 1 на 170 человек. Показатели, однако, различаются в различных регионах мира, начиная от всего лишь 1 на 300 и до 1на 40 человек. В Соединенных Штатах, заболевание, предположительно, влияет на 1 из 1750 человек (определяется как клиническое заболевание, включая герпетиформный дерматит с ограниченными симптомами желудочно-кишечного тракта) до 1 из 105 человек (определяется наличием IgATG у доноров крови). В связи с переменными признаками и симптомами, предполагается, что около 85% людей, пораженных болезнью, недиагностированы. Процент людей с клинически диагностированным заболеванием (симптомы, обеспечивающие диагностическое тестирование) в различных исследованиях составил 0.05-0.27%. Тем не менее, исследования людей из районов Европы, Индии, Южной Америки, Австралии и США (с использованием серологических методов и биопсии) показывают, что процент людей с этим заболеванием может составлять от 0,33 до 1,06% у детей (но 5,66% в одном исследовании детей сахарского народа) и 0.18-1.2% у взрослых. Среди людей, требующих первичной медицинской помощи, которые сообщают о желудочно-кишечных симптомах, частота целиакии составляет около 3%. Распространенность целиакии среди взрослых доноров крови в Иране, Израиле, Сирии и Турции, составляет 0,60%, 0,64%, 1,61% и 1,15%, соответственно. Люди африканского, японского и китайского происхождения редко диагностируются; 30) это отражает гораздо более низкую распространенность генетических факторов риска, таких как HLA-B8. Люди индийского происхождения имеют аналогичный западным людям риск целиакии. Демографические исследования также показывают, что значительная часть больных целиакией остается недиагностированной; это связано, отчасти, с тем, что многие клиницисты не знают об этой болезни, а также с тем, что болезнь может быть бессимптомной. Целиакия несколько чаще встречается у женщин, чем у мужчин. Большое многоцентровое исследование, проведенное в США, обнаружило распространенность 0,75% в группах без риска, увеличивающаяся до 1,8% у симптоматических людей, составляя 2,6% у родственников больных во второй степени родства (например, бабушки и дедушки, тети или дяди, внуки и т.д.) и 4,5% у родственников в первой степени родства (братья, сестры, родители или дети). Этот профиль подобен распространенности заболевания в Европе. Другие группы населения с повышенным риском целиакии, с показателями распространенности в диапазоне от 5% до 10%, включают в себя людей с синдромами Дауна и Тернера, диабетом типа 1, и аутоиммунными заболеваниями щитовидной железы, в том числе гипертиреозом (гиперактивностью щитовидной железы) и гипотиреозом (пониженной активностью щитовидной железы). 31) Исторически сложилось, что целиакия считалось редким заболеванием, с распространенностью около 0,02%. Причина недавнего увеличения числа зарегистрированных случаев остается неясной. Это увеличение может быть связано, по крайней мере, частично,с изменениями в диагностической практике. Также наблюдается примерно 4,5-кратное истинное увеличение, которое может произойти из-за меньшего воздействия бактерий и других патогенов в западных странах.
История
Люди впервые начали выращивать зерно в период неолита (начиная с около 9500 г. до н.э.) в Плодородном полумесяце в Западной Азии, и вполне вероятно, что целиакии до этого времени не было. Аретей из Каппадокии, проживающий во втором веке в этом регионе, зафиксировал мальабсорбтивный синдром с хронической диареей, вызывающий истощение. Его труд «CœliacAffection» (coeliacот греческого κοιλιακός koiliakos, «абдоминальный») получил внимание западной медицины, когда Фрэнсис Адамс представил перевод работы Аретея в Сиденхамском обществе в 1856 году. Пациент, описанный в работе Аретея,страдал болями в животе, был бледен, слаб и нетрудоспособен. Диарея проявлялась как зловонный жидкий стул белого цвета.Болезнь была неизлечимой и могла периодически возобновляться.Болезнь, по мнению Аретея, была связана с отсутствием тепла в желудке, необходимого для переваривания пищи и пониженной способностью распределять продукты пищеварения по всему телу, и это неполное переваривание вызывало диарею. Аретей считал целиакию болезнью старых и писал, что чаще всего она поражает женщин, и не затрагивает детей. Причиной целиакии, по мнению Аретея, является либо другая хроническая болезнь, либо потребление «большого количества холодной воды». Педиатр Самуэль Джи дал первое современное описание этого состояния у детей в лекции в госпитале для больных детей наGreatOrmondStreet в Лондоне в 1887 году. Джи признал ранние описания и термины для болезни и принял термин Аретея (глютеновая болезнь). Он прозорливо заявил: «Если пациента вообще можно излечить, то это следует делать с помощью диеты». Джи признал, что у детей с целиакией наблюдается непереносимость молока, и что следует избегать продуктов с большим содержанием крахмала. Тем не менее, он запретил рис, саго, фрукты и овощи, которые были в действительности безопасны к употреблению, и он рекомендовал сырое мясо, а также тонкие ломтики поджаренного хлеба. Джи подчеркнул, что был достигнут особый успех с ребенком, «которому подавали кварту лучших голландских мидий в день». Тем не менее, ребенок не смог соблюдать эту диету в течение более одного года. 32) Кристиан Арчибальд Гертер, американский врач, в 1908 году написал книгу о детях с целиакией. Гертер называл болезнь «кишечным инфантилизмом». Он отметил, что у таких детей наблюдалось замедление роста, и что они лучше переносили жир, по сравнению с углеводами. Эпоним целиакии – болезнь Джи-Гертера – иногда используется для подтверждения вклада обоих ученых в исследования болезни. Сидни В. Хаас, американский педиатр, сообщил о положительном эффекте банановой диеты в 1924 году. Эта диета использовалась до тех пор,пока не была определена фактическая причина целиакии. В то время как у ученых были подозрения о роли углеводов в развитии болезни, связь с пшеницей была установлена лишь в 1940-х годах голландским педиатром доктором Виллем Карелом Дике. Вполне вероятно, что клиническое улучшение у пациентов во время голландского голода 1944 года (в течение которого было мало запасов муки), возможно, способствовало его открытию. Дике заметил, что нехватка хлеба привела к существенному снижению уровня смертности среди детей, страдающих от целиакии от более чем 35% практически до нуля. Он также сообщил, что как только возобновился доступ к пшенице после конфликта, уровень смертности вновь увеличился. Связь с клейковинным компонентом пшеницы была установлена в 1952 году командой ученых из Бирмингема, Англия. Атрофию ворсинок описал британский врач Джон У. Полли в 1954 году на образцах, взятых во время операции. 33) Это открыло путь для образцов биопсии, взятых при эндоскопии. На протяжении 1960-х годов были освящены другие особенности целиакии. Ее наследственный характер был признан в 1965 году. В 1966 году была обнаружена связь герпетиформного дерматита с чувствительностью к клейковине.
Общество и культура
Христианские церкви и Евхаристия
Различные конфессии христиан празднуют Евхаристию, праздник, в ходе которого небольшой кусочек пшеничного хлеба благословляют, а затем съедают. Типичная пластина такого хлеба весит около половины грамма. Пшеничная мука содержит от 10 до 13% клейковины, поэтому одна пластина может содержать более 50 мг глютена, то количество, которое будет вредить здоровью многих людей с целиакией, особенно если потребляется каждый день. Многие христианские церкви предлагают своим прихожанам альтернативу клейковине, как правило, в форме рисовых крекеров или хлеба, не содержащего глютен. К ним относятся Объединенная методистская, христианская реформатская, епископальная, англиканская церкви (церковь Англии, Великобритании) и лютеране. Католики могут только пить кровь Христову, или попросить хлеб со сниженным содержанием глютена; безглютеновый хлеб, однако, не считается пшеничным, и, следовательно, не признается.
Римско-католическая церковь
 Римско-католическая доктрина утверждает, что для действительного причастия, хлеб, используемый на мессе, должен быть сделан из пшеницы. В 2002 году Конгрегация Доктрины Веры одобрила хлеб немецкого производства с низким содержанием клейковины, отвечающий всем требованиям католической церкви, для использования в Италии; хотя этот хлеб не является полностью свободным от глютена, он был также одобрен Итальянской Ассоциацией Целиакии. 34) Некоторые католики, больные целиакией, запрашивали разрешение на использование рисовых вафель, ив таких прошениях всегда отказывалось. Поскольку католическая доктрина утверждает, что Христос полностью и в равной степени присутствует в своей крови и плоти, можно причаститься только при помощи вина.
Для священников этот вопрос является более сложным. Будучи священнослужителем, священнику, для полноты жертвы Мессы, абсолютно необходимо причаститься как хлебом, так и вином. 24 июля 2003 года Конгрегация Доктрины Веры утвердила: «Учитывая центральное место празднования Евхаристии в жизни священника, нужно действовать с большой осторожностью, прежде чем впускать к Священство кандидатов, которые не в состоянии принимать в пищу хлеб или пить алкоголь без серьезного вреда для здоровья». 35)
К январю 2004 года,в Соединенных Штатах, Италии и Австралии стали доступны виды хлеба с крайне низким содержанием клейковины,утвержденные Церковью.
Римско-католическая доктрина утверждает, что для действительного причастия, хлеб, используемый на мессе, должен быть сделан из пшеницы. В 2002 году Конгрегация Доктрины Веры одобрила хлеб немецкого производства с низким содержанием клейковины, отвечающий всем требованиям католической церкви, для использования в Италии; хотя этот хлеб не является полностью свободным от глютена, он был также одобрен Итальянской Ассоциацией Целиакии. 34) Некоторые католики, больные целиакией, запрашивали разрешение на использование рисовых вафель, ив таких прошениях всегда отказывалось. Поскольку католическая доктрина утверждает, что Христос полностью и в равной степени присутствует в своей крови и плоти, можно причаститься только при помощи вина.
Для священников этот вопрос является более сложным. Будучи священнослужителем, священнику, для полноты жертвы Мессы, абсолютно необходимо причаститься как хлебом, так и вином. 24 июля 2003 года Конгрегация Доктрины Веры утвердила: «Учитывая центральное место празднования Евхаристии в жизни священника, нужно действовать с большой осторожностью, прежде чем впускать к Священство кандидатов, которые не в состоянии принимать в пищу хлеб или пить алкоголь без серьезного вреда для здоровья». 35)
К январю 2004 года,в Соединенных Штатах, Италии и Австралии стали доступны виды хлеба с крайне низким содержанием клейковины,утвержденные Церковью.
Песах
Еврейский праздник Песах (иудейская пасха) связан с необходимостью есть мацу, пресный хлеб, изготовленный строго контролируемым образом из пшеницы, ячменя, полбы, овса или ржи. Это исключает использование многих других зерновых культур, которые обычно используются в качестве заменителей для людей с чувствительностью к клейковине, особенно для ашкеназских евреев, которые также избегают риса. Во многих кошерных продуктах для Песаха не содержатся зерна и, следовательно, глютен. Картофельный крахмал является основным крахмалом, используемым для замены зерна. Потребление мацы является обязательным в первую ночь Песаха. Еврейский закон гласит, что человек не должен серьезно портить свое здоровье, чтобы исполнить заповедь. Таким образом, человек с тяжелой целиакией не должен потреблять мацу. Наиболее часто используемая безглютеновая маца производится из овса.
Направления исследований
Изучаются различные другие подходы, которые могли бы уменьшить потребность в диете. Все они еще находятся в стадии разработки, и не ожидается, что они станутдоступны для широкой публики в скором времени. Три основных подхода были предложены в качестве новых терапевтических средств для лечения целиакии: глютеновая детоксикация, модуляция кишечной проницаемости и модуляция иммунного ответа. 36) Использование генетически модифицированных видов пшеницы, или видов пшеницы, которые выборочно разводятся, чтобы быть минимально иммуногенными, может позволить людям с целиакией потреблять пшеницу. Это, однако, может нарушить эффекты, которые оказывает глиадин на качество теста. В качестве альтернативы, воздействие клейковины может быть сведено к минимуму путем приема комбинации ферментов (пролил-эндопептидазы и ячменной глютамин-специфической цистеин эндопептидазы (EP-B2), которые разлагают предполагаемый 33-мерный пептид в двенадцатиперстной кишке. Исследуемые альтернативные методы лечения включают ингибирование зонулина, эндогенного сигнального белка, связанного с повышенной проницаемостью кишечной стенки и, следовательно, повышенным представлениемглиадинав иммунной системе. Одним из ингибиторов этого пути является ларазотид ацетат, который в настоящее время находится на 3-й фазе клинических испытаний. 37) Другие модификаторы других хорошо понимаемых шагов в патогенезе целиакии, таких как действия HLA-DQ2 или трансглютаминазы ткани и взаимодействие MICA / NKG2D, которое может быть причастен к убийству энтероцитов. Попытки модулировать иммунный ответ в отношении целиакии, в основном, до сих пор находятся в фазе I клинических испытаний; один агент (CCX282-B) оценивали в клиническом испытании фазы II на основе малых кишечных биопсий, взятых у людей с целиакией до и после воздействия глютена.










