Содержание
Никотиновая кислота (Ниацин, Витамин B3)
Ниацин (также известный как витамин B3, никотиновая кислота, и реже – витамин РР; архаичные термины включают названия пеллагра-профилактический и анти-дерматитный фактор) представляет собой органическое соединение с формулой C6H5НО2 и, в зависимости от используемого определения, является одним из от 40 до 80 необходимых человеку питательных веществ.
Фармакологическая группа: витамины; водорастворимые витамины; витамины группы B
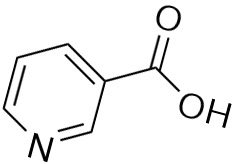
ИЮПАК название: пиридин-3-карбоновая кислота
Систематическое название: пиридин-3-карбоновая кислота
Другие названия: Бионический Витамин B3
Молекулярная формула C6NH5O2
Молярная масса 123.1094 г моль-1
Внешний вид: белые, полупрозрачные кристаллы
Плотность: 1,473 г/см3
Температура плавления: 237 ° C, 510 K, 458 ° F
Растворимость в воде: 18 г/л-1
Кислотность (рКа) 2,201
Основность (ПКБ) 11,796
Изоэлектрическая точка 4,75
Показатель преломления (Nd) 1,4936
Дипольный момент 0,1271305813 D
Применение: внутримышечно, перорально
Период полураспада: 20-45 мин
Температура вспышки: 193 ° C
Температура самовоспламенения: 365 ° C
Никотиновая кислота является одним из пяти витаминов, отсутствие которых в рационе человека связано с пандемией, то есть дефицитом ниацина (пеллагра), дефицитом витамина C (цинга), дефицитом тиамина (бери-бери), дефицитом витамина D (рахит и остеомаляция), дефицитом витамина А (куриная слепота и другие симптомы). Никотиновая кислота используется уже более 50 лет для увеличения уровня ЛПВП (липопротеинов высокой плотности) в крови, а также, как было выяснено в ряде контролируемых испытаний на человеке, может применяться для небольшого уменьшения риска сердечно-сосудистых заболеваний. Это бесцветное, водорастворимое твердое вещество является производным от пиридина, с карбоксильной группой (СООН) в 3-й позиции. Другие формы витамина В3 включают в себя соответствующий амид, никотинамид («ниацинамид»), где карбоксильная группа заменена на группу карбоксамида (CONH 2), а также более сложные амиды и различные сложные эфиры. Никотиновая кислота и никотинамид являются конвертируемыми по отношению друг к другу соединениями, устойчивый спрос на которые по всему миру возрос с 8500 тонн в год в 1980-х годах до 40 000 тонн за последние годы. Никотиновая кислота не может быть непосредственно преобразована в никотинамид, однако оба соединения могут быть в естественных условиях преобразованы в НАД и НАДФ. Никотиновая кислота, никотинамид и триптофан (через хинолиновую кислоту) являются кофакторами для никотинамид-аденин-динуклеотида (НАД) и никотинамид-аденин-динуклеотид-фосфата (НАДФ). НАД превращается в НАДФ путем фосфорилирования в присутствии фермента НАД + киназы. НАДФ и НАД являются коферментами для множества дегидрогиназ, и участвуют во многих процессах переноса водорода. НАД играет важную роль в катаболизме жиров, углеводов, белков и алкоголя, а также во клеточной сигнализации и репарации ДНК и НАДФ в основном в реакциях анаболизма, таких как синтез жирных кислот и холестерина. Органы с высокой потребностью в энергии (мозг) или высокой скоростью переработки (кишечник, кожа), как правило, наиболее восприимчивы к их дефициту. Хотя оба вещества обладают идентичной витаминной активностью, никотинамид не имеет тех же фармакологических свойств (модифицирующих липиды эффектов), как ниацин. Никотинамид не снижает уровень холестерина и не вызывает покраснений кожи. Никотинамид может быть токсичным для печени в дозах, превышающих 3 г/сут для взрослых. Никотиновая кислота является предшественником НАД+/НАДР и НАДФ+/НАДФН, которые играют важную метаболическую роль в живых клетках. Ниацин участвует в репарации ДНК и производстве стероидных гормонов в надпочечниках. Ниацин является одним из основных витаминов группы В. Его употребление способствует улучшению уровней холестерина и триглицеридов. Поскольку его побочным эффектом является резистентность к инсулину, то добавки ниацина оказывать благотворное влияние только на здоровье сердечно-сосудистой системы при соблюдении рекомендаций к употреблению.
Общая информация
Под витамином В3 часто понимают молекулу, которую чаще всего называют никотиновой кислотой или ниацином; хотя витамин В3 может быть представлен другим витамером, который называется никотинамидом. Витамин В3 необходим для поддержания функций многих ферментов. Употребление ниацина является крайне эффективным для нормализации уровней липидов в крови. У людей с низким уровнем «хорошего» холестерина отмечается его увеличение на фоне употребления добавок; у тех же, у кого наблюдается высокий уровень «плохого» холестерина отмечается его снижение. Уровни триглицеридов также снизились в ходе употребления добавки, что делает ниацин отличной кардиопротекторной добавкой. К сожалению, употребление ниацина не приводит к снижению риска смерти от сердечно-сосудистых заболеваний; способен увеличивать резистентность к инсулину, что сводит на нет преимущества ниацина касательно уровней липидов в крови. Другие преимущества ниацина заключаются в том, что он теоретически влияет на рост, когнитивные функции и продолжительность жизни. Это обеспечивается за счёт того, что употребление ниацина увеличивает клеточные уровни никотинамидадениндинуклеотида (NAD+). Предварительные данные свидетельствуют о том, что повышенные уровни NAD+ могут способствовать вышеуказанным благотворным эффектам, однако требуется больше исследований для подтверждения данного факта. Местное применение никотинамида на коже не проявило себя так же эффективно, как витамин А. Никотинамид используется местно, так как он не способствует покраснению кожи, которое отмечается при применении ниацина. Текущий данные свидетельствуют о том, что долгосрочное употребление ниацина увеличивает резистентность инсулина за счёт подавления синтеза глюкоза в печени. Это вызывает увеличение уровней глюкозы в крови, что способствует снижению чувствительности к инсулину на протяжении долгого времени; на этом фоне необходимые рецепторы перестают быть чувствительными из-за повышенных уровней глюкозы в крови. Покраснения кожи, которые могут проявляться при применении ниацина, являются временным эффектов. Хотя это не является приятным явлением, оно не является вредным. Отмечается высокая частота случаев передозировки ниацином людьми для подделки результатов теста мочи. Передозировка ниацина может вызвать проявление негативных показателей в различных органах, однако данное вещество не позволит подделать результаты анализа мочи.
Также известен как: ниацин
Не путать с: никотином (не имеет никакой связи с никотиновой кислотой)
Стоит отметить
- Употребление ниацина может вызывать покраснения, являющиеся доброкачественными с медицинской точки зрения; проявляются, как правило, на лице (отличается от покалываний в ходе употребления бета-аланина; никотинамид не имеет такого эффекта
- Высокие (не указано точно, какие) дозировки ниацина использовались лицами для маскировки наличия наркотических веществ в моче; в некоторых случаях отмечались очень плохие показатели по различным органам
Представляет собой основной витамин или минерал.
Хорошо сочетается с
- Аспирином или ларопипрантом (оба снижаются проявления покраснения на фоне употребления ниацина; вещества не дополняют друг друга)
Никотиновая кислота: инструкция
Большинство положительных эффектов ниацина проявляются при употреблении дозировок, начиная от одного грамма. Это составляет примерно 5000% от рекомендуемой дневной дозировки.
Пищевые потребности
Рекомендованная ежедневная доза ниацина составляет 2-12 мг / сут для детей, 14 мг / сут для женщин, 16 мг / сут для мужчин и 18 мг / сут для беременных или кормящих грудью женщин. Верхний допустимый уровень потребления для взрослых мужчин и женщин составляет 35 мг / сут. Количество ниацина в организме человека проверяется через измерение мочевых биомаркеров, которые, как предполагается, являются более надежным показателем, чем плазменные уровни.
Дефицит. Пеллагра
В настоящее время в развитых странах иногда наблюдается дефицит ниацина. Обычно заболевание проявляется в условиях нищеты, недоедания и хронического алкоголизма. Кроме того, заболевание, как правило, встречается в местах, где люди едят в основном маис (кукурузу, единственное зерно, содержащее плохо усваиваемый ниацин). Для повышения биодоступности ниацина в кукурузной муке/при производстве муки применяется специальная техника приготовления пищи, называемая никстамализация. При небольшом дефиците ниацина замедляется метаболизм, в результате чего у человека уменьшается устойчивость к холоду. Тяжелый дефицит ниацина в рационе вызывает заболевание пеллагру, которое характеризуется диареей, дерматитом и слабоумием, а также поражением на нижней части шеи, называемом «воротник Касаля», гиперпигментацией, утолщением кожи, воспалениями полости рта и языка, расстройствами пищеварения, амнезией, бредом, и в конечном итоге, при отсутствии лечения, может закончиться смертью. Распространенные психиатрические симптомы дефицита ниацина включают раздражительность, плохую концентрацию, тревожность, усталость, беспокойство, апатию и депрессию. Исследования показали, что у пациентов с алкогольной пеллагрой дефицит ниацина может быть важным фактором, влияющим как на начало, так и на тяжесть протекания данного заболевания. Больные алкоголизмом обычно страдают повышенной кишечной проницаемостью, что приводит к негативным последствиям для здоровья. Болезнь Хартнапа – это наследственное нарушение питания в результате дефицита ниацина. Это заболевание было впервые идентифицировано в 1950-х годах семьей Хартнап в Лондоне. Болезнь связана с дефицитом ниацина в кишечнике и почках, когда организм испытывает определенные сложности в переработке и абсорбции пищевого триптофана. Симптомы болезни аналогичны симптомам пеллагры, и проявляются в виде красной чешуйчатой сыпи, а также повышенной чувствительности к солнечному свету. Для лечения этого заболевания ниацин принимают перорально в дозах от 40 до 200 мг. Болезнь хорошо поддается лечению при ее диагностике на ранних стадиях. Синтез ниацина при карциноидном синдроме также является дефицитным, из-за метаболической утечки его предшественника триптофана в серотонин.
Терапевтическое воздействие
В 1955 году Altschul и соавт. (1955) впервые описали ниацин в качестве гиполипидемического вещества, что сопровождалось последующими исследованиями. Никотиновая кислота является старейшим гиполипидемическим препаратом с уникальными анти атеросклеротическими характеристиками. Она снижает уровень холестерина липопротеинов низкой плотности (ЛПНП), холестерина липопротеинов очень низкой плотности (ЛПОНП) и триглицеридов (ТГ), а также эффективно увеличивает уровень холестерина липопротеинов высокой плотности (ЛПВП). Несмотря на важность других сердечно-сосудистых факторов риска, высокий уровень ЛПВП снижает риск сердечно-сосудистых заболеваний, вне зависимости от уровня ЛПНП. Другие эффекты включают антитромботические и противовоспалительные воздействия, улучшение эндотелиальной функции и стабилизация уровня бляшек. Ниацин сам по себе или в комбинации с другими гиполипидемическими препаратами, такими как статин или эзетимиб, значительно снижает риск развития сердечно-сосудистых заболеваний и атеросклероза. Терапевтическое воздействие ниацин проявляет в основном через свой конкретный G белковый рецептор (GPR109A и GPR109B), недавно названый гидроксильной карбоновой кислотой, рецептор 2, который экспрессируется в большом количестве в жировой ткани, селезенке, клетках иммунной системы и кератиноцитах, однако не экспрессируется в печени, почках, сердце или кишечнике. GPR109A ингибирует производство циклического аденозин монофосфата и, таким образом, липолиз, позволяя свободным жирным кислотам в печени производить ТГ и ЛПОНП и, следовательно ЛПНП. Уменьшение содержания свободных жирных кислот также подавляет печеночную экспрессию аполипопротеина C3 (APOC3) и PPARg коактиватора-1b (PGC-1b), увеличивая таким образом цикл ЛПОНП и уменьшая его производство. Он также ингибирует диацилглицерол ацилтрансферазу-2 (важный печеночный синтез ТГ). Механизм, ответственный за увеличение ЛПВП, все еще полностью не установлен, но, кажется, что он действует при помощи различных способов. Ниацин увеличивает уровни аполипопротеина A1 из-за антикатаболического эффекта, который ведет к повышению обратного транспорта холестерина. Он также ингибирует печеночное поглощение ЛПВП, уменьшая производство гена белка-переносчика холестеринового эфира. Наконец, он стимулирует ABCA1 транспортер в моноцитах и макрофагах и увеличивает производство рецептора, активируемого пролифератором пероксисом γ, что приводит к обратному транспорту холестерина. Результаты нескольких экспериментов с использованием ниацина сообщили об улучшении функционирования эндотелия сосудов. В эксперименте с лицами, страдающими сахарным диабетом 2 типа, никотиновая кислота вызывала заметное улучшение функций эндотелия по сравнению с контрольной группой. Суточная доза ниацина, равная 1 г, вызывала значительные изменения свойств липидов, и плато достигалось при дозе в 2 грамма. GPR109A в иммунных клетках, таких как моноциты, макрофаги и дендритные клетки, отвечает за атеросклерозные эффекты ниацина, вызываемые уменьшением инфильтрации иммунных клеток сосудистой стенки. Кроме того, уменьшается количество эндотелиальных адгезионных молекул, таких как сосудистые молекулы клеточной адгезии 1 (VCAM-1) или хемокинов, таких как моноцит хемотаксический белок-1 (MCP-1) и воспалительных белков, что приводит к атеросклеротической стабилизации и проявлению антитромботических эффектов. Изменения в молекулах адгезии и хемокинах могут происходить через активацию рецепторов GPR109A на иммунные клетки. Адипокины – это медиаторы, производимые адипоцитами. Некоторые адипокины, такие как фактор некроза опухолей (TNF)-а, интерлейкины и хемокины, обладают провоспалительным эффектом, в то время как некоторые другие, такие как адипонектин, оказывают противовоспалительное действие и регулируют воспалительные процессы, уменьшая сосудистую прогрессию и развитие атеросклероза. Никотиновая кислота увеличивает уровни адипонектина в плазме у человека и мыши, однако вызывает ингибирование провоспалительных хемокинов, таких как МСР-1 и фракталкин. Другим недавно изученным терапевтическим эффектом никотиновой кислоты является нейропротекторное и противовоспалительное действие при животной моделе артрита, хронической почечной недостаточности или сепсисе, однако, в этой области необходимо большее количество работ. После проведения проекта коронарного препарата в качестве одного из первых экспериментов для изучения долгосрочных клинических гиполипидемических эффектов ниацина с 1960-х до начала 1970-х годов (JAMA, 1975), было проведено множество других экспериментов. Их результаты обобщены в двух последних мета анализах, и был сделан вывод о том, что терапевтические дозы ниацина отдельно или в комбинации с другими липид модифицирующими препаратами, такими как статины, значительно снижают риск развития сердечно-сосудистых заболеваний и прогрессирование атеросклероза. Это согласуется с текущей Национальной Образовательной Программой о Холестероле (NCEP) по снижению уровня холестерина. Программа рекомендует принимать ниацин сам по себе при сердечно-сосудистой и атерогенной дислипидемии со средними или нормальными уровнями ЛПНП или в комбинации при более высоких уровнях ЛПНП (NCEP, 2002). 1500 мг ниацина немедленного высвобождения ежедневно вызывает 13% снижение ЛПНП, 20% снижение ЛП, 10% снижение ТГ и 19% увеличение ЛПВП по сравнению с плацебо-группой. Расширенное высвобождение ниацина в одиночку или вместе с препаратом против покраснения кожи (laropiprant) имеет подобные эффекты. Никотиновая кислота связывается и стимулирует G-белковый рецептор, GPR109A, что приводит к ингибированию распада жиров в жировой ткани. Никотинамид не связывает этот рецептор, что объясняет тот факт, почему он не влияет на уровень липидов в крови. Липиды, которые высвобождаются из жировой ткани, как правило, используются для создания липопротеинов очень низкой плотности (ЛПОНП) в печени, которые являются предшественниками липопротеинов низкой плотности (ЛНП), или «плохого» холестерина. Так как ниацин блокирует расщепление жиров, он вызывает снижение уровня свободных жирных кислот в крови и, как следствие, снижение секреции липопротеинов очень низкой плотности и холестерина в печени. При понижении уровня липопротеинов очень низкой плотности, ниацин также повышает уровень липопротеинов высокой плотности (ЛПВП), или «хорошего» холестерина в крови, и поэтому его иногда назначают людям с низким уровнем ЛПВП, которые имеют высокий риск сердечного приступа. Исследование ARBITER 6-HALTS, опубликованное в 2009 году на ежегодном собрании Американской ассоциации кардиологов в Журнале медицины Новой Англии, делает вывод о том, что при добавлении к статинам, 2000 мг ниацина расширенного высвобождения/день является более эффективным, чем эзетимиб (Zetia) в снижении толщины комплекса интима-медиа, маркера атеросклероза. Кроме того, недавний мета-анализ, охватывающий 11 рандомизированных контролируемых клинических испытаний, показал положительные эффекты ниацина в отдельности или в комбинации на все сердечно-сосудистые заболевания и развитие атеросклероза. Тем не менее, исследование 2011 года (AIM-HIGH) было приостановлено из-за того, что у пациентов вместо снижения сердечно-сосудистых заболеваний наблюдалось увеличение риска инсульта. У этих пациентов уровни ЛПНП уже хорошо контролировались при помощи препарата статина, и цель исследования заключалась в оценке действия ниацина расширенного выпуска (2000 мг в день) на повышение уровня ЛПВП в качестве дополнительного воздействия на риск. В этом исследовании препарат не показал такого эффекта, и, казалось, увеличивал риск инсульта. Роль ниацина у больных, чьи уровни ЛПНП плохо контролировались (как и в большинстве предыдущих исследований ниацина), находится в стадии изучения и дебатов. Однако, препарат, кажется, не влияет на повышение ЛПВП у пациентов, уже принимающих статины, снижающие уровень ЛПНП.
Ниациновые препараты
Многие препараты никотиновой кислоты продаются без рецепта, в качестве пищевых добавок. Ниацин немедленного высвобождения эффективен для снижения уровня холестерина, и имеет минимальные гепатотоксические побочные эффекты из-за того, что он быстро выводится из организма. Тем не менее, основной его недостаток состоит в том, что препарат вызывает сильное расширение кровеносных сосудов, вызывая покраснение и покалывание кожи, которые могут быть неприятны многим пациентам. В ниацине пролонгированного действия, отпускающегося без рецепта, таком как Endur-Acin, используется восковая матрица, которая оттягивает его выпуск. Доступный по рецепту ниацин пролонгированного действия, Niaspan, имеет пленочное покрытие, задерживающее выпуск ниацина, в результате чего поглощение наступает в течение 8-12 часов. Формулы с расширенным высвобождением обычно снижают побочные эффекты вазодилатации и покраснения, но увеличивает риск гепатотоксичности по сравнению с формулами немедленного высвобождения. Препарат Laropiprant (Merck & Ко, Inc) и ниацин ранее были одобрены для использования в Европе и продаются под маркой Tredaptive. Laropiprant – это препарат, связывающий простагландин D2, снижающий расширение сосудов и покраснение кожи до 73%. Исследование HPS2-THRIVE, спонсированное компанией Merck, не показало никаких дополнительных преимуществ Tredaptive в снижении уровня холестерина при совместном использовании с другими статиновыми препаратами, однако продемонстрировало увеличение других побочных эффектов. В результате этого исследования препарат Tredaptive был полностью изъят с международного рынка. Нет достаточных данных об эффективности и безопасности пищевых добавок ниацина, продающихся без рецепта, необходимых для нормативного утверждения FDA. Некоторые препараты, «не вызывающие покраснений», такие как inositol hexanicotinate, содержат конвертируемые соединения ниацина, но имеют небольшую клиническую эффективность в снижении уровня холестерина или препараты «замедленного высвобождения» имеют более высокую гепатотоксическую активность, следовательно, применение ниацина без рецепта врача не рекомендуется из-за его потенциально возможного вреда для здоровья.
Токсичность
Фармакологические дозы ниацина (1,5 - 6 г в день) ведут к проявлению побочных эффектов, которые могут включать дерматологические заболевания, такие как гиперемия кожи и зуд, сухость кожи, сыпь на коже и в том числе и экзему и акантоз. Некоторые из этих симптомов, как правило, связаны с ролью ниацина, как кофактора ограничителя скорости фермента гистидин декарбоксилазы, который преобразует L-гистидин в гистамин. H1 и H2 опосредованные гистамином рецепторы метаболизируются через последовательность моно (или ди-) амин оксидазы и СОМТ в метилгистамин который затем конъюгируется через печеночные CYP450. Стойкое покраснение кожи и другие симптомы могут указывать на недостатки одного или более кофакторов, ответственных за этот ферментативный каскад. Также наблюдались желудочно-кишечные нарушения, такие как диспепсия (нарушение пищеварения), тошнота и фульминантная печеночная недостаточность. Сообщалось также о гипергликемии, сердечной аритмии и возникновении «врожденных дефектов у подопытных животных». Покраснение кожных покровов длится обычно в течение примерно 15-30 минут, хотя иногда и до двух часов. Оно иногда сопровождается ощущением покалывания или зуда, в частности, в областях, покрытых одеждой. Покраснение опосредовано простагландином Е2 и D2 из-за активации GPR109A эпидермальных клеток Лангерганса и кератиноцитов. Клетки Лангерганса используют циклооксигеназу типа 1 (СОХ-1) для производства PGE2 и более всего ответственны за острое покраснение кожи, в то время как кераноциты являются COX -2 зависимыми клетками и активно участвуют в расширении сосудов. Для уменьшения покраснений кожи многие исследования направлены на изменение или блокирование простагландин опосредованного пути. Этот эффект опосредуется GPR109A-опосредованным высвобождением простагландина из клеток Лангерганса в коже и может быть блокирован путем приема 300 мг аспирина за полчаса перед приемом ниацина, при приеме одной таблетки ибупрофена в день или совместном введении антагониста простагландинового рецептора laropiprant. Прием ниацина с пищей также помогает снизить этот побочный эффект. После нескольких недель последовательного приема указанных доз, у большинства пациентов больше не наблюдается покраснений. Формы замедленного высвобождения или «устойчивые» формы ниацина разработаны как раз для уменьшения этих побочных эффектов. Одно исследование показало, что частота покраснений значительно снижается при приеме препаратов замедленного высвобождения, хотя дозы выше 2 г в день были связаны с повреждениями печени, в частности, у препаратов с медленным высвобождением. Часто полагают, что эффект покраснения кожи вызывает гистамин, однако на самом деле это не так. Основной причиной покраснения кожи является простагландин (PGD2), при этом серотонин в этой реакции играет второстепенную роль. Гепатотоксичность – это еще один побочный эффект ниацина. Метаболизм ниацина в печени происходит двумя путями: первый – объединение, путем которого производятся метаболиты никотинуровой кислоты, связанные с покраснением, и другой – амидирование, в результате которого производится NAD, связанный с гепатотоксичностью. Хотя высокие дозы ниацина могут увеличить уровень сахара в крови, тем самым ухудшая состояние больных сахарным диабетом, последние исследования показывают, что фактическое влияние вещества на уровень сахара в крови составляет всего лишь 5-10%. У пациентов с сахарным диабетом, продолжающих принимать анти-диабетические препараты, содержащие ниацин, не наблюдалось серьезных изменений уровней глюкозы в крови. Таким образом, глядя на эту картину, ниацин продолжают рекомендовать в качестве препарата для профилактики сердечно-сосудистых заболеваний у больных сахарным диабетом. Гиперурикемия – это еще один побочный эффект, возникающий при приеме высоких доз ниацина, и может привести к обострению подагры. Прием никотиновой кислоты в дозах, используемых для снижения уровня холестерина, связан с проявлением врожденных дефектов у лабораторных животных, что, возможно, также будет иметь последствия для развития плода у беременных женщин. Ниацин, особенно замедленного высвобождения, при очень высоких дозах может вызвать острые токсические реакции. Чрезвычайно высокие дозы ниацина могут также вызывать ниациновую макулопатию, утолщение желтого пятна и сетчатки глаза, что приводит к затуманиванию зрения и слепоте. Процесс макулопатии обратим после прекращения потребления ниацина.
Никотинамид
Никотинамид может быть получен из рациона, где он присутствует в основном в виде НАД+ и НАДФ+. Эти вещества гидролизуются в кишечнике, и образуемый в результате никотинамид поглощается либо сам по себе, либо после его гидролиза с никотиновой кислотой. Никотинамид в природе встречается лишь в небольших количествах. В неприготовленных продуктах никотиновая кислота присутствует в основном в виде клеточных пиридиннуклеотидов НАД и НАДФ. В ходе приготовления пищи может происходить ферментативный гидролиз коферментов. Кипение высвобождает большую часть ниацина, присутствующего в сладкой кукурузе в виде никотинамида (до 55 мг/кг).
Инозитол гексаникотинат
Одной из форм диетических добавок является инозит гексаникотинат, инозит, этерифицированный с ниацином на всех шести спиртовых группах инозитола. Инозит гексаникотинат, как правило, позиционируется как «не вызывающий покраснения кожи» ниацин в дозах 250, 500 или 1000 мг / таблетку или капсулу. Препарат доступен без рецепта, часто под маркой «ниацин», что вводит потребителей в заблуждение, которые полагают, что они получают активную форму препарата. Хотя эта форма ниацина действительно не вызывает гиперемии (покраснения), так как в его формуле есть продукты немедленного высвобождения, однако доказательства того, что препарат обладает липидомодифицирующими функциями, крайне противоречивы. Клинические испытания начала 1960-х годов (проведенных Дорнером и Уэлшем) или конца 1970-х (Зилиотто, Крузе, Агусти) трудно оценить их по сегодняшним меркам. Одно из последних из этих исследований подтвердило преимущество эфиров инозитола и ксантинола никотиновой кислоты в снижении свободных жирных кислот в сыворотке, однако другие исследования, проведенные за тот же период, не подтвердили этих данных. Исследователи говорят о том, что это в первую очередь потому, что «не вызывающие гиперемии» препараты не содержат свободной никотиновой кислоты. Последнее плацебо-контролируемое исследование было небольшим (11 человек в группе), но результаты трехмесячного применения 1500 мг / сут не показали тенденции к улучшению общего уровня холестерина, ЛПНП, ЛПВП и триглицеридов. Таким образом, до сих пор нет достаточных доказательств для того, чтобы рекомендовать инозит гексаникотинат для лечения дислипидемии. Кроме того, члены Американской ассоциация кардиологов и Национальной образовательной программы по холестерину стоят на позиции, что только ниацин может быть использован для лечения дислипидемии, и только под руководством врача. Причина этого – в том, что ниацин при эффективном потреблении 1500-3000 мг / сут также потенциально может иметь серьезные побочные эффекты. Таким образом, при приеме терапевтических доз ниацина, в том числе щелочной фосфатазы (ALP), аспартаттрансаминазы (AST) и аланинаминотрансферазы (ALT), необходимо проводить тестирование функций печени для контроля над уровнем ферментов печени.
Источники и состав
Источники и структура
 Витамин В3 состоит из двух молекул, а именно никотинамида и никотиновой кислоты, иногда в совокупности их называют «ниацин» (хотя этот термин также используется для обозначения только никотиновой кислоты), которые вместе с аминокислотой триптофана, в конечном счёте, превращаются в коферменты никотинамид-аденин-динуклеотид (НАД) и никотинамид-аденин-динуклеотид фосфат, которые передают гидриды, имеющие важное значение для множества химических реакций в клетке.1)
Рекомендуемая дневная дозировка ниацина составляет 16 мг в сутки для взрослых мужчин в 14 мг в сутки для взрослых женщин, которые несложно заполучить при нормальном рационе, так как витамин В3 и другие эквиваленты ниацина (молекулы, которые, в конечном счёте, могут быть преобразованы в НАД или НАДФ) обнаруживаются во всех животных, растительных и грибных пищевых источниках из-за его так называемой вездесущности в фундаментальной биохимии. Однако ниацин более всего распространён в мясе, яйцах, рыбе, молочных продуктах, некоторых овощах и цельной пшенице. В добавок, недавно выяснилось, что эквивалент ниацина, известный как рибозид может быть обнаружен в коровьем молоке.2)
Витамин В3 также доступен в форме фармацевтических добавок, что описано в разделе «Составы и варианты».
Витамин В3 состоит из двух молекул, а именно никотинамида и никотиновой кислоты, иногда в совокупности их называют «ниацин» (хотя этот термин также используется для обозначения только никотиновой кислоты), которые вместе с аминокислотой триптофана, в конечном счёте, превращаются в коферменты никотинамид-аденин-динуклеотид (НАД) и никотинамид-аденин-динуклеотид фосфат, которые передают гидриды, имеющие важное значение для множества химических реакций в клетке.1)
Рекомендуемая дневная дозировка ниацина составляет 16 мг в сутки для взрослых мужчин в 14 мг в сутки для взрослых женщин, которые несложно заполучить при нормальном рационе, так как витамин В3 и другие эквиваленты ниацина (молекулы, которые, в конечном счёте, могут быть преобразованы в НАД или НАДФ) обнаруживаются во всех животных, растительных и грибных пищевых источниках из-за его так называемой вездесущности в фундаментальной биохимии. Однако ниацин более всего распространён в мясе, яйцах, рыбе, молочных продуктах, некоторых овощах и цельной пшенице. В добавок, недавно выяснилось, что эквивалент ниацина, известный как рибозид может быть обнаружен в коровьем молоке.2)
Витамин В3 также доступен в форме фармацевтических добавок, что описано в разделе «Составы и варианты».
Биологическое значение
Витамин В3 является одним из основных витаминов, являясь предшественником молекул, которые играют важную роль в окислительно-восстановительных реакциях в клетках; в конечном итоге, он может способствовать антиоксидантному и метаболическому эффекту в качестве ферментного кофактора. Он существует в двух основных формах: никотинамида и никотиновой кислоты. Независимо от формы употребляемого вещества, витамин В3 в итоге преобразуется в организме в нуклеотид, известный как никотинамид-аденин-динуклеотид (НАД), который существует в окисленной (НАД+) и подавленной (НАДФ) формах; они оба составляют окислительно-восстановительный комплекс. NAD+ могут фосфолирироваться в НАДП+, который может затем подавляться в НАДФ. НАДХ и НАДФ действуют в качестве кофактора для многих антиоксидантных ферментов в клетке (глутатионредуктазе, каталазе и супероксиддисмутазе) и обеспечивают снижение эквивалентов для них, и они могут снова образовывать НАД+ и НАДП+ соответственно.3) НАДХ и НАДФ также играют роль в окислительно-восстановительных реакциях в АДФ-рибозе, которые необходимы для многих регуляторных изменений в клетке, например, от регуляции кальциевого канала до воздействия на эндокринные изменения и регуляцию апоптоза. Витамин В3 преобразуется в НАДХ и НАДФ, которые используются многими антиоксидантными ферментами в клетке для преобразования химических процессов при окислительно-восстановительных реакциях. Витамин В3 может взаимодействовать с многочисленными ферментами в качества кофактора изменения их действия. Биосинтез биологически активного витамина В3 зависит от конвертации витамина (ниацина или никотинамид) в никотин-амидаденин-динуклеотид (НАД+) после употребления. Это превращение вовлекает различные пути для ниацина и ниацинамида. Ниацин изначально имеет фосфорибозную группу, добавленную за счёт фермента никотината фосфорибозилтрансферазы, который образует никотинат мононуклеотид (НаМН), а он, в свою очередь, затем аденилируется с помощью мононуклеотида аденилилтрансферазы для образования никотината аденин динуклеотида (НаАД), который, в конечном счёте, амидируется для образования НАД+. Для никотинамида требуется на один шаг менше, так как у него уже имеется фосфорибозильная группа в никотинамид фосфорибозилтрансферазе, за которой следует аденилирование с помощью мононуклеотида аденилтрансферазы для образования НАД+. Затем НАД+ имеет потенциал для того, чтобы быть фосфорилированным в НАДП+ в пероксисомах или митохондриях.4) В случаях, когда в рационе человека недостаточно витамина В3, может происходит синтез НаМН из L-триптофана в размере, соответствующем 1 мг витамина В3 на 67 мг употреблённого L-триптофана, что свидетельствует о том, что синдром дефицита (пеллагра) может быть частично предотвращён при достаточном употреблении белка. Биологически активные формы витамина В3 могут использоваться несколько раз в клетках человека, так как никотинамид, образованный из НАД+ может преобразовываться при помощи фермента никотинамида фосфорибозилтрансферазы (НАМФТ или висфатина); в этом случае происходит новое формирование никотинамид мононуклетоида, который затем превращается обратно в НАД+.5) Предшественники биологически активного витамина В3 активируются тогда, когда они связываются с сахаром (рибозой) и затем изменяются в организме. В случаях низкого потребления витамина В3 аминокислота L-триптофан может использоваться для образования витамина В3.
Составы и варианты
Ниацин (никотиновая кислота) является основной формой добавок витамина В3, продающаяся в качестве мгновенно высвобождающегося ниацина, который усваивается и абсорбируется достаточно быстро; однако в качестве побочного эффекта может проявляться покраснение. Ниацин также может быть представлен в форме препарата с устойчивым высвобождением, в котором ниацин высвобождается в течение длительных периодов, оказывая негативное влияние на печень.6) Фармацевтические препараты с пролонгированным высвобождением существуют и имеют среднюю степень высвобождения, которая как раз и называется пролонгированным высвобождением: «Ниаспан» является торговым названием ниацина с пролонгированным высвобождением, который создан с целью снижения вероятности побочного эффекта в виде покраснения, который связывают с высокими пиковыми уровнями ниацина в крови; также отмечается снижение уровня негативного воздействия на печень. Ниацин является первичной формой витамина В3, используемой в добавках. Он бывает 3 форм: мгновенно высвобождающийся (может вызывать покраснения), устойчиво высвобождающийся (может негативно влиять на печень) и пролонгированно высвобождающийся, который переносится лучше всего Ниацинамид (синонимичен с никотинамидом) не вызывает покраснений, как ниацин, так как ниацин вызывает этот побочный эффект из-за воздействия на рецептор HM74A; рецептор также связывают с эффектом подавления липидов, а ниацинамид никак не воздействует на данный рецептор.7) Никотинамид является аминовой формой ниацина, которая проявляет некоторые биологические эффекты; не связана с покраснением и снижением холестерина, которые наблюдаются при употреблении ниацина. Рибозид никотинамида является нуклеозидом, который состоит из ниацинамида и рибозы, которая может увеличивать общую концентрацию НАД при пероральном употреблении у животных;8) это вещество обнаруживается в небольших количества в некоторых продуктах, например, в сывороточном белке или пекарных дрожжах. Рибозид никотинамида может также быть синтезирован in vitro.9) Рибозид никотинамида является относительно новой формой добавок витамина В3, которая является активной в ходе перорального употребления её животными. С ней не связывают эффект покраснения, так как она содержит никотинамид, а не ниацин. Другой альтернативной формой является инозитол гексаникотинат (ИГН); инозитол является основой этой молекулы, в то время как шесть молекул ниацина связаны с ней за счёт карбоновых связей. Также известно, что это вещество всасывается из кишечника10) со значением биодоступности в 70%. Считается, что всасывание происходит без затрагивания химического состава молекулы, в ходе метаболизма происходит высвобождение ниацина. Увеличение ниацина в сыворотке крови отмечается у людей, которые употребляли ИНГ, уже через 6-12 часов, в то время как при употреблении свободной формы ниацина этот же процесс происходил через час; общий уровень высвобождения ниацина является недостаточным для проявления покраснений и снижения холестерина. Тем не менее, считается, что данное вещество имеет некоторые биологические эффекты, например, снижение уровня фибриногена, улучшение вазодилатации и вязкости крови, способствует улучшению транспортировки кислорода. Употребление 1000 мг приводит к достижению его в сыворотке крови на уровне 30 мкг на мл, такая же дозировка ИНГ (соответствует 910 мг ниацина) приводит к пиковым значениям в плазме крови на уровне 200 нг на мл (0,2 мкг на мл); таким образом, 2400 мг ИНГ привели к достижению уровня ниацина в сыворотке крови на уровне 0,1 мкг на мл. В то время как добавки инозитола гексаникотината являются биоактивными при пероральном употреблении, считается, что он может высвобождать достаточно ниацина для проявления покраснения и снижения холестерина.
Молекулярные мишени
Рецепторы никотиновой кислоты (ниацин)
Ниацин, по-видимому, имеет несколько рецепторов, которые действуют как рецепторы никотиновой кислоты. Главным из них является GRP109A (альтернативное название – PUMA-G у мышей и HM74A у людей), который представляет собой рецептор G-белка в сочетании в Gi. Существует два подвида этого рецептора, у людей наиболее схожий (HM74A или GRP109A, или HM74b в одном отчёте) реагирует на ниацин, в то время как лишь немного похожий подвид (HM74 или GRP109B) не достигает 1мм.11) Эти рецепторы изначально расположены на адипоцитах и спленоцитах, они также располагались на макрофагах.12) Активация рецепторы стимулирует высвобождение простаноидов, которые, как считается, способствуют реакции покраснения за счёт ниацина. Другие эндогенные лиганды для этого рецептора включают короткую цепную жирную кислоту бутират и кетоновые тела бета-гидроксибутират, в то время как препараты с такими же целями включают в себя ацифран и аципимокс, а также различные низкомолекулярные фенольные соединения.13) Рецептор, известный как HM74A, является рецептором ниацина, который обнаруживается в адипоцитах и клетках селезёнки. Активация этого рецепторы вызывает некоторые эффекты, являющиеся уникальными для добавок ниацина, например, покраснения; невосприятие рецептором никотинамида объясняет отсутствие покраснений при его употреблении.
Простагландин Д2 (ниацин)
Вторичный к воздействию на рецептор HM74A, ниацин индуцирует высвобождения простагландина Д2 (ПГД2) за счёт бета-аррестина1 в эпидермальных клетках, известных как Лангергансы.14) Этот эффект проявляется достаточно быстро при пероральном употреблении 500 мг ниацина субъектами, которые испытывали покраснение, которое выявлялось уже на уровне сыворотки крови при помощи его метаболитов 9алфа и 11бета-ПГД2. Так как выработка простагландинов требует активности ферментов циклооксигеназы (ЦОКС), выработка простагландинов из ниацина может частично снижаться из-за воздействия ингибиторов ЦОКС, например, аспирина.15) Рецептор, с помощью которого ПГД2 действует (рецептор ДП1), может также быть блокированным, что связано с механизмом фармацевтического ларопипранта, который обычно назначают с ниацином для улучшения усвояемости. Ниацин увеличивает концентрации простагландина ПГД2 в крови за счёт активации HM47A, участвующего в приведении в действие рецептора ПГД2, что может вызвать покраснения. Препараты, которые блокируют циклооксигеназу или рецептор ДП1, могут помочь избежать возникновения этого побочного эффекта.
Отток холестерина (ниацин)
АТФ-связывающий кассетный транспортер А1, более известный под аббревиатурой АВСА1, является мембранным белком, который играет важную роль в выработке сывороточного липопротеина высокой плотности (ЛПВП). Его транскрипция увеличивается в ответ на инкубацию ниацина в клетках печень через регуляторный элемент DR4, который связывает транскрипционный фактор LXRальфа; LXRальфа, сам по себе, и LXRбета не проявляются в зависимости от показателей ниацина.16) Возможно (но не подтверждено), что эффекты ниацина на АВСА1 в клетках печени опосредуются через рецептор ниацина HM74A, так как известно, HM74A связан с экспрессией PPARгамма; индукция его эндогенного лиганда в макрофагах и адипоцитах является путём расширения от PPARгамма к АВСА1 за счёт LXRальфа. Исследование на макрофагах показало, что эффект ниацина на PPARгамма зависит от синтеза простагландина за счёт HM74A, действуя через фосфолипазу А2 и ЦОКС1. Ниацин увеличивает уровни мембранного белка, известного как АВСА1, который играет важную роль в образовании «хорошего» холестерина. Повышенная активность АВСА1 из-за ниацина была продемонстрирована in vitro, за счёт неё произошло увеличение липидизации аполипопротеина АИ (АпоАИ) или включение холестерина и фосфолипидов в структуру АпоАИ, что приводит к повышению липидного оттока из клетки. Этот повышенный отток происходит благодаря увеличению активности АВСА1 в общем; он не ограничен увеличением индукции ниацина. АпоАИ является основным компонентом «хорошего» холестерина17) (явно может показывать вероятность смерти от сердечно-сосудистых заболеваний), и процесс липидизации является основным шагом в синтезе «хорошего» холестерина, поэтому увеличение липидизации АпоАИ за счёт увеличения активности АВСА1, в конечном счёте, приводит к увеличению уровней «хорошего» холестерина в сыворотке крови. Ниацин не действует на синтез АпоАИ, сам по себе, и он18) также не увеличивает темпы синтеза фосфолипидов или холестерина в клетках печени. Способность ниацина подавлять синтез ЛПОНП при разовом его употреблении может быть связано с этим механизмом, так как, в то время как это не было продемонстрировано напрямую с ниацином, активация АВСА1, как считается, может уменьшать уровни секреции ЛПОНП.19) Ниацин, по-видимому, может увеличивать активность АВСА1, что приводит к большему оттоку липидов из печени. Этот механизм может лежать в основе синтеза «плохого» холестерина (за счёт увеличения липидизации аполипопротеина АИ) и снижения триглицеридов за счёт снижения секреции ЛПОНП. Эти эффекты касательно АпоАИ были подтверждены клинически; увеличение содержащих АпоАИ липидов в крови субъектов было подтверждено при употреблении ниацина, хотя тестирование проводилось на субъектах с низким уровнем «плохого» холестерина. Употребление ниацина, как выяснилось, приводит к увеличению сывороточных уровней АпоАИ.
ПАРП-1 (Никотинамид)
Фермент поли(АДП-рибоза) полимераза 1 (ПАРН-1) расположен в ядре клетки, и при употреблении свободного НАД+, который превращается в АДП-рибозу, затем распределяется по различным факторам ядерной транскрипции, чтобы помочь им работать должным образом; этот процесс называется АДФ-рибозилирование; ингибирование ПАРП-1 может снизить активность транскрипционных факторов, влияющих на него, а предоставление большего количества НАД+ без воздействия на ПАРП-1 может увеличить его активность.20) ПАРП-1, в основном, известен как элемент, играющий важную роль в репарации ДНК, и его ингибирование может способствовать увеличению чувствительности раковых клеток к противораковой терапии. Мишени ПАРП-1 для АДФ-риболизирования включают NF-kB21) (в процессе, опосредованном CREB-связывающим белком) и ПАРП-1 сам по себе, так как он саморегулирует свою функцию за счёт АДФ-риболизирования. Другие белки необязательно взаимодействуют с ПАРП-1, так как им необходима АДФ-рибоза, но лишь в тех ситуациях, где НАД+ истощается; ПАРП-1 физически взаимодействует с белком никотинамидом мононуклеотидом аденилилтрансферазой 1 (НМНАТ-1) для помощи в стимулировании выработки локального НАД+ и увеличения активности ПАРП-1 зависимым от НАД+ образом. ПАРП-1 также взаимодействует косвенно с сиртуином 1 (СИРТ1), белком, который регулирует энергетический баланс в клетке за счёт общего НАД+, уровни которого чувствительны к СИРТ1; ингибирование ПАРП-1 увеличит активность СИРТ1. ПАРП-1 является центральным белком в клетках ядра, облегчая действие других белков, которые вовлечены в обеспечение клеточной выживаемости за счёт отдачи поли-АДФ-рибозы для обеспечения их оптимальной работы. Эта молекула состоит из НАД+, который, в свою очередь, состоит из витамина В3; действие этого белка зависит преимущественно от доступности НАД+. ПАРП-1 регулируется статусом никотинамида в клетке, в это время ниацин обеспечивает НАД+ для работы фермента; никотинамид (косвенный источник НАД+ за счёт ферментов НМНАТ) может ингибировать фермент in vitro, хотя продемонстрировать этот эффект in vivo не удалось.22) Никотинамид является ингибитором ПАРП-1 in vitro, но не in vivo.
Фармакология
Абсорбция
Ниацин, как известно, всасывается из тонкой кишки довольно быстро (в течение 5-20 минут23)). Ниацин может всасываться из желудка, и, по крайней мере, у грызунов уровень поглощения ниацина из кишечника, по-видимому, не изменяется в процессе старения. Инозитол гексаникотинат (ИНГ), часто рекламируемый в качестве ниацина без побочного эффекта в виде покраснений, как правило, всасывается из кишечника со средним уровнем абсорбции, составляющем 70% (хотя уровень абсорбции варьирует, иногда значительно отклоняясь от средних значений).
Транспортировка в сыворотке крови
Стандартная фармацевтическая дозировка 1-3 г ниацина может приводить к его увеличению в сыворотке крови на 100-500 мкм, причём этот процесс является дозозависимым; употребление 2 г отражает в сыворотке крови в концентрации 300 мкм. Пиковые значения в сыворотке крови достигаются спустя 0,5-1 час после употребления однократной дозы. ИНГ, однако, достигает значительно более низких концентраций в сравнении с такими же дозировками ниацина; 1000 мг ИНГ (соответствует 910 мг ниацина) достигается пикового значения концентрации в сыворотке крови на уровне 2 мкм. Ниацин достигает своих пиковых значений при употреблении в форме ИНГ через 6-12 часов.24)
Метаболизм
Ниацин в значительно степени метаболизируется в печени при поглощении одним из двух способов: либо он сопрягается с глицина (эти метаболиты могут вызывать покраснения), либо они амидируется с образованием никотинамида. Никотинамид может преобразовываться в метаболит 1-метилникотинамида (МНА) за счёт фермента никотинамида N-метилтрансферазы в печени; этот промежуточный метаболит, как известно, является биоактивным перорально и местно, а также может в дальнейшем метаболизироваться в 1-метил-2-пиридон-5-карбоксамид (М2ПИ) или 1-метил-4-пиридон-5-карбоксамид (М4ПИ) за счёт фермента альдегидоксидазы. Альтернативный метаболический путь для никотинамида включает его превращение в никотинамид N-оксид (N-OX).25) При употреблении ИНГ, по-видимому, его всасывание происходит напрямую; его скорость гидролиза высвобождать ниацин в поток крови является очень низкой, что может быть причиной низких пиковых концентраций ниацина, отмечаемых при употреблении ИНГ.
Выведение
Около 75% ниацина выводится через мочу через 96 часов в качестве немодифицированного ниацина или его метаболитов. Все три метаболита никотинамида, N-OX или два продукта 1-метилникотинамида (М2ПИ и М4ПИ) могут обнаруживаться в человеческой моче.
Воздействие на организм
Неврология
Инсульт
 У крыс употребление 20-80 мг ниацина на кг массы тела спустя два часа после инсульта (MCAO индуцированного), как представляет, может способствовать сохранению функциональных параметров, в то время как 40 мг на кг массы тела снижали уровень инфаркта; эта дозировка ассоциируется с большими показателями VEGF и меньшими TNF-альфа (VEGF является нейропротекторным за счёт активации PI3K / Akt). Так или иначе, 40 мг ниацина на кг массы тела могут увеличивать ангиогенез у крыс после инсульта (ангиогенез также связывают с повышенной активностью VEGF).26)
Изучение риска инсульта у животных с диабетом I типа является полезным, так как диабет связывают с повышенным риском инсульта и более слабым восстановлением после инсульта. При употреблении вещества спустя 24 часа после инсульта и затем в течение 28 дней крысами с диабетом I типа выяснилось, что ниацин в концентрации 40 мг на кг массы тела вызывал улучшение показателей сосудистого и аксонового27) ремоделирования.
По-видимому, ниацин, употребляемый в течение короткого периода времени сразу после инсульта у крыс, имел защитный эффект у крыс, в то время как продолжительное употребление ниацина после инсульта, индуцированного у крыс, могло благотворно влиять на сам процесс реабилитации.
Влияние ниацина на инсульт у людей пока что однозначно не выяснено, чем благотворное его влияние у животных. Ранее исследование на основе 3 г ниацина, принимаемого мужчинами, которые испытали ИМ, показало снижение риска возникновения инсульта. Ещё одно исследование, известное под аббревиатурой AIM-HIGH, где ниацин (до 2000 мг в сутки) добавлялся к симвастатиновой терапии, покзаало благотворное влияние на сердечно-сосудистую систему у пациентов с сердечно-сосудистыми заболеваниями, низким уровнем «хорошего» холестерина и высоким уровнем триглицеридов. Исследование было прекращено раньше запланированного срока из-за очевидности его провальных результатов; были сделаны предположения, что ниацин может увеличивать риски ишемического инсульта.28) Дополнительный анализ продемонстрировал, что существует увеличение доли пограничных состояний инсульта (95% ДИ коэффициент составил 1,00-3,17; P=0,050), хотя многомерный анализ показал, что употребление ниацина является статистически неважным фактором касательно этого повышенного риска; тем не менее, ниацин не оказывает никакого благотворного влияния касательно инсульта.
В добавок, мета-анализ показал отсутствие влияния ниацина на инсульт, показатель отношения шансов (ОШ) составил 0,99 (95% ДИ: 0,5-1,54), хотя удаление результатов AIM-HIGH из мета-анализа действительно вело к значительному снижению риска развития инсульта (ОР 95% ДИ 0,58-0,92).29) Более поздний мета-анализ также показал отсутствие общего риска инсульта (Р 95% 0,75-1,22), хотя в подгруппе исследований, где пациенты не лечились статинами, отмечается снижение риска инсульта у пациентов с пограничными состояниями (ОР 95% ДИ 0,61-1,00, Р=0,05).
Данные по людям, которые пока что не являются совсем достоверными, показали, что сам по себе ниацин может снижать риски проявления инсульта у лиц, не принимающих статины, но ниацин не оказывает дополнительного благотворного влияния у лиц, уже принимающих статины.
У крыс употребление 20-80 мг ниацина на кг массы тела спустя два часа после инсульта (MCAO индуцированного), как представляет, может способствовать сохранению функциональных параметров, в то время как 40 мг на кг массы тела снижали уровень инфаркта; эта дозировка ассоциируется с большими показателями VEGF и меньшими TNF-альфа (VEGF является нейропротекторным за счёт активации PI3K / Akt). Так или иначе, 40 мг ниацина на кг массы тела могут увеличивать ангиогенез у крыс после инсульта (ангиогенез также связывают с повышенной активностью VEGF).26)
Изучение риска инсульта у животных с диабетом I типа является полезным, так как диабет связывают с повышенным риском инсульта и более слабым восстановлением после инсульта. При употреблении вещества спустя 24 часа после инсульта и затем в течение 28 дней крысами с диабетом I типа выяснилось, что ниацин в концентрации 40 мг на кг массы тела вызывал улучшение показателей сосудистого и аксонового27) ремоделирования.
По-видимому, ниацин, употребляемый в течение короткого периода времени сразу после инсульта у крыс, имел защитный эффект у крыс, в то время как продолжительное употребление ниацина после инсульта, индуцированного у крыс, могло благотворно влиять на сам процесс реабилитации.
Влияние ниацина на инсульт у людей пока что однозначно не выяснено, чем благотворное его влияние у животных. Ранее исследование на основе 3 г ниацина, принимаемого мужчинами, которые испытали ИМ, показало снижение риска возникновения инсульта. Ещё одно исследование, известное под аббревиатурой AIM-HIGH, где ниацин (до 2000 мг в сутки) добавлялся к симвастатиновой терапии, покзаало благотворное влияние на сердечно-сосудистую систему у пациентов с сердечно-сосудистыми заболеваниями, низким уровнем «хорошего» холестерина и высоким уровнем триглицеридов. Исследование было прекращено раньше запланированного срока из-за очевидности его провальных результатов; были сделаны предположения, что ниацин может увеличивать риски ишемического инсульта.28) Дополнительный анализ продемонстрировал, что существует увеличение доли пограничных состояний инсульта (95% ДИ коэффициент составил 1,00-3,17; P=0,050), хотя многомерный анализ показал, что употребление ниацина является статистически неважным фактором касательно этого повышенного риска; тем не менее, ниацин не оказывает никакого благотворного влияния касательно инсульта.
В добавок, мета-анализ показал отсутствие влияния ниацина на инсульт, показатель отношения шансов (ОШ) составил 0,99 (95% ДИ: 0,5-1,54), хотя удаление результатов AIM-HIGH из мета-анализа действительно вело к значительному снижению риска развития инсульта (ОР 95% ДИ 0,58-0,92).29) Более поздний мета-анализ также показал отсутствие общего риска инсульта (Р 95% 0,75-1,22), хотя в подгруппе исследований, где пациенты не лечились статинами, отмечается снижение риска инсульта у пациентов с пограничными состояниями (ОР 95% ДИ 0,61-1,00, Р=0,05).
Данные по людям, которые пока что не являются совсем достоверными, показали, что сам по себе ниацин может снижать риски проявления инсульта у лиц, не принимающих статины, но ниацин не оказывает дополнительного благотворного влияния у лиц, уже принимающих статины.
Сердечно-сосудистые заболевания
Атеросклероз
Повреждение и гибель эндотелиальных клеток человек путём окисления ЛПНП считается необходимым условием развития атеросклероза; может быть снижено in vitro при употреблении 250-1000 мкм ниацина путём сокращения воспалительных молекул, включая NF-kB p65 и notch1, в то время как макрофаги также секретируют менее воспалительные цитокины с помощью того же рецептора в диапазоне 500-1000 мкм через действие ниацина на его рецепторы, включая GPR109A у мышей (известный как HM74A у людей).30) Пенные клетки также вносят свой вклад на ранних стадий атеросклероза, они формируются в тот момент, когда макрофаги потребляют или содержат избыточные уровни холестерина. Ниацин помогает снизить образование пенных клеток за счёт индукции транскрипции макрофагов PPARгамма, которая приводит к двум эффектам: увеличивает образование CD36 («мусорный» рецетор, который чувствует и поглощает окисленный «плохого» холестерин; регулируется с помощью PPARгамма31)), а также регуляцию АВСА1 (под воздействием PPARгамма), который экспортирует липиды из клетки в частицы «хорошего» холестерина,32) что приводит к общему снижению образования пенных клеток. Ниацин может также снижать образование пенных клеток через другой механизм при использовании фермента CD38 в синтезе лизосомальной молекул NAADP, которая регулирует холестериновый лизосомальный отток холестерина. Другой механизм, с помощью которого ниацин может предотвратить атеросклероз, происходит на уровне дифференциации и миграции макрофагов: М1 и М2 способствуют адаптивному балансу, причём атеросклеротическое поражение формируется с помощью макрофагов М1, в то время как макрофаги М2 секретируют противовоспалительные цитокины. Дифференциация макрофагов в фенотип М1 (индуцированный с помощью IFN-гамма) может быть снижена в момент, когда ниацин действует на его макрофаговые рецепторы (в концентрациях, сравнимых с теми, что используются для снижения холестерина), их хемотаксис в атеросклеротических поражениях, вызванных MCP-1, снижается.33) Исследования in vitro показали, что ниацин может в теории предотвращать образование атеросклеротических бляшек за счёт снижения уровня воспаления и повреждения эндотелия стенки через несколько механизмов. Морские свинки, получавшие высокую дозировку ниацина (100 мг на кг массы тела) испытали снижение воспаления аорты и отложений липидов в артериальной стенке, снижение атеросклероза отмечается у мышей, употреблявших ниацин (0,3% от рациона; дозировка, влияющая на улучшение уровня холестерина), причём сам процесс происходит в зависимом от связывания ниацина образом; необязательно отмечается изменение уровня холестерина. Ограниченные исследования на животных показали, что пищевой ниацин в дозировках, пригодных для снижения холестерина, снижает отложение бляшек на стенках сосудов, задерживая формирование атеросклероза. В исследовании с использованием группы плацебо у людей, отмечается что употребление 1000 мг ниацина ежедневно в течение года пациентами, которые лечились также статинами и у которых отмечается изначально низкий уровень «хорошего» холестерина и ишемическая болезнь сердца, отмечается незначительная тенденция по приостановке изменения толщины комплекса «Интима-медиа» по сравнению с плацебо (P=0,08). Другое исследование с использованием 1500 мг ниацина, который был добавлен к статиновой терапии пациентом старше 65 лет с атеросклерозом, показало дополнительное улучшение в сравнении с плацебо в снижении объёма бляшек в стенках артерий спустя 18 месяцев лечения; хотя, на самом деле, улучшения отмечаются в обеих группах. Тем не менее, менее масштабное исследование с использование более высокой дозировки (2г) в течение 1 года пациентами, которые уже лечились статинами при наличии у них диабета II типа и ишемической болезни сердца или периферического атеросклероза с низким уровнем «хорошего» холестерина», показало значительное снижение объёма стенки сонной артерии по сравнению с плацебо.34) Исследования на людях показали, что ниацин обеспечивает прогресс в состоянии атеросклероза, но преимущественно у тех пациентов, которые уже употребляют статины. Дозировка в 2 г может оказывать некоторый эффект у пациентов, принимающих статины на фоне атеросклероза; эффективность более низких дозировок не выяснена.
Кровоток и вазорелаксация
Одно исследование касательно употребления ниацина с оценкой кровотока предплечья не показало никакого эффекта при употреблении 1 г в течение двухнедельного курса относительно здоровыми субъектами, 1500 мг пролонгированного высвобождения ниацина у мужчина с метаболическим синдромом не повлияло на проточно-опосредованную дилатацию (ПОД). В рамках одного исследования не удалось выявить воздействия ниацина на ПОД у пациентов с ишемической болезнью сердца; улучшения отмечаются лишь у подгруппы с низким уровнем «хорошего» холестерина.35) У субъектов с низким уровнем «хорошего» холестерина 1 г пролонгированного высвобождения ниацина в течение одного недели показал увеличение кровотока (за счёт ПОД) на 4,5%; этот механизм не был связан с простагландином, так как ларопипрант (ингибитор простагландина Д2) не показал никакого воздействия. Данный эффект также совпал с увеличением косвенного (но не всег) билирубина на 62%. Так как желчные кислоты билирубина являются антиоксидантном эндотелия, и в ходе этого исследования было выявлено благотворное влияние, зависимое от оксида азота; считается, что предохраняющий эффект билирубина касательно биодоступности билирубина лежит в основе наблюдаемого преимущества. И увеличение билирубина, и улучшения в кровотоке прекратились спустя неделю после отмены употребления ниацина. У субъектов, которые ранее перенесли инфаркт миокарда, а затем употреблявших ниацин (вместе с ларопипрантом), отмечается увеличение зависимого от оксида азота кровотока через двенадцать недель терапии наряду с индуцированной нитроглицерином вазодилатацией, оба из которых не коррелировали с изменениями в триглицеридах.36) Такие же улучшения в кровотоке были отмечены у ВИЧ-инфицированных пациентов с низким уровнем «хорошего» холестерина, употреблявших ниацин отдельно.37) Может отмечаться улучшение в кровотоке, связанное с употреблением ниацина, в то время как продолжительное его употребление может повлиять на данный фактор лишь у субъектов с изначально низким уровнем «хорошего» холестерина.
Кровяное давление
Ниацин, как известно, влияет на диаметр кровеносных сосудов, особенно это проявляется на фоне покраснения от ниацина, которое проявляется на фоне кожной вазодилатации (расширение сосудов к коже); на этом фоне были сделаны предположения, что он воздействует на кровяное давление за счёт увеличения ширины артерий и вен. Тем не менее, в ходе одного обзора отмечается, что возможный эффект снижения кровяного давления за счёт ниацина происходит независимо от простагландина, который опосредует покраснение, известный ещё как ПГД2. Настойки ниацина, как было отмечено, при разовом употреблении могут снижать кровяное давление у гипертоников при отсутствии эффекта у пациентов с нормальным артериальным давлением; это связано с увеличением сердечного выброса и частоты сердечных сокращений, совпадающих у обеих групп. Другое исследование подтвердило данный факт, также выяснилось, что 24-часовое амбулаторное кровяное давление не затрагивается при употреблении 1 г ниацина в течение двух недель относительно здоровыми субъектами. С точки зрения эффектов хронического употребления ниацина на кровяное давления, в ходе одного обзора, при котором обычно измерялось кровяное давление у гипертоников,38) не было выявлено статически значимого долгосрочного снижения кровяного давления, связанного с употреблением ниацина, хотя методология исследования для измерения изменений кровяного давления не была идеальной, согласно авторам обзора. Так или иначе, в обзоре отмечается, что в ходе одного масштабного исследования (Проект исследования противоишемических препаратов), который изначально не показал никакого влияния ниациновой терапии на кровяное давление; однако в ходе post-hoc анализа выяснилось, что у субъектов с метаболическим синдромом происходило умеренное (на 2,2 мм рт. ст.) снижение систолического артериального давления с одновременным (на 2,9 мм рт. ст.) снижение диастолического давления. Post-hoc анализ другого клинического испытания показало, что систолическое кровяное давление было уменьшено на 2,2 мм рт. ст., а у пациентов с дислипидемией – на 2,7 в сравнении с группой плацебо через 24 недели. Ниацин, по-видимому, может снижать кровяное давление в краткосрочной перспективе у гипертоников, хотя изменения кровяного давления в долгосрочной перспективе не выяснены; некоторые доказательства склоняются к его способности незначительно снижать кровяное давление у пациентов с дислипидемией.
Триглицериды
Ниацин, по-видимому, может снижать уровень триглицеридов в крови за счёт ингибирования синтеза жирных кислот, а также этерификации для образования триглицеридов в печени, которая увеличивает скорость деградации аполипопротеина В с одновременной снижением его секреции в клетках печени.39) Механизм, с помощью которого ниацин осуществляет этот эффект, происходит через прямо и неконкурентное ингибирование диацилглицерол ацетилтрансферазы 2 (ДГАТ2), финального фермента в синтезе триглицеридов в клетках печени; процесс осуществляется без ингибирования ДГАТ1. Эффекты ниацина на синтез триглицеридов могли задействовать липопротеины очень низкой плотности (ЛПОНП) в сыворотке крови, где ниациновая терапия в течение 16 недель у субъектов с неалкогольным жировой болезнью печени (НАЖБП) могла снижать ЛПОНП в сыворотке крови, а также комплексы триглицеридов и аполипопротеинов В в сравнении с плацебо с потенциалом, сравнимым с фенофибратом. Ниацин проявляет свой эффект за счёт снижение печёночной секреции ЛПОНП, хотя это не приводит к увеличению количества триглицеридов в печени даже при НАЖБП.40) В дополнение в этому эффекту на печень, ниацин может подавлять высвобождение свободных жирных кислот из жировой ткани, которая, как правило, подвергается реэтерификации в качестве триглицеридов в печени, а затем секреции за счёт ЛПОНП. Тем не менее, этот специфичный механизм, опосредованный с помощью рецептора HM74A, не является релевантным по отношению к свойствам ниацина снижать триглицериды. Ниацин, по-видимому, может снижать синтез триглицеридов в клетках печени, что, в конечном итоге, снижает сывороточные уровни ЛПОНП и АпоВ наряду с сывороточными триглицеридами. Подавление высвобождения свободных жирных кислот из адипоза могут не играть существенную роль в снижении сывороточных триглицеридов, тем не менее. Благотворное влияние на триглицериды может произойти в течение недели употребления ниацина в концентрации 1 г, хотя и в совсем незначительной степени около 4%. Употребление 1500-2000 мг ниацина в течение года с последующими обследованиями в течение года лицами, которые уже употребляют статины и у которых отмечается низкий уровень «хорошего» холестерина, привело к снижению триглицеридов на 28,6% (при употреблении только статинов – на 8,1%). Ниацин, по-видимому, снижает уровни триглицеридов. Существует такое явление как «отскок жирных кислот», наблюдаемый на фоне употребления ниацина в качестве его первичного действия на рецептор HM74A в адипозных тканях - в них может наблюдаться снижение липолиза и уменьшение секреции неэтерифицированных жирных кислот (НЭЖК) в крови и улучшение сохранения адипоза; это вполне обратимое явление, так как уже в первый день непрерывного воздействия отмечается чистое увеличение НЭЖК, а не их подавление,41) изменения на НЭЖК не отражают изменений в триглицеридах. Неэтерифицированные жирные кислоты (НЭЖК, синонимично со свободными жирными кислотами или СЖК), как известно, подвергаются влиянию при употреблении ниацина, в ходе которого наблюдается эффект «отскока», в то время как этот отскок соответствует некоторым эффекта ниацина, он всё же больше всего зависит от эффектов ниацина на триглицериды.
Холестерин
Самым первым механизмом, который объясняет улучшение холестериновых профилей в сыворотке крови, являлось снижение высвобождения неэтерифицированных жирных кислот (НЭЖК) из тканей; механизм более не считается механизмом хронического употребления ниацина, связанного с увеличением показателей, нежели снижением; рецептор HM74A является доступным в условиях эффекта ниацина у мышей,42) в то время как другие лиганды HM74A (аципимокс и MK-0354) были менее эффективными или вообще неэффективными касательно холестерина соответственно. Считается, что влияние ниацина на сывороточные НЭЖК не является главным определяющим фактором воздействия на уровни холестерина; современные теории отражают данные касательно увеличения их синтеза или снижения его катаболического уровня. Несмотря на известное улучшение показателей «хорошего» холестерина за счёт использования ниацина, существует лишь базовое понимание этого эффекта. Идея о том, что эффект отскока, наблюдаемый с ниацином, связан с его воздействием на уровень холестерина, не является более актуальной. Первый потенциальный механизм включает синтез «хорошего» холестерина в печени за счёт увеличения транскрипции гена АВСА 1 (который зависит от связывания LXRальфа с промоторной областью DR4 этого гена). Активность АВСА1 способствует «липидизации» основного белка «хорошего» холестерина, известного как аполипопротеин А-И (АпоАИ) за счёт его увеличения, связанного с фосфолипидами и холестерином; это является обязательным шагом в синтезе «хорошего» холестерина, который увеличивается при употреблении 500-1000 мкм ниацина in vitro. Этот механизм не был подтверждён, в то время как АпоАИ может увеличиться наряду с увеличением «хорошего» холестерина у субъектов, принимающих ниацин, с изначально низким уровнем «хорошего» холестерина, LXRальфа требуется коактиватор (PPARгамма) для оказания данного эффекта, который активируется при помощи рецептора ниацина. Так или иначе, активность рецептора ниацина не нужна для его оказания эффекта на уровни холестерина,43) что предполагает необходимость воздействия других механизмов. Другая теория, относящаяся в синтезу «хорошего» холестерина из ниацина, твердит о зависимости холестеринэстер транспортного белка (ХЭТБ), несмотря на снижение общего холестерина и триглицеридов, которым, как выяснилось, не требуется этот белок. ХЭТБ является белком, который облегчает передачу липидов между различными липопротеинами (в общем, этот процесс заключается в отдаче триглицеридов из ЛПОНП к «хорошему» холестерина, принимая при этом эфир холестерина; процесс называется обратной транспортировкой холестерина44)). Ниацин снижает экспрессию ХЭТБ в печени и его активность в крови мышей;[138] снижение ХЭТБ увеличивает количество «хорошего» холестерина в крови, так как катаболизм уровней холестерина всех типов отражает активность процесса обратной транспортировки холестерина, достигая равновесия. Если ХЭТБ снижается, то потребуется больше «хорошего» холестерина для нормализации у крыс в ходе процесса обратной транспортировки. Этот механизм может быть связан с LXRальфа, в то время как гетеромер LXRальфа вместе с рецептором ядра витамина А (RXR) активирует элемент DR4, увеличивающий ХЭТБ; ниацин способствует гетеродимеризации LXRальфа и PPARгамма, которые всё ещё активируют DR4, но при этом наблюдается оттока холестерина. Эта конкурентная гетеродимеризация не была продемонстрирована экспериментальных путём, хотя в ходе исследования при использовании 2000 мг ниацина у людей не удалось найти воздействия на активность сывороточного ХЭТБ, несмотря на увеличение «хорошего» холестерина. Последний потенциальный механизм для «хорошего» холестерина не включает его увеличения, а базируется на основе сохранения уже образованного «хорошего» холестерина, насыщенного с АпоАИ, который снижает показатели липопротеинов, поступающих в печёночные клетки, несмотря на неизменную отдачу холестерина из «хорошего» его типа в клетки печени, что происходит за счёт снижения экспрессии рецептора (АТФ-синтазы бета-цепи), которая, как правило, перетаскивает «хороший» холестерин в клетку. Эта гипотеза работает с учётом предположения о сниженном катаболизме «хорошего» холестерина, который является первичным звеном, определяющим его повышенных уровней; также происходит воздействие на АпоАИ, и его клиренс из крови и поглощение печенью снижаются. Текущие теории показывают, как употребление ниацина способствует улучшению показателей «хорошего» холестерина в крови за счёт улучшения его синтеза с помощью одного или двух различных механизмов; рассматривается также механизм «захвата» печенью «хорошего» холестерина (что позволяет ему оставаться в крови). Употребление ниацина (1 г) в течение одной недели лицами в низким уровнем «хорошего» холестерина не является достаточным для увеличения уровней «хорошего» холестерина, хотя всё же незначительный эффект наблюдается; изменения в «хорошем» холестерине могут быть опосредованы улучшением вазодилатации оксида азота, хотя также отмечается увеличение косвенного билирубина. Долгосрочное употребление диабетиками сопровождается увеличением больших частиц «хорошего» холестерина на 32,7%, в то время как количество мелких его частиц снизилось на 8,2%. Увеличение «хорошего» холестерина достигает своего пика спустя несколько недель; употребление ниацина действительно может влиять на концентрацию «хорошего» холестерина. В ходе одного мета-анализа выяснилось, что ниацин может оказывать защитный эффект относительно смертности от сердечно-сосудистых заболеваний;45) отмечается, что в ходе исследований на субъекта в ишемической болезнью сердца, терапия ниацином связывалась со снижением риска реваскуляризации коронарных артерий (RR = 0,31; 95% ДИ = 0,15-0,63), нефатального инфаркта миоркарда (RR = 0,72; 95% ДИ = 0,60-0,86) и транзиторной ишемической атаки (RR = 0,76; 95% ДИ = 0,61-0,94), в то время как показатель снижения общей смертности не показал статистической важности (RR = 0,883; 95% ДИ = 0,773-1,008). Семь исследований включили в данный мета-анализ46) (и одно наблюдение) на основе 5137 пациентах, употреблявших различные фармацевтические препараты статинового и фибратового класса. У субъектов со статиновой терапией и низким уровнем «хорошего» холестерина в ходе одного исследования отмечается, что 1500-2000 мг ниацина могли способствовать положительному влиянию на уровень «хорошего» холестерина (20%) и снижению «плохого» холестерина (17%) в сравнении с плацебо, хотя в отношении заданного клинического предела (смерть или госпитализация) ниацин и плацебо показали одинаковое количество испытуемых. Это исследование показало высокую долю пациентов с метаболическим синдромом (80%), а дополнительные заметки47) выявили возможную способность ниацина разрушать резистентность к инсулину; этот побочный эффект носит компенсирующий характер, так как в ходе самого исследования выяснилось, что статины на порядок опережают по преимуществам ниацин. В то время как в ходе более раннего исследования с использованием высоких дозировок ниацина (3000 мг) было выявлено снижение смертности на 14% в сравнении с плацебо наряду со снижением общего холестерина, также отмечается, что это снижение принимает схожую с исследованиями на основе статинов и плацебо магнитуду Добавление ниацина к статиновой терапии может оказывать дополнительные эффекты на биомаркёры сердечно-сосудистых заболеваний без фактического снижения риска сердечно-сосудистых заболеваний.
Взаимодействие с метаболизмом глюкозы
Инсулин
Длительное употребление ниацина, как было уже отмечено, снижает чувствительность к инсулину, что приводит к компенсаторному увеличению объёмов выработки инсулина с помощью бета-клеток поджелудочной железы для поддержания уровня глюкозы в крови.48) Ниацин, по-видимому, не оказывает прямых эффектов на бета-клетки поджелудочной железы, тем менее, при перфузии изолированных «островков» ниацина у крыс не удалось in vitro проявить секрецию инсулина. Это показывает, что ниацин увеличивает выработку инсулина за счёт косвенного механизма, вторичного по отношению к периферической инсулиновой устойчивости. Его употребление, как отмечается, индуцирует устойчивость к инсулина при дозировках в диапазоне 500-1000 мг, что соответствует дозировкам, способствующих снижению холестерина. Следует отметить, что хроническое употребление ниацина может быть необходимым для увеличения выработки инсулина, а его разовое употребление, как выяснилось в ходе одного исследования, способствовало снижению уровней инсулина у относительно здоровых субъектов, полное восстановления уровня происходило спустя один день; другие исследования касательно разового употребления добавок показали незначительно или полностью отсутствующий эффект касательно уровней инсулина.49) Эффекты хронического употребления ниацина на уровни инсулина также может зависеть от тех, на какой категории лиц проводит испытание. Ниацин, как отмечается, может вызвать гиперинсулинемию у относительно здоровых пожилых пациентов (1000 мг в день), продемонстрировав практически удвоенные уровни инсулина у субъектов в НАЖБП (2000 мг в день). У пациентов с метаболическим синдромом употребление ниацина в дозировке 1500 мг в день в течение 6 недель увеличило уровни инсулина на 30%. Разгрузочные концентрации инсулина, по-видимому, увеличиваются на фоне хронического употребления ниацина. Степен, с которой это происходит, соответствует толерантности к глюкозе на исходном уровне. Таким образом, добавки ниацина могут вызвать проблемы у пациентов с тяжёлыми нарушениями толерантности к глюкозе.
Чувствительность к инсулину
У пациентов с избыточной массой тела и неалкогольной жировой болезнью печени (НАЖБП) употребление ниацина (титруемого до 2000 мг) ежедневно в течение 16 недель вызвало увеличение резистентности к инсулину в печени, мышцах и жировых тканях с ингибирующим эффектом на действия инсулина в печени у мужчин без диабета, но с дислипидемией.50) У взрослых мужчин с метаболическим синдромом 1500 мг ниацина значительно затрудняло проявление чувствительности к инсулину по оценке HOMA-IR (на 42%), что связывается с увеличением инсулина в сыворотке крови, несмотря на увеличение сывороточного адипонектина. Это отмечается и в других случаях (увеличение HOMA-IR на 22%), например, при употреблении аспирина наряду с ниацина не помогло предотвратить пониженную чувствительность к инсулину. Этот эффект может сохраняться у относительно здоровых субъектов. У субъектов, употреблявших 1 г ниацина в течение двух недель, после чего оказывалось гиперинсулинно-эуглигемическое воздействие, требовалось меньше глюкозы для поддержания гомеостаза, что является показателем пониженного усвоения глюкозы (за счёт увеличенной резистентности к инсулину). Ниацин, по-видимому, может способствовать развитию инсулинорезистентности у почти всех субъектов, которые употребляет более грамма в день в течение нескольких дней. Эта инсунорезистентность изначально связана с увеличением уровня глюкозы при замерах натощак за счёт снижения показателя, отражающего скорость, с которой глюкоза перемещается из крови в ткани) с последующими увеличения уровней инсулина. Ниацин-индуцированная резистентность изначально связывалась с эффектом отскока в жировых тканях, где увеличенное высвобождение неэтерифицированных жирных кислот (НЭЖК) из ниацина снижало эффекты воздействия инсулина. Это является правдоподобным фактом, так как резистентность к инсулину может быть индуцирована в течение 24-часовой воздействия с помощью НЭЖК у грызунов.51) Другие источники свидетельствуют о том, что инсулиновая резистентность не связана с отскоком НЭЖК, тем менее, у субъектов, которые сталкивались с инсулиновой резистентностью после употребления ниацина, не обязательно отмечались повышенные уровни сывороточных НЭЖК. Другим возможным вариантом является то, что ниацин может практически полностью ингибировать фермент под названием диацилглицерин-ацилтрансферазы 2 (ДГАТ2) со значением IC50, равным 100 мкм (эффект практически совпадает и при значении, равном 300 мкм). Ингибирование этого фермента не вызывает per se инсулиновую резистентность при употреблении ниацина,52) но так как ДГАТ катализирует первую стадию синтеза триглицеридов, его ингибирование может способствовать накоплению диацилглицерина (ДАГ), который является молекулой, частично влияющей на резистентность инсулина из-за ниацина. Увеличение ДАГ в клетках печени подавляет воздействие инсулина, в то время как ниацин-опосредованное ингибирование ДГАТ2 вызывает инсулиновую резистентность,53) препятствуя тем самым возможности инсулина подавлять синтез глюкозы и косвенно содействуя состоянию гипергликемии. Увеличение сывороточных НЭЖК и накопление молекул, воздействующих на липиды в печени, может объяснить ниацин-опосредованную инсулиновую резистентность.
Глюкоза в крови
Хотя хроническое употребление высоких дозировок ниацина снижает чувствительность к инсулину, его не связывают с изменением уровней глюкозы в крови. Это может быть объяснено за счёт компенсаторного увеличения выработки инсулина, в результате чего уровень глюкозы в крови практически не изменился.54) Активация рецептора ниацина (HM73A) некоторыми другими агонистами, по-видимому, быстро снижает уровень глюкозы в крови у диабетиков, восстанавливая чувствительность к инсулину или улучшая показатели усвоения глюкозы. Это показывает, что рецепторы ниацина сами по себе могут оказывать благотворное влияние на метаболизм глюкоз, и ниацин-индуцированная инсулиновая резистентность не усиливается за счёт активации HM74A. Хотя хроническое употребление высоких дозировок ниацина снижает чувствительность к инсулину, компенсаторные увеличения уровней инсулина позволяют сохранить уровни глюкозы практически неизменными у здоровых людей.
Гликоген
При изучении скелетных мышц терапия ниацином показала индукцию резистентности к инсулину в этих тканях у субъектов с избыточной массой тела и НАЖБП (2000 мг ежедневно в течение 16-недельного курса). Одно исследование на голодных крысах (натощак отмечаются увеличенные концентрации неэтерифицированных жирных кислот (НЭЖК) в плазме крови, что схоже с употреблением ниацина, также отмечается снижение в скелетных мышцах гликогена) показало, что при употреблении 20 мг ниацина на кг массы тела в разовом порядке отмечается снижение гликогена в камбаловидной мышце, в то время как икроножные мышцы и печень остались незатронутыми.55) Хотя ниацин снижает чувствительность к инсулину, ограниченное число исследований показало, что изменения гликогена могут зависеть от специфики тканей. Необходимо больше исследований для конкретизации эффектов ниацина на уровни мышечного гликогена у относительно здоровых субъектов.
Гликирование
При тестировании процесса гликирования in vitro, ниацин обладал лишь незначительными ингибирующими эффектами на гликирование бычьего сывороточного альбумина из известного гликирующего агента (метилгликоксал), несмотря на тестирование других антиоксидантов, например, цинка (10-25 мкг на мл), который проявил больше потенциальных преимуществ.56) Стоит отметить, что любые эффекты ниацина на гликирование in vitro, необходимо интерпретировать с той оговоркой, что ниацин приводит к снижению чувствительности к инсулину. В то время как ниацин-индуцированная резистентность инсулина хорошо компенсируется у здоровых молодых людей, оставляя уровень глюкозы в крови неизменным, бета-клетки поджелудочной железы у пожилых индивидов или тех, у кого отмечаются нарушения толерантности к глюкозе, могут привести к увеличению уровней глюкозы в крови. Таким образом, степень, с которой ниацин может воздействовать на гликирование in vitro не является ясной и зависит от субъекта, который подвергается исследованию.
Ожирение и жировая масса
Адипокины
Адипонектин, являющийся адипокином, как известно, обладает кардиопротекторным эффектом и считается веществом, сжигающим жир. Его концентрация увеличивается в ответ на ниацин-опосредованную активацию рецептора HM74A у мышей.57) Выработка ниацин-индуцированного адипонектина была быстрой в ходе этого исследования, причём увеличение уровней адипонектина на 37% произошло за 10 минут при инъекции, составившей 30 мг на кг массы тела. Пиковая концентрация в сыворотке крови была отмечена через 60 минут, превышая базовый показатель ещё 24 часа после употребления. Известно, что у людей под воздействием ниацин увеличивается лептин, что, как полагают, происходит за счёт того же механизма, так как фармацевтический агонист HM74A Аципимокс также индуцирует секрецию лептина из адипоза как in vitro, так и in vivo. Активация рецептора ниацина касательно жировых клеток способствует секреции адипонектина и лептина. Употребление ниацина в ходе шестинедельного курса мужчинами с избыточной массой тела способствовало увеличению сывороточного адипонектина на 43-56%, причём примерно половина увеличения проходила на высоком молекулярном уровне наряду с увеличением лептина на 26,8% без заметных изменений в резистине.58) Адипонектин, как отмечается, увеличивался на 30% у субъектов с избыточной массой тела и НАЖБП при употреблении ниацина (до 2000 мг в день), что коррелировало с увеличившейся резистентностью к инсулину;[158] за счёт этого была выдвинута гипотеза о том, что эти два направления в организме могут быть взаимосвязаны в жировых тканях. Несмотря на то, что адипонектин действует благотворно на чувствительность к инсулину, увеличение адипонектина, отмеченное при употреблении ниацина, могут связывать с ухудшением инсулинорезистентности. Считается, что это увеличение уровней адипонектина действует в качестве адаптивного ответа на инсулиновую резистентность в жировой ткани.
Адипогенез
 «Перетекание» жирных кислот в результате неэффективного скопления жира после употребления пищи, приводящей к увеличению сывороточных уровней неэтерифицированных жирных кислот (НЭЖК), побочный эффект которых проявляется в затрагивании печёночной инсулиновой чувствительности, что ведёт к увеличению выработки ЛОПН; это, в свою очередь, влияет определённую роль на формирование жировой дистрофии печени. Разовое употребление ниацина (285 мг внутривенно) у людей, которые также употребляют другие препараты, способствовало снижению выплеску жирных кислот, что способствовало включению пищевых жиров в жировые ткани и снижению уровня сывороточных триглицеридов, например, НЭЖК.
В отличие от этого, длительное употребление ниацина, которое, как известно, способствует выработке резистентности к инсулину у мужчин, также может индуцировать адипоцитную инсулиновую резистентность, что будет способствовать выплеску жирных кислот, увеличивая сывороточные уровни НЭЖК.59)
Разовое употребление ниацина может уменьшать выплеск жирных кислот после еды, снижая уровень сывороточных неэтерифицированных жирных кислот (НЭЖК) и улучшая печёночную чувствительность к инсулину. В отличие от этого, хроническое употребление ниацина может иметь противоположный эффект на липиды за счёт снижения чувствительности к инсулину.
Никотинамид, как было отмечено, может подавлять дифференциацию адипоцитов 3T3-L1 дозозависимым образом при концентрациях, превышающих 10 мм (значение ED50), достигая полного подавления при 20 мм спустя девять дней. Это, как считается, связано с ингибирующим эффектом на поли(АДФ-рибоза) синтетазу, в отношении которой никотинамид ингибирует её при 50 мкм, в то время как ниацин не обладает данной способностью. При прохождении дифференциации и в условиях высокой концентрации глюкозы, никотинамид может ингибировать глюкозо-6-фосфат дегидрогеназу (Г6ФД) и предотвращать ненормальный окислительный стресс.60)
«Перетекание» жирных кислот в результате неэффективного скопления жира после употребления пищи, приводящей к увеличению сывороточных уровней неэтерифицированных жирных кислот (НЭЖК), побочный эффект которых проявляется в затрагивании печёночной инсулиновой чувствительности, что ведёт к увеличению выработки ЛОПН; это, в свою очередь, влияет определённую роль на формирование жировой дистрофии печени. Разовое употребление ниацина (285 мг внутривенно) у людей, которые также употребляют другие препараты, способствовало снижению выплеску жирных кислот, что способствовало включению пищевых жиров в жировые ткани и снижению уровня сывороточных триглицеридов, например, НЭЖК.
В отличие от этого, длительное употребление ниацина, которое, как известно, способствует выработке резистентности к инсулину у мужчин, также может индуцировать адипоцитную инсулиновую резистентность, что будет способствовать выплеску жирных кислот, увеличивая сывороточные уровни НЭЖК.59)
Разовое употребление ниацина может уменьшать выплеск жирных кислот после еды, снижая уровень сывороточных неэтерифицированных жирных кислот (НЭЖК) и улучшая печёночную чувствительность к инсулину. В отличие от этого, хроническое употребление ниацина может иметь противоположный эффект на липиды за счёт снижения чувствительности к инсулину.
Никотинамид, как было отмечено, может подавлять дифференциацию адипоцитов 3T3-L1 дозозависимым образом при концентрациях, превышающих 10 мм (значение ED50), достигая полного подавления при 20 мм спустя девять дней. Это, как считается, связано с ингибирующим эффектом на поли(АДФ-рибоза) синтетазу, в отношении которой никотинамид ингибирует её при 50 мкм, в то время как ниацин не обладает данной способностью. При прохождении дифференциации и в условиях высокой концентрации глюкозы, никотинамид может ингибировать глюкозо-6-фосфат дегидрогеназу (Г6ФД) и предотвращать ненормальный окислительный стресс.60)
Жировое окисление
Рецепторы никотиновой кислоты выражаются в адипоцитах, активация которых подавляет аденилатциклазу.61) Этот эффект представляется более эффективным на 30% в адипоцитах в сравнении с использованием других клеточных линий (селезёнки). Так как активация этого рецептора ингибирует аденилатциклазу, и фенольные соединения, которые действуют на неё, также снижают уровни липолиза, общий эффект никотиновой кислоты может привести к снижению липолизу в адипоцитах, как минимум, в краткосрочной перспективе. В долгосрочной перспективе, тем не менее, рецептор никотиновой кислоты может десенсибилизироваться в связи с хроническим воздействием агониста, и в ходе одного исследования на мышах было отмечено, что адипоциты, которые стали резистентными к инсулину после употребления ниацина, проявили повышенную чувствительность к адренорецепторам (бета1 и бета2) в увеличении уровней цАМФ в жировых клетках, (цАМФ обычно подавляется ниацином под воздействием рецептора GRP109A). Это может быть связано с ниацин-опосредованной негативной регуляцией генов при воздействии инсулина, включая PDE3B, который обычно ухудшает показатели цАМФ, что является потенциальной адаптивной реакцией в жировых клетках, которые, как отмечается, нормализуют показатели липолиза (у крыс при использовании ниацина). Похоже, что ниацин действует на рецепторы с целью подавления липолиза (разбитие триглицеридов в свободные жирные кислоты для использования в качестве энергии). Будучи надёжным, этот эффект не является долговечным, он длится всего несколько часов. Так или иначе, изменения в жировой клетке нормализуют или даже увеличивают показатели липолиза наряду с увеличением резистентности к инсулину. Одно небольшое исследование на семи относительно здоровых участниках, принимавших 500 мг ниацина, постепенно увеличивая его до 2000 мг, в течение двухнедельного курса показало снижение показателей жирового окисления. За счёт увеличения углеводного окисления не отмечается изменений в показателях скорости обмена веществ между ниацином и плацебо, тем не менее.
Скорость метаболизма
Мыши, лишённые ПАРП-1, имели более высокую скорость метаболизма и меньшую массу тела; при отсутствии ПАРП концентрации НАД+ увеличивались, активируя СИРТ1, который способствует деацетилированию различных белков (PGC-1альфа и FOXO1) для расхода энергии с помощью усиленного окислительного метаболизма и увеличенных митохондрий. СИРТ2 и СИРТ3 не подвергаются влиянию при низкой активности ПАРП-1, и ингибрование АДФ-риболизирования с помощью других средств, например, NMNAT-1, по-видимому, способствуют сжиганию жира у грызунов. При употреблении разовой дозы увеличивается активность ПАРП-1 у мышей, что временно препятствует активности СИРТ1, который, как считается, связан с ПАРП-1, обладая приоритетом в использовании НАД+. Пероральное употребление никотинамида рибозида в концентрации 400 мг на кг массы тела мышей может увеличивать содержание НАД+ в скелетных мышцах, что соответствует такой же дозировке ниацина (никотинамид мононуклеотид не является эффективным в данном случае); помимо этого, увеличивается расход энергии у мышей с излишней массой тела наряду с увеличению активности FOXO1 генов-мишеней, что говорит об эффективности перорального использования добавок Ограниченные данные по людям касательно влияния ниацина на скорость метаболизм показали, что невысокие дозировки ниацина (1000 мг) у относительно здоровых лиц не показали увеличения скорости метаболизма в сравнении с плацебо.62) ПАРП-1, по-видимому, может косвенно стимулировать накопление жира в контексте избыточного питания. У мышей с отсутствующим ПАРП-1 отмечается защитный эффект от рациона с повышенным содержанием жира за счёт повышенных концентраций НАД+, который активирует процесс сжигания жиров с помощью СИРТ1 деацетилазы. Исследования на людях не смогли продемонстрировать такой эффект при использовании нормальных дозировок ниацина. Таким образом, современные исследования не поддерживают теорию о том, что ниацин является жиросжигателем.
Скелетные мышцы и физическая работоспособность
Мышечная выносливость
Употребление ниацина людьми, как оказалось, может увеличивать экспрессию транскрипционных факторов ППАРомега и ППАРгамма коактиватора-1альфа (PGC-1альфа) в скелетных мышцах. Так как эти транскрипционные факторы являются важными регуляторами окислительного метаболизма и митохондриального биогенеза,63) это предполагает, что употребление ниацина может играть роль в выносливости скелетных мышц. Исследования на животных поддержали эту идею, где употребление ниацина вызывало переход мышечных волокон от II типа (быстро сокращающихся) к I типу (медленно сокращающиеся), увеличивая общее число волокон I типа в скелетных мышцах крыс линии Цукер с избыточной массой тела, растущих свиней (750 мг ниацина на кг рациона) и овец (1000 мг ниацина в день).64) Этот эффект может проявляться ограниченно у некоторых животных, тем не менее, исследования на здоровых крысах показали, что ниацин имеет незначительное влияние на распределение мышечных волокон или метаболический фенотип. Кроме того, несмотря на увеличение экспрессии ниацина в отношении прооксилительных транскрипционных факторов у людей, ни одно исследование не продемонстрировало, что это вещество усиливает выносливость и производительность скелетных мышец. Хотя ниацин проявил благотворное влияние на мышечный окислительный метаболизм у некоторых животных, способствуя выносливости фенотипа, эти результаты крайне зависят от объектов проведённых испытаний. Ниацин-индуцированное увеличение в проокислительном транскрипционном факторе экспрессии у людей не показало увеличения мышечной выносливости, что говорит об отсутствии его влияния на производительность. В качестве субстрата для синтеза НАД+ ниацин может косвенно поддерживать окислительный метаболизм и мышечную выносливость, тем не менее. У относительно здоровых субъектов, умеренные физические нагрузки связывают с увеличением концентраций НАД+ в крови в сравнении с показателями в состоянии покоя (не зависит от употребления каких-либо добавок), в то время как при тестировании грызунов выяснилось, что умеренные физические нагрузки привели к увеличению НАД+ в крови, уменьшение показателя произошло при изнурительной физической нагрузке,[190] происходя непосредственно в скелетных мышцах. На этом уровне нагрузок существует истощение с сопутствующим увеличением концентрации НЭЖК в скелетных мышцах,65) что, как предполагается, является показателем снижения переноса электронов из НЭЖК к синтезу АТФ. Затем было сделано предположение, что при увеличении окисления в мышцах, на которые осуществлялась нагрузка, и окислительных стрессоров, ухудшается активность цикла Кребса (ЦТК) и цепи транспортировки электронов (включая НЭЖК дегидрогеназу66)); их взаимодействие с антиоксидантами увеличивает выносливость, вторичную к сохранению внутримышечной кинетики НАД+ / НАДХ. При предоставлении 36 мг пикногенола в качестве антиоксидантна во время изматывающих физических нагрузок вплоть до изнеможения, по-видимому, была выявлена отмена снижения уровня НАД+ в крови (при употреблении может быть как увеличение, так и снижение показателя); эффект проявился ярче всего у профессиональных спортсменов. Активация мышц, как выяснилось, изначально способствует выработке НАД+ для выработки энергии для мышечной активности, но близкий к изнеможению уровень выработки НАДХ увеличивается (как минимум, происходит препятствование его обратному превращению в НАД+); этот процесс связывают с мышечной усталостью. Таким образом, адекватное употребление ниацина может быть необходимым условием для оптимального окислительного метаболизма; вполне возможно, что антиоксидантные добавки могут частично влиять на изменение кинетики НАД+.
Воспаление и иммунология
Интерлейкин
Пероральное употребление 250 мг ниацина на кг массы тела мышей значительно ослабляет рост ИЛ-1бета (на 54%) и TNF-альфа (на 43%), индуцированный инъекцией воспалительного фактора липополисахарида. (ЛПС).67)
Макрофаги
Одним из основных способов ниацина влиять на развитие атеросклероза является его воздействие на макрофаги. Ниацин, как известно, оказывает противовоспалительное действие в макрофагах при умеренных концентрациях (1-100 мкм) за счёт активации его рецептора HM74A. Этот рецептор также активирует в макрофагах мышей, которые находятся на специальной атеросклеротической диете, где ниацин оказывают более сильный противовоспалительный эффект при сравнении с макрофагами, полученными от здоровых мышей. Ниацин оказывает противовоспалительный эффект за счёт ограничения активации NF-kB p65 и IkBальфа. Стимуляция HM74A также активирует белок ядра под названием ППАРгамма, который также является противовоспалительным;68) когда в макрофагах активируется ППАРгамма, экспрессия АВСА1 / АВКГ1 увеличивается, вызывая отток холестерина, который потенциально снижает образование пенных клеток. В свою очередь, это может увеличит способность поглощать модифицированные липопротеины с помощью усиления «мусорного» рецептора CD36. Активация этого рецептора на примере мышей также снизила хемотаксис макрофагов в атеросклеротических поражениях.69) Ниацин, по-видимому, способствует продвижению макрофагов М2, что говорит о противовоспалительных эффектах и снижении вероятности проявления атеросклеротических признаков. Это происходит за счёт активации противовоспалительного рецептора ППАРгамма и вторичного к ниацину рецептора HM74A.
Нейтрофилы
Агенты, которые способствуют нормальной миграции нейтрофилов в воспалённые ткани (такие цитокины, как ИЛ-8, LTB5 или полисахарид каррагинана) являются менее эффективными при употреблении ниацина (150-600 мг на кг массы тела) за полчаса до употребления ранее обозначенных веществ мышами; этот эффект также отмечается при употреблении никотинамида (1000 мг на кг массы тела мышей) в таких же условиях. Несмотря на то, что HM74A выражается в нейтрофилах, никотинамид не активирует HM74A, предполагая, что ниацин и никотинамид подавляют миграцию нейтрофилов за счёт HM74A-зависимого механизма. Подавляющий эффект против LTB4 является наиболее сильным, так как 1000 мг никотинамида на кг массы тела может подавлять LTB4-индуцированную миграцию на 87,5% на клеточном уровне, мощно при этом сокращаясь.70) Активация ПАРП-1 также может играть роль в воспалительной реакции, так как активность провоспалительного транскрипционного фактора NF-kB является частично зависимой при АДФ-риболизировании (от НАД+) с помощью ПАРП-1. Если ПАРП-1 ингибируется, то за этим следует подавление активности NF-kB, что приводит к снижению миграции нейтрофилов. Это не говорит о том, что ниацин или никотинамид подавляют миграцию нейтрофилов за счёт ПАРП-1, тем не менее; хотя никотинамид ингибирует ПАРП-1, ниацин способствует тому, чтобы НАД+ доставлялся в иммунные клетки, увеличивая активность ПАРП-1.71) Фармакологические дозировки никотинамида или ниацина могут иметь противовоспалительные свойства на уровне нейтрофилов, снижая миграцию в воспалительные ткани.
Взаимодействие с окислением
Повреждение ДНК
Адекватные клеточные уровни НАД+ важны для активации белков, отвечающих за стресс, включая подавляющий развитие опухолей белок p53 в ответ на повреждение ДНК. Помимо этого, НАД+ проявляется антиоксидантную активность, которая вносит свой вклад в защиту от увеличенного биосинтеза НАД+ против повреждения ДНК во время окислительного стресса.72) Связь между клеточными уровнями НАД+ и возможностью соответствующей реакции на генотоксичный стресс наводит на мысль о возможной роли ниацина в профилактике раковых заболеваний. Большинство этих доказательств проявились in vitro на животных, тем не менее; необходим больше исследований для определения того факта, если это актуально для людей.
Система органов
Желудок
В исследовании на крысах употребление 20 мг никотинамида на кг массы тела за час до приёма индометацина в дозировке, индуцирующей язву желудка, предотвратило образование язве на уровне, сравнимом с контрольным (отсутствуют индуцированные язвы); эффект соответствует употреблению 400 мг сукральфата на кг массы тела, который действует локально, образуя защитный слой в желудке. Этот эффект происходит на фоне сохранения активности глутаниона, снижения липидного окисления и усиления выделения слизи в желудке. Схожий защитный эффект против индуцированного этанолом и стрессом образования язв был отмечен и в других случаях с первичным метаболитом никотинамида (1-метилникотинамид; МНА). Гастропротективный эффект связывают с увеличенной активностью простагландинов под названием ПГИ2, и никотинамид в качестве метаболита МНА был вовлечён в увеличение кровотока в желудочном отделе, снижая микрососудистую проницаемость73) после язвы. В исследовании на животных никотинамид, как оказывается, оказывает защитный эффект против желудочных язв. Это проявляется частично за счёт сохранения желудочной слизи, эффект, который, как выяснилось, является опосредованный антиоксидантной активностью никотинамида. Неизвестно, если ниацин или никотинамид могут проявлять схожие гастропротекторные эффекты у людей.
Кишечник
В толстой кишке мышей рецептор ниацина (GRP109A) требуется для оптимальной пролиферации Т-клеток CD4+ и выработки ИЛ-10, что приводит к противовоспалительному эффекту. Этот управляемый GPR109A противовоспалительный эффект опосредуется с помощью толстой короткой цепью жирных кислот бутирата, которые являются агонистом GPR109A и вырабатываются за счёт ферментации пищевых волокон бактериям толстой кишки.74) Рецепторы ниацина активизируют противовоспалительную деятельность в ткани толстой кишки, где выработанные жирные кислоты за счёт кишечных бактерий бутиратов могут активировать этот рецептор для продвижения локализованного противовоспалительного эффекта. Это показывает, что рецептор ниацина играет важную роль во взаимодействии между кишечными микробиомами и иммунной системой, создавая возможные последствия для воспалительных заболеваний кишечника и рака толстой кишки.
Печень
Эффект снижения триглицеридов на фоне ниацина восходит к печени, где секреция липопротеинов очень низкой плотности (ЛПОНП) является очень низкой; так как ЛПОНП обычно доставляет триглицериды из печени в другие ткани, снижение секреции ЛПОНП приводит к снижению триглицеридов в сыворотке крови. Снижение секреции ЛПОНП является вторичной по отношению к ингибированию липолиза в жировых тканях, так как хроническое увеличение в свободных жирных кислотах в сыворотке крови могут негативно повлиять на регуляцию секреции ЛПОНП.75) Похоже, что разовое употребление ниацина (которое снижает свободные жирные кислоты в сыворотке) также подавляет выработку ЛПОНП и его комплексообразование с триглицеридами. Это предполагает наличие другого возможного механизма, который может действовать за счёт острого подавления PGC-1бета, белка, известного как способствующего секреции триглицеридов из печени в ответ на пищевое употребление жира.76) В соответствии с этим механизмом, употребление ниацина вместе с жирной пищей может способствовать снижению нормального всплеска триглицеридов после употребления пищи. Пока что не удалось выяснить, как ниацин снижает ЛПОНП, но его способность стимулировать активность гена АВСА1 и увеличивать содержание его белка в клетках печени лежит в основе увеличения «хорошего» холестерина, который также может подавлять секрецию ЛПОПН. Ниацин (2000 мг в течение 16 недель) вместо снижения ЛПОПН и взаимодействия с триглицеридами, не увеличивал значительно внутрипечёночное содержание триглицеридов у субъектов с неалкогольной жировой болезнью печени (НАЖБП). Ниацин может снижать уровень триглицеридов в сыворотке крови за счёт двух различных механизмов, каждый из которых приводит к снижению секреции ЛПОНП в печени. Ниацин также может действовать на клетки печени с целью усиления накопления диацилглицерина (ДАГ), который связан с локализированной резистентностью к инсулину. Резистентность к инсулину в клетках печени понижает подавляющий эффект инсулина на синтез глюкозы, что приводит к увеличению оттока глюкоза из печени в кровь.77) Так как начальные стадии ниацин-индуцированной резистентности к инсулину (до увеличения базального инсулина и глюкозы) связывают с пониженными запросами для глюкозы с целью балансировки гиперинсулинно-эуглигемического воздействия. Это предполагает, что инициирование резистентности к инсулину начинается на уровне печени. Точная роль ДАГ в этом процессе является невыясненной. В то время как ДАГ способствует резистентности к инсулину за счёт активации протеинкиназы-эпсилон, активация этого белка не была обнаружена в клетках печени, которые стали резистентными к инсулину на фоне употребления ниацина. Начальный этап ниацин-индуцированной резистентности к инсулину, по-видимому, происходит на уровне печени, хотя точный механизм, с помощью которого это происходит, не выснен.
Поджелудочная железа
Ниацин, как известно, образует бета-клетки поджелудочной железы, (специальный тип клетки, который способствует секреции инсулина в ответ на глюкозу), менее чувствительные к сывороточной глюкозе. Кроме того, нормальное снижение чувствительности к глюкозе в бета-клетках поджелудочной железы связывают со старением, которое усугубляется при употреблении ниацина (500-1000 мг дважды в день). Несмотря на присутствие компенсаторного увеличения в секреции инсулина в ответ на употребление ниацина людьми и приматами с диабетом I типа, этого недостаточно для снижения уровня глюкозы в крови до нормальных уровней, что приводит к умеренной гипергликемии и гиперинсулинемии после двухнедельного курса употребления добавки.78) Следует отметить десенсибилизирующий эффект ниацина на бета-клетки поджелудочной железы, который снижает их способность чувствовать глюкозу, изначально приводя к нарушениям в секреции инсулина и умеренному увеличению уровня глюкозы. Стоит также отметить, что клеточные линии, вовлечённые в покраснения на лице, вызванные ниацином, известные также как Лангергансы, расположены в разных областях поджелудочной железы, называясь «островками Лангерганса».
Взаимодействие с продолжительностью жизни
Механизмы
НАД+ вовлечён в продолжительность жизни, в частности, за счёт ферментов, например, сиртуинов (СИРТ), которые являются зависимыми от НАД+. В частности, одним из таких СИРТов является СИРТ1 (Сир2 у немлекопитающих), который вовлечён в увеличение продолжительности жизни, связанной с ограничением калорийности79) путём митохондриального биогенеза в репарации ДНК. Витамин В3 может играть роль в продолжительности жизни, так как ниацин является субстратом в синтезе НАД+, и никотинамид является продуктом оборота НАД+. В то время как никотинамид может ингибировать ПАРП-1, который приводит к увеличению активности СИРТ1 и концентраций НАД+, никотинамид также является основным ингибитором СИРТ, хотя концентрации никотинамида значительно ниже показателей IC50 для ингибирования СИРТ в клетках млекопитающих. Вместо этого, увеличение уровней никотинамида действует в качестве субстрата для фермента NAMPT (считается человеческим гомологом Pnc1) для итогового увеличения концентраций НАД+. Показатель НАД+ / НАДХ, по-видимому, не влияет на активность СИРТ1, скорее всего, из-за высоких концентраций НАДХ, необходимых для ингибирования активности фермента; в то время как НАДХ технически является ингибитором СИРТ1, его значение IC50 составляет 11 мм, и внутриклеточный НАДХ находится в в промежутке 50-100 мкм. Таким образом, снижение в 10 раз НАД+ / НАДХ от нормальных значений изменяет активность СИР2 на 0,2%.80) Всё, что может увеличит межклеточные концентрации НАД+, может в теории способствовать долголетию. Так как ниацин является субстратом того, из чего синтезируется НАД+, он может поддерживать механизмы и воздействие, способствующее увеличению продолжительности жизни.
Взаимодействие с эстетическими показателями
Кожа
Исследование in vitro показало, что общее содержание НАД+ / НАДХ было снижено н 16% в фибробластах кожи взрослого человека по отношению к неонатальным их видам (хотя это различие не было статически значимым), и комплекс, содержащих ниацинамид наряду с другими ингредиентами, увеличил общие уровни НАД+ в фибропластах, изолированных от старой кожи взрослых людей.81) Метаболит никотинамида под названием 1-метилникотинамид (МНА) также, как полагается, обладает противовоспалительными эффектами при местном применении. Употребление ниацинамида, как было показано, восстанавливает уровни НАД+ / НАДХ в фибропластах со старых до более молодых in vitro. Низкие урвни гликозаминогликанов (ГАГ; состоят из длинных сахарных цепочек) требуются для нормальной дермальной структуры здоровой кожи, а повышенные уровни связывают с повреждённой или морщинистой кожей. Ниацинамид, как отмечается, снижает выработку ГАГ в старых фибропластах, хотя подавление при 0,5-3 мм ниацинамида (15-29%) является менее эффективным, чем 30 мкм витамина А (77%). Первичный метаболит ниацина, МНА, может обладать потенциалом напрямую связывать ГАГ, в то время как никотинамид, сам по себе, не может оказывать такого действия. Пролиферация кератиноцитов не подвергается влиянию ниацинамида.82) Процесс меланогенеза (выработка меланина) и активность тирозиназы в культуре, по-видимому, не зависит от ниацинамида при дозировке до 10 мм. Ниацин может индуцировать вторичное к снижению меланосом осветление кожи (35-68% ингибирование при 1 мм), предполагая, что это может мешать взаимодействию между кераноцитами и меланоцитами, так как меланосомы передают меланин в кератиноциты. Никотинамид, по-видимому, может способствовать осветлению кожи, обладая при этом местным противовоспалительным действием. Никотинамид, как утверждается, является идеальной формой витамина В3 для использования на коже за счёт отсутствия раздражения и высокой стабильности в косметических продуктах. Хотя некоторые другие косметические добавки, например, витамин А имеют благотворное влияние при высоких концентрациях, они также являются раздражающими, вызывая покраснение кожи и увеличение её чувствительности. Другие формы ниацина, включая никотиновую кислоту и её эфиры, связывают с некомфортным покраснение кожи. В то время как ниацин вызывает покраснение за счёт воздействия на рецептор HM74A, ниацинамид не связывает этот рецептор, не вызывая покраснения кожи. Красные прыщи снижаются в своей частоте возникновения через 12 недель лечения 5% ниацинамидным кремом, хотя никаких преимуществ не было выявлено на 4-8 неделях.83) Пожелтение кожи снижается в зависимом от времени образом при курсе в 8 или более недель 4% ниацинамидным кремом, нанесённым на лицо, хотя эффект отмечается и при использовании 2% крема в течение четырёх недель, например, загорелыми японскими женщинами. Лёгкие морщины (гусиные лапки) снижаются зависимым от времени образом при использовании 5% ниацинамидного крема для лица; не отмечается никакого эффекта через 4 недели, однако они постепенно возникают после 8 и 12 недель. Эластичность кожи также улучшает у субъектов среднего возраста при использовании 5% ниацинамидного крема в течение 12 недель в сравнении с плацебо. Нанесение 5% ниацинамидного крема на лицо японских женщин с коричневой пигментацией кожи оказало снижение гиперпигментации через четыре недели до достижения максимального эффекта. У женщин, которые визуально выглядели загорелыми, 2% ниацинамидный крем показал эффект осветления кожи, причём он не являлся дополнением к солнцезащитному крему. При местном применении на протяжении длительного периода времени ниацинамид показал увеличение качества внешнего вида кожи.
Волосы
Вторичный к воздействию на его рецептор HM74A, ниацин стимулирует высвобождение простогландина Д2 (ПГД2). Это происходит довольно быстро после перорального употребления 500 мг дозировки ниацина, которая может привести к покраснению, согласно оценке уровней его метаболитов 9альфа, 11бета-ПГФ2. ПГД2, как известно, проявляет негативное воздействие на рост волос, в частности, когда речь идёт об облысении у мужчин (андрогенная алопеция), ПГД2 увеличивается за счёт увеличения гормональное регуляции синтетического фермента, а именно простагландин Д2 синтазы (ПТГДС). Повышенные уровни ПГД2 приводят к увеличению связывания с его рецептором GPR44. Кроме того, уровни ПГД2 могут быть выше в области облысения у мужчин, где также вовлечён GPR44. Другой ПГД2 рецептор, известный как ПТГДР, не является вовлечённым в мужское облысение.84) Ниацин может увеличивать уровни ПГД2, которые являются вовлечёнными в мужское облысения. Хотя ниацин (а не никотинамид) увеличивают уровни ПГД2 в сыворотке крови, что также связывают с покраснением, сегодня нет прямого доказательства воздействия ниацина на облысение. Никотинамид входит в состав комбинированных добавок (включая кофеин, пантенол, диметикон, различные полимеры), которые вместе оказывают противоразжижающие свойства в волосяных луковицах. Стоит отметить, что ниацинамид, сам по себе, способен проникать в волосяные луковицы при местном применении. 85)
Взаимодействие с заболеваниями
Болезнь Паркинсона
Плазменные уровни аполипопротеина А1 (АпоА1), по-видимому, коррелируют с болезнью Паркинсона (БП), так как более низкий уровень АпоА1 связан с более ранним проявлением БП и больших дефицитом транспортеров дофамина.86) Сниженный уровень АпоА1 связан в БП, когда однонуклеотидный полиморфизм (ОНП) rs670 является гомозиготным в G аллеля. Эти исследования предполагают, что сывороточный АпоА1 может быть полезным биомаркёром для ПД наряду с другими возможными опциями. Так как ниацин может воздействовать на сывороточные уровни АпоА1, пищевое употребление ниацина связывают с риском БП в некоторых наблюдательных исследования (но не этих), поэтому ниацин в теории может влиять на развитие риска БП. В действительности, неясно, если употребление ниацина может играть определённую роль во влиянии на риск развития этого заболевания; не было изучено также влияние при местном применении, а на сегодняшний день существует лишь одно исследование, в ходе которого ниацин добавляли с лекарственной схеме для улучшения физических симптомов БП (жёсткость и брадикинезия) с одновременным проявлением психоактивных побочных эффектов.87)
Взаимодействие с питательными веществами
Аспирин
Аспирин иногда используется вместе с ниацином для снижения проявления покраснений, возникающих при использовании высоких дозировок; 325 мг аспирина могут снижать покраснение, возникающее на фоне употребления от 500 мг до 2000 мг ниацина. Затем выяснилось, что 325 мг аспирина являются более эффективными, чем 80 мг в снижении симптомов покраснения.88) Это снижение симптомов покраснения применяется для всех форм ниацина. Комбинированная терапия аспирина с постепенным титрованием дозировки ниацина от 500 мг до 2000 мг в течение двух недель считается идеальным путём снижения симптомов покраснения. Считается, что аспирин не полностью предотвращает покраснения, но, тем не менее, так как парасимпатическая нервная система также способствует покраснению, то аспирин не влияет на этот его вид. Снижение аспирином покраснений, вызываемых ниацином, происходит за счёт блокирования ЦОГ-1, который стимулируется за счёт рецептора никотиновой кислоты HM74A. Это приводит к выработке различных простагландинов: простагландина Д2 (ПГД2) и ПГЕ2 (но не ПГИ2), которые являются основными простагландинами, влияющими на покраснение. ПГД2, как известно, высвобождается в больших количествах в сыворотку крови при терапии никотиновой кислотой у людей, что оказывает прямое влияние на кожу, вызывая покраснение. Употребление агентов, которые блокируют рецептор ПГД2, например, ларопипранта, может снизить покраснение, вызванное ниацином, хотя он не несёт аддитивного эффекта по отношению к аспирину, так как у каждого вещества свой механизм воздействия.89) Эксперимент на людях показал, что 200 мг ибупрофена имеет подавляющий эффект на покраснение, вызванное ниацина, с той же мощностью, что 165 мг, но меньшей, чем 325 мг аспирина. Ниацин связывает и активирует рецептор HM74A, который затем индуцирует покраснение за счёт увеличения простагландинов, например, ПГД2. Этот эффект может быть подавлен с помощью аспирина или ларопипранта, которые могут снижать частоту и интенсивность покраснений на 50%.
Яблочный пектин
Яблочный пектин (2000 мг), представленный растворимыми волокнами, может снижать продолжительность покраснения от разовой дозировки ниацина (1000 мг). Это происходило наряду с незначительным уменьшением общего проявления первых признаков покраснения; преимущества были такими же, как при употреблении 325 мг аспирина, но не аддитивными при совместном их употреблении. Считается, что яблочный пектин воздействует на снижение всасываемости ниацина, так как это является общепринятым эффектом пектина на пероральные препараты, что может продлить период опорожнения желудка.90) Яблочный пектин может снижать покраснение, вызванное ниацином, вторичное по отношению к замедлению его всасывания. Снижение покраснения было относительно эффективным в ходе предварительных исследований.
Безопасность и токсикология
Генотоксичность
НАД+ является единственным субстратом для поли-АДФ-рибозы полимеразы -1 (ПАРП-1), ядерного фермента, который регулирует различные генотоксичные инсульты в клетке за счёт «зондирования» повреждений, связывая одинарном или двойным разрывом нитей ДНК, а также путём образования комплексов между полимерами АДФ-рибозы и различными акцепторными белками. ПАРП-1 является таким акцепторным белком, предотвращающим эту излишнюю активацию. Другие акцепторные белки включают исправление ядерных ферментов, например, топоизомеразы (I или II), ДНК-лигазы (I и II) и ДНК-полимеразы;91) эти комплексы могут быть расщеплены с помощью поли(АДФ-рибозы) гликогидролазы (ПАРГ), изменяя свободные молекулы АДФ-рибозы. ПАРП-1 дополнительно играет роль в стабилизации геномов за счёт модуляции хроматиновых структур,92) будучи вовлечённым в некоторые пути исправления ДНК, включая нуклеотидную эксцизионную репарацию (НЭР) и базовую эксцизионную репарацию (БЭР). Таким образом, одна общая функция ПАРП-1 заключатся в помощи в стабилизации генетического материала, как это было выяснено на мышах с отсутствующим ПАРП-1, которые являются более чувствительными к геномному повреждению.93) Это относится к витамину В3, так как активность ПАРП-1 зависит от НАД+. Стоит отметить, что этот защитный эффект может быть иногда нежелательным, так как ингибирование ПАРП-1 может являться потенциальным адъювантом во время химиотерапии или лучевой терапии, так как ПАРП-1 экспрессируется в раковой клетке, оказывая защитный эффект на геном раковой клетки. Действительно, препятствие ПАРП-1 показало некоторую эффектов у больных раком пациентов.94) НАД+-зависимый фермент ПАРП-1 является глубоко вовлечённым в стабилизацию генома из клеточных и экологических стрессов. Это происходит немного неизбирательно, однако защита нормальных клеток от стрессоров, вызывающих рак, и защита раковых клеток от токсических стрессов, которые убивают раковую клетку, могут происходить в ходе воздействия этого фермента. Никотинамид успешно используется для подавления геномного повреждения на примере стрептозотоцин-никотинамидных моделях индуцирования диабета у крыс. Стрептозотоцин явлется токсичным для бета-клеток поджелудочной железы, работающих на «входе» в ядро и НАД+. Употребление различных дозировок никотинамида может ингибировать ПАРП-1 и предоставлять НАД+ для ослабления стрептозотоцина, что приводит к двойному цитозащитному эффекту. Дозировки, использующиеся в этих исследованиях, являются достаточно высокими, так как диапазон, проявляющий эффективность у взрослого человека составляет минимум 1 г (100-350 мг на кг массы тела крыс95)).
Примеры
Некоторые исследования показали возможную токсичность ниацина, включая молодых мужчин, употребляющих очень высокие (не уточняется, какие) дозировки ниацина в попытках подтасовать результаты анализа мочи.96) Эти примеры, как правило, влияют на изменения в почках и печени, вызывая проблемы со свёртываемостью крови и когнитивными функциями. Высокие дозировки ниацина, используемые с целю обойти тест на наркотики, часто сопровождались последующей госпитализацией на фоне недостаточности множества органов. Обычно в случае передозировки у субъектов всё приходило в норму после срочной госпитализации; выделяется лишь единственный случай гепатотоксичности, связанный с употреблением умеренной (2 г) дозировки устойчивой формы ниацина, хотя неизвестно, употреблял ли субъект другие препараты. Это может быть связано с употреблением именно устойчивой формы ниацина; другой случай касается субъекта, употребившего 6 г кристаллического ниацина, после чего у него наблюдалась печёночная недостаточность; употребление устойчивой формы ниацина в дозировке 500 мг в течение восьми недель также может оказывать некоторое негативное воздействие.97) Существует несколько примеров, где устойчивая формы ниацина в сравнении с другими его формами приводила к токсичности в печени при употреблении нормальных дозировок для лечения дислипидемии.
Биосинтез и химический синтез
Биосинтез
Печень может синтезировать ниацин из основной аминокислоты триптофана. Для создания 1 мг ниацина требуется 60 мг триптофана. 5-членный ароматический гетероцикл триптофана расщепляется и меняется местами с альфа-аминокислотной группой триптофана в 6-членном ароматическом гетероцикле ниацина. В некоторых из реакций, участвующих в превращении триптофана в НАД, требуются рибофлавин, витамин В6 и железо. Из 3-метилпиридина производится ниацин в количестве несколько миллионов килограммов ежегодно.
Рецептор
В дополнение действию в качестве НАД и НАДФ, ниацин может иметь дополнительные эффекты при активации рецептора. Рецептор ниацина – это G-белковый рецептор, называемый HM74A. Он соединяется с Gi альфа-субъединицей.
Пищевые источники
 Никотиновая кислота содержится в различных пищевых продуктах, включая печень, курицу, говядину, рыбу, крупы, орехи и бобовые, а также синтезируется из триптофана, незаменимой аминокислоты, имеющейся в большинстве форм белка.
Никотиновая кислота содержится в различных пищевых продуктах, включая печень, курицу, говядину, рыбу, крупы, орехи и бобовые, а также синтезируется из триптофана, незаменимой аминокислоты, имеющейся в большинстве форм белка.
Продукты животного происхождения:
- печень, сердце и почки (9 - 15 мг никотиновой кислоты на 100 граммов)
- курица, куриная грудка (6,5 мг)
- говядина (5 - 6 мг)
- рыба: тунец, лосось, палтус (2,5 - 13 мг)
- яйца (0,1 мг)
- оленина (8,43 мг)
Фрукты и овощи:
- авокадо (1 мг ниацина на 100 граммов)
- финики (2 мг)
- помидоры (0,7 мг)
- листовые овощи (0,3 - 0,4 мг)
- брокколи (0,6 мг)
- морковь (0,3 - 0,6 мг)
- сладкий картофель (0,5 - 0,6 мг)
- спаржа (0,4 мг)
Семена:
- орехи (2 мг ниацина на 100 граммов)
- цельнозерновые продукты (4 - 29,5 мг)
- бобовые (0,4 - 16 мг)
- семена лебеды
Грибы:
- грибы, грибы шиитаке (3,5 - 4 мг ниацина на 100 граммов)
- пивные дрожжи (36 мг)
Другое:
- Напиток Monster Energy (40 мг на 16 унций)
- Rockstar Energy (100% в добавке Super Sours)
- Red Bull Energy Drink (28 мг на 12 унций)
- Five hour energy (30 мг в 1,93 унции)
- Ovaltine (18 мг)
- Арахисовое масло (15 мг)
- Тофу
- Соевый соус (0,4 мг)
- Vegemite (из дрожжей пивной дробины) (110 мг ниацина на 100 граммов)
- Marmite (из дрожжей пивной дробины) (110 мг ниацина на 100 граммов)
История
Никотиновая кислота была впервые описана в 1873 году химиком Уго Вейделем в ходе его исследований никотина. Все еще применяется оригинальная формула препарата: окисление никотина с использованием азотной кислоты. Ниацин был извлечен из печени биохимиком Конрадом Эльвейемом в 1937 году, который позже определил активный ингредиент, называемый «фактор предотвращения пеллагры» и «фактор предотвращения болезни черного языка». Вскоре после этого, в ходе исследований, проведенных в Алабаме и Цинциннати, доктор Том Спайс обнаружил, что никотиновая кислота способна излечить страдающих пеллагрой. После осознания биологического значения никотиновой кислоты, целесообразным стало назвать вещество иначе, чтобы отделить ее значение от никотина, чтобы избежать возможных недоразумений и мысли о том, что витамины или пища, содержащая ниацин, содержит никотин, или что в сигаретах содержатся витамины. Полученное в результате название «ниацин» произошло от слов «nicotinic acid + vitamin» (никотиновая кислота + витамин). Карпентер в 1951 году обнаружил, что ниацин в кукурузе является биологически недоступным, и может быть выпущен только в очень щелочной известковой воде с рН 11. Этот процесс, известный как никстамализяция, был впервые открыт доисторический цивилизаций Мезоамерики. Никотиновая кислота называется «витамин B3», так как это – третий по счету обнаруженный витамин группы В. Исторически его называют «витамин РР» или «витамин Р-Р», оба названия являются производными от термина «пеллагра-профилактический фактор».
Исследования
По состоянию на август 2008 года проходят клинические испытания комбинации ниацина с лароприпрантом. Ларопроприант уменьшает покраснения кожи лица, вызываемые ниацином.
Купить Никотиновую кислоту (Ниацин, Витамин B3)
Никотиновая кислота входит в состав множества витаминных комплексов и добавок. Отпускается без рецепта.
:Tags
Читать еще: 7-Кето ДГЭА , Андрографис метельчатый (Andrographis paniculata) , Анирацетам , Витамин , Противосудорожные средства ,










