Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Рыбий жир
 Рыбий жир является общей пищевой добавкой принимается в качестве источника омега-3 жирных кислот. Не требуется для употребления, если человек принимает в пищу достаточно жирной рыбы.
Рыбий жир является общей пищевой добавкой принимается в качестве источника омега-3 жирных кислот. Не требуется для употребления, если человек принимает в пищу достаточно жирной рыбы.
Общая информация
Рыбий жир является общим понятием, используемым для обозначения двух видов омега-3 жирных кислот: эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК). Омега-3 жирные кислоты обычно обнаруживаются в рыбе, продуктах животного происхождения и фитопланктоне. Рыбий жир обычно рекомендуется в качестве источника этих омега-3 жирных кислот, поскольку он является наиболее дешёвым и распространённым их источником. Рыбий жир при употреблении в качестве добавки обладает множеством преимуществ, в частности тогда, когда соотношение омега-3 и омега-6 жирных кислот в организме является практически равным (1 к 1). Среднестатистический рацион (содержащий красное мясо, яйца и т.д.) содержит высокую долю омега-6 жирных кислот, и поэтому рыбий жир рекомендуется к употреблению для сбалансирования этого соотношения. При соотношении 1 к 1 обеспечивается здоровье кровеносных сосудов, снижается общая концентрация липидов, а также уменьшается риск образования бляшек. Рыбий жир также может снижать риск диабета и некоторых форм раковых заболеваний, включая рак молочной железы. Рыбий жир, в первую очередь, функционирует за счёт эйкозаноидов, которые представляют собой сигнальные молекулы. Корректное соотношение омега-3 жирных кислот к омега-6 жирным кислотам обеспечивает высвобождения эйкозаноидов в ответ на стресс. Стоит отметить, что рыбий жир также может снижать уровень триглицеридов у людей с высоким содержанием триглицеридов. Тем не менее, он также может повышать уровень холестерина, так что следует соблюдать осторожность, прежде чем начать употребление рыбьего жира для этой цели.
Другие названия: эйкозапентаеновая кислота, ЭПК, докозагексаеновая кислотая, ДГК, омега-3 жирные кислоты, омега-3, омега 3, N-3 жирные кислоты.
Не путать с:
- Альфа-линоленовой кислотой (омега-3 растительного происхождения)
Интересно отметить:
- Хотя рыбий жир не представляет собой стимулятор, он увеличивает активность головного мозга, поэтому вследствие его употребления может ощущаться стимулирующий эффект.
- Большинство благотворных эффектов рыбьего жира ощущаются через несколько дней или недель, а не сразу.
- Эффекта «рыбьей отрыжки» можно избежать при употреблении добавки вместе с пищей, либо замораживая капсулы до их приёма.
Представляет собой:
- Ноотропное соединение;
- Соединение жидкой формы;
- Препарат, обеспечивающий здоровье суставов.
Хорошо сочетается с:
- Витамином Е, расторопшей, так как они являются антилипидными окислительными агентами.
- Куркумином, за счёт снижения рисков развития рака молочной железы.
- Фукоксантином, за счёт усиления эффективности фукоксантина.
- Маслом пажитника, за счёт снижения скачков уровней глюкозы после приёма пищи.
- Катехинами зелёного чая, за счёт увеличения их биологической доступности.
Особенно полезна:
- Для снижения тревожности;
- При депрессии и плохом настроении.
Плохо сочетается с:
- Блокираторами жира;
- Омега-6 жирными кислотами, например, линолевой кислоты и арахидоновой кислотой.
- Рыбий жир может окисляться при его хранении на солнце или в тепле. Хотя в целом это не оказывается негативного влияния, целесообразно хранить рыбий жир в холодильнике.
- Рыбий жир может снижать уровень свёртываемости крови, поэтому его следует употреблять с осторожностью при совместном употреблении с препаратами, разжижающими кровь, например, аспирином, варфарином или клопидогрелом.
Рыбий жир: инструкция по применению
Дозировки рыбьего жира варьируются в зависимости от цели его употребления. Для общеукрепляющего действия, рекомендуется употребление 250 мг в качестве минимальной дозировки. Американская Сердечная Ассоциация рекомендует дозировку в 1 г в день. Если целью приёма является снижение болевых ощущений, необходимо принимать дозировку, равную в 6 г в день, именно она должна быть эффективной. Так как рыбий жир представляет собой сочетание двух разных жирных кислот, дозировка рыбьего жира является суммой дозировок этих двух жирных кислот. Общее потребление эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК) должно базироваться на пищевых источниках и добавках. Чем больше ЭПК и ДГК получает человек из пищи, тем меньшие дозировки добавок ему необходимо принимать. Рыбий жир необходимо употреблять в течение дня. Для снижения вероятности проявления «рыбьей отрыжки», необходимо принимать добавку вместе с пищей. Беременные женщины должны увеличивать потребление ДГК до 200 мг в день, как минимум.
Источники и активные молекулы
Содержание рыбьего жира и источники
Рыбий жир является понятием, используемым для обозначения совокупности жирных кислот (компонентов пищевого жира), называемых эйкозапентаеновой кислотой (ЭПК) и докозагексаеновой кислотой (ДГК); они упоминаются в качестве масел из «рыбы» (несмотря на невысокое их присутствие в птице в нервной ткани все видов животных); сывороточные концентрации ЭПК и ДГК, как правило, увеличиваются при употреблении рыбы – у американцев1) обычно их уровень в два раза ниже, чем у японцев и инуитов (Гренландия). Рыбий жир является биологически активным в жире печени трески (наряду с витамином А и витамином D) и жире криля (в форме фосфолипидов, нежели триглицеридов). Любой продукт рыбьего жира может содержать большее число жирных кислот – кроме ЭПК и ДГК (например, промежуточную жирную кислоту, называемую ДПК); может содержать жирные кислоты, которые не относятся к классу омега-3 жирных кислот; точные уровни жирных кислот и омега-3 жирных кислот зависят от источника жирных кислот и обработки, что, как правило, указывается на этикетке. Рыбий жир относится к двум жирным кислотам, называемым эйкозапентаеновой кислотой (ЭПК) и докозагексаеновой кислотой (ДГК). Они обе являются омега-3 жирными кислотами. Они обнаруживаются в очень больших количествах в рыбе, если сравнивать с наземными животными. В составе добавок могут содержаться или не содержаться примеси (в зависимости от метода обработки):
- Примесь метилртути2), хотя это зависит от изначального источника рыбьего жира и метода, используемого компанией при обработке; больше информации доступность в разделе о безопасности и токсикологии.
- Примесь PCB / диоксина.
- Примесь хлорорганических соединений.
В целом, любой токсин, высвобождающийся в воде, являясь при этом жирорастворимым в природе (и, следовательно, может откладываться в тканях рыбы), имеет потенциал для того, чтобы быть обнаруживаемым в добавках рыбьего жира. Если возможно, рекомендуется использовать добавки рыбьего жира на базе определённых видов рыбы (сардина, сельдь, макрель), так как уровни ртути (используется в качестве стандартного параметра для оценки примесей в целом) обычно повышены у тех видов рыбы, которые сами потребляют другую рыбу, тем самым перенимая её уровни ртути и PCB; рыбы, обитающие на дне, также накапливают в тканях токсины и различные минералы. Глубина необходимого питания для рыбы также может коррелировать с уровнями ртути, что делает рыбу, обитающую на поверхности воды, более безопасной3). Рыбий жир имеет может иметь такие же примеси в себе, какие имела сама рыбы, но это зависит от качества обработки и источника жира. Нехищная рыба, как, например, сардина, треска или креветка (морское существо; жир криля) являются более безопасными и рекомендуются к употреблению, если цена продукта не является главным параметром выбора.
Структура и свойства
Активными компонентами рыбьего жира принято считать две омега-3 (также пишутся как n3 или ω3) жирные кислоты, а именно эйкозапентаеновую кислоту (ЭПК) и докозагексаеновую кислоту (ДГК). Обе жирные кислоты являются схожими по структуре, хотя ДГК является более длинной (эйко- относится к жирной кислоте с 20 атомами углерода в своей цепи, в то время как докоза- относится к жирной кислоте с 22 атомами углерода). Термин «Омега» используется для обозначения «конца» жирной кислоты, так как обозначение «омега» любой жирной кислоты представляет собой расстояние от конца цепи, где происходит первая двойная связь. Любая жирная кислота, которая имеет двойную ненасыщенную связь (если только одну, то она называется мононенасыщенной; если несколько, как в случае с жирными кислотами рыбьего жира, то её называются полиненасыщенной или ПНЖК), и, таким образом, имеет обозначение «омега». Ниже представлена схема, показывающая двойные связи за счёт параллельных линий.
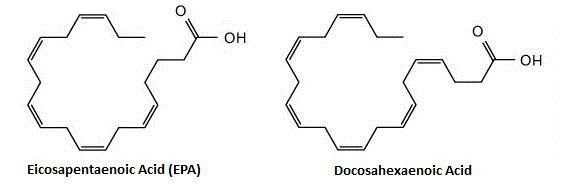
Сокращённая номенклатура для ЭПК является 20:5n3, в то время как для ДГК таковой является 22:6n3; первое число относится к углеродам в боковой цепи, а второе – к общему числу двойных связей (последнее число относится с типу омега). Эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК) являются омега-3 полиненасыщенными жирными кислотами, они содержат 20 и 22 атома углерода в длине соответственно.
Дополнительные источники омега-3 жирных кислот
Для пищевого потребления ЭПК и ДГК из рыбных продуктов есть несколько вариантов: триглицериды, реэстерифицированные триглицериды, этиловые эфиры (фармацевтический Lovaza) и фосфолипиды (ракообразные источники, например, жир криля). Эти четыре относятся к пищевым источникам ЭПК и ДГК, но жир криля примерно на треть всасывается лучше триглицеридов4) и этилового эфира (если триглицериды рыбьего жира стандартизированы до всасывания в 100%, этиловые эфиры достигают 73%), которые, по-видимому, оказывают меньше благотворного влияния в сравнении с триглицеридами на грамм продукта. Реэтерификация триглицеридов, по-видимому, усиливает их всасывание (124% триглицеридов), и, возможно, это является сравнимым с образованием фосфолипидов, причём двое не сравнивались напрямую. За счёт того, что рыбий жир является производной добавкой от рыбы, его можно классифицировать как вегетарианский продукт, но не веганский. В настоящее время единственным значимым веганским источником ДГК являются микроводоросли (фитопланктон), и его добавка называется «масло водорослей». Компонент ДГК является эквивалентом ДГК из рыбы в отношении сердечно-сосудистых заболеваний5); он сравним по критерию безопасности, что предполагает их взаимозаменяемость. Другие вегетарианские источники омега-3 жирных кислот, как правило, имеют родительскую структуру в виде альфа-линоленовой кислоты (АЛА; не путать с альфа-липоевой кислотой, у которой такая же аббревиатура); значительным источником АЛА является белковая конопля и лён, в то время как её небольшое количество содержится в спирулине и хлорелле. Вегенские источники эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК) ограничены добавками, полученными из фитопланктона.
Дефицит ДГК и регулирование ДГК
Все добавки рыбьего жира получают из рыбы, эти продукты являются побочными продуктами животного происхождения. Их использование не подходит для веганов. Стоит отметить, что абсолютное истощение ЭПК и ДГК в крови веганов не происходит, что происходит за счёт адаптационных механизмов, например, за счёт увеличения печёночной выработки ДГК из омега-3 предшественника АЛА6) без влияния на мозговой синтез; подавление ферментов, которые потребляют ДГК, включают циклооксигеназу-1 (ЦОГ1) и фосфолипазу А2, которые продлевают период полураспада ДГК. Стоит отметить, что синтез ДГК снижается при пищевом избытке ДГК, и этот адаптивный эффект, как считается, является причиной, почему отсутствуют клинически выявленные дефициты омега-3. Хотя, как правило, у веганов и вегетарианцев снижены циркулирующие уровни ЭПК и ДГК, у них вырабатываются адаптивные механизмы для сглаживания этого снижения. Абсолютное истощение этих жирных кислот не выявлено ни у одной живой системы. Для абсолютного истощения требуется дефицит в нескольких поколениях. Жирные кислоты (полиненасыщенные) превращаются друг из друга в организме за счёт класса ферментов под названием «десатуразы»; пищевые требования для омега-3 и омега-6 (незаменимые жирные кислоты) отсутствуют за счёт отсутствия дельты (Δ) 15 и Δ12 десатуразы соответственно. Фермент, известный как Δ6 является ограничивающим шагом для выработки ДГК в организме7), и употребление рыбьего жира, как правило, позволяет обойти это ограничение; иным образом, фермент сам по себе может быть нацелен на повышение концентраций ДГК в организме (отмечается в Fat-1 линии у мышей, что натуральным образом проявляет все положительные эффекты потребления рыбьего жира без необходимости его потребления внутрь); как известно, он индуцируется за счёт фукоксантина8). Без каких-либо изменений и оценки среднего потребления рыбы, уровень превращения АЛА в ДГК, как правило, составляет 2-10%. После потребления рыбьего жира, родительская омега-3 жирная кислота превращается в ЭПК и, за счёт ЭПК, превращается в ДГК через цепь ферментов, где Δ6 десатураза является ограничивающим элементом. Этот фермент является активным регулятором уровней ДГК в организме. Увеличение активности этого фермента увеличит уровни ДГК в организме, обладая синергизмом с пищевым потреблением альфа-липоевой кислоты (АЛА) в отношении увеличения уровней ДГК в организме. На примере животных (крыс и приматов), дефицит ДГК в критических тканях (сетчатка и головной мозг) происходят только в случае ограничения его потребления в течение нескольких поколения, что может действительно привести к функциональным нарушениям глаз и головного мозга9). Настоящий дефицит омега-3 (связан с дефицитом ДГК) может быть индуцирован только в случае ограничения потребления рыбьего жира в течение нескольких поколений. Проблемы с визуальной обработкой является наиболее неблагоприятным когнитивным побочным эффектом, который может возникнуть в ходе такого истощения.
Эйкозаноиды (как работает рыбий жир)
Понятие «эйкозаноид» относится к любой молекуле, полученной из липидов, до тех пор, пока она составляет более 20 углеродов в длину и служит в качестве сигнальной молекулы. Все следующие секции (резолвины, протектины и простагландины) являются подкатегориями эйкозаноидов.
Биологическая активация эйкозаноидов
Фермент, расположенный в клеточной мембране, называемой фосфолипазой А2, может гидролизировать (освобождать) жирную кислоту из середины позвоночника глицерина после активации, и, в результате, ДГК и арахидоновая кислоты, находясь в середине триглицерида, часто подвергаются мобилизации со стороны фосфолипазы А2. Фосфолипаза А2 стимулируется за счёт припадков, ишемии, стимуляции NMDA-рецепторов, а также за счёт различных воспалительных цитокинов (ИЛ-1бета, TNF-альфа и PMA), а также окислительных продуктов. Молекулы, которые стимулируют фосфолипазу А2, как правило, связаны с клеточным и метаболическим повреждением, и, таким образом, эйкозаноиды, как полагают, горметически индуцируются. Высвобождение фермента фосфолипазы А2, как правило, происходит в полиненасыщенных жирных кислотах в ответ на стресс. Эйкозаиноды из докозагексаеновой кислоты (ДГК) и арахидоновая кислота (АК) высвобождаются в ходе реакции стрессоров на клетку. В число стрессоров включают воспаление и окисление. Показатель отношения омега-3 жирных кислот к омега-6 жирным кислотам в клеточной мембране важен, так как фосфолипаза А2 не является дискриминационной по отношению к тому, какие ненасыщенные жирные кислоты подвергать высвобождению, и эйкозаноиды, которые вырабатываются тогда, когда клеточный стресс коррелирует напрямую с ненасыщенными жирами, и образует мембрану. Стандартный западный рацион питания (преимущественно, США), как правило, имеет преобладающую долю омега-6 жирных кислот в отношении 15-20 к 1 примерно (зависит от источников)10). Современный европейский рацион (данные по Великобритании) незначительно лучше – показатель составляет 15 к 1, в то время как в рамках японской диеты этот показатель составляет 4 к 1. Интересно, что в сельской местности в Индии этот показатель равен 5-6,1 к 1, а в городской местности – 38-50 к 1. Предполагается, что у палеолитических людей это соотношение составляло около 0,79 (незначительно более количество омега-3 в сравнении с омега-6) за счёт низкого поступления из пищи омега-6; сообщается, что этот показатель в рационе греков до 1960 года составляет 1-2; интересно, что у диких животных, как правило, соблюдается соотношение 1 к 111); за счёт низких показателей и свидетельств о возросшем потреблении омега-6 жирных кислот в последние 150 лет за счёт технологического развития, отмечается необходимость изучения палеолитического рациона для нормализации показателей. Показатель соотношения омега-3 жирных кислот к омега-6 жирным кислотам в клеточной мембраны (или как соотношение ЭПК к АК, ДГК к АК или ЭПК+ДГК к АК) является количественным способом выявить то, какие эйкозаноиды вырабатываются в ответ на стресс.
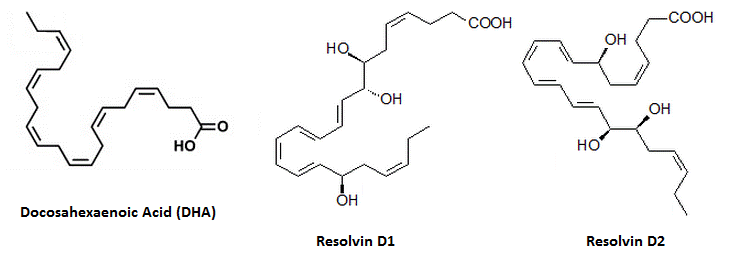
Резолвины
Резолвины (продукты с разрешённой фазой взаимодействия) являются мощными сигнальными молекулами, вовлечёнными в воспаление, получаемые из омега-3 жирных кислот; те, которые получены непосредственно из ЭПК (без вовлечения метаболизма ДГК) относят к серии Е, те, которые получены из ДГК, относят к серии Д12). Резолвины серии Е вовлечены в один из двух путей, либо в путь липоксигеназы (в пользу изолмеров R), или аспирин-индуцированный путь ЦОГ2 / P450 (в пользу изомеров S); независимо от пути, первый промежуточный продукт после ЭПК называется 15-HEPE. ДГК и резолвины из серии Д следуют подобным образом (имеют LOX путь и аспирин-индуцированный путь13)), хотя его первым промежуточным продуктом является 15-H(p)ДГК, который, как было подтверждено, увеличивает плазменные показатели после употребления рыбьего жира. Для аспирин-индуцированного превращения требуется присутствие аспирина и фермента ЦОГ2 (так как аспирин изменяет действие фермента в этом отношении14)), вызывая превращение резолвинов в изомеры R, нежели изомеры S. ЦОГ1 является неактивным в этом отношении; ацетоминофен и индометацин не могут оказывать те же самые эффекты, и лечение только аспирином увеличивает эти две молекулы за счёт того, что ДГК уже присутствует в организме. Резолвины представляют собой молекулы, названные из-за своей способности «урегулировать» воспаление. Они вырабатываются за счёт эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК). Они являются молекулами, ответственным за синергизм между рыбьим жиром и аспирином.
Резолвины серии Е включают:
- Резолвин Е1 (РвЕ1 или 5S,12R, 18Rтригидрокси-6Z,8E,10E,14Z,16E-эйкозапентаеновая кислота)
- Резолвин Е2 (РвЕ2 или 15S,18R-дигидроксиэйкозапентаеновая кислота).
Резолвины серии Д включают:
- Резолвин Д1 (РвД1 или 7S,8R,17R-тригидрокси-докоза-4Z,9E,11E,13Z,15E,19Z-гексаеновая кислота и индуцированная при лечении аспирином)
- Резолвин Д2 (РвД2 или 7S,16R,17S-тригидрокси-докоза-4Z,8E,10Z,12E,14E,19Z-гексаеновая кислота, также индуцируемая аспирином)
Резолвины серии Е выводятся из ЭПК, в то время как резолвины серии Д являются производными от ДГК. РвЕ1, как было определено, является лигандом рецептора ChemR23 GPRC15), который также является анальгетиком. Резолвин серии Д такой же структуры (РвД1) также, по-видимому, является лигандом. Резолвины серии Д обладают противовоспалительными свойствами за счёт ингибирования TNFальфа-индуцированной экспрессии цитокинов в микроглии в пикомолярном диапазоне (IC50, равный 50 пм). Они деактивируются за счёт окисления, превращаясь в окисленные резолвины (на 8 или 17 позиции).
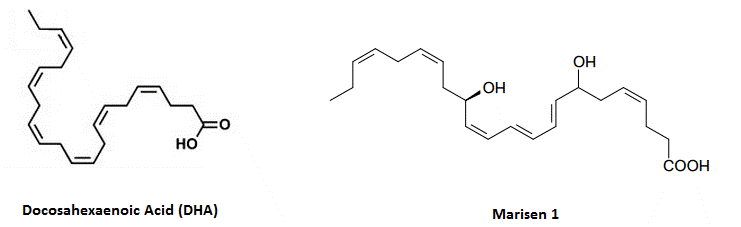
Протектины
Протектины представляют собой молекулы, которые вырабатываются из ДГК и структурно являются докозатриенами, наряду с резолвинами они опосредуют множество благотворных эффектов, связанных с употреблением рыбьего жира.
- Нейропротектин Д1 (10,17S-докозатриен пути липоксигеназы)
- Маризен 1 (7,14S-дигидрокси-докоза-4Z,8,10,12,16Z,19Z-гексаеновая кислота пути липоксигеназы)
Протектины представляют собой молекулы, получаемые из докозагексаеновой кислоты (ДГК), не относясь к резолвинам серии Д. Маризен 1 назван в честь посредников макрофагов в урегулировании воспаления; он присутствует в макрофагах и тромбоцитах, формируясь с помощью действий 12-липоксигеназы; требуется больше исследований для новых деталей.
Механизм действия нейропротектина Д1 (НПД1) более понятен. Выработанный похожим с 15-липоксигеназой образом после отщепления от фосфолипазы А2, где метаболит 17SH(p)ДГК (так же, как и в отношении резолвинов серии Д) превращается в 16(17)-эпоксид, изменяясь затем в НПД1[87]. НПД1, по-видимому, обладает мощными противовоспалительными свойствами (за счёт регулирования ИЛ-1бета, индуцированного индукцией ЦОГ2) в головном мозге в ответ на инсульт и ишемию16); обладает действиями по борьбе с болезнью Альцгеймера, предотвращая воспалительную реакцию на белковые агрегаты, отмечаемые при болезненных состояниях при IC50, равных 50 нм (бета-амилоид, может также снижать уровни пигментации). Эта защита обеспечивается за счёт PPARгамма-зависимого механизма, и так как ДГК, как отмечается, снижает накопление амилоида у животных in vitro17), НПД1 опосредует эти эффекты.
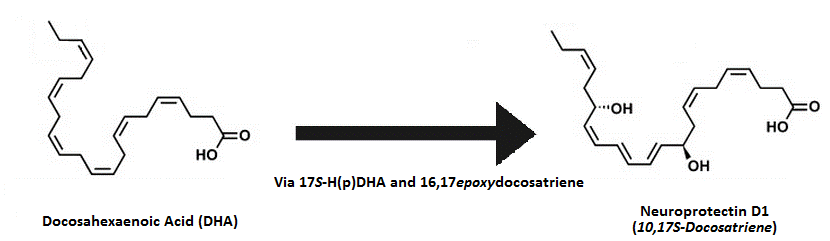
Первый метаболит ДГК может превращаться или в резолвины серии Д, или протектины. Нейпротектин Д1 (НПД1) является наиболее заметным протектином с мощным действием по борьбе с проявлением болезни Альцгеймера и нейпротективными свойствами.
Простагландины
В то время как резолвины и протектины представляют собой цепи жирных кислот, получаемых из ЭПК или ДГК, простагландины характеризуются как вещества, имеющие пентациклические кольца в своей структуре (например, пятиугольник в боковой цепи жирной кислоты по аналогии с фурановыми жирными кислотами).
Простагландины включают:
- Простагландин Ж2 (15-деокси-Δ12,14 простагландин Ж2)18)
Простагландины представляют собой эйкозаноидные метаболиты с пентациклической структурой (пятиугольной) в боковой цепи. Они также представляют собой биологически активные метаболиты полиненасыщенных жирных кислот. 15-деокси-Δ12,14 простагландин Ж2 (15д-ПГЖ2 или просто простагландин Ж2) является производным, которое может активировать PPARгамма с показателем EC50 около 20 мкм, ингибируя агрегацию IC50 в диапазоне 5-10 нм19). Простагландин Ж2 связан с активацией PPARгамма и ингибирование агрегации тромбоцитов. Простагландин Ф2альфа, как было подтверждено, увеличен у молодых мужчин в ходе употребления рыбьего жира; как отмечается, он увеличивает концентрации тромбоксана В2 (неактивный метаболит омега-6 эйкозаноида тромбоксана А2).
Молекулярные мишени
Рецепторы PPAR
Жирные кислоты рыбьего жира взаимодействуют с системой рецептора, активируемого пероксисомным пролифератором (PPAR), которые являются классом рецепторов (PPARальфа, PPARбета/омега и PPARгамма), которые, по-видимому, реагируют на пищевые липиды и структурно схожие молекулы. Они активно вовлечены в лечение диабета и метаболического синдрома (за счёт класса препаратов в виде фибратов и тиазолидиндионов), с различными эффектами на жировую массу (PPARальфа увеличивает бета-окисление жирных кислот[100], в то время как PPARгамма обеспечивает накопление жира, улучшая толерантность к инсулину; PPARомега, по-видимому, является схожим с PPARальфа в этом отношении20)). PPAR представляют собой довольно общие рецепторы, так как их способность к связыванию в 3-4 раза превышает таковую у других рецепторов, что означает, что у них отмечается достаточно общая способность к связыванию. Система PPAR является классом рецепторов, активированных пищевыми жирными кислотами и препаратами, вовлечёнными в липидный и глюкозный метаболизм. Является мишенью препаратов при диабете и ожирении (за счёт PPARгамма и PPARальфа/омега соответственно). 15-деокси-Δ12,14 простагландин Ж2 (15д-ПГЖ2) является эндогенно вырабатываемым высоко эффективным PPARгамма лигандом с EC50, равным 20 мкм, и его индукция (Fuligocandin B из Fuligo candida) осуществляет проявление преимуществ PPARгамма. 18(S)HETE из метаболизма арахидоновой кислоты активирует PPARбета и гамма с умеренной аффинностью (20 мкм и выше, чем 50 мкм), а также клеточную инкубацию с родительской арахидоновой кислоты (без контролирования метаболитом) с показателем EC50, равным 1,6 мкм21). Метаболизмы омега-3 и омега-6 обладают активаторами PPARгамма. Хотя некоторые эйкозаноиды происхождения омега-3 и омега-6, по-видимому, активируют PPARальфа, выяснилось, что лейкотриен В4 (из метаболизма арахидоновой кислоты) является наиболее биологически мощным и соответствующим показателю EC50 около 100 нм. Метаболит арахидоновой кислоты (АК) 18(S)HETE проявляет себя в 10 раз слабее (1 мкм; изомер R намного слабее), но лучше набирает коактиватор SRC-1 (30% - концентрация, необходимая для 18(S)HETE) в сравнении с LKB4). Родительская АК является слабым активатором сама по себе (50 мкм или более), но предыдущие исследования, которые не контролировали метаболиты, показали большую эффективность за счёт метаболитов (1,2 мкм). PPARальфа активируется за счёт метаболитов пути арахидоновой кислоты (омега-6). Хотя значимость этой информации не известна, нормализация показателя соотношения омега-3 к омега-6 может снизить общее стимулирования PPARальфа.
АМФК
Аденозинмонофосфат киназы (АМФК) является питательной сигнальной молекулой, которая является антагонистической по отношению к mTOR и активируется в периоды недостатка питательных веществ; она также является молекулярной мишенью различных пищевых добавок, например, берберина или препарата метморфина. Активация АМФК (отмечаемая с ЭПК и ДГК) отчасти отрицательно влияет на PPARгамма (отмечается в общем и с ЭПК), вероятно, являясь посредником с эйкозаноидами, описанными в разделе PPARгамма. ЭПК, как обнаружилось, активирует АМФК в адипоцитах за счёт инсулин-зависимых средств (не требующих активации PI3K) и рыбьего жира в макрофагах22). Подмножество альфа1 АМФК, по-видимому, подвергается наибольшему воздействию, и отмечается фосфорилирование как Thr172 (относительно АМФК) и Ser431 (относительно LKB1), и ДГК также показал свою эффективность в отношении активности АМФК. Рыбий жир активирует АМФ-активированную протеинкиназу (АМФК). Отчасти это связано с тем, что эйкозаноиды активируют PPARгамма, которая увеличивает активность АМФК. За счёт активации АМФКальфа1 ДГК может увеличивать экспрессию SIRT1, подавляя воспаление за счёт препятствования (с помощью диацетилирования) через воздействие NF-kB; также отмечается наличие противовоспалительного пути у рыбьего жира. ЭПК, как отмечается, снижает регуляцию воспалительного воздействия в адипоцитах (обычно за счёт подавления действия TNF-альфа)23). Активация АМФК за счёт ЭПК может лежать в основе высвобождения адипокинов, некоторого воспаления (макрофаги могут препятствовать активации АМФК с помощью SIRT1, и ЭПК предохраняет это), улучшенного функционирования эндотелия, гепатопротекции, чувствительности к инсулину (в связи с печенью), а также аутофагии (отмечается с ДГК, но требуется нормальная последовательность активации АМФК, как в случае с p53, который индуцирует АМФК24)). Активация АМФК была подтверждена у мышей при употреблении 500 мг ЭПК на кг массы тела (без отсылки к препарату, уточняется только дублирование в сосудах) и в ходе других исследований с употреблением рыбьего жира в дозировке 1 мл на кг массы тела или в доле 15% от рациона. Активация АМФК, как отмечается, происходит у грызунов в ходе перорального употребления ЭПК. Так как мыши без АМФК не показали никакого положительного эффекта от употребления омега-3, отмечается, что этот путь соответствует благотворному влиянию омега-3 жирных кислот.
Рецепторы СЖК
Рецептор свободных жирных кислот (СЖК), также известный как GRP120, представляет собой G-белок, совмещённый с рецептором (родопсин подобный25)) с короткой (361 аминокислота; на 97,5% гомологичен у грызунов и приматов) и длинной (377 аминокислот; только у людей) вариацией, выражаемой преимущественно в энтероэндокринных L-клетках. Этот рецептор называется рецептором свободных жирных кислот, так как он реагирует на различные жирные кислоты; некоторые омега-3 жирные кислоты (АЛА и ДГК), как было подтверждено, являются агонистами со стимулирующей активностью ДГК, равной 276+/-25% (короткий вариант) и 177+/-13% (длинный вариант) при концентрации в 100 мкм26). Так или иначе, смеси омега-3 жирных кислот оказались способными воздействовать за счёт этого рецептора. Активация этого рецептора за счёт омега-3 жирных кислот, как известно, может секретировать некоторые гормоны кишечика (глюкагон-подобный пептид 1 и холецистокинин), являясь вовлечённый в инсулиновую чувствительность, вторичную по отношению к противовоспалительным эффектам и возможным эффектам по борьбе с ожирением (так как снижение GRP120 является фактором риска в отношении ожирения; отсутствие GRP120 ведёт к ожирению у мышей). Не было подтверждено ещё, если ДГК и ЭПК являются прямыми агонистами рецепторы, или если они функционируют за счёт эйкозаноидов, хотя способность альфа-линоленовой кислоты активировать GRP120 предполагает первую возможность. Активация GRP120 (рецептор свободных жирных кислот) через потребление рыбьего жира и / или производные эйкозаноидов была подтверждена у животных. Это может лежать в основе некоторой биологической активности потребления рыбьего жира. Другие рецепторы жирных кислот существуют (все с назначением GRP), включая FFAR1 (GRP40), FFAR2 (GRP43), FFAR3 (GRP41) и GRP84. FFAR1 преимущественно отвечает на жирные кислоты со средней длиной цепи (пальмитиновая кислота и линолевая кислота27)); FFAR2 и FFAR3 отвечают жирным кислотам с длинной цепью (ацетат и бутират); GRP84 является так называемым датчиком по отношению к жирным кислотам со средней длиной цепи (лауриновая кислота). Хотя эти рецепторы свободных жирных кислот не являются молекулярными мишенями ЭПК и ДГК за счёт длинной цепи жирных кислот рыбьего жира. Другие рецепторы свободных жирных кислот не являются молекулярными мишенями употребления рыбьего жира, так как они реагируют на жирные кислоты с короткими цепями.
Фармакология
Абсорбция
ЭПК и ДГК, как правило, усваиваются и принимаются в качестве нормальных пищевых жиров; их получают в качестве упакованных в мицеллы в кишечнике, затем они распространяются в жировые и мышечные клетки за счёт клеток хиломикронов (транспортные молеклы) прежде, чем остаток хиломикронов попадёт в печень. Если рыбий жир содержится в микрокапсулах (это имеет место в некоторых пищевых продуктах для избежания рыбьего вкуса), он, как правило, всасывется через верхнюю тонкую кишку, хотя большая часть проходится также через кишечник28).
Сохранение в организме
Сохранение рыбьего жира в организме является максимальной после 3 недель употребления без значительной разницы при дозировках в указанных диапазонах (210-630 мг ЭПК и 150-450 мг ДГК).
Воздействие на организм
Неврология
Концентрации ДГК
Предполагается, что пищевой ДГК необходим для оптимального функционирования нервной системы, так как некоторые источники предполагают, что рацион с низким содержанием ДГК снижает содержание фосфолипидов в головном мозге на 32% (при высоком пищевом потреблении АЛА) или на 53% (при низком пищевом потреблении АЛА) в сравнении с рационом, богатым ДГК; хотя потери ДГК из головного мозга не проявляются в краткосрочном периоде у неноворождённых, и, по-видимому, подвергаются регулированию29), было выявлено, что новорождённые являются более чувствительными в этом отношении, так как ограничение употребления ДГК у молодых мышей привело к потерям в головном мозге через 2 недели. Потери отмечаются у взрослых приматов при ограничении употребления ДГК (это, вероятно, относится и к людям), но для этого требуется период в 18 месяцев или даже 5 лет (снижение на 70%), причём в рационе должен присутствовать алкоголь для истощения накоплений ДГК30). Краткосрочные пищевые ограничения у взрослых вряд ли могут способствовать изменениям церебральных концентраций докозагексаеновой кислоты (ДГК). Тем не менее, длительное отсутствие ДГК в рационе может иметь спсобность постепенно уменьшать концентрацию ДГК в головном мозге.
Агрессия
Предполагается, что агрессия представляет собой симптом дефицита ДГК, в ходе которого дополнительное употребление ДГК способно снизить проявление этого явления. У относительно здоровых людей ДГК, по-видимому, предотвращает избыточную агрессию в периоды стресса, и, как выяснилось, он предотвращает агрессивные срывы в периоды без стресса. Эффекты проявляются (например, в ходе депрессии или при стрессе) при употреблении 1,5 г в день; эффективность отсутствует при употреблении 150 мг ДГК в день. Снижение агрессии также было выявлено у группы молодых людей без проявления агрессии в прошлом при употреблении дозировки в 672 мг ДГК в день в течение 3 месяцев31). Исключением могут быть дети школьного возраста, у которых положительный эффект был выявлен при употреблении 3,6 г в день в ходе одного исследования. Другое исследование у детей в возрасте 8-16 лет, принимавших напиток, содержавший 1 г омега-3 жирных кислот в день (из низ 300 мг ДГК, 200 мг ЭПК, 400 мг альфа-линоленовой кислоты и 100 мг ДПК), в течение 6 месяцев, показали снижение показателей агрессии в сравнении с группой, употреблявшей напиток-плацебо с таким же ароматом и консистенцией. ДГК, по-видимому, снижает агрессию в дефицитных состояниях (агрессия может быть побочным эффектом дефицита), обладая способностью нормализовать уровни агрессии, что является положительным эффектом на фоне стресса; также может способствовать замедлению снижения проявлений стресса. Эти результаты могут быть неточными из-за воздействия на норадреналин. Смотрите раздел о стрессе для более подробной информации.
Память и обучение
ДГК была исследована для определения роли в формировании памяти, так как высокие сывороточные концентрации ДГК коррелируют с улучшенными навыками беглой речи у пожилых людей, а дефицит ДГК, как известно, способствует ухудшению обработки памяти у крыс. На примере животных, употребление ДГК (300 мг на кг массы тела – это стандартная дозировка), по-видимому, способствует улучшению когнитивных свойств в отношении долговременной памяти (не затрагивая рабочую память) у здоровых крыс32). В ходе исследований на животных выяснилось то, что докозагексаеновая кислота (ДГК) улучшает память у относительно здоровых крыс. В ходе одного исследования на относительно здоровых молодых людях (18-25 лет) выяснилось, что спустя 6 месяцев употребления 2 г Ловазы (750 ДГК; 930 мг ЭПК) выяснилось, что рабочая память улучшилась по оценке вербального теста (с улучшениями по ряду параметров); это было сочтено как независимый от метаболизма дофамина фактор вместо корреляции с содержимым ЭПК и ДГК или красными кровяными тельцами (эритроцитами; до 75% с 2,9/-1,0% для ДГК и до 350% от 0,4+/-0,1% для ЭПК) при изучении эритроцитов у лиц с низким ДГК. Так или иначе, молодёжь с низким пищевым потреблением рыбы испытала улучшение сохранения данных в памяти и сокращение времени реакции при употреблении добавки ДГК в дозировке 1160 мг в течение 6 месяцев33). Некоторые изолированные исследования, в ходе которых не сообщалось о пищевом потреблении рыбьего жира, также сообщили об улучшениях в формировании памяти (а также внимания и времени реакции). Вмешательства у пожилых людей, как правило, ведут к улучшениям как у лиц с когнитивными отклонениями, так и без них. Некоторые исследования не показали значительного благотворного влияния на когнитивные свойствами при употреблении рыбьего жира здоровыми взрослыми людьми (400-1800 мг ЭПК+ДГК, 1400 мг ЭПК и 800 ДГК или 1 г ЭПК+ДГК в течение 12 недель34)); в ходе одного из этих исследований использовался исключительный критерий для «употребления не более раза в неделю» рыбьего жира, однако остальной рацион не известен. Существуют доказательства в отношении людей касательно улучшения памяти (рабочей и эпизодической), связанной с употреблением ДГК. Хотя это и не может быть исключено, такой эффект может происходить только у людей с низким пищевым потреблением ДГК.
Депрессия
Мета-анализ употребления рыбьего жира и депрессии (включаются такие болезненные состояния как шизофрения или биполярное расстройство), основанный на 28 исследованиях с диапазоном дозировок в 136-6200 мг ЭПК и 88-3400 мг ДГК (в ходе родовой или перинатальной депрессии35), основной депрессии или депрессии без других когнитивных расстройств, депрессии, связанной с усталостью, биполярного расстройства36), шизофрении, болезни Паркинсона, самоповреждения, расстройств личности или незначительно болезненного состояния, выражающегося лёгкой депрессией37)), показал, что более высокое соотношение ЭПК к ДГК вело к проявлению антидепрессивных эффектов; три исследования с использованием чистого ДГК не показали антидепрессивного действия. Как ни странно, употребление 1г ЭПК (в качестве этилового эфир), по-видимому, проявило себя более эффективно, чем использование 2-4 г в ходе одного исследования; по крайней мере, 2 г не смогли опередить по эффективности 1 г, и мета-анализ показал такой результат, где дозировка употребляемого ЭПК была обратным образом связана с эффективностью (более высокие дозировки были менее эффективными). Помимо определения эффективности более низких дозировок этот мета-анализ показал доказательства публичного смещения (не ясно, если это связано с гетерогенностью этих исследований, так как по оценке они подвергались различным влияниям) и предположил, что у людей с более выраженной депрессией эффективность лечения была более высокой; у группы с низкими депрессивными симптомами снижение отмечено на уровне -0,074 пунктов относительно средней депрессии (95% ДИ, равное от -0,317 до 0,169), что не является статистически значимым. У группы с явной депрессией отмечается снижение на уровне -0,605 (95% ДИ, равное от -0,871 до -0,339). Надёжность исследований (по оценке Jadad) была такой же гетерогенной с включением некоторых ненадёжных исследований. Употребление 1 г эйкозапентаеновой кислоты (ЭПК), по-видимому, благотворно влияет на депрессию. Докозагексаеновая кислоты (ДГК) не связана ни с какими антидепрессивными эффектами. Антидепрессивные эффекты ЭПК являются значимыми только у людей с явно выраженной депрессией. Вполне вероятно, что рыбий жир может усиливать действие антидепрессантов, так как вышеописанный мета-анализ показал, что в ходе большинства исследований на фоне общей депрессии или болезненных состояний также использовались стандартные антидепрессанты (например, литий)38). По крайней мере, в ходе одного исследования отмечается, что рыбий жир (в изолированно состоянии в дозировке 1000 мг этилового ЭПК) сравним по эффективности с препаратом СИОЗС флуоксетином (20 мг); это также подтверждает идею о том, что комбинированная терапия является наилучшим решений, так как показатели реакции составляли 50-56% (в ходе монотерапии) и увеличивались 81% в ходе использования обоих препаратов. Синергизм отмечается в ходе исследований на животных с использованием традиционных антидепрессантов (флуоксетин и миртазапин), а также с нутрицевтическими антидепрессантами, например, уридином. Существуют доказательства того, что рыбий жир действует в качестве антидепрессанта сам по себе, но также существуют данные о том, чтобы подтвердить его значительный вклад при использовании его в качестве элемента комбинированной терапии. Комбинированная терапия означает использование рыбьего жира наряду с доказанными антидепрессантами. У относительно здоровых пожилых взрослых людей с незначительными симптомами депрессии, употребление рыбьего жира, по-видимому, не способствует улучшению дальнейшего состояния и снижению проявлений депрессии при употреблении 1800 мг ЭПК+ДГК39), также не выявлено никакой эффективности в отношении снижения симптомов депрессии (или улучшения самочувствия) у взрослых, которые не сообщали о депрессии. Существует недостаточно доказательств того факта, чтобы подтвердить антидепрессивный эффект у людей, которые сообщают об умеренной, но не изнурительной депрессии. Употребление рыбьего жира не является эффективным при умеренной депрессии, об этом свидетельствуют проведённые исследования.
Биполярное расстройство
Употребление рыбьего жира, как предполагается, помогает ослабить симптомы биполярного расстройства, в то время как схожие по действию препараты (карбонат лития или вальпроат) снижают нейронные сигнальные трансдукционные системы, что, как как считается, связано с омега-3 жирными кислотами и арахидоновым и фосфолипидным воздействием. Биполярное расстройство, как выяснилось, также связано с изменениями в мембранных липидах, но это больше относится к GLA и омега-6 жирным кислотам, нежели рыбьему жиру. Тем не менее, несмотря на предварительные исследования, которые отмечают, что употребление рыбьего жира может помочь при симптомах биполярного расстройства в дозировке 9,6 в день (6200 мг ЭПК и 3400 мг ДГК) и (хотя и осторожно) способствует снижению симптомов депрессии, отмеченных в ходе мета-анализа по данной теме; последующие исследования с использованием более маленьких дозировок (2 г дважды в день, всего 1680 мг ЭПК и 1120 мг ДГК) с или без 1 г цитидина, поставляемого за счёт CDP-холина (дважды в день; образует уридин в организме) не показали никаких результатов в ходе 16-недельного тестирования, продемонстрировав даже незначительную тенденцию к ухудшению симптомов. Существуют смешанные данные относительно добавок рыбьего жира и биполярного расстройства. Ограниченные исследования по этой теме являются слишком разными для сравнения, в их ходе используются слишком разные дозировки. Хотя благотворный эффект не может быть исключён, эффект ухудшения также возможен.
Стресс
Употребление рыбьего жира крысами (при 5% от рациона), как выяснилось, нормализует реакцию на стресс после воздействия электрическим током; в ходе тестирования использовалась долгосрочная имитация экологического стресса. Это было повторно воспроизведено на других животных и людях, употреблявших ДГК в высоких дозировках (1,5-1,8 г ДГК в день), при которых адреналиновая реакция на стресс ослаблялась40). На долгосрочных примерах по оценке кортизола (долгосрочный гормон стресса), студенты, сдававшие 20 экзаменов, имели одинаковое снижение норадреналина (на 31%) при употреблении 1,5 г ДГК в день, хотя никаких изменений в уровнях кортизола выявлено не было. В соответствии со стрессом, ЭПК и ДГК, по-видимому, вызывают определённые последствия. ЭПК за счёт модуляции некоторых иммунных функций, связанных со стрессом, а также ДГК связывают с агрессивными увеличениями во время стресса. Интересно, что низкие дозировки 762 мг ЭПК+ДГК в день могут снижать уровни норадреналина даже у здоровых лиц, не находящихся в состоянии стресса.
Метаболизм глюкозы
Дефицит омега-3 жирных кислот, как отмечается, снижает метаболизм глюкозы в головном мозге у крыс, что, как полагают, связано со снижением транспортеров GLUT1, которое можно исправить путём употребления добавок омега-3 жирных кислот (in vitro)41). У приматов, добавки ДГК (150 мг на кг массы тела), как выяснилось, улучшают поглощение глюкозы в нейронах, хотя само себе это не происходит у людей (независимо от возраста); отмечается обратная корреляция между церебральным использованием глюкозы и сывороточными триглицеридами, что предполагает то, что лечение дислипидемии может нести положительное влияние. Маловероятно, что добавки рыбьего жира увеличивают церебральный метаболизм глюкозы у людей. Люди с метаболическим синдромом или высокими уровнями триглицеридов могут испытывать положительную динамику, вторичную по отношению к снижению триглицеридов, хотя необходимо провести дополнительные исследования в этом отношении.
Кровоток и оксигенация
Изолированный ЭПК, как отмечается, может модулировать церебральный кровоток спонтанным образом у гипертензивных крыс при употреблении 100 мг на кг массы тела в течение 8 недель. По оценке гемодинамики в функциональной ближней ИК-спектроскопии, где общий кровяной гемоглобин тесно коррелирует с кровяным объёмом и измеренной оксигенацией у крыс, отмечается, что у относительно здоровых молодых людей, не употребляющих более одного жирного рыбного продукта в неделю и получавших затем 450 мг ДГК и 90 мг ЭПК в течение 12 недель, выявлено увеличение церебральной оксигенации во время когнитивного тестирования (без затрагивания венозного гемоглобина вследствие увеличения общего уровня гемоглобина); это исследования было продублировано в Medline42). Рыбий жир, по-видимому, способствует кровотоку в головном мозге у относительно здоровых взрослых людей, у которых отмечается низкое потребление рыбы.
Инсульт
Большинство эпидемиологических данных43), но не все, предполагают, что пониженный риск инсульта связан с высоким пищевым потреблением рыбы, особенно у пожилых людей, которые восполняют стандартную дозировку; считается, что это связано с омега-3 жирными кислотами, и, в частности, с ДГК44). Внутривенное введение триглицеридов рыбьего жира мышам, подверженных инсульту (гипоксии / реперфузии; 100-375 мг рыбьего жира на кг массы тела), показало снижение на 43-47% размеров инфаркта в результате предварительного лечения и отсрочки инсульта на 2 часа; употребление 100 мг ЭПК (в качестве этилового эфира) на кг массы тела в течение 8 недель у спонтанного гипертензивных крыс, перенёсших инсульт, показало модуляцию церебрального кровотока45). Возможно, что добавки рыбьего жира несут терапевтическую и профилактическую роль в отношении подверженную риску инсульта людей.
Деменция и болезнь Альцгеймера
Количество ДГК в комплексе с фосфатидилхолином в плазме, по-видимому, отрицательно коррелируют с риском деменции у людей[223], и высокое пищевое потребление рыбы, как было отмечен, оказывает защитное действие против показателя развития деменции и связанных с ней когнитивных отклонений у пожилых людей и людей среднего возраста46). Оценивая пожилых людей, более высокие уровни ЭПК (удивительно, но не ДГК) в головном мозге связывают с меньшей атрофией некоторых областей головного мозга (гиппокамп, правое миндалевидное тело) при исследованиях в течение 4 лет, и более низкие эритроцитные уровни ЭПК и ДГК связаны с пониженной массой головного мозга у пожилых людей в ходе когортных исследований. Эти результаты предполагают защитную роль ЭПК, и употребление 2000 мг ЭПК в течение 18 месяцев взрослыми людьми не показало снижения темпов атрофии. Более высокое потребление рыбы связывают со снижением риска развития деменции, а пониженные уровни докозагексаеновой кислоты (ДГК) в сыворотке крови связывают с повышенным риском деменции. Эйкозапентаеновая кислота (ЭПК), по-видимому, связана с сохранением массы головного мозга с течением времени. Повышенное употребление омега-6 в сравнении с омега-3 может быть связано с повышенной активностью ферментов ЦОГ, так как они являются конкурирующими субстратами, хотя последующая выработка PGE(2) (как известно, увеличивает секрецию амилоидов за счёт индукции гамма-сецератазы), которая, как известно, уменьшается при употреблении рыбьего жира, что не связано с ДГК-индуцированным подавлением секреции амилоидов47). Как отмечалось в разделе о протектинах, вполне вероятно, что механизм защиты от накопления амилоидов опосредован за счёт нейропротекина Д1, так как он мощно (EC50, равное 50 нм) подавляет образование амилоидов[89], обеспечивая его удаление за счёт PPARгамма-зависимых механизмов. Простагландин Е2 (PGE2) индуцированное накопление амилоидов, по-видимому, не связано с нейропротекцией в отношении болезни Альцгеймера, но связано с нейропротектином Д1. На примере животных, употребление ДГК в дозировке 300 мг на кг массы тела (дозировка для крыс) в течение 12 недель, по-видимому, способствует когнитивным свойствам, памяти, снижению уровня когнитивных отклонений на примере болезни Альцгеймера, характеризующейся бета-амилоидной пигментацией48). Кроме того, дендритный / синаптический распад, отмечаемый в ходе болезни Альцгеймера, снижается при употреблении ДГК, что, как предполагается, показывает механизм нейропротекции, являясь синергетическим с употреблением уридина49). Доказательства в отношении животных показывают значимость ДГК в высоких дозировках (300 мг на кг массы тела крыс, что соответствует человеческой дозировке в 48 мг на кг массы тела или 3,2 г ДГК для человека массой 68 кг). У людей с болезнью Альцгеймера, приём 2000 мг ДГК (без употребления ЭПК) из водорослей в течение 18 месяцев не повлиял благотворно на когнитивные отклонения, и другое исследование с использованием 1700 ДГК и 800 ЭПУ людьми с болезнью Альцгеймера в течение 6 месяцев не показало значительного ослабления скорости снижения когнитивных отклонений по оценке MMSE, не показав также изменений в психоневрологических симптомах (оба утверждения базируются на одном и том же исследовании). Исследования на базе людей с когнитивными отклонениями, вызванные старением, но без болезни Альцгеймера, показали, что 900 мг ДГК может снижать уровень когнитивных отклонений, но 500 мг ДГК и 200 ЭПК в течение 24 месяцев не проявили такого эффекта. Последующее исследование, тем не менее, не смогло найти никаких показателей когнитивных отклонений у обеих групп, что не может свидетельствовать о каком-либо влиянии рыбьего жира. Исследования с использованием практических и высоких уровней рыбьего жира людьми с болезнью Альцгеймера не показали практического положительного влияния, но исследования на пожилых пациентах без болезни Альцгеймера предположили, что ДГК может быть способной снижать уровень когнитивных отклонений. Причина этого несоответствия, если оно существует, не выявлено на сегодняшний день.
Боль
Резолвин Е1 (РвЕ1) воздействует для обезболивания через рецептор Chem23, являясь не зависимым от употребления рыбьего жира (инъекции 0,3-20 нг РвЕ1; более мощный, чем ЦОГ2 ингибитор NS-398); его метаболическая дезактивация за счёт окисления (оксо-РвЕ1) является метаболически неактивной. По-видимому, активация рецептора Chem23 за счёт РвЕ1 ингибирует ERK50) и, более конкретно, TNF-альфа индуцированную активацию ERK, которая воздействует на TRPV1 для опосредования восприятия боли. В целом, предполагается, что воздействие РвЕ1 на боль происходит, в первую очередь, за счёт отрицательной регуляции TNF-альфа и его нормальной индукции высвобождения глутамата из нейронов, активируя ERK для индукции боли за счёт TRPV1. Хотя РвЕ1 был описан выше, РвД1 (из ДГК), по-видимому, также может активировать рецептор Chem23, и родительские жирные кислоты ЭПК и ДГК также были протестированы, но показали результаты в 10000 раз слабее. Резолвин Е1 (при употреблении ЭПК) и резолвин Д2 (из ДГК), по-видимому, действует через новый рецептор для предотвращения провоспалительного цитокина, известного как TNF-альфа за счёт индукции боли. На молекулярном уровне (как много молекул требуется для индукции эффектов), РвЕ1 и РвЕ2 являются удивительно мощными. На примере людей, добавки рыбьего жира, как выяснилось, снижают боль у людей с воспалительными болями в суставах по оценке отчётов пациентов и употреблении НПВП (число лекарств подобного типа было снижены), но не по профессиональной оценке врачей.
Сердечно-сосудистые заболевания
Механизмы
СЕТР представляет собой транспортный белок, который переносит холестерин из ЛПВП или в ЛПОНП, или в ЛПНП (аполипопротеин В содержит липопротеины51)) в обмен на триглицериды, и снижение активности СЕТР увеличивает ЛПВП, возможно, только в случаях гиперлипидемии, в то время как активность СЕТП сама по себе позитивно коррелирует с ЛПНП52). За счёт этого и связью между СЕТР и высоким холестерином, увеличение активности СЕТР рассматривается как проатерогенное (увеличение ЛПНП со снижением ЛПВП, что является неблагоприятным терапевтическим эффектом); его ингибирование считается благоприятным. Ингибирование СЕТР в дальнейшем желательно как для триглицеридов в ходе восстановительного лечения, так и в ходе обмена холестерина из ЛПОНП / ЛПНП в ЛПВП в соотношении 1 к 1 с триглицеридами; истощение триглицеридов из холестерина типов ЛПНП и ЛПОНП (по сравнению с плацебо самим по себе) было подтверждено у людей в ходе употребления рыбьего жира53). Рыбий жир, как отмечается, увеличивает активность СЕТР у животных за счёт ДГК, но не ЭПК, что, как считается, лежит в основе избирательной индукции «плохого» холестерина, отмечаемого с ДГК, но не ЭПК, хотя этот факт не объясняет увеличения «хорошего» холестерина, отмечаемого с ДГК54). Вполне вероятно, что одним из механизмов, лежащих в основе благотворного влияния рыбьего жира, является ингибирование эфира холестерина белка-переносчика (СЕТР), который способен снижать уровень триглицеридов, увеличивая липопротены высокой плотности (ЛПВП). Этот путь в одиночку, тем не менее, не объясняет эффектов в отношении липопротеинов низкой плотности (ЛПНП)
Триглицериды
 В отношении триглицеридов (ТГ; фактор риска развития сердечно-сосудистых заболеваний при повышенных значениях); рыбий жир, по-видимому, является мощным и надёжным агентом снижения триглицеридов у людей с гиперлипидемией (высокие уровни ТГ).
Опубликованный мета-анализ показывает, что рыбий жир является эффективным в отношении общей дислипидемии (снижение на 0,34 ммоль на л), дислипидемией на фоне ВИЧ (7 испытаний на 372 лицами по снижению ТГ на 1,12 ммоль на л), дислипидемии, вызванной почечной недостаточностью (10 испытаний на 337 людей, снижение ТГ на 0,78 ммоль на л), диабетической дислипидемии (24 испытания на 1530 людях, снижение ТГ на 0,17 ммоль на л или на 7%). Диапазон снижения, как выяснилось, может достигать 25-30% при использовании 4 г этилового эфира ЭПК ежедневно, но более свежие исследования предполагают, что снижение является гораздо более скромным (по оценкам, снижение составляет 15-20%, а величина зависит от базового уровня триглицеридов).
ЭПК и ДГК способны снижать уровень триглицеридов, и это благотворное влияние распространяется на остальные источники ДГК, включая жир водорослей (мета-анализ) и жир криля со сравнимой эффективностью. Сравнивая эффективность ЭПК против ДГК, когда они использовались изолированно (разные испытания), ЭПК, по-видимому, проявил себя несколько более эффективно (мета-анализ, выявивший снижение на 25,1 мг на дл при использовании ДГК в изолированном состоянии55) в качестве усреднённого значения, а также снижение на 45,8 мг на дл при использовании ЭПК в изолированном состоянии; исходные дозировки и уровни ТГ равны). Тем не менее, исследования по оценке прямого сравнения между ДГК и ЭПК56) отмечают превосходство изолированного ДГК (когда дозировки совпадают; например, 4 г против 4 г). Вполне вероятно, что это расхождение связано с тем, что ЭПК традиционно используется в большей дозировке, чем ДГК, причём рыбий жир следует этому показателю дозозависимости.
Рыбий жир надёжно и эффективно снижает уровень триглицеридов через несколько недель употребления. Снижение триглицеридов базируется на дозировке, проявляясь более значительно у людей с высоким базовым уровнем триглицеридов, достигая диапазона в 15-30%. Эта эффективность является фармацевтической, в ходе чего рыбий жир был запатентован в качестве препарата «Ловаза» (этиловый эфир).
Употребление рыбьего жира, по-видимому, не влияет на постпрандиальные триглицерида при разовом употреблении (одна дозировка во время еды); было отмечено снижение постпрандиальных триглицеридов у гиперлипидемичных людей в ходе продолжительного употребления (27% при употреблении 4 г этилового ЭПК или 19% при употреблении 4 г рыбьего жира).
Снижение постпрандиальных триглицеридов происходит в ходе неоднократного употребления добавок, может в большей степени отражать эффект снижения триглицеридов сам по себе. Разовое употребление рыбьего жира не смогло оказать благотворного влияния на постпрандиальные триглицериды.
В отношении триглицеридов (ТГ; фактор риска развития сердечно-сосудистых заболеваний при повышенных значениях); рыбий жир, по-видимому, является мощным и надёжным агентом снижения триглицеридов у людей с гиперлипидемией (высокие уровни ТГ).
Опубликованный мета-анализ показывает, что рыбий жир является эффективным в отношении общей дислипидемии (снижение на 0,34 ммоль на л), дислипидемией на фоне ВИЧ (7 испытаний на 372 лицами по снижению ТГ на 1,12 ммоль на л), дислипидемии, вызванной почечной недостаточностью (10 испытаний на 337 людей, снижение ТГ на 0,78 ммоль на л), диабетической дислипидемии (24 испытания на 1530 людях, снижение ТГ на 0,17 ммоль на л или на 7%). Диапазон снижения, как выяснилось, может достигать 25-30% при использовании 4 г этилового эфира ЭПК ежедневно, но более свежие исследования предполагают, что снижение является гораздо более скромным (по оценкам, снижение составляет 15-20%, а величина зависит от базового уровня триглицеридов).
ЭПК и ДГК способны снижать уровень триглицеридов, и это благотворное влияние распространяется на остальные источники ДГК, включая жир водорослей (мета-анализ) и жир криля со сравнимой эффективностью. Сравнивая эффективность ЭПК против ДГК, когда они использовались изолированно (разные испытания), ЭПК, по-видимому, проявил себя несколько более эффективно (мета-анализ, выявивший снижение на 25,1 мг на дл при использовании ДГК в изолированном состоянии55) в качестве усреднённого значения, а также снижение на 45,8 мг на дл при использовании ЭПК в изолированном состоянии; исходные дозировки и уровни ТГ равны). Тем не менее, исследования по оценке прямого сравнения между ДГК и ЭПК56) отмечают превосходство изолированного ДГК (когда дозировки совпадают; например, 4 г против 4 г). Вполне вероятно, что это расхождение связано с тем, что ЭПК традиционно используется в большей дозировке, чем ДГК, причём рыбий жир следует этому показателю дозозависимости.
Рыбий жир надёжно и эффективно снижает уровень триглицеридов через несколько недель употребления. Снижение триглицеридов базируется на дозировке, проявляясь более значительно у людей с высоким базовым уровнем триглицеридов, достигая диапазона в 15-30%. Эта эффективность является фармацевтической, в ходе чего рыбий жир был запатентован в качестве препарата «Ловаза» (этиловый эфир).
Употребление рыбьего жира, по-видимому, не влияет на постпрандиальные триглицерида при разовом употреблении (одна дозировка во время еды); было отмечено снижение постпрандиальных триглицеридов у гиперлипидемичных людей в ходе продолжительного употребления (27% при употреблении 4 г этилового ЭПК или 19% при употреблении 4 г рыбьего жира).
Снижение постпрандиальных триглицеридов происходит в ходе неоднократного употребления добавок, может в большей степени отражать эффект снижения триглицеридов сам по себе. Разовое употребление рыбьего жира не смогло оказать благотворного влияния на постпрандиальные триглицериды.
Липопротеины
Считается, что ДГК опосредует эффект повышения холестерина в ходе употребления рыбьего жира, так как употребления ДГК увеличивает «хороший» холестерин на 4,49 мг на дл (95% ДИ, равное 3,50-5,48 мг на дл) и «плохой» холестерин на 7,23 мг на дл (95% ДИ, равное 3,98-10,5), в то время как ЭПК незначительно увеличивает «хороший» холестерин на 0,20 мг на дл (95% ДИ, равный -0,82-0,41) и недостоверно влияет на «плохой» холестерин, увеличивая на 1,85 мг на дл (95% ДИ, равное -3,01-6,71) со спорадическими случаями того, как ЭПК увеличивает «хороший» и «плохой» холестерин57), что можно объяснить превращением ЭПК в ДГК в организме. Употребление рыбьего жира, вторичного по отношению к компоненту ДГК, может увеличивать липопротеины ЛПВП и ЛПНП в организме. По-видимому, увеличение ЛПНП несколько превалирует над ЛПВП, и, таким образом, большие дозировки рыбьего жира не целесообразно употреблять людям с высоким «плохим» холестерином, если снижение триглицеридов считается более важным, либо необходимо наряду с рыбьим жиром употреблять статины или схожие агенты по снижению холестерина. Возможно, что рыбий жир может снижать уровень «плохого» холестерина, но это достаточно редко; для этого требуется, чтобы пациент не имел нарушений в функционировании ЛПНП, в первую очередь (нормальные уровни холестерина)58), или он должен принимать препараты, угнетающие «плохой» холестерин, например статины (смотрите раздел о взаимодействии с другими препаратами). Вполне возможен эффект снижения «плохого» холестерина на фоне употребления рыбьего жира со статинами, в то время как рыбий жир и статины обладают синергизмом в отношении снижения «плохого» холестерина, что сводит на нет негативное увеличение «плохого» холестерина из-за рыбьего жира, которое возможно у гиперлипидемичных людей.
Риски сердечно-сосудистых заболеваний
В ходе вторичной профилактики сердечно-сосудистых заболеваний, мембранный показатель омега-6 жирных кислот к омега-3 жирным кислотам составляет 4 к 1 (в среднем при западном рационе он равен 15-16,7 к 1) или ниже, что связано со снижением на 70% общей смертности, по оценке перспективного исследования. Нормализация показателей омега-3 жирных кислот и омега-6 жирным кислотам, по-видимому, связана с кардиопротекцией.
Эндотелиальные взаимодействия
Механистическим базисом для улучшения функционирования релаксации эндотелия с n-3 PUFA может включать подавление тромбоксана А2 или циклические эндопероксиды, уменьшенное образование цитокинов, дополненный эндотелиальный синтез оксида азота, улучшение чувствительности сосудистой гладкой мышечной клетки по отношению к оксиду азота, а также пониженную экспрессию эндотелиальных молекул адгезии59).
Взаимодействие с метаболизмом глюкозы
Примечание: Для полноценного обзора по поводу того, как употребление рыбьего жира взаимодействует с метаболизмом глюкозы, смотрите пункты о поджелудочной железе и печени в разделе «Взаимодействия с системами органов». Диабетическая нефропатия и анализ ретинопатии также представлен в разделе о системе органов, хотя диабетическая нейропатия описана в разделе «Неврология».
Сахар в крови и гликемический контроль
Употребление рыбьего жира (в исследованиях использовался этиловый эфир ЭПК) показало, что потребление рыбьего жира может достаточно надёжным образом повысить уровень глюкозы в диапазоне 2-6 мг на мл, причём это относится как к диабетикам, так и здоровым людям; такие выводы сделаны на базе нескольких мета-анализов (большинство позитивных, некоторые – противоречивые), отмечается также тенденция по увеличению уровня глюкозы в гиперлипидемичных пациентов. Эта повышенная концентрация глюкозы не часто встречается на фоне увеличений биомаркеров диабета в качестве побочных эффектов (HbA1c60) и фруктозамин61)), что предполагает, что это может лежать в основе последующих патологий диабета. Стоит отметить, что увеличения глюкозы не отмечается при употреблении низких дозировок рыбьего жира (6 г рыбьего жира, содержащего 1080 мг ЭПК и 720 мг ДГК), что, по-видимому, демонстрирует дозозависимый эффект; в ходе одного исследования не удалось найти влияния 4 г рыбьего рыба, однако 7,5 г (2600 мг ЭПК и 1,4 мг ДГК) вызвали увеличение. Отмечается небольшое увеличение уровней глюкозы в крови на фоне употребления рыбьего жира, что не зависит от состояния болезни (влияет на диабетиков, гиперлипидемичных пациентов и здоровых людей), являясь маленьким (2-6 мг на дл) и не связанным с увеличением диабетических параметров HbA1c и фруктозамина. Увеличение глюкозы, по-видимому, происходит при использовании высоких дозировок рыбьего жира. Диабетики, желающие начать приём рыбьего жира, должны начать с минимальной эффективной дозировки.
Чувствительность к инсулину
У здоровых людей рыбий жир может не увеличивать чувствительность к инсулину в случае рациона с высоким (37%) содержанием жиром, когда потеря или набор массы тела предотвращены при дозировке в 3,6 ЭПК+ДГК в день. Это исследование отмечает незначительную тенденцию улучшения чувствительности у лиц, у которого были изначально более высокие показатели соотношения омега-6 жирных кислот в омега-3 жирным кислотам. Другие исследования показали схожие результаты у здоровых лиц, однако показатели соотношения фосфолипидов не были выявлены. У относительно здоровых мужчин, даже в случае сочетания физических нагрузок с рыбьим жиром, не было выявлено никаких изменений чувствительности к инсулину, которые бы были вызваны рыбьим жиром62). Рыбий жир, по-видимому, является аддитивным, но не синергетическим в отношении физических нагрузок. Другие исследования предполагают улучшения чувствительности к инсулину, которые, как правило, имеют худшие показатели соотношения омега-3 жирных кислот к омега-6 жирным кислотам, например, пожилые люди, люди с нездоровым метаболизмом и страдающие ожирением63). Стоит отметить, что эти доказательства не являются «железобетонными», и некоторые известные исследования показали отсутствие изменений в чувствительности к инсулину даже у вышеуказанных групп людей64). Тем не менее, информация из этого раздела показывает, что большое количество систематических мета-анализов не выявило значительной возможности рыбьего жира изменять уровни глюкозы или инсулина у диабетиков II типа. Вышеописанный механизм увеличения чувствительности к инсулину может сохранять текучесть клеток и реологию, а также приводить ненормальные показатели соотношения омега-3 жирных кислот к омега-6 жирным кислотам в нормальное состояние (предотвращая ненормальные показатели, в первую очередь) без терапевтического влияния на этот фактор. Это поддерживается Хогардом и другими исследователями, которые показатели корреляцию между мембранным содержимым PUFA (не зависит от того, является ли принадлежным к омега-3 или омега-6 классу), включая соотношения омега-3 жирных кислот к омега-6 жирным кислотам и чувствительностью к инсулину. Наконец, у тех, у кого выработалась устойчивость к инсулину при избытке фруктозы, рыбий жир не является эффективным в отношении уменьшения инсулинорезистентности (хотя он по-прежнему снижает уровень триглицеридов). Это делает правдоподобным утверждение о том, что эффект чувствительности к инсулину рыбьего жира проявляется на клеточном уровне, так как фруктоза вызывает инсулинорезистентность на уровне печени и поджелудочной железы65). Другой возможный механизм просто отрицает негативное воздействие некоторые насыщенных жирных кислот в отношении чувствительности к инсулину. Пальмитиновая кислота, как известно, индуцирует мышечную резистентность к инсулину, и полиненасыщенные жиры (омега-3 или омега-6) могут снижать негативные эффекты пальмитиновой кислоты. Существуют некоторые сведения, предполагающие, что рыбий жир может увеличивать чувствительность к инсулину, но эти исследования являются изолированными и зависимыми от заранее существующих условий, которые препятствуют чувствительности к инсулину. Употребление рыбьего жира не увеличивает чувствительность к инсулину или снижение глюкозы (долгосрочный маркер метаболизма глюкозы). Рыбий жир может, тем не менее, снижать уровень глюкозы в крови при одноразовом употреблении.
Риск диабета
По-видимому, отмечается пониженный риск развития диабета в случае нормализации показателя соотношения омега-3 жирных кислот к омега-6 жирным кислотам66).
Жировая масса и ожирение
Механизмы
У мышей высокие дозировки (15% от рациона) рыбьего жира, как отмечается, индуцируют экспрессию CPT-1, Nrf1 и PPARальфа в жировой ткани; последний из перечисленных элементов, как правило, обладает свойствами расщепления жира при активации; следующий перед ним фермент опосредует транспортировку карнитина в митохондриях, п также служит в качестве лимитирующей стадии окисления жира67). PGC1альфа, как отмечается, также индуцируется в жировой ткани мышей, хотя активация PGC1альфа может увеличивать расход энергии с помощью экспрессии UCP2; вполне возможно, что это всего лишь обратная реакция активации PPARальфа, так как существуют сходства в этом отношении между рыбьим жиром и фибратами (фармацевтические активаторы PPAR). Кроме того, ДГК, как считается, является активным ингредиентом, так как он лучше коррелирует с потерей массы тела у людей. Рыбий жир может технически активировать рецептор PPAR для индукции митохондриального биогенеза, увеличивая скорость метаболизма. Хотя этот эффект подтверждён на примере грызунов, всё же требуется высокая пероральная дозировка. На примере грызунов отмечается генетическая разница при рассмотрении метаболизма PPAR. В исследованиях по оценке скорости метаболизма выяснилось отсутствие явного влияния (несмотря на повышение жирового окисления) у относительно худых мужчин68). Рыбий жир ненадёжным образом увеличивает скорость метаболизма. Могут отмечаться противовоспалительные эффекты на уровне жировой ткани в качестве свидетельства снижения секреции цитокинов под влиянием жирных кислот рыбьего жира. Рыбий жир может оказывать локальное противовоспалительное действие, которое может косвенно помогать жировому метаболизму у людей, у которых отмечается избыточное воспаление (например, у людей с метаболическим синдромом).
Адипокины
С помощью этих агонистов рыбий жир может увеличивать секрецию адипонектина из жировых клеток. Интересен факт, что упоребление 2 г рыбьего жира в течение 6 недель физиологически соответствует подобному эффекту69). Более высокие уровни циркулирующего адипонектина отмечаются при рационе с более высоким содержанием рыбьего жира и омега-3. ЭПК является более мощным в отношении увеличения адипонектина в сравнении с ДГК, и это увеличение является опосредованным через активацию PPARгамма. Рыбий жир может положительно регулировать уровни лептина в том же порядке.
Взаимодействия с углеводами
Отмечается, что жиросжигающий эффект рыбьего жира относительно набора массы тела у крыс с высоким содержанием жиров в рационе восстанавливается у диабетических крыс, включение большого количества сахарозы в рацион уменьшает противовоспалительные эффекты и эффекты снижения массы тела рыбьего жира.
Увеличение массы тела
У крыс с рационом с высоким содержанием жиров употребление рыбьего жира (без превышения нормы потребления калорий), по-видимому, способствует ослаблению скорости набора жира в течение времени в периоды, когда он составляет 20-40% от всех калорий70); некоторые исследования с более разумными дозировками (1-12%) показали такие же результаты, но в меньшей степени, причём выяснилось, что ДГК более эффективен, чем ЭПК. Не ясно, если этот эффект проявляется таким же образом у диабетиков, так как в ходе одного исследования выяснилось увеличение набора массы тела (без замеров массы жира), однако такой эффект сохраняется у животных с уже избыточной массой тела, которые являются субъектами последующего набора массы тела. В общем, высокие дозировки рыбьего жира у крыс (на непрактичном для человека уровне) способны надёжно уменьшать увеличение массы тел, если крысы употребляли провоцирующий ожирение рацион. Как отмечается, это происходит в меньшей степени при использовании малых дозировок, которые могут быть более подходящими для употребления людьми. Рыбий жир, как известно, подавляет адипогенный рецептор PPARгамма, а также его уровни мРНК71).
Взаимодействия со скелетными мышцами
Рыбий жир, как отмечается, увеличивает экспрессию фермента карнитин пальмитоилтрансферазы-1 (CPT-1) в мышечных клетках (вероятно является вторичным по отношению к активации PPAR), а также увеличивает экспрессию пероксисомалацин-СоА оксидазы и UCP3 при очень высоком пищевом потреблении (40% от всего рациона). Взаимодействия со скелетными мышцами могут опосредовать потерю жира за счёт калорийных расходов.
Вмешательства
Изучая обзорные исследования, была выявлена обратная корреляция употребления пищевого рыбьего жира и показателей ожирения (предполагает защитный эффект) или отсутствие значительной связи вообще72). Изучая вмешательства, одно исследование на относительно здоровых худых мужчинах показало, что замена употребления 6 г жирных кислот на рыбий жир в течение 3 недель привела к потере жира на -0,88+/-0,16 (в случае с плацебо этот показатель составил -0,3+/-0,34 кг), что связывают с увеличением жирового окисления, но не ускорением метаболизма. Рыбий жир может увеличивать потерю жира у относительно худых лиц, однако требуются дополнительные исследования для подтверждения этого эффекта. У лиц с избыточной массой тела, ведущих сидячий образ жизни, 6 г рыбьего жира не смогли превзойти 6 г контрольного масла (подсолнечного), либо с, либо без аэробных упражнений, хотя отмечается слабый синергизм между рыбьим жиром и физическими нагрузками73). Отсутствие благотворного влияния рыбьего жира на снижение жировой массы к людей с избыточной массой тела было также отмечено у женщин с инсулиновой резистентностью при употреблении 2,9 г ДГК и 1,3 г ЭПК в течение 24 недель. Так или иначе, отмечается (при гиперлипидемии), что снижение жира в организме, отмечаемое на фоне употребления рыбьего жира, является значительным лишь в случае физических нагрузках, так как его изолированное употребление не принесло никакого эффекта при использовании аналогичных дозировок. В исследованиях с усиленными калорийными ограничениями употребление рыбьего жира (2800 мг омега-3 жирных кислот) женщинами с избыточной массой тела связывают с повышенными потерями жира в организме и общей массы (на 24%), чем в случае с контрольным препаратом (солевой раствор), что, как считается, связано с увеличением уровня кетонов, обнаруживаемых в крови. Некоторая степень потери жира также отмечается при употреблении рыбьего жира на фоне диеты Зона (диета Зона уже сама по себе эффективна в этом отношении), в то время как отдельно препарат не был эффективен. Рыбий жир может играть определённую роль в снижении массы тела у людей с избыточной массой тела, однако лишь при его использовании не отмечается никакого эффекта. Этот эффект является зависимым от других привычек, способствующих снижению массы тела, например, от физических нагрузок или калорийных ограничений. Сам по себе эффект не является очень сильным.
Мышечная масса и гипертрофия
Механизмы
Употребление рыбьего жира, как отмечается, может увеличивать синтез белка мышц, индуцированного лейцина как у молодых, так и пожилых лиц74). Возможный механизм подавления SMAD2 и индукции SMAD7 (отмечаемый в почечных клетках и сердечных клетках), который, как известно, подавляет воздействие миостатина, так как миостатин является зависимым от ядерной транслокации SMAD2 / 3 (комплекса), и это, как было отмечено, ингибируется рыбьим жиром. Нет никаких доказательств взаимодействия рыбьего жира и миостатина. Эти отношения не были оценены в ходе прямых исследований.
Мышечная биоэнергетика
Употребление очень высоких дозировок (1 г на кг массы тела; около 28% ЭПК+ДГК от общего рациона) рыбьего жира крысами показало увеличение ресинтеза и повышение окисления глюкозы, не зависимой от инсулина; отмечается увеличение на 14% концентрации лактата, которая является зависимой от стимуляции инсулина. Повышенное окисление глюкозы и её усвоение могут снижать эффекты увеличения транскрипции АМФК. Активация АМФК, как отмечается в других тканях, происходит за счёт ДГК, например, в кишечнике, хотя это и происходит опосредовано через адипонектин. Это увеличение окисления глюкозы (возможно, что за счёт АМФК) также отмечается при употреблении 1,8 г омега-3 (1,1 г ЭПК и 0,7 г ДГК), что количественно вызвало одинаковые показатели окисления глюкозы, несмотря на снижение на 17% AUC в отношении инсулина. Рыбий жир, по-видимому, активируют мРНК в отношении разобщающих белков (выработка тепловой энергии) в мышиных мышцах UPC3, бурой жировой ткани UCP2 и печёночной UCP275), хотя падение было выявлено в белой жировой ткани UCP2. Мышечная положительная регуляция также проявляется у крупного рогатого скота. Хотя повышенная экспрессия UCP коррелирует с пониженной энергетической эффективностью, дозировка в 7,2 г рыбьего жира (1,1 г ЭПК и 0,7 г ДГК) незначительно нарушила энергетическую эффективность у относительно здоровых мужчин. Это исследование отмечает тенденцию увеличения использования жира за счёт углеводов, тем не менее; показатели по разделительным белкам не измерялись. В отношении этого вопроса дело может касаться дозировки, так как метаболическая эффективность в отношении энергетической усвояемости значительно снижается при передозировке рыбьего жира на 40% у крыс. Инкубация рыбьего жира (технически ЭПК) в мышечных клетках связана с увеличенной способностью мышечных клеток переключаться с глюкозы на жир в качестве первичного субстрата окисления, этот феномен известен в качестве «биоэнергетической гибкости» или «метаболического переключения»76).
Скорость выздоровления и катаболизм
У мышей, подверженных иммобилизации, употребление рыбьего жира вовлечено в снижение показателей мышечной дегенерации. Тем не менее, оно также препятствует восстановлению после повторения того же пути в течение нескольких дней. Некоторые исследования на основе послеоперационных ситуация показывают увеличение сохранения мышечной массы тела при добавлении ЭПК к энтеральному питанию77). На данный момент этот факт ещё исследуется, однако некоторые уже проведённые исследования не выявили никакой разницы. Рыбий жир значительно влияния на метаболизм глюкозы и жировой метаболизм в мышечных клетках, спососбствуя гибкости этого процесса. В умеренных дозировках рыбий жир благотворно влияет на биоэнергетические показатели за счёт комбинированного воздействия употребления добавок и митохондриальных ферментов. Множество антидиабетических эффектов рыбьего жира могут косвенно быть связаны с увеличенным усвоением глюкозы в мышцах, а также повышенной инсулиновой чувствительностью. Предварительные исследования предполагают, что рыбий жир может увеличивать гипертрофию. Эти данные являются обнадёживающими, однако пока что ограниченными.
Влияние на здоровье
У мышей в течение более длительных периодов времени рыбий жир может предохранять эффекты некоторых гормонов (инсулина, адипонектина) на мышечные клетки в условиях воздействия риска ожирения, обусловленного рационом78). Это может происходить за счёт компонента рыбьего жира, а именно ДГК, который способен частично обращать вспять снижение, отмечаемое в ходе усвоения глюкозы в мышцах на базе пальмитиновой кислоты, являющейся насыщенной жирной кислотой. Нормализация показателей фосфолипидов (независимо от рыбьего жира) может увеличивать секрецию адипонектина, тем не менее. Не ясно, если рыбий жир или этот показатель являются конечными причинами отмечаемого благотворного влияния на здоровье. В мышечных клетках рыбий жир может увеличивать уровни АМФК мРНК, в частности, и АМФКа2. Он вовлечён в воздействие в отношении белой жировой ткани. Высокие дозировки ЭПК (500 мг на кг массы тела), как отмечается, снижают экспрессию PPARальфа и PPARгамма в мышечных клетках, вмешиваясь в выработку провоспалительных TNFальфа и ИЛ-6, которые придают правдоподобность его противовоспалительным эффектам. Повышенная экспрессия GLUT4 отмечается при этой дозировке, хотя более низкие дозировки показывают только увеличения транслокации GLUT1. Возможно, за счёт АМФК, пониженное отношение омега-6 жирных кислот к омега-3 жирным кислотам (больше омега-3 в сравнении с омега-6) в мышечных клетках связано с повышенным употреблением глюкозы и улучшенной толерантностью к глюкозе во всём организме, не зависимой от митохондрий. Показатель составлял около 0,5 к 1 – 1,5 к 1 (рыбий жир) по отношению к 17,5 к 1 -29,7 к 1 (контрольные замеры), измерения проводились в клеточной мембране. Мембраны мышечных клеток, по-видимому, высоко восприимчивы к пищевым изменениям употребления омега жирных кислот, что связывают in vivo с инсулиновой чувствительностью у людей79).
Иммунология и воспаление
Циркулирующие цитокины
Секреция интерлейкина-2 (ИЛ-2) из лимфоцитов, как отмечается, может быть снижена в моменты, когда клетки селезёнки мышей инкубируются с жирными кислотами рыбьего жира, которые, как выяснилось, влияют на людей независимо от состояния заболевания (лимфоциты в этом исследовании были выделены у диабетиков и контрольной группы). Так как ИЛ-2 является цитокином, который положительно влияет на пролиферацию Т-клеток, являясь стимулятором секреции TNF-альфа и ИЛ-1 (альфа и бета), вероятно, что подавление ИЛ-2 лежит в основе других иммунологических эффектов употребления рыбьего жира. Механизмы установлены не полностью, так как подавление воздействия ИЛ-2 (по оценке прогрессии Т-клеточного цикла) было отмечено в ходе употребления рыбьего жира, также отмечается снижение диацилглицерина (ДАГ) и церамидов[372], причём оба являются положительными регуляторами пролиферации Т-клеток80). Хотя сам по себе рецептор не является затронутым в этом контексте, пониженный сигнальный потенциал (по оценке фосфорилирования ERK1 / 2) отмечается в Т-клетках, инкубированных с рыбьим жиром81), что может быть связано с пониженным набором изомером протеинкиназы (альфа и эпсилон) по отношению к клеточной мембране; это может привести и иммуносупрессивному эфекту рыбьего жира, который является зависимым от реологических мембран и соотношения омега-3 жирных кислот к омега-6 жирным кислотам. Употребление 3,5 г рыбьего жира в течение 12 недель (относительно здоровыми людьми в возрасте 50-70 лет) не показало значительного влияния на ИЛ-2, а также не было выявлено влияния при употреблении 2 г людьми с изолированной гипертриглицеридемией. Тем не менее, употребление 18 г рыбьего жира (2,754 г ЭПК и 1854 мг ДГК) в день относительно здоровыми молодыми людьми привело к снижению секреции ИЛ-2 в стимулированных PBMC в диапазоне 23-52%, а у диабетиков II типа ИЛ-2 был снижен в ходе употребления рыбьего жира (1548 мг ЭПК и 338 мг ДГК в течение 8 недель) на 17,1%. Эффективность рыбьего жира в подавлении активности Т-клеток и ИЛ-2, по-видимому, не зависит от состояния заболевания. У спортсменов, которые до физических нагрузок употребляют рыбий жир (в течение 6 недель 1300 мг ЭПК и 300 мг ДГК), было отмечено увеличение нейтрофилов (PBMC), вырабатываемых ИЛ-2, при замерах через 3 часа после тренировок в сравнении с плацебо, причём ИЛ-2 обычно подавляется после тренировок, что было объяснено снижением иммуносупрессии. Такой же эффект был выявлен у профессиональных пловцов82). Интерлейкин-2, по-видимому, несколько ненадёжно подавляется в ходе употребления рыбьего жира, что может происходить из-за соотношения омега-3 жирных кислот к омега-6 жирным кислотам. Подавление ИЛ-2 происходит из-за нарушений воздействия на Т-клетки, и это приводит к уменьшению ИЛ-2, что, в конечном счёте, ведёт к снижению пролиферации Т-клеток, фактору некроза опухолей (TNF-альфа) и ИЛ-1бета. Фактор некроза опухоли альфа (TNF-альфа) является провоспалительным цитокином, который, как представляется, отрицательно коррелирует с состоянием омега-3. Этот цитокин положительно реагирует на стимулирование ИЛ-2, и снижение ИЛ-2 приводит к снижению TNF-альфа. Как и в случае с ИЛ-2, рецепторы TNF-альфа не явяляются затронутыми в ходе употребления рыбьего жира, но в отличие от ИЛ-2, стимулирование TNF-альфа из уже простимулированной иммунной клетки (в данном случае, моноцитов), по-видимому, не изменяется. Снижения TNF-альфа были отмечены у относительно здоровых мужчин83) и молодёжи (детей диабетиков II типа и молодых людей с избыточной массой тела), а также у относительно молодых взрослых людей при дозировке в 18 г, а также при употреблении более умеренных дозировок у людей, находящихся на гемодиализе. Тем не менее, как и в случае с ИЛ-2, отмечаются нулевые эффекты, не предполагающие изменений84), и демография положительных и отрицательных исследований часто перекрывается болезненными состояниями, например, гемодиализом, и поэтому маловероятно, что данный эффект проявляется у конкретной группы лиц. Концентрации TNF-альфа в сыворотке, по-видимому, ненадёжно уменьшается в ходе употребления рыбьего жира, и за счёт высокой корреляции со снижениями ИЛ-2 и TNF-альфа в паре с правдоподобным механизмом, считается, что снижения TNF-альфа происходя за счёт снижения циркулирующих уровней ИЛ-2. С-реактивный белок обычно находится в обратной зависимости с сывороточными омега-3 жирными кислотами, при этом он положительно коррелирует с омега-6 жирными кислотами. С-реактивный белок, как отмечается, снижает в покое у относительно здоровых мужчин в ходе 6-недельного употребления 2224 мг ЭПК и 2208 мг ДГК, и у женщин на гормональной заместительной терапии также отмечается снижение С-реактивного белка при употреблении 7-14 г рыбьего жира в день (35% и 10,7% соответственно). Употребление 1,5 г рыбьего жира с или без 800 мг витамина Е не показали снижение С-реактивного белка. У людей, перенёсших инсульт (65+/-10 лет) и употреблявших 1,2 г рыбьего жира в день не отмечается изменений в С-реактивном белке; у молодых людей, принимавших 0,6 г ЭПК и 0,25 г ДГК не отмечается никаких снижений, а у лиц с умеренной гипертриглицеридемией эти показатели также не затрагиваются85). С-реактивный белок, по-видимому, снижается в ходе употребления рыбьего жира, хотя этот факт не является надёжным. Обычно не выявляется значительного влияния. Вполне возможно, что очень высокие дозировки рыбьего жира могут усилить снижение CRP. Употребление 3,5 г рыбьего жира в течение 12 недель (людьми в возрасте 50-70 лет) не показало влияния на ИЛ-6 вместе с другими 12 параметрами (ИЛ-1альфа, ИЛ-1бета, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8 (или CXCL8), ИЛ-10, ИЛ-12р70, ИЛ-13, IFNгамма). ИЛ-1бета и ИЛ-6, тем не менее, оставались незатронутыми у людей на диализе (при употреблении 2400 мг и 3400 мг рыбьего жира) и просто здоровых лиц (775 мг ЭПК), но ИЛ-6, как сообщается, снизился у относительно здоровых мужчин употреблявших 1,5-2,5 г рыбьего жира в день в диапазоне 10-12%, а также у женщин, находящихся на гормональной заместительной терапии, при употреблении 7-14 г рыбьего жира в день. Уровни секреции ИЛ-6 в ответ на стимуляцию LPS были подвержены незначительному влиянию при употреблении 7-14 г женщинами в постменопаузе; отмечается снижение на 14% у студентов-медиков в ответ на LPS. При оценке функции нейтрофилов, было выявлено, что, хотя ИЛ-1бета, ИЛ-10 и ИЛ-23 подавляются (ИЛ-5 и ИЛ-17 испытывают такую же тенденцию, ИЛ-6 не проявлял никаких свойств к подавлению. ИЛ-1 (оба его вида) снижались при употреблении рыбьего жира. Другие интерлейкины, как правило, не подвергались значительному воздействию, хотя ИЛ-6, по-видимому, снижался в некоторых случаях. Состояния, когда ИЛ-6 снижался, коррелируют с состояниями, когда С-реактивные белки также снижаются.
Хемотаксис и факторы клеточной адгезии
Хемотаксис представляет собой процесс, при котором иммунные клетки рекрутируются в определённом участке в организме в ответ на секретируемые цитокины, которые вовлечены в иммунную клетки наряду с эндотелием, пока он прикрепляет к клетке факторы адгезии (Е-селектин, ICAM-1, VCAM-1 наиболее изучены), втягиваясь в ткань86). Метаболит арахидоновой кислоты, известный как лейкотриен В4, является мощным хемоаттрактантом (содействует хемотаксису), по-видимому, употребление рыбьего жира способствует снижению этого хемоаттрактанта, и, в конечном счёте, происходит снижение хемотаксиса, который происходит в нейтрофилах и моноцитах как больных, так и здоровых людей87). По-видимому, отмечается уменьшение хемотаксиса на фоне употребления рыбьего жира, что снижает показатели, при которых иммунные клетки (нейтрофилы и моноциты) могут проникнуть в ткани. Это является иммуносупрессивным действием, так как оно снижает уровни иммуноподдерживающего метаболита омега-6 жирной кислоты (лейкотриена В4), снижая иммунитет и зависимые от воспаления циркулирующие цитокины. На примере животных in vitro, пониженная экспрессия факторов клеточной адгезии была выявлена в моноцитах, макрофагах, лимфоцитах и эндотелии. Этот эффект отмечается как с ЭПК, так и с ДГК88) в изоляции. На примере людей, употребление рыбьего жира может снижать способность изолированных иммунных клеток выражать факторы клеточной адгезии в ответ на иммуностимулирующие агенты при тестировании вне организма, а также сывороточные уровни растворимых факторов адгезии, которые, как отмечается, также снизились. По-видимому, отмечается некоторое иммуносупрессивное снижение факторов адгезии на фоне старения, проявляющееся преимущественно у пожилых, а не молодых людей, однако этот факт не является надёжным. Факторы клеточной адгезии технически снижаются при употреблении эйкозапентеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК). Так как омега-6 жирные кислоты оказывают противоположный эффект, то вполне вероятно, что увеличение соотношения омега-3 жирных кислот к омега-6 жирным кислотам оказывает иммуносупрессию, в то время как обратный процесс способствует иммуностимуляции.
Нейтрофилы
Показатели ЭПК и ДГК в нейтрофилах достоверно увеличиваются в ходе употребления рыбьего жира. Употребление ЭПК в изоляции способно увеличить уровни ДГК в мембранах нейтрофилов, хотя очень высокие дозировки (1600 мг) ДГК необходимы для увеличения концентрации ЭПК89). Подавление лейкотриенов В4, отмечаемое in vitro и в ходе перорального употребления у людей90), по-видимому, связано со сниженной возможностью стимулированных нейтрофилов вырабатывать его, что было подтверждено на людях, употреблявших рыбий жир (снижение на 31% при употреблении 775 мг ЭПК). При изучении генов, подверженных воздействию рыбьего жира в нейтрофилах, снижение содержания белков PI3Kальфа и мРНК PI3Kгамма (PI3Kбета и PI3Kомега не изменяются) было выявлено, а снижения воздействия за счёт Akt / NF-kB также играет определённую роль. Употребление рыбьего жира за счёт взаимодействия жирных кислот рыбьего жира и мембран нейтрофилов, по-видимому, снижает способность нейтрофилов секретировать провоспалительный лейкотриен В4. Это может быть связано с подавлением фосфоинозитидной 3-киназы (PI3K) / Akt. В отношении окислительной функции (нейтрофилы используют окисление для разрушения патогенов за счёт процесса, известного как окислительный всплеск, который опосредуется за счёт NADPH) выработка супероксида увеличивается в ходе употребления рыбьего жира в дозировке 2 г в день (300 мг ЭПК и 400 мг ДГК). Употребление 2 г рыбьего жира (300 мг ЭПК и 400 мг ДГК) в день в течение 8 недель пациентами, больными раком, обратило вспять индуцированное химиотерапией снижение числа нейтрофилов и фагоцитоз (нейтропения), приведя к его увеличению на 29% (все PMBC) и увеличению на 14% соответственно; выработка супероксида нейтрофилов увеличилась на 28%.
Моноциты и макрофаги
Секреция моноцитов ИЛ-1бета, ИЛ-6 и TNF-альфа, по-видимому, не является затронутой (активация MCP-1) в ходе употребления рыбьего жира в дозировке 1500 мг в день в течение 12 недель с или без 800 мг витамина Е. 3 недели употребления 4 г рыбьего жира не показали значительного влияния на параметры активации моноцитов или адгезии у здоровых людей или у людей с ишемической болезнью сердца91).
Естественные клетки-киллеры
Естественные клетки киллеры (ЕК) представляют собой иммунные клетки, которые направлены на индукцию гибели клеток, являются важным фактором предотвращения раковых заболеваний. Рыбий жир в доле 10% от общего рациона крыс способен предохранять уровни ЕК, близкие к предоперационным уровням по сравнению со стандартным рационом без видимого эффекта в отношении предоперационного (здорового) уровня. У пожилых людей (55 лет и старше) употребление добавок рыбьего жира (720 мг ЭПК, 280 мг ДГК) в течение 12 недель способствовало снижению на 48% активности клеток ЕК, которое не было воспроизведено за счёт употребления ДГК (720 мг) или других протестированных жирных кислот (арахидоновой кислоты, GLA, альфа-линоленовой кислоты), несмотря на то, что другие исследования отмечают тот факт, что дополнительное употребление ДГК может снижать активность клеток ЕК у молодых людей (при дозировке в 6000 мг в день); употребление ЭПК в дозировке 1350-4150 мг в день в течение 12 недель молодыми людьми не показало никакого увеличения. Активность клеток ЕК, как выяснилось, увеличивалась у относительно здоровых молодых мужчин, занимавшихся физическими нагрузками (увеличение клеток ЕК, вызванное физическими нагрузок), что, как считается, вызвано за счёт снижения концентраций PGE(2), которые естественным образом замедляют активность клеток ЕК. Отмечается также увеличение ИЛ-2, который, как известно, стимулирует активность ЕК. Существуют смешанные свидетельства относительно роли рыбьего жира в отношении активности ЕК, причём были выявлены как увеличения, так и снижения. Необходимо провести дополнительные исследования для определения причины расхождений.
В-клетки
В-клетки являются видом лимфоцитом с известными эффектами в лёгких и кишечной ткани; они служат для секреции антител и некоторых цитокинов в качестве вспомогательных клеток для защиты от патогенов. В-клетки, как было подтверждено, включают липиды рыбьего жира в свои мембраны ex vivo и в ходе перорального употребления. Считается, что механизм, с помощью которого рыбий жир действует, - это поддержка образования липидных плотов92). У мышей, употреблявших рыбий жир (в доле 12-14,5% от рациона в калорийном исчислении) отмечается увеличение экспрессии рецепторов CD69 и CD40 без воздействия на CD80, CD86 и MHCII; секреция В-клеток IFNгамма и ИЛ-6, по-видимому, увеличивается на 50% ex vivo при стимуляции с помощью LPS и была также отмечена in vivo. Реакция В-клеток на антигены, по-видимому, не подвергается сильному влияния, так как более высокие концентрации IgA были обнаружены у мышей. У людей исследования не смогли выявить изменения в сывороточных концентрациях В-клеток (отсутствие активации) с дозировками ДГК, варьирующими от 720 мг до 6000 мг. Употребление рыбьего жира, как выяснилось, изменяет концентрацию В-клеток в организме, а связывание В-клеток с антигенами, по-видимому, является неизменным. Тем не менее, В-клетки, по-видимому, являются более восприимчивыми по отношению к воспалительной стимуляции, что способствует увеличению секреции большего числа антител, что ведёт к тому, что рыбий жир может усиливать адаптивный иммунитет. Активация В-клеток может лежать в основе увеличения сывороточного интерлейкина 6 (ИЛ-6) и интерферона-гамма (IFNгамма).
Т-клетки
Т-клетки представляют собой лимфоциты, которые могут быть разделены на вспомогательные Т-клетки (зависит от того, если они выражают рецептор CD4, и в этом случае они называются CD4-положительными) и цитотоксические Т-клетки (такая же суть, но рецептор называется CD8). CD4+ и CD8+ являются аббревиатурами для вспомогательных и цитотоксических Т-клеток соответственно. Активация CD4+ Т-клеток происходит тогда, когда Т-клетки встречаются с антигеном, представляющим клетки (дендритные клетки) и опосредуется рецепторами (TCRξ/CD3) и костимуляторами (ICOS и CD28 в качестве положительных модуляторов и CTLA-4 и CD152 в качестве негативных). По-видимому, сигнальный каскад, приводящий к экспрессии рецептора Т-клеток (TCR) подавляется в тот момент, когда рыбий жир внедрён в клеточную мембрану93), и, в конечном счёте, отмечается снижение, связанное с Т-клетками и дендритными клетками, а также иммуносупрессивным эффектом, подтверждённым у мышей при использовании доли омега-3 в доле 1,5% от общего рацион или 200 мг на кг массы тела. Внедрение жирных кислот рыбьего жира в мембрану Т-клетки, по-видимому, связано с уменьшением дендритных клеток, ослабляя их активацию. Изучая употребление рыбьего жира человеком, не удалось выявить отрицательного влияния функции Т-клеток при употреблении 4050 мг ЭПК в течение 12 недель молодыми мужчинами и мужчинами среднего возраста, 6000 мг ДГК в течение 90 дней или комбинацию 720 мг ЭПК и 280 мг ДГК[431]. Тем не менее, одно исследование на здоровых пожилых взрослых людях с такой же дозировкой (720 мг ЭПК и 280 мг ДГК) показало) подавляющий эффект, связанный с ЭПК (и омега-6 жирной кислотой GLA), но не ДГК. Этот подавляющий эффект был частично обращён вспять через 4 недели после прекращения употребления. Интересно, что пищевая альфа-линоленовая кислота (родительская омега-6 жирная кислота), как сообщается, снижает уровень пролиферации лимфоцитов при дозировке в 18 г в день, и in vitro арахидоновая кислота также показала иммуносупрессивный эффект относительно пролиферации лимфоцитов. Возможно, что в целом полиненасыщенные жирные кислоты играют важную роль (было отмечено, что подавление Т-клеток отменяется не ЦОГ / LOX ингибиторами (эйкозаноидами), а липидными антиоксидантами), хотя это не объясняет отсутствие эффективности ДГК в этом же исследовании, где ЭПК был иммуносупрессивным94). Существуют смешанные свидетельства относительно того, как рыбий жир связан с иммуносупрессией у относительно здоровых людей. Вполне возможно, что взаимодействие рыбьего жира и Т-лимфоцитов связано больше с мембранными ненасыщенными жирными кислотами (PUFA), нежели с соотношением омега-3 жирных кислот к омега-6 жирным кислотам, хотя это утверждение требует дополнительных исследований.
Взаимодействия с окислением
Жировое окисление
ЭПК и ДГК рыбьего жира представляют собой ненасыщенные жирные кислоты, и каждая ненасыщенная связь (двойная связь) может потенциально быть окисленной; это преобразовывает липид сам по себе в окислитель, способный вырабатывать другие окислители; эти феномен соответствует любым ненасыщенным жирным кислотам, включая арахидоновую кислоту. Хотя для этого иногда требуется биологическая активность (первый этап выработки эйкозаноидов из ДГК требует наличие свободного радикала); желательно избегать окисления рыбьего жира ex vivo (до употребления), так как это является причиной того, почему витамин Е (липидный антиоксидант) почти всегда включён в добавки рыбьего жира (на этом фоне выявлены неясные результаты95)). Жировое окисление может быть измерено в крови или с помощью TBARS[458], малонового диальдегида (МДА), 4-гидрокси-2-ноненаля, или с помощью окислительных метаболитов эйкозаноидов (стоит отметить 8-изо-PGF2альфа); иногда сывороточный витамин Е также измеряют, и отклонение, как считается, происходит из-за предотвращения жирового окисления. На основе этих измерений, МДА и 4-гидркоси-2-ноненаль могут быть более надёжными, так как 8-изо-PGF2альфа, как отмечается, снижаются в моче в ходе употребления рыбьего жира (показатель антиоксидантнго эффекта), и жирные кислоты, например, конъюгированная линолевая кислота (КЛК), как выяснилось, взаимодействует с 8-изо-PGF2альфа независимо от окисления. Полиненасыщенные жирные кислоты могут окисляться с целью образования липидных пероксидов, которые могут вырабатывать множество промежуточных продуктов, например, 4-гидрокси-2-ноненаль или малоновый диальдегид. Эти промежуточные продукты являются проокислительными. Приём 8 г рыбьего жира (1600 мг ЭПК + ДГК), которые были уже окислены до употребления, относительно здоровыми людьми в течение 7 недель не показали свидетельств жирового окисления (замеры витамина Е, изопростана и гидрокси-ноненаля); стоит отметить другие исследования с использованием неокисленного рыбьего жира, в ходе которых не удалось выявить увеличения мочевого изопростана или сывороточных биомаркеров (МДА) в ходе употребления рыбьего жира96), что, как считается, является общепринятым утверждением[468]. При выборочном изучении этого доказательства получаются смешанные данные; некоторые исследования сообщают об увеличении 4-гидрокси-2-ноненаля в ходе употребления ДГК людьми, и комбинированное употребление рыбьего жира, и физические нагрузки (без витамина Е) могут увеличивать жировое окисление у животных за счёт TBARS. Существуют достаточно слабые доказательства увеличения липидного окисления в ходе употребления рыбьего жира (даже если он был окислён до употребления). Существует достаточно доказательств для предположения того, что такое увеличение не происходит у относительно здоровых взрослых людей. Повреждение ДНК может запросто быть индуцировано окислительным стрессом; липидные пероксиды способны повреждать ДНК, и механизм, за счёт которого происходит окисление связан с механизмом риском раковых заболевания (причём индукция повреждения ДНК является негативной)97). Исследования на примере животных по измерению повреждения ДНК отмечают снижение повреждения при употреблении рыбьего жира в сравнении с сафлоровым маслом в качестве эталона (по оценке мочевого 8-оксо-7,8-дигидрогуанина); не удалось выявить индукцию повреждения при употреблении 3305 и 3679 мг изолированного ДГК на кг массы тела относительно здоровыми крысами (самцами и самками соответственно; человеческий эквивалент 529 мг на кг массы тела и 588 мг на кг массы тела), хотя ДГК показал увеличение повреждения ДНК у старых крыс при дозировке в 300 мг на кг массы тела. Одно исследование, подтвердившее увеличение мочевого 8-оксо-7,8-дигидрогуанина при нормализации соотношения омега-3 жирных кислот к омега-6 жирным кислотам (в сравнении с высоким показателем омега-6), показало увеличение ферментов восстановления ДНК98). На примере людей предполагается (эпидемиологически), что более высокие сывороточные показатели омега-3 жирных кислот связаны с более высокими показателями повреждения ДЕК в сравнении с более высокими показателями омега-6 жирных кислот, однако вмешательства в отношении фрагментации ДНК не показали никакого воздействия во время марафона, а также во время беременности. Теоретически возможно, что высокие дозировки рыбьего жира (наименьшей является 300 мг на кг массы тела крыс или 48 мг ДГК на кг массы тела людей) у восприимчивой популяции, например, у пожилых людей, может усиливать показатели повреждения ДНК, но неизвестно, насколько это соответствует употреблению, так как усиленное восстановление ДНК также было отмечено. Базируясь на свидетельствах по людях, факт того, что употребление рыбьего может вызывать повреждение ДНК, не является проблемой.
Антиоксидантные ферменты
В отношении исследовании на людях, которые измеряют антиоксидантные ферменты (в первую очередь глутанионпероксидазу, каталазу и супероксиддисмутазу), не было выявлено значительных изменений в защитных или повреждающих механизмах99), хотя ограниченные свидетельства предполагают незначительное (не критическое) увеличение глутатиона у женщин с избыточной массой тела. Увеличение отмечается в ходе исследований на грызуна по изучению популяций, у которых происходило подавление глутатиона (увеличение считается вторичным по отношению к сохранению глутатиона), однако в ходе исследований на людях это повторить не удалось. Хотя увеличения антиоксидантных ферментов были выявлены спорадически, не было отмечено значительного эффекта употребления рыбьего жира на большинство измеряемых параметров.
Упражнения и производительность
VO2 Max и потребление кислорода
Исследования, не показавшие значительного влияния употребления рыбьего жира на VO2 max, базировались на употреблении 3000 мг рыбьего жира (1300 мг ЭПК; 300 мг ДГК) в течение 6 недель.
Подавление иммунитета, вызванное физическими нагрузками
В ответ на физические нагрузки у тренированных мужчин, употребление высоких дозировок рыбьего жира (2224 мг ЭПК и 2208 мг ДГК) в течение 6 недель способствовало снижению воспалительных цитокинов (CRP и TNF-альфа), однако не удалось изменить индуцированные физическими нагрузками изменения в иммунных параметрах. Естественные клетки-киллеры, по-видимому, усиливают цитотоксичность в течение 2 течение после тренировки (впоследствии достигаются базовые значения)100), и употребление 3000 мг рыбьего жира (1300 мг ЭПК и 300 мг ДГК) в день в течение 6 недель относительно здоровыми мужчинами может усиливать индуцированное физическими нагрузками увеличение активности клеток ЕК наряду с увеличением ИЛ-2 (без изменений в ИЛ-4, ИЛ-6, кортизоле или IFNгамма). Это несколько отличается от других противовоспалительных препаратов, например, индометацин ослабляет активность естественных киллеров от физических нагрузок, и это, как считается, связано с увеличением количества клеток ЕК, нежели с индивидуальной активностью (нет данных относительно увеличения активности в момент, когда клеточная концентрация контролировалась). Возможные объяснения этого факта могут заключаться в увеличении ИЛ-2 (было выявлено стимулирование активности клеток ЕК) и снижении концентрации PGE(2), что способствует смягчению негативного регулятора активности клеток ЕК. Предварительные данные свидетельствуют, что рыбий жир может усиливать цитотоксическую реакцию естественных клеток-киллеров (ЕК) на физические нагрузки, но это происходит за счёт вариабельности, отмечаемой к естественными клетками-киллерами в целом; неизвестно, насколько надёжным является этот эффект.
Беременность и лактация
Примечание: Любые вмешательства в виде увеличения потребления рыбьего жира во время беременности должны сопровождаться избеганием содержания в нём ртути, так как младенцы, по-видимому, подвержены высокому риску когнитивных отклонений в случае чрезмерного потребления ртути (относительно взрослых людей). Советы по тому, как избежать содержания ртути, можете найти в первом разделе.
Благотворные эффекты для матерей
Считается, что употребление рыбьего жира матерями может благотворно влиять на плод за счёт эффективности ЭПК и ДГК в отношении развития, что, как считается, лежит в основе снижения плазменных показателей ЭПК и ДГК, отмечаемых у беременных женщин. Одно исследование на беременных женщинах, которые имели выраженное депрессивное расстройство, показало, что употребление 2200 мг ЭПК и 1800 мг ДГК способствовало снижению депрессивных симптомов во время перинатального и послеродового периодов, хотя кроме этого вмешательства было проведено большое количество испытаний с использованием ЭПК и ДГК, которые показали нулевые результаты101). Вполне возможно, что рыбий жир действует так же, как у других людей с депрессией (ЭПК обладает большей эффективностью в отношении людей с выраженной депрессией), и связанная с беременностью и родами депрессией, может оставаться незатронутой. Рыбий жир, особенно эйкозапентаеновая кислота (ЭПК), как выяснилось, не обладает никакими специальными эффектами в отношении депрессии, связанной с периодами беременности и родов. ЭПК является антидепрессантом в большинстве депрессивных когортах. Это было отмечено и на примере беременных женщинах, у которых были выявлены депрессивные расстройства. Большинство исследований депрессии с меньшей магнитудой сообщают об отсутствии благотворного влияния рыбьего жира на депрессию. Гестационный диабет является переходным состоянием диабета, происходящим в ходе 3-8% беременностей; на основе смешанного обследования было проведено исследование, если рыбий жир как-либо связан с риском развития гестационного диабета. Употребление 800 мг ДГК в день беременными женщинами не показало значительного изменения риска развития гестационного диабета102). Рыбий жир, по-видимому, не снижает значительно риск гестационного диабета. Преэклампсия является осложнением беременности, связанным с сужением сосудов и повреждением эндотелия, и его патология, как выяснилось, вовлекает простагландины103). Один мета-анализ без достаточных доказательств проявил эффективность рыбьего жира (на базе недоказательных исследований); в ходе более надёжного испытания на 2399 женщинах не удалось выявить защитный эффект при употреблении 800 мг ДГК (1,5 г омега-3). Не существует достаточных доказательств того, что рыбий жир снижает риски развития преэклампсии.
Роды
Отмечается меньшее количество смертей детей грудного возраста в случае, если мать употребляла ДГК; в ходе одного исследования отмечается, что если в ходе контрольных замеров было выявлено 12 и 5 неонатальных смертей и судорог (соответственно), то при употреблении 800 мг ДГК это число снизилось до 3 и 0. Это исследование показало необходимость дальнейших исследований. Масса тела ребёнка, как отмечается, увеличивается при употреблении рыбьего жира в умеренной степени (на 47 г; 95% ДИ, равное 1-93 г); отмечается увеличение времени до рождения (на 2,55 дней; 95% ДИ, равное 1,03-4,07 дней), однако, несмотря на увеличение времени до рождения, этот анализ выявил только защитный эффект против преждевременных родов при измерении до 34 недель (никакой эффект не был выявлен на 37 неделе). Это увеличение времени до рождения привело к увеличению массы тела младенцев, что было выявлено при употреблении 2700 мг рыбьего жира104). Рыбий жир может снижать риск родовых осложнений и риски преждевременных родов (относительно тех, кто не употребляет омега-3 жирные кислоты); существуют умеренные доказательства увеличения массы тела при рождении и увеличения времени до рождения. Очень предварительные данные свидетельствуют о том, что добавки рыбьего жира могут снижать риск неонатальной смерти.
Употребление во время беременности и польза для плода
Употребление омега-3 жирных кислот (любых полиненасыщенных жирных кислот), как известно, связано с проникновением через плацентарные барьеры105) за счёт транспортеров FATP (в частности, через FATP4) для регулирования развития нервной системы. В отличие от взрослых, плод не способен по своей сути самостоятельно синтезировать омега-3 жирные кислоты, и поэтому употребление их родителем является обязательным; употребление ДГК, как было подтверждено (на примере приматов) в 8-22 раза является более эффективным в отношении увеличения нейронных запасов ДГК у плода, чем употребление родителем омега-3 жирной кислоты (АЛА). Стоит отметить, что арахидоновая кислота (аналог омега-6 в отношении ЭПК) также является очень важной для умственного развития, но, как представляется, является менее чувствительной к рациону, что предполагает более эффективное регулирование. Докозагексаеновая кислота (ДГК) играет важную роль в развитии нервной системы плода во время беременности. Плод зависит от запасов ДГК родителя либо от его употребления данной добавки. Это считается причиной, по которой употребление рыбьего жира, как считается, увеличивает когнитивное развитие у ещё не рождённых детей, однако не известно, если соотношение омега-3 жирных кислот к омега-6 жирным кислотам играет роль, так как арахидоновая кислота также играет критическую роль. Один обзор и мета-анализ (11 испытаний в обзоре на 5272 индивидах; 7 испытаний в мета-анализе), проведённых для изучения когнитивных и визуальных характеристик плодов матерей, которые употребляли омега-3 жирные кислоты во время беременности, в ходе оценок106) (два не были обнаружены в интернете) показали отсутствие значительного эффекта влияния рыбьего жира на когнитивные способности, однако было выявлено одно надёжное преимущество в отношении так называемых «развивающих стандартных оценок» (3,92; 95% ДИ, равное 0,77-7,08), однако тут был выявлен высокий риск систематической ошибки. Отмеченное смещение, выявленное в ходе обзоре, является наибольшим беспокойством, которое может вызывать повышенные показатели истирания, и не ясна также рандомизация, которая может говорить о предвзятости некоторых исследований, по которым не были опубликованы все данные (аналогичные нулевые результаты были опубликованы в некоторых исследованиях). Необходимые последующие исследования для определения эффектов употребления матерью рыбьего жира на когнитивное развитие плода. Хотя в настоящее время благотворное влияние исключено не может быть, текущие данные конкретно его не выявили.
Лактация
Пищевое употребление ДГК является критическим в течение первых трёх месяцев жизни, когда оно коррелирует с нейронными уровнями ДГК (по оценке вскрытий), и за счёт этого важность этой добавки является очень высокой в отношении детей; отмечается рекомендация к употреблению добавки недоношенными детьми. ДГК является также компонентом грудного молока (ребёнок получает вещество при употреблении грудного молока); концентрация ДГК в грудном молоке коррелирует с рационом матери107). Употребление АЛА (из льна или растительных источников омега-3) не является эффективным в отношении увеличения концентрации ДГК в грудном молоке, несмотря на увеличение концентрация АЛА в грудном молоке. Считается важным для детей употребление докозагексаеновой кислоты (ДГК) во время первых нескольких месяцев жизни в целях поддержки когнитивного развития. ДГК обнаруживается в грудном молоке, а также является обязательной добавкой в любом детском питании. Употребление матерью лосося (3,54 г рыбьего жира) в течение 20 недель беременности до родов является достаточным условием для увеличения концентраций ЭПК (на 80%) и ДГК (на 90%) в грудном молоке по сравнению с тем, когда матери, как правило, не употребляли рыбу108). Увеличение концентраций в грудном молоке отмечается при употреблении, а также во время беременности и лактации либо во время обоих состояний; отмечается некоторая дозозависимость, а наивысшие уровни достигаются на 2 неделе употребления109). Суточное потребление не требуется, так как употребление рыбьего жира (или употребление рыбы) многократным образом с последующим прекращением в течение 2-4 недель не нормализовало концентрации ЭПК и ДГК в грудном молоке, хотя отклонение от этого утверждения имеет место быть110). Одно исследование (употребление лосося дважды в неделю, которые обеспечивает 3,45 г рыбьего жира) показало снижение концентраций IgA в грудном молоке. Концентрации ДГК в грудном молоке отражают пищевую концентрацию ДГК. Употребление рыбы и употребление соответствующих пищевых добавок может увеличивать уровни ДГК в грудном молоке. Употребление добавок может не потребоваться, так как 90% увеличения было отмечено при употреблении 3,45 г рыбьего жира в неделю (за счёт употребления лосося). Ежедневное употребление рыбьего жира или рыбных продуктов не требуется.
Взаимодействия с системами органов
Глаза
 Омега-3 жирные кислоты, особенно ДГК, известны как вовлечённые участники модуляции целостности капиллярной сетчатки, неоваскуляризации и воспаления, связанного с их протектинами и резолвинами.
ДГК, как было отмечено, снижается в сетчатке диабетических грызунов (как и в плазме крови человека), пищевое употребление рыбьего жира (5% от рациона, что составляет 10,26% ДГК и 14,16% ЭПК) способно отменить увеличение ангиогенеза, ослабляя воспалительные биомаркеры у крыс с диабетом II типа (по сравнению с соевым маслом), а также I типа. Эта защита, по-видимому, распространяется за рамки диабета (отмечается на примере ретинопатии у недоношенных при употреблении в доле 2% от рациона), что, кажется, связано с увеличением эйкозаноидов (нейропротекина Д1 и резолвина Е1/Д1, которые были выявлены), а также нормализацией соотношения омега-3 жирных кислот и омега-6 жирным кислотам, так как линия Fat-1 у мышей (генетически изменяется для нормализации соотношения), по-видимому, снижает риск ангиопатии111).
Увеличение кислотного сфингомиелина (КСМ) также полностью нормализуется по сравнению с омега-6 (из сои) контрольными уровнями, который считается вовлечённым в патологию ангиогенеза сетчатки.
Нормализация показателей омега-3 жирных кислот к омега-6 жирным кислотам, по-видимому, является защитным фактором против ангиогенеза. ДГК также является важным фактором в отношении этой защиты. У грызунов эта защита является почти абсолютной в ходе разумного приёма пищевого рыбьего жира. Это означает, что люди, употребляющие рыбий жир, будут испытывать схожий эффект.
Омега-3 жирные кислоты, особенно ДГК, известны как вовлечённые участники модуляции целостности капиллярной сетчатки, неоваскуляризации и воспаления, связанного с их протектинами и резолвинами.
ДГК, как было отмечено, снижается в сетчатке диабетических грызунов (как и в плазме крови человека), пищевое употребление рыбьего жира (5% от рациона, что составляет 10,26% ДГК и 14,16% ЭПК) способно отменить увеличение ангиогенеза, ослабляя воспалительные биомаркеры у крыс с диабетом II типа (по сравнению с соевым маслом), а также I типа. Эта защита, по-видимому, распространяется за рамки диабета (отмечается на примере ретинопатии у недоношенных при употреблении в доле 2% от рациона), что, кажется, связано с увеличением эйкозаноидов (нейропротекина Д1 и резолвина Е1/Д1, которые были выявлены), а также нормализацией соотношения омега-3 жирных кислот и омега-6 жирным кислотам, так как линия Fat-1 у мышей (генетически изменяется для нормализации соотношения), по-видимому, снижает риск ангиопатии111).
Увеличение кислотного сфингомиелина (КСМ) также полностью нормализуется по сравнению с омега-6 (из сои) контрольными уровнями, который считается вовлечённым в патологию ангиогенеза сетчатки.
Нормализация показателей омега-3 жирных кислот к омега-6 жирным кислотам, по-видимому, является защитным фактором против ангиогенеза. ДГК также является важным фактором в отношении этой защиты. У грызунов эта защита является почти абсолютной в ходе разумного приёма пищевого рыбьего жира. Это означает, что люди, употребляющие рыбий жир, будут испытывать схожий эффект.
Поджелудочная железа
Эйкозаноиды, полученные из арахидоновой кислоты (АК), по-видимому, вовлечены в разрушение поджелудочных бета-клеток (инсулин вырабатывает клетки поджелудочной железы), а также их популяции112), причём выработка PGE2 из активности ферментов ЦОГ является наиболее соответствующей и связанной с ЦОГ2 в частности. ЦОГ2 сверхэкспрессируется в бета-клетках поджелудочной железы за счёт транскрипционного фактора NF-ИЛ6113), и его повышенная активность за счёт цитокина ИЛ-1бета, по-видимому, связана с общим воспалением и PGE2. Когда PGE2 увеличивается в поджелудочных клетках, секреция инсулина подавляется, также подавляется пролиферация бета-клеток. 12-HETE (катаболит арахидоновой кислоты) также обнаруживается в клетках поджелудочной железы, и, по-видимому, он также вовлечён в токсичность бета-клеток за счёт NADPH-оксидазы-1 зависимых механизмов вследствие превращения с помощью 12-LOX (также выражается в клетках поджелудочной железы), не подавляя секрецию инсулина, как это делают схожие структуры (5-HPETE, а также LTB4 и 15-HETE); хотя пищевое включение омега-3 жирных кислот может снизить метаболит арахидоновой кислоты LTB4, результаты на людях с использованием 5-HETE не предполагают подавления114). Отмечаются ограниченные данные относительно установления связи между этими механизмами и употреблением добавок рыбьего жира. Одно исследование касательно Fat-1 у мышей (с нормальным соотношением омега-3 жирных кислот к омега-6 жирным кислотам) показало более выраженное проявление защитных механизмов против воспаления, индуцированного гибелью клеток, являясь более устойчивым в отношении поджелудочного токсина стрептозотоцина. Не существует доказательств в отношении людей для предположения связи между употреблением рыбьего жира и улучшением функционирования поджелудочных клеток. Эта связь может быть правдоподобной в отношении мышей, у которых это было выявлено.
Почки
Употребление рыбьего жира оказывает благотворное влияния на функции почек у диабетиков (а также у людей с риском диабетической нефропатии) при употреблении 4 г в день, тогда как на примере животных, употреблявших высокие дозировки, было выявлено значительное защитное действие. Механизм может осуществляться через снижение провоспалительных цитокинов в почках и через выработку эйкозаноидов. На сегодняшний день нет большого объёма источников касательно этой функции, и, по крайней мере, один текущий обзор предположил, что воздействие рыбьего жира на функции почек является предварительным. Существуют корреляцию установленные между употреблением пищевого PUFA (полиненасыщенного жира) омега-3 и предотвращением заболеваний почек, что свидетельствует о профилактической роли. Употребление омега-3 жирных кислот может оказывать защитный эффект в отношении развития патологий почек, связанных с диабетом.
Взаимодействие с раковым метаболизмом
Кожа
Высокое потребление пищевых рыбных продуктов связано с пониженным риском рака кожи (в то время как повышенное употребление омега-6 жирных кислот связано с повышенным риском), что считается связанным с пониженной индуцированной солнечным светом иммуносупрессии (отмечается у крыс и людей при 4000 мг ЭПК + ДГК115)), что приводит к снижению кратности опухолей и увеличению задержки опухоли. Механизмы, как полагают, связаны с мембранным содержанием жирных кислот (и за счёт этого происходит воздействие эйкозаноидов и простагландинов), так как ЭПК, как известно, конкурирует с арахидоновой кислотой в мембране, и высокое потребление омега-6 жирных кислот у исследуемых животных увеличивалось индуцированный солнечной радиацией канцерогенез, являющийся вторичным по отношению к иммуносупрессии116). Употребление рыбьего жира и, в частности, соотношение омега-3 жирных кислот к омега-6 жирным кислотам в мембранах кожи, по-видимому, обладает защитным механизмом в отношении рака кожи. Связь между рыбьим жиром и развитием рака кожи связано с иммунитетом, а высокое потребление рыбьего жира снижает иммуносупрессию, вызванную солнечным светом.
Поджелудочная железа
В раковых клетках поджелудочной железы ЭПК и ДГК индуцируют апоптоз (не ингибируется ингибиторами ЦОГ) за счёт индукции активных форм кислорода и последующей аутофагии в концентрации 10 мм, что отменялось (in vitro) при добавлении витамина Е; когда мышам с опухолями в поджелудочной железе (MIA-PaCa-2 клеточные линии) вводили с помощью инъекций и рациона долю в 5% рыбьего жира, выяснилось, что рыбий жир связывают со снижением объёма опухоли примерно на треть в сравнении с контрольным замером.
Взаимодействия с болезненными состояниями
Красная волчанка
Красная волчанка представляет собой болезненное состояние, сопровождающееся артритом, васкулитом, сыпью и поражением центральной нервной системы, что, по-видимому, связано с пониженным содержанием омега-3 (ЭПК и АЛА) и GLA в липидных мембранах. Рыбий жир был исследован в отношении лечения волчанки в ходе первого пилотного исследования на людях; была отмечена полная ремиссия в ходе употребления ЭПК и ДГК в течение 8 месяцев или более (162 мг ЭПК и 144 мг ДГК). Другие исследования отмечают, что 3 г омега-3 жирных кислот из рыбьего жира или ЭПК в изоляции у пациентов с волчанкой (употребление до 24 недель) оказывает снижение общих симптомов по оценке рейтинговых шкал SLAM-R (снижение на 33-34%), BILAG (снижение на 51%) и может оказывать благотворное влияние на кровоток по оценке опосредованной кровотоком вазолидилатации117); были выявлены смешанные эффекты (у 55% пациентов) в отношении лечения дислипопротеинемии. У крыс прогрессирование нефрита ослабляется при употреблении добавок рыбьего жира, что способствует увеличению продолжительности жизни; этот эффект также был отмечен у людей (15 г в течение 1 года) в гораздо меньшей степени, где протенурия уменьшилась незначительно и скорость клубочковой фильтрации не изменилась. Существует несколько свидетельств, например, по крайне мере, одно исследование, отмечающее благотворное влияние, выявленное на 3 месяце, но уже не обнаруженное на 6 месяце (200 мг на кг массы тела при 18,6% ЭПК и 12,1% ДГК), и благотворное влияние также выявлено при высоких дозировках (20 г в день в течение 12 недель; исследование не коснулось 6-месячного срока). Интересно, что единственное исследование, использовавшее длительное употребление высоких дозировок (15 г в день в течение 1 года), показало тусклые результаты относительно почечных симптомов волчанки. Употребление рыбьего жира играет роль контролирования симптомов, связанных с волчанкой, однако существуют данные для того, чтобы полагать то, что долгосрочное употребление высоких дозировок рыбьего жира аннулирует благотворное влияние, и более низкие дозировки (стандартная дозировка в 180 мг ЭПК и 120 мг ДГК) могут быть более полезными. Так как гамма-линоленовая кислота (GLA) и дигомо-y-линоленовая кислота (DGLA), по всей видимости, связаны с сипмтомами волчанки, вполне вероятно, что соотношение омега-3 жирных кислот к омега-6 жирным кислотам в липидной мембране является важным, и высокие дозировки искажают соотношение серьёзным образом в сторону омега-3.
Взаимодействие с эстетическими параметрами
Кожа
Пищевое употребление ЭПК, как известно, увеличивает кожные уровни ЭПК в ходе приёма 10 г рыбьего жира (1800 мг ЭПК и 1200 мг ДГК), 4 г рыбьего жира (95% ЭПК этилового эфира) и 10 г рыбьего жира (1800 мг ЭПК и 1200 ДГК118)). Солнечное излучение, как известно, временно подавляет иммунную систему дозозависимым образом119), и у людей с контактным дерматитом (топическая аллергическая реакция) это может быть использовано в качестве научно-исследовательских моделей для оценки фотоиммуносупрессии. Используя эту модель, 5 г рыбьего жира (3500 мг ЭПК и 500 мг ДГК) продемонстрировали снижение фотоиммуносупрессии на 6,9-11%. Вызванная солнечными лучами эритема (покраснение), по-видимому, снижается в ходе употребления в течение 3 месяцев или около того; при этом, время, необходимое для индукции новой эритемы вырастает на 37-117%. Снижение чувствительности к солнечным ожогам также было выявлено. Рыбий жир, по-видимому, защищает кожу от солнечных лучшей, оказывая благотворное влияние во время индуцированной солнечными лучами иммуносупрессии, а также индуцированных солнечными лучами покраснений (эритема). Пониженный риск ожогов, как выяснилось, связан с употреблением рыбьего жира. Эти механизмы, по-видимому, являются чувствительными в отношении соотношения омега-3 жирных кислот к омега-6 жирным кислотам. Существуют смешанные свидетельства касательно того, как окисление подвергается влиянию в коже после употребления рыбьего жира; одно исследование сообщает об отсутствии изменений повреждения ДНК самого по себе, но отмечается снижение индуцированного солнечными лучами повреждения ДНК, в то время как жировое окисление (TBARS) увеличивается в тканях кожи. Вполне возможно, что употребление рыбьего жира может увеличивать жировое окисление к коже, но это, как отмечается, не связано с побочными токсикологическими эффектами, например, повреждением ДНК. Эти эффекты снижаются в ходе воздействия солнечных лучей и употребления рыбьего жира, нежели только при воздействии солнечных лучей. Рыбий жир изначально может снижать степень пролежней у тяжелобольных пациентов в исследовании, которое проводилось на базе GLA и антиоксидантов; благотворное влияние, как сообщается, происходит за счёт улучшения кровотока в ходе комбинированной терапии или изменений в иммунитете; рыбий жир в изоляции, как отмечается, может проявлять эти свойства снижения образования пролежней на 20-25%, хотя это исследование было раскритиковано за отсутствие достаточной информативной базы. Теоретически возможно, что употребление рыбьего жира может снижать интенсивность образования пролежней у тяжелобольных пациентов, но это утверждение не имеет веских доказательств и требует дальнейшего изучения.
Волосы
Существует удивительное отсутствие информационных источников о связи рыбьего жира и волос, несмотря на факт того, что простагландины вовлечены в регуляцию роста волос. Определённая связь существует, так как фосфолипаза А2 была обнаружена в волосяных фолликулах на внешнем эпителии, и рецепторы для PGE(2) (EP3 и EP4) были обнаружены на дермальных сосочках. Препараты, которые действуют, как PGE2 и PGE2альфа (випростол и латанопрост), по-видимому, индуцируют рост волос, связанный с обеспечением волосяных фолликулов фазой анагена, в то время как избыточная экспрессия ЦОГ2 индуцирует потерю волосы (восстанавливается с помощью ингибиторов ЦОГ2); как избыточная экспрессия, так и отмена активности фосфолипазы А2 снижает рост волос. Как PGE2, так PGE2альфа вырабатываются локально в клетках волос и теоретически могут индуцировать рост волос за счёт их рецепторов (EP3 и EP4), хотя все рецепторы простагландина выражаются в различных областях волосяного фолликула120). Существует, кроме того, связь между рецепторами простагландина и метаболизма андрогенов за счёт рецепторов, которые реагируют на оба класса молекул (AKR1C1 dв меньшей степени, а CBR1 и AKR1C3 выражаются в фолликулах волос); PGE(2) может не увеличивать тестостерон сам по себе, тем не менее. Кроме того, фермент, известный как простагландин Д2 синтаза (который превращает метаболит арахидоновой кислоты PGH2 в PGD2), как известно, индуцируется за счёт воздействия андрогенов, и более высокие уровни PGD2 коррелируют с этим, обладая причинной ролью в подавлении роста волос у мужчин; ЭПК, как отмечается, подавляет PGD2 в тучных клетках (иммунные клетки) за счёт конкурирования с арахидоновой кислотой на уровне ферментов ЦОГ; отмечается также подавление PGD2 в макрофагах. Выработка простагландина Е2 (PGE2) из эйкозаноидов, по-видимому, является положительным модулятором рост волос, в то время как воспаление представляет собой фактор негативного воздействия на рост волос за счёт простагландинов (и ЦОГ2). Эта связь между этой связью и употреблением рыбьего жира не известна на сегодняшний день. Употребление полиненасыщенных жиров собаками (9,3 г линолевой кислоты, или 3,3 г, или 0,42 г АЛА на 100 кКал), как отмечается, увеличивает мягкость и блеск волос, а также жирность и шероховатость, что, как считается, связано с повышенным содержанием эфиров холестерина в клетках волос. Это отмечается также и у собак121). Дополнительные исследования необходимы для определения эффектов употребления рыбьего жира относительно волос.
Взаимодействие с питательными веществами
Уридин
В клеточных мембранах виды фосфатидов связываются с жирными кислотами, уридином, холином, а также другими молекулами, например, аминокислотами для образования компонентов мембраны. Уридин является важным элементом в организме, он часто представлен в виде субстрата для образования молекулы цитидин-5’-трифосфата, способность которого проявляется в лимитирующей стадии передачи цитидина монофосфата из цитидин-5’-трисфосфата к фосфохолину, что приводит к выработке CDP-холина. Так как CDP-холин сильно взаимодействует с ДГК для образования фосфолипидов фосфотидилхолинов в мембранах122), употребление уридина (за счёт CDP-холина) считается синергическим. Положение уридина является лимитирующей стадией в организме в выработке фосфатидилхолина (за счёт CDP-холина), связанной с докозагексаеновой кислотой (ДГК). Употребление уридина ускоряет выработку. Употребление холина, уридина и ДГК (компонентов синтеза фосфатидилхолина крысами, по-видимому, ведёт к увеличению концентраций фосфатидилхолина мембраны головного мозга на 50% или более, являясь синергическим, как и любой агент в отдельности, увеличивающий фосфатидилхолина н 13-22% в ходе этого исследования, где комбинация всех агентов увеличила концентрацию фосфатидилхолина на 45%. Это положительное влияния на фосфолипиды головного мозга также относится к другим фосфатамидам, например, фосфатидилэтаноламину, фосфатидилинозитолу и фосфатидилсерина, в то время как ДГК является менее эффективным, чем комбинированная терапия, уридин в изоляции,как правило, является неактивным, что исключает аддитивные эффекты. Уридин и докозагексаеновая кислота (ДГК), по-видимому, является синергетической в отношении увеличения концентраций фосфолипидов в головном мозге на исследуемых животных (уридин увеличивает способность ДГК увеличиваться). Также может отмечаться последующий синергизм с холином. Это предполагает эффективность с жиром криля, который используется в комплексе с ДГК, фосфатидилхолином и уридином. Комбинированная терапия ДГК (300 мг на кг массы тела) и уридин в качестве 5’-монофосфатазы (0,5%), как выяснилось, увеличивает дендритную плотность позвоночника (на 36%) у взрослых людей в песчанках гиппкампа в течение 4 недель; комбинированная терапия оказалась более эффективной, чем ДГК сам по себе (18%), и уридин, будучи неактивным в изоляции, проявил синергические свойства. Отмечается отсутствие влияния на размер позвоночника, эффективность присутствует только в отношении его плотности. Уридин вовлечён в увеличение дендритной плотности позвоночника в гиппокампе, индуцированного докозагексаеновой кислотой (ДГК), которая, как считается, лежит в основе возможного синергизма касательно улучшения памяти.
Линолевая кислота (омега-6)
Линолевая кислота (ЛК) является родительской омега-6 жирной кислотой, которая биологически превращается в арахидоновую кислоту в организме, и, как правило, антагонизирует эффекты добавок рыбьего жира. Одно исследование, измерявшее эффекты снижения триглицеридов рыбьим жиром показало, что в то время как рыбий жир (3,1 г в день) снижал триглицериды на 51% в сочетании с низким пищевым употреблением ЛК, увеличения линолевой кислоты на 7,3 г в день с одновременно высоким пищевым потреблением ЛК способствовало ослаблению снижения триглицеридов до 19%. Это, возможно, распространяется на употребление пищи, так как рыба, имевшая большее соотношение омега-6 жирных кислот к омега-3 жирным кислотам оказывала меньшее благотворное влияния на артерогенез (бляшки в артериях), чем оказывала рыба с превалированием омега-3 жирных кислот над омега-6 жирными кислотами. Эффекты рыбьего жира на иммунные клетки может быть не связано с употреблением линолевой кислоты. Родительская омега-6 жирная кислота может быть антагонистом эффекта рыбьего жира по снижению триглицеридов, несмотря на то, принимается ли она в форме добавки или получается из пищи. Если рыбий жир используется для этих целей, совместное употребление не рекомендуется.
Астаксантин
Астаксантин представляет собой каротиноид, который служит в качестве липидного антиоксиданта, он частично может оказывать благотворное влияние при употреблении красной рыбы (лосося) или масла криля. Снижение пролиферативной способности лимфоцитов отмечается с рыбьим жиром (17 мг на кг массы тела) в комбинации с астаксантином (1 мг на кг массы тела), который, как полагают, является аддитивным или синергическим, поскольку никакого снижения не было выявлено при использовании каждого препарата в отдельности; отмечаются действительные сокращения при использовании астаксантина (5 мкм) и с ПНЖК в других ситуациях123), но в более высоких концентрациях / дозировках.
Куркумин
Куркумин представляет собой основной биологически активное вещество среди куркуминоидов, получаемых из некоторых видов специй (обычно куркумы, но его небольшое содержание присутствует с имбире). Комбинирование ДГК и куркумина в изолированных раковых клетках молочной железы (MDA-MB-231, MCF-7 и трёх других), по-видимому, синергически обладает антипролиферативным действием, хотя 30 мкм соединения в изолированном состоянии не показали действия комбинированного состава (18 мкм ДГК и 12 мкм куркумина) в отношении подавления пролиферации. Отмечается меньшая геномная активность при использовании комбинированного состава, но действующего под влиянием комбинации, включающей CXCR4 (подавлена), ароматазы (индуцирована), SERPINB5 (подавлена), PPARгамма и p53 фосфорилирования. Рыбий жир и куркумин, по-видимому, синергически действуют в отношении подавления пролиферации раковых клеток молочной железы, что связано с индукцией некоторых белков, не отмечаемой при использовании веществ изолированно. Отмечаются синергические противовоспалительные эффекты в макрофагах при использовании куркумина и жирных кислот рыбьего жира по оценке LPS-индуцированной выработки PGE(2), и на примере крыс с колитом (воспалительное расстройство кишечника) куркумин и рыбий жир, как отмечается, действовали с синергизмом124). Нейротрофический фактор мозга (BNDF) представляет собой белок, который положительным образом регулирует синаптический и нейронный рост, и за счёт положительного влияния с долгосрочной эффективностью и синаптического роста, он считается молекулярной мишенью когнитивного улучшения. ДГК, как известно, поддерживает нейронную текучесть мембран; также было отмечено увеличение концентраций BDNF125), и ДГК (1,25% от рациона), как отмечается, может увеличивать BDNF-индуцированное обучение, которое происходит при упражнениях у крыс. За счёт этого синергизма между ДГК, упражнениями и способностью куркумина поддерживать уровни BDNF, предполагается, что они действительно являются синергическими веществами. Теоретически, куркумин может синергически взаимодействовать с рыбьим жиром с отношении нейротрофического фактора мозга (BDNF), что способствует обучению. Этот эффект не был продемонстрирован на практике.
Фукоксантин
Каротиноиды из морских водорослей, а именно фукоксантин, как отмечается, обладает некоторым синергизмом с рыбьим жиром для в отношении ослабления наборы массы тела у мышей с избыточной массой тела и диабетических мышей. Добавление рыбьего жира в рацион в доле 6,9% (довольно высокая дозировка), как выяснилось, делает 0,1% пищевого фукоксантина более ффективным в отношении подавления набора жировой массы в двойном размере. Фукоксантин и рыбий жир могут синергически взаимодействовать в отношении их жиросжигающих эффектов. Дальнейшие исследования необходимо для подтверждения этой связи. Интересно, что фукоксантин может увеличивать печёночные уровни ДГК независимо от употребления рыбьего жира.
Пажитник
При употреблении масла пажитника (в формуле с 15% рыбьего жира по массе) диабетическими крысами в доле 5% от общего рациона, это привело к снижению на 51% уровней глюкозы в крови после еды за счёт снижения активности ферментов расщепления углеводов в поджелудочной железе (снижение на 46% в альфа-амилазе, снижение на 37% в мальтазе) и плазме крови (на 52% альфа-амилазы, на 35% мальтазы)126). 5% комбинированного состава были несколько более эффективными, чем 5% масла пажитника и намного эффективнее, чем 5% рыбьего жира. Защитный эффект в отношении бета-клеток также был выявлен при использовании этого комбинированного состава, а уменьшения триглицеридов приписываются рыбьему жиру. Эта комбинация также нормализует увеличение ACE, которое испытывают диабетические крысы.
Таурин
Таурин представляет собой серосодержащую аминокислоту, которая рассматривается ка антидиабетическая; она была изучена наряду с жирными кислотами рыбьего жира, так как они обе присутствуют в морепродуктах. Ожидаемый рост жира в организме мышей, которые употребляли таурин (4% от рациона) и рыбий жир, снизился при приёме комбинированного состава, нежели этих веществ по отдельности; уровни инсулина и глюкоза также были ниже при использовании комбинации, нежели молекул по отдельности127). Таурин потенциально обладает аддитивным благотворным влиянием при употреблении с рыбьим жиром.
Статины
Пациенты, принимающие статины, связаны с более нормализованными показателями, связанными с замедлением прогрессирования атеромы по сравнению с высоким уровнем омега-6 жирных кислот, и вмешательства по снижению соотношения с помощью доставки пищевых омега-3 жирных кислот снижает кардиометаболические факторы риска. За счёт этого благотворного влияния нормализованных показателей даже у пациентов на статинах, отмечается высокая безопасность употребления рыбьего жира в рамках статиновой терапии128), поэтому эта комбинация является вполне достойной. Некоторые исследования показали, что комбинирование статиновых препаратов (обычно симвастина) и омега-3 жирных кислот (2-4 г ЭПК + ДГК) дополняет друг друга в отношении улучшения показателей «хорошего» холестерина, в то время как может отмечаться снижение триглицеридов (неотъемлемое свойство рыбьего жира); за счёт этого обеспечивается синергическое снижение «плохого» холестерина (отмечается, что рыбий жир сам по себе может увеличивать уровень «плохого» холестерина). Потенциальный синергизм или аддитивный положительный эффект были выявлены в отношении сосудистой функции у диабетиков, и этот синергизм может также применяться к ловастатину (за счёт его нутрицевтической формы в виде красного дрожжевого риса). Синергизм между омега-3 жирными кислотами и статиновыми препаратами, по-видимому, является схожим по результату, улучшая его, или схожим по эффективности с комбинацией статинов и фибратов (розувастатина и фенофибрата). Употребление рыбьего жира, по-видимому, является синергическим со статиновыми препаратами с точки зрения кардиометаболических параметров, так как они оба снижают уровень триглицеридов и увеличивают интенсивность снижения липопротеинов низкой плотности статиновых препаратов. Не ясно на сегодняшний день, если эта синергия имеет определённую роль у людей, которые уже используют статины и фибраты.
Безопасность и токсикология
Для возможных последствий безопасности жирового окисления из ненасыщенных жирных кислот, пожалуйста, изучите пункт о жировом окислении в разделе взаимодействия с окислением.
Ртуть в рыбе и добавки на базе рыбы
Хотя существует множество токсинов, связанных с потреблением рыбы, ртуть является одной из основных причин озабоченность в виду её корреляции с употреблением омега-3 из рыбы; были выявлены её побочное действие на детские когнитивные свойства при употреблении беременными матерями, так как ртуть может проникать через плацентарный барьер, достигая ребёнка; анализ проведён по оценке воздействия пуповины. Другие токсины не имеют сильной корреляции у детей, например PCB и диоксины, и они вызывают меньше беспокойств, чем ртуть. Кроме того, ртуть имеет негативный фармакокинетический профиль. Когда рыба готовится, метилртуть связывается с белками продукта, и 95% употреблённой ртути всасывается в течение 2 дней, сохраняясь в организме в течение 70-90 дней129). В некоторых эпидемиологических исследованиях высокое употребление ртути связывают с рисками развития сердечно-сосудистых заболеваний, что, чаще всего, связывают с употребление китового мяса, но также относится и к обычному потреблению ртути. Омега-3 обеспечивает защитный эффект, и избегание использования источников с ртутью значительно снижает риск сердечно-сосудистых заболеваний130). Только наивысшие источники ртути (у акулы и кита), по-видимому, вызывают значительный эффект в ходе данного эпидемиологического исследования, хотя эффект ртути сам по себе может быть дозозависимым. На примере еде, один недавний обзоры отметил, что рыба, соответствующая понятию «Высокое содержание омега-3, низкое содержание ртути», - это лосось, форель и креветки. Они были исследованы, как и другая рыба (треска, палтус, акула, три вида тунца, макрель, морской окунь, тилапия и рыба-меч) на содержание ртути. Результаты были такими:
- Макрель, треска, форель, сом, выращенные на ферме, и консервированный лосось, кретки, тилапия показали результат ниже 0,1 мкг на г (0,044, 0,026, 0,020, 0,014-0,015, 0,027-0,076, 0,012 и 0,020 соответственно)
- Консервированный палтус и тунец превысили 0,1 мкг на г (0,069-0,160, 0,030-0,102)
- Длиннопёрый тунец, рифовый окунь, желтопёрый тунец, чилийский сибас, рыба-меч и акула превысили 0,1 мкг на г (0,148-0,259, 0,465, 0,291, 0,194, 0,293 и 0,541 соответственно).
Они также содержали среднее количество омега-3, на основании обзора из некоторых источников131), были выявлены их усреднённые значения:
- Тилапия и рифовый окунь имели меньше, чем 2 г на 90 г (0,115 и 0,170)
- Треска, тунец, зубатка и креветки показали между 0,2-0,4 г на 90 г (0,204, 0,238, 0,260, 0,301)
- Сибас и рыба-меч показали между 0,4-0,6 г на 90 г (0,417, 0,493)
- Акула, желтопёрый тунец, длиннопёрый тунец показали между 0,6-0,8 г на 90 г (0,711, 0,716, 0,732)
- Палтус и форель показали между 0,8-1 г на 90 г (0,800, 0,818)
- Лосось и макрель показали свыше, чем 1 г на 90 г (1,090-1,582, причём у выращенной на ферме рыбы показатели были выше; у консервированной макрели показатель составил 1,251).
В добавках, представленных капсулами рыбьего жира и маслом печени трески отмечается относительно низкий уровень ртути. Хотя продукты варьируют в отношении этой концентрации (зависит от использованной рыбы), одно исследование выявило диапазон в 0,013 нг на г – 2,03 нг на г ртути в самой рыбе, не выявив метилртути в капсулах; отмечается содержание в 0,233 нг на г в масле печени трески. Исследование, проведённое в США на базе трёх (неназванных) брендов, выявило значения в 9,89 нг на г, 38,8 нг на г и 123 на г в рыбьем жире из лосося. В обращении к ОРС, в котором описываются многочисленные проведённые испытания, отмечается, что многие популярные продукты рыбьего жира, продаваемые в Северной Америке, содержат около 0,1 мкг на г; это продукты, выпускаемые под брендами TwinLab, Kyolic, Nature's Way, Natrol, Health from the Sun, и Nordic. Хлорорганические соединения и PCB обнаруживаются на очень низких уровнях во многих исследованиях по их выявлению. Некоторые исследования вообще не смогли их выявить, тем не менее, как правило, их уровень является самым высоким в жире хищных рыб, например, в жире акулы (как правило, за счёт сквалена). Добавки, выработанные из трески, сардин и скумбрии (нехищные рыбы, обитающие в холодной воде) являются наиболее безопасными с точки зрения ртути. Масло криля является альтернативным вариантом, если используется невысокая дозировка. Лосось, макрель, треска, форель и креветки, выращенные на ферме, являются наилучшей рыбой для употребления, если целью является получение наибольшего количества омега-3 жирных кислот с наименьшим количеством примесей.
:Tags
Читать еще: SR9009 , Азатиоприн , Айяуаска , Аланилглютамин (Сустамин) , Гастрит ,










