Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
Псориаз
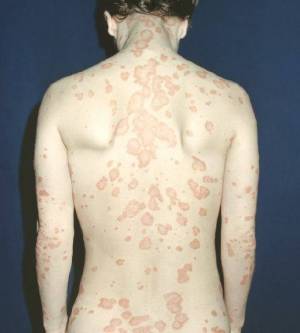 Псориаз (от греческого слова ψωρίασις, означая «состояние зуда»1); psora переводится как «зуд», а –sis означает «действие, состояние»; также упоминается как psoriasis vulgaris) представляет собой общее, хроническое, рецидивирующее / затихающее, иммуноопосредованное системное заболевание, которое характеризуется поражением кожи, включая красные, чешуйчатые пятна, папулы, бляшки, которые обычно зудят2). Поражения кожи при псориазе могут быть разными по тяжести, начиная от незначительных локализованных пятен и закачивая охватом всего тела.
Существует пять основных типов псориаза: бляшковидный псориаз, каплевидный псориаз, обратный псориаз, гнойничковый псориаз и эритродермический псориаз3). Бляшковидный псориаз, являясь наиболее распространённой формой, как правило, проявляется в виде красных и белых чешуйчатых пятен на верхнем слое кожи. Клетки кожи быстро накапливаются в местах образования бляшек, становясь серебристо-белыми на вид. Бляшки часто встречаются на коже локтей и коленей, однако они могут проявиться в любом месте, включая скальп головы, ладони рук, подошву ног и половые органы. В отличие от экземы, псориаз, скорее всего, можно обнаружить на внешней стороне суставов. Ногти часто также поражаются (псориатическая дистрофия ногтей), и это может рассматриваться в качестве изолированного проявления. Воспаление суставов, известное как псориатический артрит, затрагивает до 30% людей с псориазом4).
Причины псориаза полностью не изучены. Это не просто заболевание кожи, оно может оказывать негативное влияние на многие системы органов. Псориаз связывают с повышенным риском некоторых видов рака, сердечно-сосудистых заболеваний и других иммуноопосредованных заболеваний, включая болезнь Крона и язвенный колит. Обычно считается генетическим заболеванием, хотя также может быть вызван под влиянием факторов окружающей среды. Псориаз развивается тогда, когда иммунная система по ошибке вырабатывает вместо нормальных клеток кожи патогенные, отправляя неисправные сигналы, которые вызывают перепроизводство новых клеток кожи. Болезнь не заразна. Окислительный стресс, а также стресс и отмена системных кортикостероидов, как считается, являются триггерами псориаза. Травмы кожи могут вызвать местные псориатические изменения кожи, известные как явление Кебнера5).
Не существует никакого лечения псориаза, однако различные процедуры могут помочь контролировать симптомы6). Эффективность и безопасность целевой иммунной терапии изучается, и некоторые её виды были одобрены (или отклонены по соображениям безопасности) регулирующими органами. Болезнь поражает 2-4% от общей численности населения7).
Псориаз (от греческого слова ψωρίασις, означая «состояние зуда»1); psora переводится как «зуд», а –sis означает «действие, состояние»; также упоминается как psoriasis vulgaris) представляет собой общее, хроническое, рецидивирующее / затихающее, иммуноопосредованное системное заболевание, которое характеризуется поражением кожи, включая красные, чешуйчатые пятна, папулы, бляшки, которые обычно зудят2). Поражения кожи при псориазе могут быть разными по тяжести, начиная от незначительных локализованных пятен и закачивая охватом всего тела.
Существует пять основных типов псориаза: бляшковидный псориаз, каплевидный псориаз, обратный псориаз, гнойничковый псориаз и эритродермический псориаз3). Бляшковидный псориаз, являясь наиболее распространённой формой, как правило, проявляется в виде красных и белых чешуйчатых пятен на верхнем слое кожи. Клетки кожи быстро накапливаются в местах образования бляшек, становясь серебристо-белыми на вид. Бляшки часто встречаются на коже локтей и коленей, однако они могут проявиться в любом месте, включая скальп головы, ладони рук, подошву ног и половые органы. В отличие от экземы, псориаз, скорее всего, можно обнаружить на внешней стороне суставов. Ногти часто также поражаются (псориатическая дистрофия ногтей), и это может рассматриваться в качестве изолированного проявления. Воспаление суставов, известное как псориатический артрит, затрагивает до 30% людей с псориазом4).
Причины псориаза полностью не изучены. Это не просто заболевание кожи, оно может оказывать негативное влияние на многие системы органов. Псориаз связывают с повышенным риском некоторых видов рака, сердечно-сосудистых заболеваний и других иммуноопосредованных заболеваний, включая болезнь Крона и язвенный колит. Обычно считается генетическим заболеванием, хотя также может быть вызван под влиянием факторов окружающей среды. Псориаз развивается тогда, когда иммунная система по ошибке вырабатывает вместо нормальных клеток кожи патогенные, отправляя неисправные сигналы, которые вызывают перепроизводство новых клеток кожи. Болезнь не заразна. Окислительный стресс, а также стресс и отмена системных кортикостероидов, как считается, являются триггерами псориаза. Травмы кожи могут вызвать местные псориатические изменения кожи, известные как явление Кебнера5).
Не существует никакого лечения псориаза, однако различные процедуры могут помочь контролировать симптомы6). Эффективность и безопасность целевой иммунной терапии изучается, и некоторые её виды были одобрены (или отклонены по соображениям безопасности) регулирующими органами. Болезнь поражает 2-4% от общей численности населения7).
Признаки и симптомы
Псориаз обыкновенный (также известный как хронический стационарный псориаз или бляшковидный псориаз) представляет собой наиболее распространённую форму, поражая 85-90% людей с псориазом. Бляшковидный псориаз, как правило, проявляется в виде набухших областей воспалённой кожи, покрытых серебристо-белой чешуйчатой кожей. Эти области называют бляшками, и они наиболее часто встречаются на локтях, коленях, волосистой части головы и на спине8). Псориатическая эритродермия включает в себя широкое воспаление и шелушение кожи на большей части поверхности тела. Она может сопровождаться сильным зудом, отёками и болью. Она часто является результатом обострения нестабильной формы бляшковидного псориаза, особенно после резкой отмены системных глюкокортикоидов. Эта форма псориаза может быть смертельной за счёт крайне выраженного воспаления и шелушения, которые нарушают способность организма регулировать температуру и проявлять барьерные функции9).
Гнойничковый (пустулёзный) псориаз
Гнойничковый псориаз проявляется в виде набухших шишек, наполненных неинфекционным гноем (пустулы). Кожа под и вокруг пустул нежная и красного цвета10). Гнойничковый псориаз обычно может быть локализован, обычно на руках и ногах (ладонно-подошвенный псориаз), либо может быть обобщённым, то есть распространённым случайным образом по различным частям тела. Стойкий акродерматит представляет собой форму локализованного псориаза, ограниченного пальцами рук и ног, который может распространиться на остальные части рук и ног. Ладонно-подошвенный пустулёз представляет собой другую форму локализованного гнойничкового псориаза, схожую со стойким акродерматитом, где нежные пустулы красного цвета и чешуйчатая кожа могут быть обнаружены на ладонях и подошвах ног. Обобщённый гнойничковый псориаз (гнойничковый псориаз фон Zumbusch), также известный как герпетиформное импетиго во время беременности, представляет собой редкую и тяжёлую форму псориаза, в ходе которой может понадобиться госпитализация. Прогрессирование обобщённого гнойничкового псориаза часто вызвано инфекцией, резкой отменой лечения кортикостероидами, беременностью, гипокальциемией, лекарственными препаратами или после раздражающего местного лечения псориаза. Эта форма псориаза характеризуется острым началом в виде многочисленных пустул, окружённых нежной кожей красного цвета. Эта кожная сыпь часто сопровождается лихорадкой, болями в мышцах, тошнотой и повышением количества белых кровяных клеток крови. Кольцевой гнойничковый псориаз (APP), редкая форма обобщённого гнойничкового псориаза, является наиболее распространённым типом, проявляемым в детстве. APP, как правило, развивается чаще у женщин, чем у мужчин, и обычно протекает менее тяжело, чем другие формы обобщённого гнойничкового псориаза, например, герпетиформное импетиго. Эта форма псориаза характеризуется кольцеобразными бляшками с пустулами и жёлтыми корочками. APP чаще всего поражает торс, шею, руки и ноги.
Другие поражения кожи
Дополнительные виды псориаза, поражающие кожу, включают обратный псориаз, каплевидный псориаз, оральный псориаз и себорейный псориаз11). Обратный псориаз (также известный как флексуральный псориаз) можно узнать по гладким, но воспалённым участкам кожи. Пятна часто поражают складки кожи, особенно вокруг половых органов (между бёдрами и пахом), подмышки, а также в складках кожи в местах, где отмечается избыточный вес живота (слой жира), между ягодицами в ягодичной щели и под грудью в инфрамаммарной складке. Тепло, травмы и инфекция, как считается, играют роль в развитии атипичной формы псориаза. Пелёночный псориаз представляет собой подтип псориаза, встречаемого у младенцев, он характеризуется красными папулами с серебряными точками, размещаясь в области подгузника, который может достигать области торса или конечностей. Пелёночный псориаз часто неправильно диагностируется в качестве пелёночного дерматита12). Каплевидный псориаз характеризуется многочисленными мелкими, чешуйчатыми, красными или розовыми каплевидными поражениями (папулами). Эти многочисленные пятна псориаза появляются на больших участках тела, в первую очередь, на туловище, а также на конечностях и волосистой части головы. Каплевидный псориаз часто вызывается стрептококковой инфекцией, как правило, при стрептококковом фарингите13). Обратный процесс не существует. Оральный псориаз встречается очень редко, в отличие от красного плоского лишая, другого распространённого папулосквамозного расстройства, которое поражает обычно кожу и рот. Когда псориаз затрагивает слизистую оболочку полости рта, заболевание может протекать бессимптомно, но могут проявляться белые или жёлто-серые бляшки14). Складчатый язык является наиболее частым проявлением орального псориаза, и как сообщается, обнаруживается у 6,5-20% людей с псориазом, который поражает кожу. Микроскопическое представление слизистой оболочки полости рта, пострадавшей от географического языка (миграционный стоматит) очень схоже с представлением псориаза. Тем не менее, современные исследования не показали никакой связи между двумя условиями15). Себорейный псориаз является распространённой формой псориаза с клиническими аспектами псориаза и себорейного дерматита, и может быть трудно отличимым от последнего. Эта форма псориаза обычно проявляется в виде красных бляшек с жирными выделениями в областях повышенной выработки кожного сала, например, в волосистой части головы, на лбу, на складках кожи рядом с носом, на коже вокруг рта, на коже на грудине выше молочной железы и в складках кожи.
Псориатический артрит
Псориатический артрит представляет собой форму хронического воспалительного артрита, который имеет очень переменчивую клиническую картину, часто встречаясь вместе с кожным и ногтевым псориазом16). Он, как правило, включает в себя болезненное воспаление суставов и окружающей соединительной ткани; может выявляться в любом суставе, но чаще всего поражает суставы пальцев рук и ног. Это может привести к отёку пальцев рук и ног в форме колбасы, которое называется дактилитом. Псориатический артрит также может поражать бёдра, колени, позвоночник (спондилит) и крестцово-подвздошные сочленения (санкроилеит)17). У примерно 30% людей с псориазом будет выявлен псориатический артрит. Кожные проявления при псориазе, как правило, происходят до артритных проявлений в 75% случаев.
Изменения ногтей
Псориаз может поражать ногти и оказывать различные изменения в облике пальцев рук и ног. Псориаз ногтей происходит у 40-45% людей с псориазом, поражающим кожи, проявляется в течение всей жизни у 80-90% людей, страдающих от псориатического артрита18). Эти изменения включают рубцевание ногтей (поражения размером с головку булавки отмечаются у 70% страдающих ногтевым псориазом), эффект отбеленных ногтей, небольшие участки кровотечения из капилляров под ногтями, жёлто-рыжеватое обесцвечивание ногтей, известное как появление пятна под ногтем за счёт утолщения кожи (подногтевой гиперкератоз), что ослабляет разделение ногтя (онихолизис), а также разрушение ногтей.
Медицинские признаки
В дополнение к появлению и распространению сыпи, конкретные медицинские признаки могут использоваться врачами для оказания помощи при диагностике. Они включают признак Ауспица (кровотечение при удалении шкалы), явление Кебнера (псориатические поражения кожи, вызванные травмой кожи), а также зуд и боль, локализованные в папулах и бляшках.
Причины
Причины псориаза полностью вы изучены, однако существует несколько теорий на этот счёт.
Генетические
Около одной трети людей с псориазом сообщают о наличии семейной истории болезни, и исследователи определили генетические локусы, связанные с этим заболеванием. Исследования на идентичных близнецах показывают наличие вероятности, равной 70%, того, что если у одного близнеца развился псориаз, то и у другого он тоже должен проявиться. Риск составляет около 20% для неидентичных близнецов. Эти данные позволяют предположить как генетическую предрасположенность, так и реакцию на факторы окружающей среды в отношении развития псориаза19). Псориаз обладает сильным наследственным компонентом, и многие гены связаны с ним, однако неясно, как эти гены друг с другом взаимодействуют. Большинство идентифицированных генов связано с иммунной системой, в частности, с главным комплексом гистосовместимости (MHC) и Т-клетками. Генетические исследования ценны за счёт их способности определить молекулярные механизмы и пути дальнейших исследований и потенциальных лекарственных препаратов. Классический геном-анализ сцепления определил девять локусов на разных хромосомах, которые связаны с псориазом. Они называются генами предрасположенности к псориазу от 1 до 9 (от PSORS1 до PSORS9). В рамках этих локусов на путях могут происходить воспаления. Некоторые вариации (мутации) этих генов обычно встречаются при псориазе. Полногеномный поиск ассоциаций определил другие гены, которые изменяются в характерные варианты при псориазе. Некоторые из эти генов экспрессируют воспалительные сигналы белков, которые поражают клетки иммунной системы, которая также вовлечена в протекание псориаза. Некоторые из этих генов также вовлечены в другие аутоиммунные заболевания20). Основным определяющим фактором является PSORS1, который, вероятно, составляет 35-50% наследуемого псориаза. Он контролирует гены, которые поражают иммунную систему или кодирует белки кожи, которые становятся избыточными при псориазе. PSORS1 расположен на хромосоме 6 в главном комплексе гистосовместимости (MHC), который контролирует важные иммунные функции. Три гена в локусе PSORS1 обладают выраженной связью с псориазом обыкновенным: вариант HLA-C HLA-Cw6, который кодирует класс I белка MHC; CCHR1, вариант WWC, который кодирует спиралевидный белок, который гиперэкспрессируется в псориатическом эпидермисе; вариант CDSN аллели 5, который кодирует корнео-десмосому, белок, который экспрессируется в гранулированных и ороговевших слоях эпидермиса, активируясь при псориазе. Два основных гена иммунной системы, которые изучаются на данный момент, включают бета субъединицу интерлейкина-12 (ИЛ12В) в хромосоме 5q, которая экспрессирует интерлейкин-12В, и ИЛ23R в хромосоме 1р, которая экспрессирует рецептор интерлейкина-23, будучи вовлечённой в дифференцировку Т-клеток. Рецептор интерлейкин-23 и ИЛ12В оба выраженным образом связаны с псориазом. Т-клетки вовлечены в воспалительные процессы, которые способствуют псориазу. Эти гены находятся на пути, который регулирует альфа-фактор некроза опухоли и ядерный фактор kB, два гена, вовлечённые в воспаление. Недавно, первый ген, напрямую связанный с псориазом, был установлен. Редкая мутация в гене, кодирующем белок CARD14, а также триггер фактора окружающей среды, были достаточными условиями для того, чтобы проявился бляшковидный псориаз (наиболее распространённая форма псориаза)21).
Образ жизни
Условия, которые, как сообщаются, способствуют обострению заболевания, включают хронические инфекции, стресс, изменения времени года и климата. Другие условия включают в себя горячую воду, расчёсывание пораженных псориазом участков кожи до царапин, сухость кожи, чрезмерное потребление алкоголя, курение и ожирение22).
ВИЧ
Люди с ВИЧ / СПИДом часто страдают от псориаза23). Распространённость псориаза у ВИЧ-инфицированных сравнима с распространённостью у ВИЧ-отрицательных людей, тем не менее, псориаз имеет свойство быть более тяжёлым у лиц с ВИЧ. Отмечается гораздо более высокая распространённость псориатического артрита у ВИЧ-инфицированных, нежели у тех, кто не является инфицированным. Иммунная реакция у ВИЧ-инфицированных обычно характеризуется клеточными сигналами из подмножества Th2 CD4+ Т-хелперов, тогда как иммунная реакция в ответ на обыкновенный псориаз характеризуется клеточными сигналами подмножества Th1 CD4+ Т-хелперов и Th17 Т-хелперов24). Предполагается, что уменьшение присутствия CD4+ Т-клеток вызвано сверхактивацией CD8+ Т-клеток, который ответственны за обострение псориаза в ВИЧ-положительных людей. Псориаз у пациентов с ВИЧ / СПИДом часто протекает тяжело и может не подвергаться лечению при использовании традиционной терапии.
Лекарственные препараты
Вызванный лекарственными препаратами псориаз может происходить при употреблении бета-блокаторов, лития, антималярийных препаратов, нестероидных противовоспалительных препаратов, тербинафина, блокаторов кальциевых каналов, каптоприла, глибурида, гланулоцитарного колониестимулирующего фактора, интерлейкинов, интерферонов, гиполипидемических препаратов, и, как бы это странно не звучало, ингибиторов ФНО, включая инфликсимаб или адалимумаб25). Отмена приёма кортикостероидов (местные стероидные крема) может усугубить псориаз.
Механизм
Псориаз характеризуется аномально избыточным и быстрым ростом эпидермального слоя кожи26). Аномальная выработка клеток кожи (особенно во время заживления раны) и переизбыток клеток кожи вызваны последовательностью патологический событий при псориазе. Клетки кожи при псориазе заменяются каждые 3-5 дней, а не 28-30 дней, как должно быть. Эти изменения, как полагают, происходят из-за преждевременного созревания кератиноцитов, вызванного воспалительным каскадов в дерме с участием дендритных клеток, макрофагов и Т-клеток (три подтипа белых кровяных клеток)27). Эти иммунные клетки перемещаются из дермы в эпидермис, секретируя воспалительные химические сигналы (цитокины), например, альфа-фактор некроза опухоли, интерлейкин-1бета, интерлейкин-6 и интерлейкин-22. Эти секретируемые воспалительные сигналы, как считается, стимулируют пролиферацию кератиноцитов. Одно из предположений базируется на том, что псориаз включает в себя дефект Т-регуляторных клеток и Т-регуляторного цитокина интерлейкина-10. Генные мутации белков, вовлечённые в барьерные свойства кожи, были выявлены в качестве маркеров предрасположенности к развитию псориаза. ДНК, высвобождаемая из погибающих клеток, действует в качестве воспалительного стимула при псориазе28), стимулируя рецепторы в определённых дендритных клетках, которые, в свою очередь, вырабатывают цитокин интерферон-альфа. В ответ на эти химические реакции в дендритных клетках и Т-клетках, кератиноциты также секретируют цитокины, например, интерлейкин-1 и интерлейкин-6, а также альфа-фактор некроза опухоли, которые подают обратный сигнал воспалительным клеткам для обеспечения и стимулирования дополнительного воспаления. Дендритные клетки преодолевают врождённую иммунную систему и адаптивную иммунную систему. Они увеличиваются при псориатических поражениях, индуцируя пролиферацию Т-клеток и тип 1 Т-хелперов (Th1). Целевая иммунотерапия, а также псорален и ультрафиолет А (PUVA) могут помочь снизить количество дендритных клеток, способствуя при этом секреции цитокиновых клеток Th2 через цитокиновый профиль клеток Th1 / Th1729). Псориатические Т-клетки переходят от дермы в эпидермис, секретируя интерферон-гамма и интерлейин-17. Интерлейкин-23, как известно, индуцирует выработку интерлейкина-17 и интерлейкина-22. Интерлейкин-22 работает в комбинации с интерлейкином-17, индуцируя кератиноциты к секреции привлекающих нейтрофилы цитокинов.
Диагностика
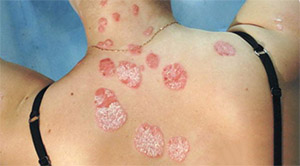 Диагностика псориаза обычно базируется на внешнем виде кожи. Кожные характеристики, типичные для псориаза: чешуйчатость, эритематозные бляшки, папулы, пятна на коже, которые могут быть болезненными и зудеть. Никаких специальных анализов крови или диагностических процедур не требуется для постановки диагноза.
Дифференциальная диагностика псориаза включает дерматологические условия, схожие по внешнему виду с дискоидной экземой, себорейной экземой, розовым лишаем (может быть спутан с каплевидным псориазом), грибком ногтей (может быть спутан с псориазом ногтей) или кожной лимфомой Т-клеток (у 50% с раком изначально по ошибке диагностируется псориаз). Дерматологические проявления системных заболеваний, таких как сыпь вторичного сифилиса, могут также быть спутаны с псориазом.
Если клинический диагноз является неопределённым, проводится биопсия или выскабливание кожи для того, чтобы исключить одни расстройства, подтвердив при этом диагноз. Кожа, взятая при биопсии, при изучении под микроскопом покажет булавовидные проекции эпидермиса, переплетающиеся с дермой. Утолщение эпидермиса является ещё одним характерной гистологическим открытием в отношении поражений псориазом30). Зернистый слой эпидермиса часто отсутствует или значительно уменьшен в псориатических поражениях; клетки кожи самого поверхностного слоя кожи также являются аномальными, так как они не созревают до конца. Несмотря на наличие зрелых клеток, эти поверхностные клетки всё равно сохраняют своё ядро. Воспалительные инфильтраты, как правило, могут быть визуализированы на микроскопии при исследовании ткани кожи или суставной ткани, поражённой псориазом. Эпидермальная ткань кожи, поражённая псориатическим воспалением, часто обладает множеством CD8+ Т-клеток, в то время как преобладание CD4+ Т-клеток отмечается в воспалительных инфильтратах дермального слоя кожи и суставов.
Диагностика псориаза обычно базируется на внешнем виде кожи. Кожные характеристики, типичные для псориаза: чешуйчатость, эритематозные бляшки, папулы, пятна на коже, которые могут быть болезненными и зудеть. Никаких специальных анализов крови или диагностических процедур не требуется для постановки диагноза.
Дифференциальная диагностика псориаза включает дерматологические условия, схожие по внешнему виду с дискоидной экземой, себорейной экземой, розовым лишаем (может быть спутан с каплевидным псориазом), грибком ногтей (может быть спутан с псориазом ногтей) или кожной лимфомой Т-клеток (у 50% с раком изначально по ошибке диагностируется псориаз). Дерматологические проявления системных заболеваний, таких как сыпь вторичного сифилиса, могут также быть спутаны с псориазом.
Если клинический диагноз является неопределённым, проводится биопсия или выскабливание кожи для того, чтобы исключить одни расстройства, подтвердив при этом диагноз. Кожа, взятая при биопсии, при изучении под микроскопом покажет булавовидные проекции эпидермиса, переплетающиеся с дермой. Утолщение эпидермиса является ещё одним характерной гистологическим открытием в отношении поражений псориазом30). Зернистый слой эпидермиса часто отсутствует или значительно уменьшен в псориатических поражениях; клетки кожи самого поверхностного слоя кожи также являются аномальными, так как они не созревают до конца. Несмотря на наличие зрелых клеток, эти поверхностные клетки всё равно сохраняют своё ядро. Воспалительные инфильтраты, как правило, могут быть визуализированы на микроскопии при исследовании ткани кожи или суставной ткани, поражённой псориазом. Эпидермальная ткань кожи, поражённая псориатическим воспалением, часто обладает множеством CD8+ Т-клеток, в то время как преобладание CD4+ Т-клеток отмечается в воспалительных инфильтратах дермального слоя кожи и суставов.
Классификация
Морфологическая
Псориаз классифицируется как папулосквамозное расстройство, он чаще всего подразделяется на различные категории в зависимости от гистологических характеристик. Варианты включают бляшковидный псориаз, гнойничковый псориаз, каплевидный псориаз и флексуральный псориаз. Каждая форма имеет код МКБ-10. Псориаз также может классифицироваться на негнойчниковые и гнойничковые типы31).
Патогенетическая
Другая схема классификации базируется на генетических и демографических факторах. Тип 1 имеет положительную семейную историю, начинаясь в возрасте до 40 лет и связан с человеческим лейкоцитарным антигеном HLA-Cw6. Тип 2 не имеет никакой семейной истории, проявляется в возрасте до 40 лет и не связан с HLA-Cw6. Тип 1 встречается у 75% людей с псориазом32). Классификация псориаза в качестве аутоиммунного заболевания вызвала значительные споры. Исследователи предложили различные описания псориаза и псориатического артрита; некоторые авторы классифицировали их в качестве аутоиммунных заболеваний33), в то время как другие классифицировали их не как аутоиммунные заболевания, а в качестве иммуноопосредованных воспалительных заболеваний34).
Тяжесть заболевания
Нет общего мнения по поводу того, как классифицировать тяжесть псориаза. Лёгкая форма псориаза определяется в процентах площади поверхности тела (BSA) < 10, индексом охвата и тяжести псориаза (PASI) ≤ и дерматологическим индексом качества жизни (DLQI) ≤ 1035). Умеренная и тяжёлая степень псориаза определяется теми же показателями, а именно, BSA > 10, PASI > 10 и DLQI > 10. DLQI является показателем для изменения влияния различных дерматологических заболеваний на повседневную деятельность. Оценка DLQI варьируется от 0 (минимальное нарушение) до 30 (максимальное нарушение) и подсчитывается таким образом, что каждый ответ оценивается в 0-3 пункта, где наивысшее значение обозначает большее социальное или профессиональное нарушение. Индекс охвата и тяжести псориаза (PASI) - наиболее широко используемый инструмент измерения тяжести псориаза. PASI оценивает тяжесть поражений и площадь поражений, сочетая эти два фактора в один со значениями от 0 (отсутствует болезнь) до 72 (наиболее тяжёлая форма заболевания)36). Тем не менее, индекс PASI является слишком громоздким, поэтому были проведены попытки упростить индекс для клинического использования.
Управление
В то время как не существует возможности полного излечения псориаза выработано множество вариантов поддерживающего лечения. Вещества для местного применения обычно используются при лёгкой степени заболевания, фитотерапия применяется при умеренной тяжести, а системные средства актуальны при тяжёлой стадии заболевания37).
Вещества для местного применения
Местные кортикостероидные препараты являются наиболее эффективными веществами при непрерывном использовании в течение 8 недель; ретиноиды и каменноугольная смола, как выяснилось, обладают ограниченным благотворным влиянием, и их эффективность может не превышать плацебо. Больше преимуществ было выявлено при сравнении очень мощных кортикостероидов с мощными кортикостероидами. Аналоги витамина D, например, парикальцитол, оказались значительно более эффективными, чем плацебо. Комбинированная терапия витамином D и кортикостероидами оказалась более эффективной, чем отдельное применение каждого составляющего; витамин D, как было установлено, превосходит по эффективности каменноугольную смолу при хроническом псориазе38). Увлажняющие и смягчающие средства, включая минеральные масла, вазелин, кальципотриол и декубал, как выяснилось, увеличивают очищение псориатических бляшек. Смягчающие вещества, как было показано, являются более эффективными при очистке псориатических бляшек в сочетании с фототерапией39). Тем не менее, некоторые смягчающие вещества не оказывают никакого влияния на очищение псориатических бляшек, и они даже могут снизить уровень очищения, достигнутый с помощью фототерапии. Смягчающее вещество, а именно салициловая кислота, структурно схожа с парааминобензойной кислотой (PABA), которая обычно входит в состав солнцезащитных кремов и, как известно, мешает процессу фототерапии при псориазе. Кокосовое масло, при использовании в качестве смягчающего средства при псориазе, как выяснилось, уменьшается очищение бляшек при фототерапии. Лекарственные кремы и мази, наносимые напрямую на псориатические бляшки, могут помочь снизить воспаление, снизить их размеры, замедлить процесс обновления кожи, а также очистить поражённую кожу от бляшек. Мази и кремы, содержащие каменноугольную смолу, кортикостероиды, дитранол (дезоксиметазон), флуоцинонид, аналоги витамина D3 (например, кальципорол) и ретиноиды, обычно рекомендуются к применению. Использование инструкции полезно для того, чтобы выявить необходимую дозировку. Другой вид местной терапии для лечения псориаза является формой бальнеотерапии, который включает ежедневные ванны в Мёртвом море. Они обычно проводятся в течение четырёх недель с различным количеством солнечного воздействия. Метод является экономически эффективным, и он распространяется в качестве метода лечения псориаза без применения лекарственных препаратов40). При нё наблюдается снижение показателей PASI более, чем 75%, и ремиссия в течение нескольких месяцев. Большинство положительных эффектов и побочных эффектов терапии обеспечиваются за счёт ультрафиолетового излучения солнца. Побочные эффекты могут быть лёгкими, например, зуд, фолликулит, солнечные ожоги, пойкилодермия; также присутствует теоретический риск развития немеланомного рака кожи или проявления меланомы. Тем не менее, наиболее актуальные исследования определили, что в долгосрочной перспективе не было выявлено риска проявления меланомы. Данные являются неубедительными в отношении немеланомного рака кожи, однако подтверждается идея о том, что терапия связана с повышенным риском доброкачественных форм вызванных солнцем повреждений кожи, например, актинического этастоза или печёночных пятен. Бальнеотерапия Мёртвого моря также эффективна при псориатическом артрите41).
Фототерапия
Фототерапия в форме солнечного света давно используется при псориазе42). Длины волны в 311-313 нанометров наиболее эффективны, и с этой целью были разработаны специальные лампы. Время воздействия должно контролироваться во избежание чрезмерного воздействия и ожогов кожи. Лампы UVB должны быть оснащены таймером, чтобы лампа могла выключиться через определённый период времени. Количество используемого света определяется типом кожи человека. Повышение риска развития рака после лечения является незначительным. Фототерапия с использованием узкой полосы света UVB (NBUVB) продемонстрировала одинаковую с PUVA эффективность43). Основным механизмом NBUVB является индукция повреждения ДНК в форме димеров пиримидина. Этот тип фототерапии полезен при лечении псориаза, так как образование этих димеров мешает клеточному циклу, останавливая его. Прерывание клеточного цикла, вызванного NBUVB, противопоставляется характерному быстрому делению клеток кожи при псориазе. Активность многих типов иммунных клеток, обнаруживаемых в коже, также эффективно подавляется с помощью фототерапии NBUVB. Наиболее распространённым побочным эффектом этой формы фототерапии является покраснение кожи; менее распространёнными побочными эффектами фототерапии NBUVB являются зуд и образование волдырей, раздражение глаз в виде конъюнктивального воспаления или воспаления роговицы, герпес в связи с реактивацией вируса простого герпеса на коже и губах. Во время фототерапии должна обеспечиваться защита глаз. Псорален и фототерапия ультрафиолетом А (PUVA) сочетают в себе пероральное и местное применение псоралена с воздействием ультрафиолета А (UVA). Механизм действия PUVA не известен, но, возможно, он вовлекает активацию псоралена светом UVA, который ингибирует аномально быструю выработку клеток в псориатической коже. Существует несколько механизмов действия, связанных с PUVA, включая эффекты на иммунную систему кожи. PUVA связывают также с тошнотой, головной болью, усталостью, жжением, зудом. Долгосрочное лечение связано с плоскоклеточным раком (но не с меланомой)44). Комбинированная терапия при умеренной или тяжелой степени псориаза на базе PUVA и ацитретина показала положительные результаты, однако использование ацитретина связывают с врождёнными дефектами и повреждением печени.
Системные агенты
Устойчивый к веществам местного применения и фототерапии псориаз может лечиться с помощью системной терапии, включающей пероральные препараты или инъекционное лечение45). Пациенты, собирающиеся проходить системное лечение, должны иметь соответствующие нормативным значениям анализы крови и тестирования функции печени для проверки показателей токсичности. Беременность должна быть исключена при большинстве видов лечения. Большинство людей испытывают рецидив псориаза после прекращения системного лечения. Небиологическое системное лечение, часто используемое для лечения псориаза, включает использование таких препаратов, как метотрексат, циклоспорин, гидроксикарбамид, фумараты, такие как диметилфумарат и ретиноиды. Метотрексат и циклоспорин являются препаратами, которые подавляют иммунную систему; ретиноиды представляют собой синтетические формы витамина А. Эти агенты также рассматриваются в качестве первой линии лечения псориатической эритродермии. Биопрепараты прерывают иммунный процесс, связанный с псориазом. В отличие от обобщённой иммуносупрессивной лекарственной терапии на базе метотрексата, биопрепараты ориентируют на конкретные аспекты иммунной системы, способствующей псориазу46). Эти препараты обычно хорошо переносятся, и ограниченные данные по долгосрочному использованию показали, что биопрепараты являются безопасными для долгосрочного использования при умеренной или тяжёлой стадии бляшечковидного псориаза. Тем не менее, за счёт иммуносупрессивного действия, биопрепараты связаны с небольшим увеличением риска инфекции. Профессиональные принципы использования в отношении биопрепаратов рекомендуют их использование в качестве третьей линии лечения при псориазе при ненадлежащей реакции на местное лечение, фототерапию и применение небиологического системного лечения. Безопасность биопрепаратов во время беременности не была оценена. Европейские принципы использования рекомендуют избегать биопрепаратов, если планируется беременность; терапия анти-ФНО, например, инфликсимабом, не рекомендуется для использования хроническими носителями вируса гепатита В или ВИЧ-инфицированными лицами. Некоторые моноклональные антитела имеют в качестве мишеней цитокины, молекулы, которые клетки используют для отправки воспалительных сигналов друг другу. ФНО-альфа представляет собой один из главных исполнителей воспалительных цитокинов. Четыре моноклональных антитела (мАт) (инфликсимаб, адалимумаб, голимумаб и цертолизумаба пэгол) и один рекомбинантный рецептор-ловушка ФНО-альфа, этанерцепт, были разработаны для ингибирования воздействия ФНО-альфа. Дополнительные моноклональные антитела были разработаны против провоспалительных цитокинов интерлейкин-12, интерлейкин-23 и интерлейкин-1747) и ингибитора воспалительного пути с другой, нежели анти-ФНО-альфа антител, стороны. ИЛ-12 и ИЛ-34 имеют общий элемент, р40, который является мишенью одобренного FDA устекинумаба. Два препарата, которые нацелены на Т-клетки, включают в себя эфализумаб и алефацепт. Эфализумаб представляет собой моноклональное антитело, которые специфическим образом нацеливается на субъединицу CD11a LFA-1. Он также блокирует молекулы адгезии в эндотелиальных клетках, которые выстилают кровеносные сосуды, что привлекает Т-клетки. Эфализумаб был добровольным образом снят с европейского рынка в феврале 2009 года и с американского рынка в июне 2009 года самим производителей за счёт того, что препарат связывали со случаями прогрессивной мультифокальной лейкоэнцефалопатии. Алефацепт также блокирует молекулы, которые дендритные клетки используют для сообщения с Т-клетками, и даже вызывает процесс гибель Т-клеток со стороны естественных клеток-киллеров, что является методом контроля воспаления. У людей с псориазом могут развиться нейтрализующие антитела в отношении моноклональных антител. Нейтрализация происходит тогда, когда антитела по борьбе с препаратом предотвращают связывание моноклональных антител, например, инфликсимаба,с антигеном в лабораторных испытаниях. В частности, нейтрализация происходит, когда антитела по борьбе с препаратом связывается с антигеном инфликсимаба вместо ФНО-альфа. Когда инфликсимаб более не связывается с ФНО-альфа, он больше не снижает воспаление, и псориаз может усугубиться. Нейтрализация антитела не была выявлена в отношении этанерцепта, биопрепарата, который является слитым белком, состоящим из двух рецепторов ФНО-альфа. Отсутствие нейтрализующих антител в отношении этанерцепта, вероятно, является вторичным по отношению к врождённому присутствию рецептора ФНО-альфа, а также развитию иммунологической толерантности48).
Хирургическое вмешательство
Ограниченные данные свидетельствуют о том, что удаление миндалин может положительным образом сказаться на тех, у кого выявлен хронический бляшковидный псориаз, каплевидный псориаз и ладонно-подошвенный пустулёз49).
Альтернативная терапия
Неконтролируемые исследования показали, что люди с псориазом или псориатическим артритом может быть полезен рацион с добавлением рыбьего жира, богатого эйкозапентаеновой кислотой (ЭПК) и докозагексаеновой кислотой (ДГК). Выявлены противоречивые данные о том, что существует повышенный показатель псориаза у людей с целиакией. Тяжесть псориаза уменьшается через 3 месяца рациона без содержания глютена у пациентов с антиглиадиновыми антителами.
Прогноз
Большинство людей с псориазом испытывают не более, чем умеренные поражения кожи, которые можно эффективно лечить с помощью применения препаратов местного действия. Псориаз, как известно, оказывает негативное влияние на качество жизни как больного человека, так и членов его семьи. В зависимости от тяжести заболевания и мест поражения, люди могут испытывать значительный физический дискомфорт и некоторую нетрудоспособность. Зуд и боль могут мешать осуществлению основных функций, например, уходу за собой и сну. Участие в спортивных мероприятиях, определённые занятия и уход за членами семьи могут стать проблемой для тех, у кого бляшки расположены на руках и ногах. Бляшки на волосистой части головы могут особенно причинять дискомфорт, так как их зачастую могут принимать за перхоть50). Лица с псориазом могут чувствовать себя неловко из-за своей внешности, поэтому они обычно имеют низкую самооценку, которая вытекает из страха общественного неприятия и психосексуальных проблем. У людей с данным заболеванием часто развивается депрессия. Люди с псориазом часто чувствуют к себе предвзятое отношение, так как многие воспринимают псориаз как заразное заболевание. Психологический дистресс может привести к значительной депрессии и социальной изоляции; высокие показатели мыслей о суициде связаны с псориазом. Существует множество инструментов для оценки качества жизни пациентов с псориазом и другими дерматологическими расстройствами. Клинические исследования показали, что такие люди часто имеют пониженное качество жизни. Дети с псориазом могут столкнуться с издевательствами со стороны сверстников51). Некоторые заболевания могут быть также связаны с псориазом. Они наблюдаются чаще у пожилых людей. Около половины людей с псориазом после 65 лет имеют, по крайней мере, три сопутствующих заболевания, и у двух третей наблюдается два сопутствующих заболевания52).
Сердечно-сосудистые заболевания
Псориаз связывают с ожирением и некоторыми другими сердечно-сосудистыми и метаболическими нарушениями. Заболеваемость сахарным диабетом на 27% выше у людей, поражённых псориазом, чем у тех, кто им не страдает. Тяжёлые случаи псориаза могут быть ещё сильнее связаны с развитием диабета, нежели лёгкая степени псориаза. Молодые люди с псориазом также подвержены высокому риску развития диабета53). Люди с псориазом или псориатическим артритом имеют незначительно более высокие риски сердечных заболеваний и инфарктов по сравнению с людьми в целом. Риск сердечно-сосудистых заболеваний, по-видимому, коррелирует с тяжестью псориаза и его длительностью. Не существует убедительных доказательств того, что псориаз связан с повышенным риском смерти от сердечно-сосудистых заболеваний. Метотрексат может способствовать в некоторой степени защите сердца54). Шансы наличия гипертонии в 1,58 раз выше у людей, страдающих псориазом, чем у тех, кто не страдает от него; эти шансы повышаются ещё больше при тяжёлых случаях псориаза. Подобная взаимосвязь была отмечена у людей, которые страдают от псориатического артрита – шансы наличия гипертонии, как выяснилось, в 2,07 раз выше при сравнении аналогичной вероятности у людей в целом. Связь между псориазом и гипертонией не выяснена. Предполагаемые механизмы, вовлечённые в эту связь, включают: нарушение регуляции системы ренин-ангиотензин, повышенные уровни эндотелина 1 в крови и повышенный окислительный стресс. Частота аномалий сердечного ритма фибрилляции предсердий в 1,31 раза выше у людей с умеренным псориазом и в 1,63 раза выше у людей с тяжёлым псориазом. Может отмечаться умеренный повышенный риск инсульта, связанный с псориазом, особенно при тяжёлых случаях55). Лечение высоких уровней холестерина статинами связано со снижением тяжести псориаза, согласно шкале PASI, а также с улучшениями факторов риска других сердечно-сосудистых заболеваний, например, маркеров воспаления56). Эти кардиопротективные эффекты относятся к способности статинов улучшать профиль кровяного давления и за счёт их противовоспалительных эффектов. Использование статинов людьми с псориазом и гиперлипидемией связано с пониженными уровнями высокочувствительного С-реактивного белка и ФНО-альфа, а также пониженной активностью иммунного белка LFA-1. Сравнивая с людьми без псориаза, те, у кого он был выявлен, более удовлетворяют критериям метаболического синдрома57).
Другие заболевания
Частота болезни Крона и язвенного колита увеличивается при сравнении с аналогичными показателями у обычных людей – на 3,8% и 7,5% соответственно. Несколько исследований оценили связь рассеянного склероза с псориазом, и эта связь находится под вопросом. Псориаз связан с увеличением на 16% общего относительного риска для некожного рака. Люди с псориазом имеют на 52% повышенный риск рака лёгких и бронхов, повышенный на 205% риск развития рака верхних отделов желудочно-кишечного тракта, повышенный на 31% риск развития рака мочевого канала, повышенный на 90% риск развития рака печени и повышенный на 46% риск развития рака поджелудочной железы. Риск развития немеланомного рака кожи также повышается. Псориаз увеличивает риск развития плоскоклеточного рака кожи на 431%, увеличивая при этом риск базально-клеточной карциномы на 100%. Отсутствует риск развития меланомы, связанной с псориазом.
Эпидемиология
Псориаз, по оценкам, затрагивает 2-4% населения западных стран. Частота псориаза варьируется в зависимости от возраста, пола, региона проживания и национальности; на это влияет комбинация факторов окружающей среды и генетических факторов. Он может проявляться в любом возрасте, хотя, чаще всего, его первые проявления наблюдаются между 15 и 25 годами. Примерно треть больных псориазом сообщают о первичном диагностировании до 20 лет58). Псориаз в равной степени затрагивает как мужчин, так и женщин. Люди с воспалительными заболеваниями кишечника, например, болезнью Крона и язвенным колитом, находятся в условиях повышенного риска развития псориаза. Псориаз наиболее распространён в странах, расположенных вдали от экватора. Лица европеоидной расы более предрасположены псориазу, относительно редко заболевание встречается у афроамериканцев и чрезвычайно редко – у коренных американцев.
История
 Учёные полагают, что псориаз был включён среди различных кожных заболеваний, называемых tzaraath (переводится как проказа) в еврейской Библии; это заболевание объяснялось как наказание на клевету. Пациент признавался «нечистым», находясь в поражённой фазе 59). Тем не менее, более вероятно, что эта путаница возникла после того, как греки начали использовать один термин для обоих состояний. Греки использовали термин «лепра» для состояний, проявляющихся чешуйчатой кожей. Термин «псора» они использовали для заболеваний, проявляющихся кожным зудом. Состояние стало известным как «проказа Уиллана» в конце 18 века, когда английские дерматологи Роберт Уиллан и Томас Бейтман дифференцировали его от других заболеваний кожи. Проказа, по их словам, отличается правильной, круглой формой пятен, в то время как псориаз можно выявить по пятнам неровной формы. Уиллан идентифицировал две категории: leprosa graecorum and psora leprosa.
Псориаз, как считается, изначально был описан древнеримским учёным Корнелиусом Цельсом. В 1813 году английский дерматолог Томас Бейтман описал возможную связь между симптомами псориаза и артритом60).
В истории псориаза применялись методы лечения сомнительной эффективности и высокой токсичности. В 18 и 19 веках применялся препарат Фаулера, который содержал ядовитые и канцерогенные соединения мышьяка, который использовали дерматологи для лечения псориаза. Ртуть также использовалась при лечении псориаза в этот период времени. Сера, йод, фенол также широко использовался для лечения псориаза в эти века, когда неверно считалось, что псориаз является инфекционным заболеванием. Каменноугольная смола широко использовалась вместе с ультрафиолетовым излучением света в качестве местного лечения в начале 1900-х годов61). В этот же период, псориатический артрит лечился внутривенными инъекциями препаратов золота таким же образом, как и при ревматоидном артрите. Все эти методы лечения были заменены современными местными и системными видами терапии.
Учёные полагают, что псориаз был включён среди различных кожных заболеваний, называемых tzaraath (переводится как проказа) в еврейской Библии; это заболевание объяснялось как наказание на клевету. Пациент признавался «нечистым», находясь в поражённой фазе 59). Тем не менее, более вероятно, что эта путаница возникла после того, как греки начали использовать один термин для обоих состояний. Греки использовали термин «лепра» для состояний, проявляющихся чешуйчатой кожей. Термин «псора» они использовали для заболеваний, проявляющихся кожным зудом. Состояние стало известным как «проказа Уиллана» в конце 18 века, когда английские дерматологи Роберт Уиллан и Томас Бейтман дифференцировали его от других заболеваний кожи. Проказа, по их словам, отличается правильной, круглой формой пятен, в то время как псориаз можно выявить по пятнам неровной формы. Уиллан идентифицировал две категории: leprosa graecorum and psora leprosa.
Псориаз, как считается, изначально был описан древнеримским учёным Корнелиусом Цельсом. В 1813 году английский дерматолог Томас Бейтман описал возможную связь между симптомами псориаза и артритом60).
В истории псориаза применялись методы лечения сомнительной эффективности и высокой токсичности. В 18 и 19 веках применялся препарат Фаулера, который содержал ядовитые и канцерогенные соединения мышьяка, который использовали дерматологи для лечения псориаза. Ртуть также использовалась при лечении псориаза в этот период времени. Сера, йод, фенол также широко использовался для лечения псориаза в эти века, когда неверно считалось, что псориаз является инфекционным заболеванием. Каменноугольная смола широко использовалась вместе с ультрафиолетовым излучением света в качестве местного лечения в начале 1900-х годов61). В этот же период, псориатический артрит лечился внутривенными инъекциями препаратов золота таким же образом, как и при ревматоидном артрите. Все эти методы лечения были заменены современными местными и системными видами терапии.
Общество и культура
Международная федерация ассоциаций псориаза (IFPA) является глобальной организацией, состоящей из национальных и региональных ассоциаций пациентов с псориазом, включая также ведущих экспертов по псориазу и псориатическому артриту для участия в научных конференциях, которые проходят каждые три года62). Международная сеть псориаза, программа Fondation René Touraine, включает в себя дерматологов, ревматологов и других лиц, вовлечённых в управление псориазом. Некоммерческие организации Национального фонда псориаза в Соединённых Штатах, Ассоциация псориаза в Соединённом Королевстве и Австралийская организация псориаза предлагают пропагандистские и образовательные мероприятия о псориазе в соответствующих странах.
Исследования
Роль инсулинорезистентности в патогенезе псориаза находится в стадии исследования. Предварительные исследования предположили, что антиоксиданты, такие как полифенолы, могут оказывать благотворное воздействие на воспалительные характеристики псориаза63). Многие новые препараты изучали в качестве соответствия мишени оси Th17 / ИЛ-23, особенно ингибиторы ИЛ-23р19, так как ИЛ-23р19 присутствуют в повышенной концентрации в кожных поражениях псориазом, способствуя меньшей защите против оппортунистических заболеваний. Другие цитокины, такие как ИЛ-17 и ИЛ-22, также являются мишенями ингибирования, так как они играют важные роли в патогенезе псориаза. Другим направлением исследования является использование ингибиторов фактора роста сосудистого эндотелия для лечения псориаза. Пероральные препараты были исследованы в качестве альтернатив препаратам, вводимых путём инъекций, например, ингибиторы Янус киназы, ингибиторы протеинкиназы С, ингибиторы митоген-активированных протеинкиназ и ингибиторы фосфодиэстеразы 4, все из которых проявили эффективность в фазах 2 и 3 клинических испытаний. Тем не менее, эти средства имеют потенциально серьёзные побочные эффекты за счёт свои иммуносупрессивных механизмов.
:Tags
Читать еще: Аланин , Витамин D4 (22-дигидроэргокальциферол) , Гедерагенин , Салация , Флудрокортизон ,










