Инструменты пользователя
Инструменты сайта
- Life support
- Афродизиаки
- Липолитические (жиросжигающие) средства
- Ноотропные средства
- Нейропротекторы
- Снотворные средства
- Спортивная медицина
- Гормоны и гормональные препараты
- Анаболические/андрогенные стероиды
- Пептиды
- Селективные модуляторы андрогенных рецепторов (SARM/САРМ)
- Аминокислоты
- Витамины
- Растения
- Алкалоиды
- Лечение
- Что лечим
- Анальгетические средства
- Антибиотики
- Антигистаминные препараты
- Антидепрессанты
- Антикоагулянты
- Антисептические средства
- Диуретики
- Небензодиазепины (Z-препараты)
- Нейролептики
- Препараты, применяемые при химиотерапии
- Нестероидные противовоспалительные препараты
- Противогрибковые средства
- Противокашлевые препараты
- Противоопухолевые препараты
- Противорвотные средства
- Противосудорожные средства
- Все страницы
Содержание
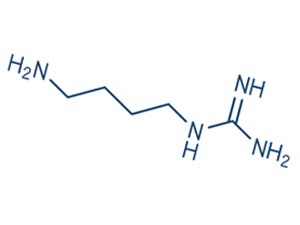
Агматин
 Агматин ((4-аминобутил) гуанидин) является продуктом декарбоксилирования аминокислоты аргинина и промежуточным продуктом биосинтеза полиаминов. Обсуждается теория о том, что агматин является нейротрансмиттером. Агматин синтезируется в мозге, хранится в синаптических везикулах, аккумулируясь при поглощении, высвобождается путем деполяризации мембраны, и инактивируется агматиназой. Агматин связывается с альфа2-адренорецепторами и участками связывания имидазолина, и блокирует рецепторы NMDA и другие катионные, управляемые лигандами, каналы. Агматин ингибирует синтазы окиси азота (NOS) и индуцирует высвобождение некоторых пептидных гормонов.
Агматин – это метаболит L-аргинина. Он является перспективным препаратом, потому как снимает невропатические боли и помогает в борьбе с наркотической зависимостью. Прием агматина снижает риск возникновения инсультов и благотворно влияет на умственную деятельность.
Основная информация
Агматин получают из L-аргинина путем декарбоксилирования (удаления всех карбоновых кислот). Он накапливается в нейронах и выводится оттуда в процессе нейронной деятельности. Считается, что агматин сочетает в себе функции нейромедиатора и нейромодулятора.
По результатам предварительных исследований, благодаря высоким потенциальным возможностям агматина, в ближайшем будущем люди смогут применять его в качестве обезболивающего, а также для снятия наркозависимости. Он также защищает наш мозг от токсинов и инсультов.
Сам по себе, агматин способен обострять восприятие боли, он эффективен лишь в комбинации с обезболивающими препаратами вроде морфина и фентанила. Синергия агматина с опиоидными анальгетиками позволяет ему снижать их активные дозы, не допуская при этом привыкания, и ослаблять боль.
Агматин имеет несколько механизмов действия. Он может блокировать рецепторы N-метил-D-аспартата (NMDA) и никотиновые ацетилхолиновые рецепторы, а также активизировать рецепторы имидазолина. Агматин также мешает ферментной активности синтазы окиси азота, регулируя, таким образом, уровень концентрации окиси азота в клетках. Агматин также обладает способностью перекрывать кальциевые каналы и блокировать определенные рецепторы серотонина. На сегодняшний день все механизмы действия агматина до конца не изучены.
По данным многочисленных опытов над животными, агматин крайне интересен с научно-исследовательской точки зрения. Его нельзя поставить в один ряд с другими пищевыми добавками, поскольку было проведено лишь несколько экспериментов с участием людей (им вводили агматин внутривенно, а не перорально) и воздействие данного препарата на человека до сих пор до конца не изучено. Ученые должны досконально изучить свойства агматина именно при пероральном приеме, что позволит говорить о более глобальных вещах и делать дальнейшие выводы.
Другие названия: вещество-заменитель клофелина, 4-(амино-бутил)гуанидин, декарбоксилированный аргинин
Не путать с: L-аргинином (исходным веществом)
Агматин ((4-аминобутил) гуанидин) является продуктом декарбоксилирования аминокислоты аргинина и промежуточным продуктом биосинтеза полиаминов. Обсуждается теория о том, что агматин является нейротрансмиттером. Агматин синтезируется в мозге, хранится в синаптических везикулах, аккумулируясь при поглощении, высвобождается путем деполяризации мембраны, и инактивируется агматиназой. Агматин связывается с альфа2-адренорецепторами и участками связывания имидазолина, и блокирует рецепторы NMDA и другие катионные, управляемые лигандами, каналы. Агматин ингибирует синтазы окиси азота (NOS) и индуцирует высвобождение некоторых пептидных гормонов.
Агматин – это метаболит L-аргинина. Он является перспективным препаратом, потому как снимает невропатические боли и помогает в борьбе с наркотической зависимостью. Прием агматина снижает риск возникновения инсультов и благотворно влияет на умственную деятельность.
Основная информация
Агматин получают из L-аргинина путем декарбоксилирования (удаления всех карбоновых кислот). Он накапливается в нейронах и выводится оттуда в процессе нейронной деятельности. Считается, что агматин сочетает в себе функции нейромедиатора и нейромодулятора.
По результатам предварительных исследований, благодаря высоким потенциальным возможностям агматина, в ближайшем будущем люди смогут применять его в качестве обезболивающего, а также для снятия наркозависимости. Он также защищает наш мозг от токсинов и инсультов.
Сам по себе, агматин способен обострять восприятие боли, он эффективен лишь в комбинации с обезболивающими препаратами вроде морфина и фентанила. Синергия агматина с опиоидными анальгетиками позволяет ему снижать их активные дозы, не допуская при этом привыкания, и ослаблять боль.
Агматин имеет несколько механизмов действия. Он может блокировать рецепторы N-метил-D-аспартата (NMDA) и никотиновые ацетилхолиновые рецепторы, а также активизировать рецепторы имидазолина. Агматин также мешает ферментной активности синтазы окиси азота, регулируя, таким образом, уровень концентрации окиси азота в клетках. Агматин также обладает способностью перекрывать кальциевые каналы и блокировать определенные рецепторы серотонина. На сегодняшний день все механизмы действия агматина до конца не изучены.
По данным многочисленных опытов над животными, агматин крайне интересен с научно-исследовательской точки зрения. Его нельзя поставить в один ряд с другими пищевыми добавками, поскольку было проведено лишь несколько экспериментов с участием людей (им вводили агматин внутривенно, а не перорально) и воздействие данного препарата на человека до сих пор до конца не изучено. Ученые должны досконально изучить свойства агматина именно при пероральном приеме, что позволит говорить о более глобальных вещах и делать дальнейшие выводы.
Другие названия: вещество-заменитель клофелина, 4-(амино-бутил)гуанидин, декарбоксилированный аргинин
Не путать с: L-аргинином (исходным веществом)
Следует отметить, что:
- Хотя, на сегодняшний день, агматин считается нетоксичным, препарат до сих пор не тестировали на предмет токсичности при приеме доз, превышающих рекомендуемые.
- При изучении действия агматина, следует отталкиваться от дозировки 2,670мг (именно такая доза препарата рассматривалась в экспериментах с участием людей).
Класс веществ:
- Аминокислота (пищевая добавка)
- Ноотропное средство
Хорошо сочетается с:
- бупропионом (лекарственным антидепрессантом; агматин усиливает действие первого)
- опиоидными анальгетиками (такими, как морфин)
- каннабиноидами (например, марихуана), поскольку агматин посылает активные сигналы на каннабиоидный рецептор (CB1)
- Выведение алкоголя из организма (ослабляет симптомы алкогольного отравления)
Применяется при:
- Невропатической боли
- Депрессиях и изменениях настроения в целом
- Снижении аппетита
- Наркозависимости
Не сочетается с:
- L-аргинином и L-цитруллином (из-за возникновения некоторых нежелательных неврологических эффектов; влияние на сердечнососудистую систему до конца не изучено)
- йохимбином и раувольсцином (агматин активизирует рецептор α2A, который эти препараты блокируют)
- D-аспартовой кислотой, ввиду уменьшения числа сигналов, поступающих на NMDA-рецепторы
- алкоголем (одновременное употребление способствует развитию язвы желудка)
История
Термин «агматин» был придуман в 1910 году Альбрехтом Косселем, немецким ученым, который первым определил, что вещество содержится в сперме сельди. Скорее всего, слово происходит от а- (амино-) + г- (гуанидин) + -ма (ptomaine, трупный яд) + ин для благозвучия.
Исследования на животных

ИЮПАК название: 1-(4-аминобутил) гуанидин
Молекулярная формула: C5H14N4
Молярная масса: 130,19 г моль-1
Плотность: 1,2 г/мл
Температура плавления: 102°С; 216°F; 375 К
Температура кипения: 281°С; 538°F; 554 К
Растворимость в воде: высокая
Температура вспышки: 95.8°C; 204,4°F; 368,9 K
Лечение с применением экзогенного агматина оказывает нейропротекторное действие при животных моделях ишемии и нейротравм.
Агматин: инструкция по применению
Стандартной дозировки агматина пока не существует, в связи с недостаточным количеством научных данных о влиянии препарата на человека. И, тем не менее, в рамках одного исследования с участием людей, испытуемым, страдающим от невропатических болей, ежедневно давали агматин в дозах 1,300-2,670мг. Для улучшения умственной функции, по подсчетам ученых, необходимо принимать 1.6-6.4мг/кг агматина перорально (то есть 217-435мг для человека весом 70 кг). При подсчете дозы, не учитывались дозировки 10-40мг/кг у крыс. Максимальной считается доза 6.4мг/кг массы тела. Все исследования основываются на ежедневном приеме агматина. Агматин плохо усваивается, если употреблять его вместе с диетическим белком, поскольку у них с аргинином одинаковые механизмы транспортировки. Для того, чтобы понять, распространяются ли полезные свойства агматина на человека, необходимо провести много новых исследований.
Источники и структура
Источники
Агматин – это молекула (а именно, биогенный амин), которая представляет собой декарбоксилированный L-аргинин и имеет молекулярное название 4-(аминобутил)гуанидин;1) до этого агматин называли не иначе как «вещество-заменитель клофелина», все благодаря его способность вытеснять и занимать место родственного ему клофелина в рецепторах. Агматин – это небольшой биогенный амин, который выполняет роль сигнальной молекулы в организме человека; он является декарбоксилированной формой аминокислоты L-аргинина. Агматин представляет собой побочный продукт жизнедеятельности бактерий (поскольку фермент, отвечающий за его выделение из аргинина, находится внутри бактерии) и встречается в следующих видах ферментированных продуктов:
- Вино – в концентрациях до 6.5мг/м3 в белом и до 22мг/м3 в красном
- Пиво - 0.5–42мг/м32)
- Сакэ – 114мг/м3
- Кофе (растворимый) - 0.4–5.3мг/м3
- Мясо, мясные продукты млекопитающих животных (3.1мг/м3 в идеале, до 27мг/м3 после приготовления и до 42мг/м3 после обработки ферментами)3)
- Рыба (разброс значений велик – от микроскопической до 401мг/м3)4)
Продукты, в которых агматин содержится в микроскопических концентрациях (практически неразличимых в крови), включают зеленые и обжаренные зерна кофе, муку, а также соевый соус и капустный сок. Агматин содержится в самых разных продуктах, наряду с другими полиаминами, но в гораздо меньших количествах, чем в пищевых добавках, и поэтому, в данном случае, не имеет биологической ценности.
Структура и свойства
Агматин представляет собой биогенный амин с одним или двумя положительными зарядами, что не дает ему пассивно проходить через мембраны (с помощью переносчиков). Молекула обычно имеет прочное основание (алкалин),5) а ее беспротоновая форма доминирует при pH 7,2 (что близко к нормальным концентрациям) и является наиболее стабильной молекулой (1325кдж/моль), в этом ей немного уступают модификация с одним протоном (1070клж/моль) и нейтральная ее форма (705кдж/моль) с pKa 8,93. Ввиду своей липофильности и бесконечных водородных связей, агматин, предположительно, усваивается с трудом.
Биосинтез
Уровень концентрации фермента аргинин декарбоксилазы (АДК) в человеческих тканях отличается от его количества в тех областях организма, где обычно накапливается агматин,6) и такой диссонанс вызван тем, что большая часть агматина в организме не имеет отношения к процессу биосинтеза под действием АДК. В целом, иРНК фермента АДК представлены в достаточно большом количестве в клетках печени и почек, скелетной мускулатуры, тонкой кишки, и мозга (больше всего его в гипоталамусе, продолговатом мозге и гипокампе; чуть меньше в стриатуме и коре больших полушарий с паравентрикулярным ядром гипоталамуса; большинство нейронов с наиболее высокой иммуно-гистологией располагаются на неокортикальных гипокамповых промежуточных нейронах); некоторые – в иммунных клетках, таких как макрофаги и лимфоциты.7) Если рассматривать запасы агматина в организме, эксперименты с крысами показывают, что больше всего его в желудке, тонкой кишке и надпочечнике , некоторое количество содержится также в клетках гладкой мускулатуры и эндотелия, чуть меньше – в сердце, селезенке, тканях аорты и головного мозга. Если рассматривать участки мозга с наивысшей концентрацией агматина, то у крыс это паравентрикулярное ядро гипоталамуса и супраотичекое ядро8), обычно в областях, где нейроны образуют деполяризирующий синапс с пирамидальными нейронами. По данным исследований, сравнительно высокие концентрации агматина были обнаружены в самом низу стволовой части головного мозга головного мозга (висцеральные релейные ядра промежуточного нерва и понтинного парабрахиального комплекса, а также перевентрикулярные области, включая латеро-дорсальное ядро, клетки голубоватого пятна в мозге и дорсальный шов), среднем отделе мозга (вентральная область покрышки и переакведуктальное серое вещество), и переднем отделе мозга (пре-оптическая зона гипоталамуса, миндалевидная железа, перегородки, опорное ядро краевой полосы, средний таламус и гипоталамус). По некоторым данным, агматин присутствует не только в нейронах, но и в астроцитах9), хромаффинных клетках надпочечника. Существует еще четыре источника агматина, включая микрофлору кишечника и диетический белок. Печеночно-кишечная рециркуляция также способствует накоплению агматина в организме.
Метаболизм
Хотя L-аргинин в ходе метаболизма трансформируется в окись азота (сначала превращаясь в L-цитруллин, выделяя, под действием фермента синтазы окиси азота, саму окись азота в качестве побочного продукта), агматин не может стать субстратом окиси азота.10) Несмотря на то, что он влияет на ее усвоение и переваривание, это никак не связано с вышеописанной трансформацией. Агматин не является метаболическим «предком» окиси азота. Метаболический путь агматина связан с действием фермента диамин оксидазы (DAO), который также отвечает за усвоение и переваривание гистамина (поэтому его еще называют гистаминазой),11) в результате чего агматин преобразуется в 4-гуанидинобутират. Таким образом метаболизируется 50% агматина (в клетках печени крыс), а блокировка этого фермента удваивает концентрации агматина в плазме крысиной крови (с 0,7 до 1,3µM, по данным этого исследования). Диамин оксидазы в больших количествах содержится в тканях почек, ЖКТ, эпителия и гладкой мускулатуры эндотелия, отсутствуя в клетках скелетной мускулатуры, сердечной мышцы, печени, головного мозга и надпочечников. Под действием DAO (основного катаболита агматина), агматин преобразуется в 4-гуанидинобутират. Этот фермент в больших количествах содержится в мембране слизистой, почках и эндотелии. Агматин может превращаться в путресцин (полиамин), чему напрямую способствует фермент агматиназы, выделяющий, в качестве побочного продукта, амид угольной кислоты, косвенное воздействие на трансформацию агматина оказывает его изначальное преобразование в карбамил путресцин (фермент агматин деиминазы, выделяющий аммиак, в качестве побочного продукта) и последующее превращение в путресцин (побочный продукт – карбамил фосфат) под действием фермента путресцин транскарбомилазы. Независимо от метаболического пути, около 10% агматина в ходе метаболизма преобразуется в полиамиды. Агматин усиливает действие фермента, известного как антизим, который препятствует внутриклеточному накоплению полиаминов и их синтезу из орнитина (при блокировке L-орнитин декарбоксилазы); полиамины активизируют этот фермент, при этом, агматин является единственной известной науке молекулой (кроме поли-аминов), которая также «руководит» данным ферментом. Агматин является промежуточным продуктом (между аргинином и путресцином) синтеза полиаминов, и преобразование агматина в путресцин осуществляется по одному или двум метаболическим путям (побочные продукты: амид угольной кислоты или аммиак). И, тем не менее, агматин может мешать биологической деятельности полиаминов, способствуя снижению их числа в клетках. Один эксперимент с живыми организмами также показал, что около 1-3% агматина, выращенного в клетках печени крыс, преобразовалось в ГАМК (гамма-амино-масляную кислоту), что существенно меньше, чем количество преобразованных поли-аминов (10%) и гуанидинобутиральдегида (50%); 30% агматина не подверглось метаболизму. Похоже, агматин не является практичным веществом. Если агматин выбирает второй метаболический путь (когда вырабатывается карбамил фосфат), то в ходе метаболизма, под действием фермента карбамат киназы, который одновременно с этим метаболизирует АДФ в АТФ, агматин преобразуется в карбамат. Этот путь, известный как «путь деиминазы», дает возможность бактериям производить АТФ из аргинина и агматина.12) Механизм, описанный ранее, характерен и является общим для ферментов транс-карбомилазы (под действием которых производится карбамоил фосфат), поскольку как орнитин транс-карбомилаза, так и оксамат транс-карбомилаза постоянно участвуют в бактериальном синтезе АТФ (производя карбамат). Как минимум в бактериях (ученые сомневаются, является ли целесообразным относить это к человеку), агматин может использоваться для синтеза АТФ.
Соблюдение баланса
Концентрации агматина в кровяной сыворотке крыс варьируются в диапазоне от 6.8+/-0.6нг/мл и до 6.8-16.9нг/мл, у человека же они значительно выше, например, 47нг/мл, 33.8+/-16.6нг/мл, или 79.42-82.44нг/мл. Уровень содержания агматина в спинномозговой жидкости (CSF) крыс составляет 6.1-23.5нг/мл, тогда как у человека - от 24.3-54.0нг/мл. Последнее из проведенных исследований показало возможную взаимозависимость между концентрациями агматина в спинномозговой жидкости и в кровяной сыворотке.13) Уровень мозговой концентрации агматина у крыс, как отмечается, составляет 15.3+/-2.4нг/г,, тогда как в мозге жвачных животных концентрация агматина выше (1.5-3.0нмоль/г или 0.2-0.4µг/г). Уровень содержания агматина в мозге жвачных животных зависит от концентрации его в катехлоламинах, 0.2-0.4µг/г агматина в коровьем мозге составляет 0.5µг/г и совпадает с концентрациями норадреналина и допамина.14) Концентрация агматина в сыворотке стабильна и обычно не выходит за пределы 50нг/мл у крыс и, соответственно, у человека уровень содержания агматина в сыворотке выше. Подобное наблюдается у катехоламинов. Отмечается, что уровень концентрации агматина в плазме (не зависит от приема) значительно снижается, вследствие метаболического синдрома (на 3,7%) и существенно повышается при шизофрении и в периоды депрессии.15) Итак, при метаболическом синдроме, запасы агматина в организме сокращаются (незначительно), а при стрессовых состояниях, таких как депрессия и шизофрения, наоборот, увеличиваются.
Фармакология
Попадание в кровяную сыворотку
 При пероральном употреблении, агматин усваивается организмом и впоследствии начинает влиять на умственную функцию (достигая мозговых клеток).
Говоря о распределении агматина в организме, в низких дозах (9нмоль у крыс) он обладает способностью увеличивать свои концентрации во всех органах (ЖКТ, печень, селезенка, легкие, головной мозг, толстая кишка, почки, надпочечники, сердце и мышцы скелетной мускулатуры), при этом, спустя 3 часа после перорального приема агматина, его концентрация в печени составляет 64+/-7%.
Итак, при пероральном приеме, агматин сразу усваивается организмом, распределяясь по тканям; в частности, он попадает в клетки головного мозга.
Если говорить о систематической циркуляции агматина в сыворотке, то период его полувыведения из организма составляет меньше 10 минут, хотя в клетках головного мозга период полураспада превышает 12 часов.
Таким образом, циркулируя в сыворотке по различным органам, половина агматина крайне быстро выводится из организма, тогда как период полувыведения из мозговых клеток значительно более длительный.
При пероральном употреблении, агматин усваивается организмом и впоследствии начинает влиять на умственную функцию (достигая мозговых клеток).
Говоря о распределении агматина в организме, в низких дозах (9нмоль у крыс) он обладает способностью увеличивать свои концентрации во всех органах (ЖКТ, печень, селезенка, легкие, головной мозг, толстая кишка, почки, надпочечники, сердце и мышцы скелетной мускулатуры), при этом, спустя 3 часа после перорального приема агматина, его концентрация в печени составляет 64+/-7%.
Итак, при пероральном приеме, агматин сразу усваивается организмом, распределяясь по тканям; в частности, он попадает в клетки головного мозга.
Если говорить о систематической циркуляции агматина в сыворотке, то период его полувыведения из организма составляет меньше 10 минут, хотя в клетках головного мозга период полураспада превышает 12 часов.
Таким образом, циркулируя в сыворотке по различным органам, половина агматина крайне быстро выводится из организма, тогда как период полувыведения из мозговых клеток значительно более длительный.
Накопление в клетках
Агматин не может пассивно пересекать клеточные мембраны, поскольку на физиологическом pH у него есть протоны, которым необходим фермент-переносчик. Попадая в кровь крыс, агматин сразу же накапливается в клетках печени (со скоростью 0.37+/-0.04нмоль/час/мг белка). Накопление в клетках, так или иначе, перекликается с транспортировкой путресцина, поскольку в высоких концентрациях последний может препятствовать накоплению агматина16), и наоборот. Перемещение агматина в клетках требует энергозатрат. Экстра-нейронный моно-аминовый транспортер (EMT) и транспортер органических катионов-2 (OCT2) могут использоваться для переноса агматина в клетки организма, а транспортер органических катионов-1 (OCT1) в 9 раз менее активен в этом отношении, чем два первых. Эти рецепторы насыщаются 1-2мМ (Kм) при Vmax 8-16нмоль/мин/мг белка (11.5+/-1.1 для OCT2 и 15.9+/-3.5 для EMT). При помощи ферментов-переносчиков, агматин попадает в клетки и ткани организма, при этом все его переносчики взаимодействуют с транспортерами путресцина. EMT и OCT2, предположительно, являются транспортерами агматина.
Распределение в клетках мозга
Если рассматривать отдельные области головного мозга, т.н. базовый агматин (без приема) обнаружен в коре головного мозга крыс (14.9-16.6нг/г), гипоталамусе (19.5-23.9нг/г), спинном мозге (22.2-25.9нг/г), мозжечке (20.6-37.0нг/г) и гипокампе (23.6-33.1нг/г). Методы иммунной гистологии, которые используются во всем мире, предполагают, что наибольшие концентрации агматина характерны для коры больших полушарий и подушковидного мицелия (внутренней части гипокампа), но могут быть обнаружены и в других областях мозга, где задействован транспортный ингибитор осевого циллиндра (таких, как передний отдел и головного мозга и его стволовая часть); ни в мозжечке, ни в спинном мозге не обнаружено различимых концентраций нейроно-содержащего агматина. Уровень содержания агматина в головном мозге связан с количеством рецепторов имидазолина и ферментов, ответственных за синтез агматина (аргинин декарбоксилаза);17) Фермент, расщепляющий агматин (агматиназа) в больших количествах содержится в гипоталамусе и гипокампе и отсутствует в коре головного мозга. Таким образом, агматин присутствует в различных областях мозга, при этом наибольшие концентрации характерны для внутренней части гипоталамуса и коры больших полушарий. Известно, что агматин преодолевает гематоэнцефалический барьер, и при внутревенном вливании мышам 10, 50 и 300мг/кг, наивысшая доза способствует повышению концентрации неврального агматина приблизительно до 800нг/г (на 700% выше базового уровня агматина), а у обезьян инъекции 25-200мг/кг агматина способствуют увеличению уровня агматина в коре передних полушарий (11.3μM или 1,469нг/мл), что составляет примерно 16% от концентрации агматина в плазме (70.2μM или 9,126нг/мл). Агматин очень долго выводится из организма (период полного вывода составляет 24-72 часов). Как у мышей, так и у обезьян, инъекции L-аргинина не влияют на увеличение мозговых концентраций агматина. Если говорить о высоких дозах агматина, то при этом увеличиваются его мозговые концентрации, и агматин преодолевает гематоэнцефалический барьер. В плазме содержится большее количество агматина, чем в клетках мозга, при этом, прием L-аргинина на концентрации агматина не влияет.
Неврология
Агматин считается относительно новым нейромедиатором, поскольку его метаболизм (как синтез, так и выведение из организма) регулируют нейроны, в которых он накапливается (перед синапсом); после попадания в нервные терминалы,18) агматин высвобождается, вследствие деполяризации нейрона, руководящего нейромедиаторами. Агматин также может накапливаться в астроцитах. Агматин иногда называют нейромодулятором. Это, по всей видимости, связано с наблюдениями ученых, связанных со способностью агматина преобразовывать сигналы в позитивные, с помощью NMDA-рецептора (путресцина), адрено-рецепторов α2 и серотонергических рецапторов (5-HT1A/1B) в низких концентрациях, при этом агматин не может прикрепляться к полиаминам на связующем участке (чему мешает путресцин), блокируя α2-рецепторы и будучи несовместимым с сигналами 5-HT1A/1B 19) в более высоких концентрациях. Агматин является медиатором нового поколения, и поэтому активно взаимодействует с другими системами нейро-медиаторов. Его также называют нейро-модулятором, поскольку некоторые механизмы его действия, в зависимости от контекста, являются реверсивными.
Нейро-трансмиссия имидозолина
Агматин является лигандом рецепторов имидазолина, наиболее близким по структуре рецепторам группы I1 и чуть менее родственным рецепторам группы I2b. Такая идентичность позволяет агматину вытеснять из рецептора идазоксан, занимая его место, подобно тому, как он вытесняет клофелин из рецептора α2A, и ученые подсчитали оптимальную концентрацию для этого (EC50) - 0.7µM для I1 и 1µM для I2. Агматин – это вещество, обладающее сродством к рецептору имидазолина (его активатор) с довольно высокой степенью родства. Действие рецептора имидазолина связано с повышенной секрецией β-эндорфина. Рецепторы имидазолина активизируются при повышенной выработке эндорфинов (при этом уходит боль и снижается уровень глюкозы в крови)
Адренергическая нейро-трансмиссия
Известно, что агматин вступает в реакцию с адренергическим рецепторами группы Альфа-2 (α2), будучи близким по своей структуре всем четырем группам (значение переменной Ki колеблется в диапазоне от 0.8 до 164μM20) и EC50 4µM агматина, как отмечается, ниже, чем у норадреналина (0.8µM), основного лиганда адренергических рецепторов), тогда как практически не имеет родственных связей ни с рецепторами группы Альфа-1 (α1), ни с β-адренергическими рецепторами. Что касается идентичности с α2A-рецепторами, она настолько высока, что агматин способен на связующем участке вытеснять клофелин.21) Один из экспериментов показал, что агматин в концентрации 10µM сдвинул кривую «концентрация-эффект» влево (что свидетельствует об усилении интенсивности сигналов норадреналина и вещества-агониста моноксидина с IC50 7.76 и 6.86), тогда как при концентрации 100-1,000µM агматина, эффект был прямо противоположным – замедление сигналов; разработчики эксперимента заметили, что в низких дозах агматин является положительным аллостерическим модулятор сигналов α2A-2 рецептора, в то время как более высокие дозы мешали поступлению этих сигналов на рецептор. Агматин очень во многом идентичен адренергическим рецепторам группы Альфа-2, и совсем не похож на рецепторы группы Альфа-1, как и на весь класс бета-адренергических рецепторов. В низких концентрациях он является положительным аллостерическим модулятором (который усиливает сигналы других лигандов, не активизируя при этом сам рецептор), тогда как в более высоких концентрациях он выступает в роли конкурентоспособного ингибитора. Многочисленные исследования живых организмов так и не выявили, обладает ли агматин, сам по себе, сродством с этими рецепторами (и является ли аллостерическим модулятором, косвенно влияющим на образование сигналов рецепторов), тогда как опыты на моделях живых организмов позволяют ученым сделать вывод, что, под действием ингибиторов α2A-рецепторов, некоторые свойства агматина не проявляются (йохимбин и раувольсцин, в большинстве случаев). С полной уверенностью можно сказать, что агматин посылает свои сигналы при помощи α2A-рецепторов (в животных моделях), что, вероятно, связано с ранее упомянутой аллостерической модификацией. Такую картину не всегда можно наблюдать в живых организмах, возможно из-за того, что в среду не попадают другие лиганды (агматин усиливает их сигналы, что позволяет сделать вывод об их присутствии). Известно, что у жвачных животных концентрация агматина в организме взаимосвязана с уровнем катехоламинов в мозге (0.2-0.4µг/г для агматина, 0.5µг/г для допамина и норадреналина) и оказывает значительное воздействие на группу рецепторов катехоламинов (α2-адренергические рецепторы) и незначительно влияет на другие рецепторы (α1- адренергический, β-адренергический, а также на допаминовые D2- рецепторы). Считается, что агматин взаимодействует с ферментами моно-аминовой оксидазы (MAO), поскольку лиганды имидазолина обладают такой способностью, ведь MAO-ферменты похожи по своей структуре на рецепторы имидазолина.22) Учеными было обнаружено, что агматин является лигандом моно-аминовой оксидазы-А рядом с флавиновым участком (неэффективным в плане предотвращения окисления кинурамина, IC50 1,000µM[24]) и в других областях, при концентрации IC50 , равной 168µM, однако в живых организмах это свойство агматина менее выражено. Уровень концентрации агматина в организме связан с количеством катехоламинов, при этом препарат вступает в реакции (слабые) с ферментами MAO (при пероральном приеме агматина для ингибирования моно-аминовой оксидазы необходимы высокие концентрации). Агматин, в концентрации EC50 5µM, осуществляет позитивную регуляцию, которая заключается в высвобождении адреналина и норадреналина из хромафинных клеток надпочечников (эти клетки относятся к имидазолину, а не к α2A-рецепторам, поэтому они взаимодействуют с рецепторами имидазолина, отвечающими за синтез катехоламинов) и из других областей, при этом ученые отмечают усиление действия норадреналина на фоне деятельности α2A-рецепторов (в клетках эндотелия). Такое потенцирование обостряет чувствительность веществ к кокаину (кокаин ингибирует деятельность фермента-переносчика норадреналина), и, тем не менее, сам по себе, агматин не влияет на видоизменения транспортера норадреналина.23) Однако, в результате активизации α2A-рецепторов в клетках эндотелия, прекращается синтез катехоламинов, подобным действием обладают и рецепторы имидазолина. Агматин выполняет функцию регулятора катехоламинов, который может как способствовать, так и мешать их высвобождению. Значимость агматина с практической точки зрения до сих пор под вопросом.
Глютаминергическая нейро-трансмиссия
Агматин имеет сродство с NMDA-рецепторами (его концентрация полу-максимального ингибирования IC50 варьируется в диапазоне 100-300μM), поскольку гуанидиновая группа агматина вступает в реакции с канальной порой NMDA-рецептора, а также закрепляется как на связующем участкеMK-80124) , так и на связующем участке поли-аминов (Ki = 15μM), чего нельзя сказать об участках глютамата и глицина. Ввиду того, что в концентрациях ниже 100μM агматин не может активизировать рецептор, вытесняя, при этом, вещества-агонисты, такие как MK-801, он, по сути, является антагонистом /ингибитором (но не выдерживает конкуренцию, так как не ингибирует глютамат на физиологическом уровне). Еще одним доказательством функции ингибитора рецепторов является защита от нейро-токсичных источников стресса, сигналы которых проходят через NMDA-рецептор, но на вещества, сигналы которых проходят по тому же пути, но огибают сам рецептор (кальцимин и стауроспорин), агматин не влияет.25) Каинатный и AMPA-рецепторы чаще всего не подвергаются влиянию агматина, который (в концентрации 3,000μM) частично блокирует лишь 15-20% их деятельности, а четыре белка-гетеродимера (ε1ζ1 через ε4ζ1) в равной степени подвергаются ингибированию со стороны агматина. Закрепление агматина на связующем участке поли-аминов может способствовать поступлению на NMDA-рецептор сигналов других поли-аминов, таких как спермидин (конкурентное ингибирование). Это также иногда происходит с гистамином, который, как считают ученые, тоже закрепляется на связующем участке поли-аминов (по неподтвержденной информации, это единственный участок, на котором он закрепляется), и в этом ему может мешать агматин.26) Агматин закрепляется на двух участках NMDA-рецептора (ни один из которых не связывает глютамин), где выполняет роль неконкурентного ингибитора. Активизируя рецептор, агматин может эффективно ингибировать поли-амины, и, несмотря на то, что он ингибирует NMDA-рецепторы, это не относится к двум глютаминергическим рецепторам (AMPA и каинатному). Будучи ингибитором NMDA-рецептора, агматин обладает защитным действием против эксайто-токсичности глютамата (снижение на 19-51% цито-токсичности в концентрации 10-1,000µM) и эксайтотоксичности NMDA-рецептора, эффективность агматина в обоих случаях одинаковая (46% при 1,000µM). Более низкие концентрации агматина (1-10µM) также считаются биоактивными и препятствуют снижению уровня катехоламинов в организме, которое наблюдается при эксайтотоксическом действии глютамата В живых организмах, защитное действие 1,000µM агматина можно сравнить с действием дезипрамина в той же концентрации и с эффектом от 20µM MK-801. В живых организмах, после инъекций низких доз агматина в спинномозговой канал и под оболочку позвоночника, препарат ингибирует NMDA-рецептор27) Таким образом, агматин защищает наши клетки от нейронального эксайтотоксического повреждения (вызванного деятельностью глютамата и NMDA-рецептора), что, по всей видимости, связано с блокировкой NMDA-рецептора, через который проходят все вредоносные сигналы. Это характерно для живых организмов (при пероральном приеме агматина), и хотя для максимальной эффективности агматина необходимы крайне большие дозы, которые не сочетаются с пероральным приемом, вещество действует даже при физиологической концентрации в крови. Считается, что взаимодействие агматина с NMDA-рецептором посредством ингибирования второго первым играет роль при возникновении алкогольной и кокаиновой зависимостей, при этом защитное действие агматина от нейронального эксайтотоксического повреждения клеток мозга задействует NMDA-рецептор. Некоторые эффекты анти-депрессанта (в значительной степени влияющие на образование сигналов калия и кальция), возможно, тоже связаны с антагонизмом NMDA-рецептора. Открытие учеными способности агматина ингибировать NMDA-рецептор – это своеобразный прорыв, которого все так долго ждали, ведь именно благодаря этой реакции, агматин эффективен при профилактике и лечении наркозависимости и благотворно влияет на клетки организма, защищая их от нейро-токсического повреждения (возникающем обычно при злоупотреблении глютаматом и различными стимуляторами).
Нейро-трансмиссия окиси азота
Окись азота у ученых связана с самыми недрами раздела «здоровье сердечнососудистой системы», потому как оказывает влияние на кровоток и здоровье сердечной мышцы. В данной главе описана исключительно неврология. Как отмечают ученые, агматин является нейронным деактиватором синтазы окиси азота (nNOS), Ki которого, на фоне повышенной активности оксидазы восстановленного никотинамидадениндинуклеотидфосфата (NADPH), составляет 29µM. Известно, что L-аргинин мешает деятельности данного элемента и препятствует деактивации синтазы окиси азота агматином. Деактивация синтазы окиси азота напрямую (либо косвенно вследствие ингибирования NMDA-рецептора, поскольку его активация способствует повышению активности синтазы окиси азота) участвует в реакциях мгматина с опиоидами, так как ингибиторы NOS обычно понижают сопротивляемость организма действию опиоидов, в чем также участвуют ингибиторы NMDA-рецептора.28) Агматин препятствует активации нейронной изоформы фермента синтазы окиси азота, чему есть много примеров, как напрямую (через деактивацию nNOS), либо косвенно (на фоне блокировки NMDA-рецептора). Для всех неврологических явлений, возникающих на фоне деактивации синтазы окиси азота, возможным «противоядием» является L-аргинин (в виде пищевой добавки).
Холинолитическая нейро-трансмиссия
Установлено, что 1mM агматина мешает ответной реакции рецептора никотинового ацетилхолина на действия агониста диметилфенилпиперациниума (DMPP) на 67+/-11% (что характерно как для конкурентного, так и для неконкурентного ингибирования). Агматин, возможно, является антагонистом рецепторов никотинового ацетилхолина, однако имеющихся фактов недостаточно, чтобы научно обосновать данное утверждение.
Серотонергическая нейро-трансмиссия
Сам по себе, агматин довольно редко вступает в реакции с серотонином, поскольку он не оказывает влияния на высвобождение последнего из нейронов PC12 (1-100µM), и даже когда запасы серотонина истощаются (на 70%), эффект «анти-депрессанта» при приеме агматина сохраняется.29) Говорят, что это свойство агматина связано с рецепторами серотонина, поскольку при ингибировании либо 5-HT1A, 5-HT1B и 5-HT2A, либо 5-HT2C рецепторов, «эффект анти-депрессанта» у агматина пропадает. Блокировка 5-HT3-рецептора не влияет на данное свойство агматина, возможно, в связи с тем, что данный рецептор, сам по себе, является антагонистом, агматин же не является прямым лигандом 5-HT2 -рецепторов. Сигналы агматина усиливаются, проходя через серотонергический рецептор, но это не влияет на изменение концентраций синаптического (внеклеточного) серотонина и никоим образом не зависит от них. Такое усиление серотонергических сигналов агматина и лежит в основе эффекта «анти-депрессанта». Ранее описанные механизмы и синергия агматина с серотонергическими анти-депрессантами30) объясняет тот факт, что агматин усиливает сигналы серотонина. До сих пор неизвестно, связано ли это с постсинаптическими модификациями белка или с аллостерической модификацией рецептора (концентрации синоптического серотонина тут ни при чем), и не совсем ясно, что выступает в роли медиатора этих эффектов, поскольку как антагонизм NMDA-рецептора, так и ингибирование синтазы окиси азота способствуют усиление серотонергических сигналов, тогда как блокировка имидазолина и α2A-рецепторов мешает проявлению эффекта «анти-депрессанта» при приеме агматина. Непонятно, каким образом агматин усиливает серотонергические сигналы, но его собственные сигналы, проходя по одному из четырех классических (для него) путей (или часто по нескольким), впоследствии благоприятно воздействуют на сигналы серотонина, преобразовывая их.
Каннабидергическая нейро-трансмиссия
Эндоканнабиоиды - это природные лиганды каннабиоидных рецепторов (CB1 и CB2; первый больше связан с неврологией), которые получили свое название в честь первого открытого учеными лиганда, тетрагидроканнабиола марихуаны. CB1-рецепторы, как правило, представлены в среднем отделе головного мозга, что очень похоже на схему размещения рецепторов имидазолина и самого агматина, а в тканях сердечной мышцы все они оказывают друг на друга положительное воздействие. Несмотря на то, что агматин (в виде инъекций 50-100мг/кг) неэффективен в плане снижения термального болевого порога (на основании теста горячей пластинки у крыс), 50мг/кг агматина способствуют синергическому усилению обезболивающего действия каннабиноидергических наркотиков на 300-440%, воздействуя непосредственно на рецепторы имидазолина, хотя при применении CB1-рецептора, этот эффект не проявляется.31) Похоже, сигналы агматина, поступая на рецепторы имидазолина (подобную картину можно наблюдать везде, где агматин усиливает гипотермию, вызванную действием каннабиоидов), способствуют увеличению активности CB1-рецептора, при этом все-таки необходимым условием является присутствие в реакции вещества-агониста, и маловероятно, что в данном случае действуют также и другие механизмы, поскольку йохимбин не отменяет синергию (за исключением α2A-рецепторов), а антагонизм NDMA-рецептора уменьшает анальгетические свойства агматина, при прохождении его сигналов через CB1-рецептор, при этом ингибирование синтазы окиси азота не играет никакой роли. Общим для всех исследований является тот факт, что активизация рецепторов имидазолина мешает отцеплению антагониста CB1-рецептора (SR 141716A) с его связующего участка,32) что предполагает присутствие в реакции аллостерической модификации CB1-рецептора (образованной в результате деятельности имидазолина). Когда сигналы агматина поступают на рецепторы имидазолина, первый усиливает анти-термическое обезболивающее действие каннабиоидов. Между ними несомненно существует некая синергия, при этом агматин выступает в роли косвенного положительного модулятора (что, вероятно, связано с изменением им структуры рецептора для лучшего прохождения сигналов) CB1-рецепторов. Возможно, между агматином и CB1-рецептором существует синергия (не доказанная наукой) в избавлении от невропатических болей (всем известен эффект от курения марихуаны).
Опиоидергическая нейро-трансмиссия
Активизация рецепторов имидазолина (в особенности, I2-рецепторов) в надпочечниках способствует высвобождению β-эндорфина (природного опиоидергического обезболивающего), который важен как для центральной, так и для периферической областей мозга. Усиление опиоидергических анальгетических свойств и притупление болевого порога (снижение восприимчивости к боли) наблюдалось у антагонистов NMDA-рецепторов и раньше (возможно, в этом - заслуга агматина), хотя, как показало одно из исследований, снижение воспримчивости к боли связано с активизацией рецепторов имидазолина.33) Агматин обладает природной способностью высвобождать некоторые опиоиды, посредством активизации имидазолиновых рецепторов в надпочечниках. Поэтому, что касается самого принципа взаимодействия агматина с опиоидами (что также относится к β-эндорфину), в основе его лежит единоличная синергия агматина, характерная для людей со здоровыми (нормально функционирющими) надпочечниками. Выраженное анальгетическое (обезюоливающее) действие морфина усиливается, если принимать его в комбинации с агматином, при этом в роли медиатора выступают α2A-рецепторы, тот же эффект наблюдается при одновременном приеме агматина с оксикодоном и фентанилом (двумя опидоэргическими препаратами, подобными морфину). Агматин, будучи в синергии с опиоидами, усиливает их и без этого выраженное обезболивающее действие. Учеными установлено, что агматин (в виде инъекций 4нмоль, эффективность которых сохраняется в течение 48 часов после введения одной дозы) является мощным ингибитором переносимости μ-опиоидных агонистов (эндо-2 и DAMGO-AG). Подобную картину можно также наблюдать у резус-макак при пероральном приеме агматина (40-80мг/кг). Эксперементальные животные хуже переносят опиоидные препараты. Невосприимчивость организма к опиоидам (когда при продолжительном приеме снижается их эффективнность) усиливается при одновременном приеме агматина, который синергически способствует сохранению обезболивающих свойств опиоидов. Адренергические рецепторы связаны с опиоидными рецепторами, при этом в результате активизации α2A-рецептора34) и одновременном ингибировании β-адренергических рецепторов усиливается способность агматина смягчать симптомы, возникающие у людей после отмены морфина; и наоборот, йохимбин (ингибитор α2A-рецептора) негативным образом усугубляет эти симптомы. Исследование зависимости (обычно при самолечении) или симптомов, связанных с отменой опиоидергических препаратов, показало, что, при одновременном приеме агматина и фентанила, люди запросто «слезают» с последнего. Что касается предпочтительных мест введения психоактивных веществ (CPP; предпочтение одного места всем другим является био-маркером аддиктивного поведения), прием агматина при лечении морфином способствует менее выраженному аддиктивному поведению.35) Агматин вступает в синергию с опиоидными препаратами, такими как морфин или фентанил, препятствуя привыканию к ним и развитию зависимости впоследствии. Агматин довольно эффективен в данном случае.
Боль и обезболивание
Агматин является беспротоновым лигандом ASIC336), одного из шести кислотно-чувсвительных йонных каналов, которые, как правило, активизируются кислотностью (протонами); ASIC3 – это нечто уникальное, ведь, в ответ на повышенную кислотность, он не теряет своей чувсвительности37); этот канал находится внутри сенсорных нейронов, где активизируется при наличии болевых раздражителей. Агматин синтезирует свои сигналы при нейтральном pH-уровне (7.4) и считается нонпротоновым лигандом, поскольку он не привязывается к тем участкам канала, где располагаются протоны (при кислотной чувствительности).38) Данная реакция является уникальным свойством агматина (не характерным для поли-аминов и аргинина), при этом агматин также делает рецепторы кислотно-чувствительными (pH 7.0). И, тем не менее, разработчики эксперимента отмечают, что слабая выраженность сигналов при низких дозах агматина, как правило, обычное явление (при нормальных условиях), хотя у мышей воздействие агматина на боль (в ходе реакции с ASIC3) сохраняется. Боли, связанные с повышенной кислотностью (когда уровень pH в крови приблизительно равен 7.0), релевантны в следующих случаях: воспаления, инфекции, ишемия, гематомы и физические упражнения, тогда как условия, в которых определяющую роль играет агматин (при усилении боли) – это рак и различные травмы.39) Агматин обладает способностью активизировать ASIC3-рецептор, который задействуется при восприятии боли, вызванной повышенной кислотностью, и из-за этого механизма он, теоритически, может вызывать боль. Практическое значение этого пути не известно, но на сегодняшний день ученые сходятся во мнении, что агматин, как правило, не посылает болевые сигналы, однако в черезчур высоких концентрациях он способен усиливать боли, связанные с повышенной кислотностью. Медицинская проба с уксусной кислотой (в модели висцеральной боли) показала, что агматин обладает слабым обезболивающим действием. Согласно исследованиям воспалительной и невропатической боли, на анальгетические свойства агматина влияет величина дозы. Сам по себе, агматин либо совсем не обезболивает, либо оказывает кратковременное обезболивающее действие (10-30 минут, только при термальной гипералгезии) у крыс. Кратковременный эффект, возможно, связан с быстрым периодом полувыведения агматина из организма (менее 10 минут) и с выделением β-эндорфина из надпочечников. Агматин не эффективен при боли от термических повреждений и малоэффективен при висцеральной боли. Несмотря на это, агматин, в зависимости от концентрации, облегчает симптомы воспалительных и невропатических болей. Эксперимент с двойным слепым методом (его частично финансировало медицинское отделение «Тримарко», проводился обладателями патента), в ходе которого больным с дегенеративными патологиями пояснично-крестцового отдела позвоночника (вследствие радикулопатии, n=61) на протяжении 14 дней давали 2.67г сульфата агматина, в результате чего у них уменьшились болевые ощущения (по данным визуальной аналоговой шкалы – «болевой» анкеты МакГилла), но значительного улучшения не наблюдалось (по данным индекса Оствестри). Эти свойства агматина сохраняют свою статистическую значимость даже спустя 60-65 дней после отмены сульфата агматина. Изолированный агматин эффективно снижает уровень восприятия боли именно на данной стадии заболевания, и поскольку обезболивающее действие агматина в данном случае впечатляет, необходимы дальнейшие исследования.
Зависимость
α2A-рецепторы являются своего рода центрами развития зависимости, чему способствует их активация (примером тому – клофелиновая и никотиновая зависимости40)), а деактивация имеет противоположный эффект (по некоторым ограниченным данным, прием йохимбина также вызывает зависимость). Чувствительность α2A –рецепторов обостряется в ответ на действие препаратов, вызывающих зависимость, таких как никотин, который усиливает стимуляцию рецепторов (судя по локомоции у крыс) и, при дальнейшем употреблении, способствует развитию зависимости. Предотвращая активацию α2A –рецепторов, агматин, предположительно, препятствует развитию гиперлокомоции, вызванной употреблением никотина (гиперлокомоция возникает через неделю после постоянного курения. Агматин эффективно сдерживает дальнейшее развитие локомоции у хронических курильщиков, что, вероятно, связано с предотвращением активации α2A-рецепторов (что не дает никотину высвобождать новые катехоламины, при регулярном курении). Пост-симптомы отказа от алкоголя, такие как «отряхивание мокрой собаки»или попросту тремор и тревога смягчаются при приеме агматина. И хотя механизм действия агматина в данной реакции неизвестен, ученые предполагают, что он связан с антагонизмом NMDA-рецептора, поскольку полиамины активируют NDMA-рецептор нейро-токсическим образом (отказ от алкоголя) 41), при этом агматин выполняет роль ингибитора. Таким образом, агматин пригодится в пост-алкогольный период, и несмотря на то, что никотин и опиоиды так или иначе влияют на активацию α2A-рецептора, принцип реакций агматина с алкоголем совсем иной (антагонизм NMDA-рецептора). Кокаиновая зависимость, как отмечают ученые, отчасти вызвана ингибированием NMDA-рецептора в живых организмах (действие на человека не до конца изучено) и ингибированием синтазы окиси азота в планариях (животные модели, не относящиеся к классу млекопитающих, но с нейро-трансмиссией, как у млекопитающих), и эти две реакции являются связующим звеном между кокаиновой зависимостью и агматином. Одновременный прием агматина с фентанилом в дозировке, достаточной для предотвращения аддиктивного поведения, возникающего на фоне приема фентанила, никак не повлиял на кокаиновую зависимость у крыс.42) Практическая целесообразность этих данных под вопросом, поскольку ивестно, что кокаин не вызывает у крыс такой сильной зависимости, как у людей, и занимает более низкую позицию в рейтинге влияния на крыс, чем интенсивные подсластители; о влиянии на людей данные отсутствуют. На сегодняшний день, данных, подтверждающих анти-аддиктивные свойства агматина при приеме наряду с кокаином крайне мало, при этом у экспериментальных крыс зависимость и вовсе формируется не полностью, а ввиду существенных видовых различий между крысами и людьми, ученые не могут спрогнозировать, поможет ли агматин преодолеть кокаиновую зависимость.
Инсульт и ишемия
В целом, эксперименты с животными, которым предварительно (перед наступлением искусственно спровоцированного инсульта) давали агматин, доказывают эффективность инъекций 100мг/кг агматина, защищающего, таким образом, нервную систему.43) Профилактическая терапия агматином (перед наступлением намеренно спровоцированного инсульта у экспериментальных животных), в большинстве случаев, оказывает благоприятное воздействие на клетки нервной системы и считается надежной превентивной мерой. Ферменты синтазы окиси азота, ингибитором которых является агматин, преобразуют инсульты (индуцибельная синтаза окиси азота способствует повышению выработки окиси азота, тем самым нанося вред клеткам мозга, тогда как эндотелиальная синтаза окиси азота оказывает защитное действие, расширяя сосуды; нейрональная синтаза окиси азота также немного нейротоксична) и, считается, что эти ферменты – одна из целей агматина на пути профилактики инсульта, поскольку они ингибируют iNOS (220μM) в 34 раза эффективнее, чем eNOS (7500μM), и, как отмечают ученые, после инсульта содержание в крови фермента синтазы окиси азота меняется (уровень iNOS повышается, а выработка eNOS прекращается), при этом агматин оказывает профилактическое действие, снижая уровень концентрации iNOS на 13.35% (в течение 6 часов) и на 46.30% (в течение 24 часов), больные, как правило, идут на поправку втечение четырех дней после начала приема агматина.44) Вероятно, на фоне менее активного производства iNOS окиси азота (доказано), также снижается концентрация пироксинитратов. Агматин благотворно влияет на метаболизм окиси азота, при этом воспалительные процессы в iNOS затухают и eNOS тоже защищена. Это способствует снижению концентрации окиси азота и пероксинитрата в крови, что крайне важно в случае возникновения инсульта, при котором малейшее повышение уровня этих веществ в крови наносит неоценимый ущерб. Рецептор аквапорина-4 - это рецептор астроцитов, который избирательно накапливает воду, угнетение (или удаление) данного рецептора повышает выживаемость клеток при отеке мозга45), возникающем вследствие ишемического инсульта. Агматин (100мг/кг) способствует снижению концентрации аквапорина-4, которая резко подскочила в крови при экспериментальном инсульте и, на фоне отека мозга, агматин полностью нормализует концентрацию ранее упомянутого рецептора. При профилактическом приеме агматина, количество аквапорина-4 значительно уменьшается, в результате чего после экспериментального инсульта реже происходит отек мозга. Это свойство агматина можно назвать универсальным. Если взять нейроны и нейроглиальные клетки, то профилактические инъекции 100 мг/кг агматина, в живых организмах46) и в изолированных клетках, препятствуют истощению запасов астроцитов (нейроглиальных клеток). Эксперимент с живыми организмами, подтвердил тот факт, что активная транслокация ядерного фактора «каппа-би» внутрь ядра связана с более мощной активацией IκBα и IKKα/β, защищающей клетки от разрушения. И хотя до сих пор неизвестно, что выполняет роль медиатора в данной реакции, агматин активирует PI3K/Akt во всех клеточных областях, и ученые называют это путем клеточного выживания (Akt посылает свои сигналы на NF-kB).47) Агматин защищает клетки от ишемии/гипоксической смерти, которая наступает вследствие усиления действия ядерного фактора «каппа-би», который впоследствии способствует повышению концентрации в крови белка опухолей сурвивина.
Стресс и тревога
Фермент аргинин декарбоксилазы активируется при повышенной кислотности как в растениях, так и в бактериях 48), реагируя на осмотический и медно-оксидативный виды стресса. Ввиду вышесказанного и того что у млекопитающих, подверженных стрессу в результате переохлаждения, как в клетках коры головного мозга (15.3+/-2.4нг/г до 57.4+/-19.6нг/г; 275%), так и в плазме (6.8+/-0.6нг/мл до 58.1+/-12.8нг/мл; 754%) наблюдается увеличение концентраций агматина, можно сделать вывод, что фермент аргинин декарбоксилазы чувствителен к стрессам, при которых в организме начинает активно синтезироваться агматин (хотя авторы как минимум одного исследования твердят о том, что при стрессе активируются другие механизмы, поскольку скачок агматина в плазме обнаруживается спустя 4 часа после приема и поэтому слишком рано делать выводы, что все дело в этом ферменте). Фермент, синтезирующий агматин из аргинина (известный как аргинин декарбоксилаза) размножается в периоды стресса, поэтому в ответ на стресс, запасы агматина в организме значительно увеличиваются. Такая реакция, как считают ученые, является защитной реакцией агматина на стресс. При гипоксии отмечается повышенная активность аргинин декарбоксилазы. Говоря о механизмах, субарахноидальные инъекции агматина (10-40мкг) могут перевозбуждать нейроны клеток голубоватого пятна в мозге (через сигналы окиси азота). Данная область мозга отвечает за физическую реакцию организма на стресс, в частности, за состояния тревоги и депрессии49), и поэтому считается, что это связано с приемом агматина. Агматин также вступает в некоторые реакции с алкоголем, при приеме препарата в условиях отказа от алкоголя, у людей пропадает чувство тревоги, характерное для тех, кто резко перестал употреблять алкоголь[174] , и можно сказать, что степень беспокойства (вызванного алкогольной зависимостью) зависит от агматина (чем ниже его концентрация в организме, тем реже Вы тревожитесь). Агматин принимает участие в формировании тревожных состояний в мозге, при этом прием алкоголя снижает тревожность за счет истощения запасов агматина в организме. Эксперимент в приподнятом крестообразном лабиринте (EPM; стандартный тест на тревожность у крыс) показал, что инъекции 20-40мг/кг и 40мг/кг агматина эффективно снижают тревожность, и действие агматина в данном случае сопоставимо (даже чуть более эффективно) с эффектом от 30мг/кг имипрамина. Исследование перорального агматина (10-40мг/кг) у крыс подтвердило, что, при приеме препарата, чувство тревоги у крыс притупляется; это было установлено в ходе теста социальной конфликтности у крыс, в котором им также давали диазепам (80мг/кг и 5мг/кг), обе дозы которого оказались неэффективными. В тесте на тревожность, когда мышам то включали, то выключали свет, агматин в той же дозировке либо не оказывал никакого эффекта, либо эффект был, но только после инъекции 80мг/кг, либо 10мг/кг перорально; в обоих случаях агматин действовал менее эффективно, чем препарат сравнения (диазепам). В дозировке 100мг/кг агматин либо не действовал, либо только усугублял степень тревожности. Агматин обладает способностью убирать тревогу, в тех же дозах, которые принимают для лечения депрессии; все это наглядно показано на кривой нормального распределения и удвоение дозы агматина лишает его успокаивающей способности. Общее седативное действие агматина при максимальной его эффективности либо менее мощное, либо такое же, как у препарата сравнения (валиум).
Депрессия
Исследование активности агматиназы как у депрессивных, так и у би-полярных людей, показало, что стандартная кинетика агматина (без приема) меняется у людей с симптомами депрессии, поскольку в этом состоянии у человека уровень агматина в сыворотке повышается, как и степень ущерба, нанесенного организму стрессом. На агматин также влияют депрессанты, способствующие истощению его запасов в организме, как, например, бупропион (велбутрин), тогда как селективные ингибиторы обратного захвата серотонина (SSRI-препараты) вызывают увеличение концентрации агматина. Депрессия также связана с ненормальными сигналами рецептора имидазолина. Депрессия связана с изменением кинетики агматина и его функции, но, к сожалению, то, какими будут изменения, предугадать невозможно. Фармацевтические антидепрессанты также по-разному воздействуют на агматин (повышая, либо снижая его концентрацию в клетках), но в любом случае помогают в борьбе с депрессией. При приеме агматина отдельно от других препаратов (10-40мг/кг перорально для крыс, 1.6-6.4мг/кг для человека), сокращается длительность периода иммобильности, что доказано в ходе теста принудительного плавания, причем эта реакция наблюдается у всех, при приеме агматина в концентрациях 5-40мг/кг или 10мг/кг перорально и в различных дозах инъекционно (0.01-100мг/кг; более эффективными дозами считаются 10-50мг/кг).50) В ходе экспериментов с активным контролем было установлено, что агматин (50мг/кг) чуть менее эффективен, чем 15мг/кг имипрамина, а 10-100мг/кг агматина не уступают 30мг/кг имипрамина. В ходе теста с подвешиванием крыс за хвост, агматин действовал подобно антидепрессанту, при этом 40-80мг/кг агматина перорально можно поставить в один ряд по эффективности с 10мг/кг имипрамина. Сам по себе, агматин в умеренных дозах обладает «эффектом антидепрессанта», доказанным в ходе эксперимента с крысами, которым давали препарат перорально. Эффективность агматина в данном случае можно сравнить с действием имипрамина (возможно, первый чуть менее эффективен). По подсчетам ученых, оптимальным человеческим эквивалентом стандартной дозы для крыс (10-40мг/кг) является 1.6-6.4мг/кг агматина (217-435мг для человека с массой тела 150 фунтов). Установлено, что агматин образует синергию с многочисленными антидепрессантами, такими как бупропион (10-20мг/кг агматина инъекционно, в зависимости от активности рецепторов имидазолина), имипрамин (0.01-50мг/кг, не всегда), SSRI (5-10мг/кг агматина в виде инъекций, в зависимости от активности рецепторов имидазолина), а также, как ни странно, путресцин (полиамин), образующий синергию с агматином в условиях депрессивной симптоматики (0.001мг/кг агматина инъекционно). «Эффект антидепрессанта» блокируют L-аргинин, йохимбин (ингибитор α2A-рецептора), и гуанозиммоносульфат; в ходе другого исследования было установлено, что ингибиторы калийных каналов (принцип действия агматина) выводятся из строя другими ингибиторами (PDE5), такими как виагра. Блокировка 5-HT1A, 5-HT1B, 5-HT2A или 5-HT2C рецепторов серотонина сводит эти эффекты на нет, то же самой происходит при блокировке «дельта» и «му» - элементов опиоидных рецепторов (но не «каппа») 51), открытие калийных каналов также мешает деятельности агматина. На вышеупомянутые эффекты никак не влияют: празозин (ингибитор α1A-рецептора), истощение запасов серотонина, блокировка бета-адренергической системы (пропанолол) или 5-HT3-рецепторов. Синергизм, вероятно, является следствием ингибирования каналов калия,52) поскольку ранее упомянутые классические антидепрессанты, как правило, обладают такой способностью, также как аденозин (эндогенный нейро-трансмиттер) и фолиевая кислота, которая, при открытии калийных каналов, способствует развитию депрессии. Ранее упоминалось, что синергизм не наступает при блокировке различных рецепторов серотонина, которые являются медиаторами каналов калия. И, наконец, несмотря на то, что агматин (500µM), не самостоятельно, ингибирует калийные каналы, «эффект антидепрессанта» пропадает под действием веществ, открывающих эти каналы. «Эффект антидепрессанта» у агматина связан с усилением действия других веществ. Поскольку сам по себе агматин не может ингибировать каналы калия, он (любыми путями) увеличивает эффективность других веществ, заставляя их это делать на манер антидепрессантов. Такой синергизм требует, чтобы сигналы этих веществ, поступающие на рецепторы серотонина, сохранялись (сигналы активных молекул), и чтобы также сохранялись сигналы агматина, проходящие через α2A-рецепторы. В ходе пилотного эксперимента с участием депрессивных людей, не резистентных к антидепрессантам (с клинической, моно-полярной/би-полярной видами депрессии), которым ежедневно давали 2-3г агматина перорально (и никаких других лекарств), были установлены 3 случая ремиссии, которая сохранялась при последующем приеме парахлорофенилаланила (PCPA); из всего этого следует, что, так же как и в экспериментах с животными, «эффект антидепрессанта» при приеме агматина людьми никак не связан с выработкой серотонина. Согласно небольшому пилотному исследованию, агматин вызывает ремиссию у страдающих депрессией (т.н. лечебный эффект)
Аппетит
Y-Нейропептид - это пептидный нейрогормон, который регулирует чувство голода, благодаря чему его еще называют 'орексигенный' (или возбуждающий аппетит) гормон; его инъекции в паравентрикулярное ядро (PVN) гипоталамуса улучшают аппетит. Действие Y-нейропептида тесно связано с α2-адренергическими рецепторами53) , при активации которых (как правило, клофелином) повышается концентрация Y-нейропептида; этим и объясняется снижение аппетита при приеме препаратов-антагонистов (йохимбина и раувольсцина). Инъекции агматина в гипоталамус сытых крыс повышают у них аппетит 54) (10-20нмоль на 45-54% в течение 24 часов), что связано с повышенной активностью Y-нейропептида, при этом в роли медиатора выступает α2-адренергический рецептор, а прием йохимбина смягчает действие агматина. Внутрибрюшинные инъекции агматина (40-80мг/кг) также повышают аппетит (на 44-49% в течение 24 часов), тогда как дозировка 20кг/кг неэффективна. Агматин – это своеобразный антипод йохимбина, прием первого может улучшать аппетит (в роли медиатора - α2A-рецепторы), но только у крыс, которые уже сыты, чего не скажешь о голодных крысах. Ученые пока не знают, как применить эту информацию на практике, однако в будущем это свойство агматина может помочь людям с недостатком массы тела, которые всю жизнь пытаются набрать вес.
Память и мыслительный процесс
Известно, что агматин активно и в больших количествах накапливается в гипоталамусе, особенно в пирамидальных CA1-нейронах. В ходе экзоцитотического процесса, вызванного синаптическим Ca2+, агматин высвобождается из гипоталамуса вместе с пузырьками глютамата 55), в результате чего концентрация агматина в синапсе увеличивается под действием гипокампа (при активации нейронов) и ускоряется мыслительная функция (на 60-85%, тест с водным лабиринтом у крыс); отмечались и более высокие скачки (на 210-573%), но эффект сохранялся лишь в течение 85-95 минут;56) уровень базового агматина в организме, как правило, не меняется, оставаясь в пределах нижнего диапазона, как упоминалось ранее. Последующее выделение агматина из гипокампа протекает менее интенсивно. Учеными установлено, что при мыслительном процессе, агматин также накапливается в радиальном, предлобном и околоносовом внешних слоях гипокампа, а также в клетках голубоватого пятна в мозге, где активность нейронов усиливается при приеме агматина. Голубое пятно отчасти способствует проявлению этих полезных свойств агматина там, где необходимо избежать ингибирования, предлобная зона отвечает за обучаемость и за способность к целенаправленной деятельности,57) а околоносовая область (также как и сам гипокамп) благотворно воздействуют на определение местоположения смещенного объекта. Будучи нейро-трансмиттером, агматин участвует в процессе запоминания. В процессе обучения, концентрация агматина в гипокампе, окололобной зоне, радиальном слое и околоносовой области увеличивается, что негативно влияет на образование глютаминергических сигналов (это также связано с антагонизмом NMDA-рецептора) Одно из исследований (в мезенхимальных стволовых клетках человека, а не в нейронах) показало, что повышенная активность фермента аргинин декарбоксилазы способствует увеличению запасов агматина (в 2 раза), что, как считают ученые, усиливают действие нейротрофического фактора головного мозга (BNDF), на фоне фосфориляции Akt транскрипционного фактора CREB. BNDF - это конечное звено CREB, конечного звена Akt, активацию которого вызывает прием агматина; агматин выбирает такой путь, чтобы выжить в этих стволовых клетках58), что, в свою очередь, балансирует синаптическую пластичность и оптимизирует процесс запоминания внутри нейронов.Помимо возможного усиления транскрипционного фактора BDNF (принимающего участие в процессе запоминания), если ежедневно в течение двух недель принимать 20мг/кг агматина перорально, то в предлобной зоне гипокампа растет уровень концентрацииаденилат циклазы. Агматин, вероятно, участвует в процессе запоминания, на фоне активного синаптического синтеза или повышенной активности циклического аденозинмонофосфата (cAMP); эти два обстоятельства никак не связаны между собой. И наоборот, некоторые механизмы агматина могут способствовать развитию амнезии, как, например, антагонизм NMDA-рецепторов59) и нарушение метаболизма окиси азота, так как оба эти фактора принимают участие в процессе запоминания. Инъекции 40мг/кг агматина блокируют синтазу окиси азота (это связано со снижением уровня L-цитруллина, которое свидетельствует о том, что аргинин реже превращается в цитруллин под действием синтазы окиси азота). Примечательно, что в процессе обучения концентрация цитруллина повышается как в зубчатой извилине, так и в предлобной зоне гипокампа. И хотя, на выходе из гипокампа, агматин смешан с пузырьками глютамата (агониста NMDA-рецепторов), в обычных условиях (без перорального приема) это не повод для беспокойства; в процессе обучения, в мозге крыс увеличиваются запасы базового синаптического агматина (с 0.25µM до 0.75µM)60), тогда как концентрация полу-масимального ингибирования NMDA-рецептора варьируется в пределах 100-300µM. И тем не менее, ученые до конца не уверены, могут ли высокие пероральные дозы агматина ингибировать NMDA-рецепторы гипокампа. Некоторые механизмы агматина, по подозрению ученых, способствуют развитию амнезии, поскольку и NDMA-рецептор, и NO-синтаза (которую агматин ингибирует) благотворно влияют на процесс запоминания. Ученые пока не знают, как применить эту противоречивую информацию на практике. В экспериментах в водных лабиринтах, направленных на исследование пространственного мышления, микро-инъекции агматина в гипокамп оказались неэффективными в плане улучшения памяти, что можно сказать и о внутрибрюшинных инъекциях препарата (10-50мг/кг).61) Агматин не влияет на развитие пространственного мышления, что подтверждается результатами еще одного исследования. Ситуативный страх и процесс познания, как было отмечено дважды, можно моделировать инъекциями агматина (20-40мг/кг внутривенно), тогда как избегание ингибирования и поведенческое мышление улучшаются. Функция определения местоположения смещенного в пространстве объекта (но не распознавание новых объектов) усиливается, при пероральном приеме и внутривенном введении стандартных дозировок агматина (10мкг интратекально, либо 40мг/кг внутривенно). Между прочим, функции, для которых необходима хорошая память (чему способствует агматин) – это те функции, при которых, в ходе процесса обучения, области мозга распознают сигналы агматина (независимо от приема препарата). Сюда относятся околоносовая область и гипокамп (определение местоположения смещенного в пространстве объекта), тогда как клетки голубого пятна реагируют на прием агматина, отвечая при этом за действия, связанные с избеганием ингибирования. Полезные свойства агматина связаны как со сложностью задания, так и со временем его выполнения, и, предположительно, относятся скорее к более сложным заданиям, а не к простым. Агматин стимулирует области мозга, отвечающие за познание, которые либо реагируют на введение агматина, либо сами его синтезируют, направляя в синапсис в большом количестве. Поэтому агматин помогает выполнять задания, связанные с избеганием ингибирования, определением местоположения смещенных в пространстве объектов, и улучшает поведенческое мышление; он не влияет на пространственное мышление, и даже может усугублять контекстуальный страх (избегание негативных раздражителей) Скорее всего, речь здесь идет о кривой нормального распределения, поэтому более высокие дозы не являются более эффективными, чем оптимальные в каждом конкретном случае, и ученые до сих пор в замешательстве, улучшает ли агматин (в виде пищевой добавки) кратковременную память или нет.
Эпилепсия и конвульсии
Сигналы окиси азота положительно влияют на судорожные припадки, выступая в роли медиатора, при этом L-аргинин повышает восприимчивость организма к таким состояниям (после того, когда они уже вызваны другим веществом), чему препятствует ингибирование синтазы окиси азота. Считается, что сигналы агматина, проходящие через α2A-рецептор, способствуют ослаблению синтеза окиси азота (являясь конечным пунктом индуцибельной NO-синтазы), что, в свою очередь, снижает частоту возникновения припадков и их интенсивность. Когда у человека случается судорожный припадок, сигналы окиси азота усиливаются, что приводит более тяжелым последствиям припадка. Считается, что агматин, делая сигналы окиси азота менее интенсивными, при воздействии на ее адренергический рецептор α2A, защищает организм от таких состояний. Агматин (100мг/кг в виде инъекций за 45 минут до начала припадка) усиливает действие фенобарбитола (ED50 снижается с 22.54 до 16.82мг/кг) и вальпроата (с 256.1 до 210.6мг/кг), однако, сам по себе, не защищает крыс от судорожных припадков, вызванных электрошоком, а также не влияет на действие других препаратов против эпилепсии (карбамазепина, ламотригина, фенитоина, окскарбазепина и топирамата). В других экспериментах, инъекции агматина в сопоставимых дозировках (80-160мг/кг, но не ниже) также помогали предотвратить препадки, вызванные действием электрошока62), тогда как более низкие дозировки (30мг/кг перорально) помогали снизить вероятность наступления припадка за 15 минут до его предполагаемого начала, сохраняя свою эффективность в течение 6 часов (наибольший эффект был заметен через 4 часа), а действие 60-120мг/кг агматина не многим отличалось от дозировки 30мг/кг. Прием агматина в более низких дозировках (5-40мг/кг; наиболее эффективны 10-20мг/кг за 30-45 минут до припадка) перед приемом пентиленететразола (PTZ) способствовал уменьшению частоты конвульсий, при этом эффект был менее выраженным при одновременном приеме йохимбина и синтеза окиси азота, и усиливался под действием ингибитора NO-синтазы L-NAME. У грызунов, агматин эффективно подавляет эпилептические припадки различного происхождения (PTZ и MES), что было подтверждено на примере крыс, в течение15-360 минут после перорального приема однократной дозы; человеческий эквивалент составляет 5мг/кг массы тела.
Сигналы кальция
Агматин вступает в несколько реакций с кальцием. Первая заключается в том, что при активации NMDA-рецептора повышается уровень содержания внутриклеточного кальция, который затем активирует индуцибельную NO-синтазу63) и, будучи антагонистом NDMA-рецептора, агматин ограничивает количество внутриклеточного кальция (агматин также может воздействовать на нейрональную NO-синтазу, реакций с которой больше). Кроме того, ученые заметили, что агматин напрямую блокирует каналы поступления кальция, находящиеся внутри нейронов гипокампа (обратимая реакция), при этом IC50 составляет 0.79-1.57µM, а в концентрации 100нМ агматин ингибирует 21+/-4% этих каналов; в других экспериментах агматин вставал на место дильтиазема, ингибитора каналов кальция. Ученым так и не удалось доказать влияние агматина (в концентрациях до 500µM) на каналы натрия или калия. Говорят, что окись азота повышает проходимость активированных кальцием каналов калия, что является последствием активации NMDA-рецептора;64) агматин, предположительно, воздействует на каналы калия (будучи антагонистом NMDA-рецептора), что способствует проявлению у агматина «эффекта антидепрессанта», хотя бы частично. В целом, агматин, вероятно, является антагонистом сигналов кальция (предотвращая образование сигналов NMDA-рецептора и напрямую ингибируя приток нового кальция, говоря о физиологических концентрациях) и может косвенно блокировать образование сигналов калия (также через антагонизм NMDA-рецептора).
Прочие механизмы
Когда мышам с провалами памяти, вызванными диабетическим токсином стрептозотоцином, на протяжении 30 дней инъекционно вводили низкие дозы агматина (5-10мг/кг), у них в итоге снизился уровень глюкозы в крови и улучшилась память, хотя последний эффект не связан I2-рецептором имидазолина, необходимого звена в реакции с глюкозой (то есть, существуют два независимых друг от друга механизма). Агматин также обладает защитным действием при нарушениях памяти, связанных с пигментацией бета-амилоидов, MPTP-токсина, скополамина, и с воспалением (возбудитель - липополисахарид).65) Агматин защищает мозг от проникновения экспериментальных токсинов, вызывающих амнезию и от факторов, негативно влияющих на процесс запоминания (воспаление и повышение уровня глюкозы в крови) Два эксперимента показали, что агматин препятствует ингибированию опережающего импульса (PPI; явление, при котором 'опережающий импульс', обладающий, как правило, нейронным действием, слабо проявляется перед осуществлением потенциального действия или пульса, и в связи со снижением чувствительности его сигналы ослабевают). При высокой активности PPI, потенциал действий преувеличивается, а при низко активном PPI, все потенциальные действия амортизируются. Несостоявшаяся блокировка опережающего импульса, как полагают, возникает на фоне шизофрении и прочих неврологических недугов, такие как состояние повышенной тревожности или посттравматическое стрессовое расстройство (PTSD); у шизофреников концентрация агматина в сыворотке необычайно высока. Инъекции агматина, сделанные экспериментальным животным, показали, что, в ответ на звук и на действие фенциклидина, препарат способен смягчать симптомы PPI. Амопрофин же вызывает зависимость,66) а агматин (у крыс) не допускает повышения концентрации первого в крови и гиперлокомоции, вызванной приемом амфетаминов/кетамина. Агматин вступает в реакции с PPI, явлением в неврологии, при котором возникает меньший 'опережающий импульс', который, вследствие кратковременного снижения чувствительности, ослабляет последующие импульсы.
Долголетие
Неврологическое старение
 В процессе старения происходит нарушение нитренергической (относящейся к окиси азота) системы, поскольку растет общая активность синтазы окиси азота в префронтальной коре, при этом запасы агматина в данной области и в гипокампе (в CA1 клетках) истощаются, наряду с увеличением количества полиаминов. Считается, что повышенная активность NOS и снижение уровня агматина в органихме связаны с возрастными поведенческими отклонениями.67)
Если крысам ежедневно на протяжение 4-6 недель делать инъекции агматина (40мг/кг), у них нормализуется активность синтазы окиси азота в зубчатой извилине и префронтальной коре, при этом уровень содержания eNOS или nNOS белков остается прежним (процесс старение также на это не влияет), что является наглядным подтверждением ранее упомянутой теории, ведь в этой дозе агматин, как известно, корректирует возрастные поведенческие расстройства.
Итак, агматин помогает бороться с возрастными поведенческими отклонениями.
В процессе старения происходит нарушение нитренергической (относящейся к окиси азота) системы, поскольку растет общая активность синтазы окиси азота в префронтальной коре, при этом запасы агматина в данной области и в гипокампе (в CA1 клетках) истощаются, наряду с увеличением количества полиаминов. Считается, что повышенная активность NOS и снижение уровня агматина в органихме связаны с возрастными поведенческими отклонениями.67)
Если крысам ежедневно на протяжение 4-6 недель делать инъекции агматина (40мг/кг), у них нормализуется активность синтазы окиси азота в зубчатой извилине и префронтальной коре, при этом уровень содержания eNOS или nNOS белков остается прежним (процесс старение также на это не влияет), что является наглядным подтверждением ранее упомянутой теории, ведь в этой дозе агматин, как известно, корректирует возрастные поведенческие расстройства.
Итак, агматин помогает бороться с возрастными поведенческими отклонениями.
Здоровье сердечнососудистой системы
Агматин выполняет роль модулятора здоровья сердечнососудистой системы (в обоих направлениях), поскольку вступает в реакции с окисью азота. В следующих разделах синонимом позитивного регулирования будет повышение активности окиси азота (и расширение кровеносных сосудов), тогда как негативное регулирование мы будем отождествлять с ингибированием окиси азота (или сужением кровеносных сосудов).
Механизмы позитивного регулирования
Прием агматина способствует расслаблению кровеносных сосудов, так, в концентрации 10µM он стимулирует синтез окиси азота в клетках эндотелия и увеличивает цГМФ в клетках (в нормальной последовательности, при влиянии NO на рецептор). Прямая стимуляция агматином синтеза окиси азота (подобно L-аргинину и D-аргинину) возникает при воздействии препарата на α2A-рецептор, а раувольсцин блокирует действие агматина на уровне рецептора. Аргинин активирует его при концентрации 1mM, тогда как агматина в этом случае требуется в 100 раз меньше.68) Воздействуя на α2A-рецептор, агматин стимулирует синтез окиси азота. Такой же механизм характерен и для L-аргинина (и, само собой разумеется, для L-цитруллина), однако эффективность агматина в данном случае в 100 раз выше. В целом, NO-синтез зависит от сигналов G-белка (Gi/o; и от активности α2A-рецептора) и ферментов NO-синтазы, поскольку ингибиторы ферментов последней enzymes abolish the препятствуют ее выработке.69) Активация кальциевых каналов и рецепторов рианодина (RyR), которые, выбрасывая кальций из клетки, модифицируют кальциевые каналы, также играет определенную роль. Реакция агматина с рецепторами рианодина (в роли медиатора которых выступает окись азота) может быть следствием повышенной (под действием NO) активности цикличной ADP-рибозы (cADPr); cADPr является позитивным регулятором RyR и, хотя агматин не влияет на ее концентрацию или закрепление на том или ином участке, ингибирование cADPr мешает синтезу окиси азота.70) Из этого следует, что увеличение запасов кальция в клетках способствует повышению активности ферментов eNOS, ввиду активации белка, известного как калмодулин. Повышение уровня окиси азота при α2A-рецептора происходит в том случае, если G-белок, в паре с α2A, будут воздействовать на cADPr-молекулу, которая будет способствовать повышению активности рецептора рианодина. Этот рецептор высвобождает кальций, который впоследствии активирует эндотелиальную синтазу окиси азота (eNOS) и способствует последующему NO-синтезу. Проблема в том, что функционирование рецепторов рианодина (RyRы) зависит (как и стимулирует) от выработки окиси азота, и поэтому является как начальным, так и конечным звеном в реакции агматина с NO-ферментами; ингибирование ферментов NO-синтазы мешает влиянию агматина на RyRs.[ Liou SF, et al The vasorelaxing action of labedipinedilol-A involves endothelial cell-derived NO and eNOS expression caused by calcium influx . J Cardiovasc Pharmacol. (2005) ] Любопытно, что воздействие агматина на окись азота нарушалось при блокировке рецепторов имидазолина, фосфолипазы C (PLC) и PI3K, которые не имеют отношения к ингибированию NO-синтазы (L-NAME тут ни при чем). Известно, что имидазолин посылает сигналы через α2A-рецепторы на PI3K и PLC, а сигналы PI3K через Akt, которые активируют eNOS и агматин, проходят по данному сигнальному пути.71) Для включения рецептора рианодина необходима окись азота (как начальное и конечное звено ферментов NO-синтазы), что объясняется прохождением ее сигналов как через α2A-рецептор, так и через рецепторы имидазолина, в результате чего активируется сигнальный путь PI3K/Akt/eNOS, на котором синтезируется окись азота. Не факт, что активация PI3K/Akt/eNOS на какое-то время усиливает синтез оксида азота, поскольку в больших количествах она активизирует сигнальный путь RyR/калмодулин, отвечающий за ее дальнейший активный синтез.
Механизмы негативного регулирования
В некоторых реакциях, агматин действует как сосудосуживающее средство. Как отмечают ученые, агматин в высоких концентрациях (1мM) в незначительной степени усиливает способность норадреналина сужать артерии (EC50 снижается с 2.2µM до 1.5µM), одновременно лишая клофелина (0.9µM - 2.6µM) и метоксамина (1.6µM - 2.8µM) сосудосуживающих свойств. Агматин (в высоких концентрациях) может усиливать сосудосуживающее действие норадреналина. Агматин является маломощным конкурентным ингибитором всех изоформ NO-синтазы, при этом значения Ki различны: 220μM (iNOS), 660μM (nNOS) и 7500μM (eNOS). В ходе ряда других исследований было установлено, что агматин блокирует nNOS при концентрации полумаксимального ингибирования IC50 160μM, iNOS при 260μM72), однако влияние агматина на nNOS и eNOS не было доказано. Прочие эксперименты оказались нерезультативными, поскольку не было установлено, что агматин вообще является ингибитором ферментов NO-синтазы (и особенно eNOS, которая итак меньше всех подвергается ингибированию, если вообще поддается), что, вероятно, обусловлено с необходимостью высоких концентраций. Агматин способен блокировать деятельность ферментов NO-синтазы, но для этого нужны довольно большие количества препарата; и если ингибирование iNOS и nNOS ферментов невозможно без перорального приема агматина (при котором свойства проявляются наиболее ярко), блокировка eNOS-фермента не представляет никакой важности с практической точки зрения (поскольку речь идет о слишком высоких концентрациях препарата). Несмотря на то, что агматин является слабым конкурентным ингибитором, он считается нереверсивным деактиватором фермента синтазы окиси азота (NOS) при Ki = 29μM. Такой механизм действия является следствием трехкратного повышения активности NADPH-оксидазы NO-синтазы (предмет исследования - nNOS), которая вызвала резкий всплеск концентрации H2O2 и окислительную деактивацию этого фермента. Такая реакция была вызвана действием калмодулина (переносчика электрона NADPH-оксидазы в гем-группу фермента NO-синтазы; сам по себе, калмодулин может ослаблять действие NO-синтазы, деактивируя ее), спустя час после приема которого активность NO-синтазы снизилась на 30+/-1.2%, при этом NADPH-оксидаза оставалась пассивной в течение 20 минут, зато потом эффективно деактивировала синтазу, спустя 20-60 минут после приема препарата. В целом, негативное регулирование агматина (слабый конкурентный ингибитор, зато окислительный деактиватор) характерно и для других ингибиторов NO-синтазы , таких, как аминогуанидин73) и гуанабенц. Биологическая ценность данного свойства пока не установлена, поскольку период полувыведения агматина из плазмы слишком короткий, но, в отличие от ингибирования фермента, деактивация NO-синтазы требует физиологически релевантных концентраций. Агматин способен деактивировать ферменты NO-синтазы, что происходит при гораздо более высоких его концентрациях (в 3 раза выше, чем при деактиваци eNOS). Ученые до сих пор не уверены, каким образом деакивация синтазы влияет на синтез окиси азота в живых организмах.
Ткани сердечной мышцы
Учеными было отмечено, что в изолированных вентрикулярных миоцитах, агматин (0.1-10мM) препятствует накоплению кальция в клетках и сокращает пиковую амплитуду канала кальция L-типа (в зависимости от концентрации). В изолированных клетках высокие концентрации агматина блокируют кальций. Практическая целесообразность данного явления до сих пор не установлена.
Кровоток и коагуляция
При приеме агматина, отмечается расслабление сосудов в клетках почек (вследствие чего ускоряется клубочковая фильтрация)74) и в клетках сердечнососудистой системы (кольцах аорты), что связано с активностью окиси азота в эндотелии (которой мешают ингибиторы NO-синтазы). Эксперименты с внутривенным вливанием агматина не увенчались успехом в попытке доказать способность агматина изменять тонус сосуда внутри артериальной хвостовой вены у крыс. В живых организмах, агматин, вступая в реакцию с окисью азота, обладает сосудо-расслабляющим действием. Исследование времени коагуляции крови (антикоагулянты его увеличивают) на примере крыс, котрым давали 300μг/kг агматина, показало, что после начала кровотечения, кровяное давление у крыс повысилось, что увеличило их шансы на выживание, и что йохимбин и аргинин сводят данный эффект на нет (что предполагает зависимость от α2A-рецептора и снижения концентрации окиси азота). Итак, агматин останавливает кровотечения, что связано с повышением артериального давления и позволяет предположить, что агматин оказывает модулирующее действие на кровоток в целом, а не просто разгоняет кровь
Артериальное давление
Агматин известен, как вещество-заместитель клофелина, поскольку встает на место последнего внутри α2A-рецептора и рецептора имидазолина, при этом клофелин, как известно, снижает артериальное давление, при участии рецептора имидазолина75), подобным действием обладает и агматин. Как ни странно, вместо того, чтобы вытеснить клофелин из рецептора имидазолина, агматин в данный процесс не вмешивается. Воздействуя на рецепторы имидазолина, агматин снижает артериальное давление. Инъекции агматина крысам под анастезией способствуют снижению артериального давления.76)
Реакции с метаболизмом глюкозы
Уровень глюкозы в крови
Активация рецепторов имидазолина в надпочечнике, как известно, снижает уровень глюкозы в крови у крыс-диабетиков, пораженных стрептозотоцином, и агматин активирует эти рецепторы.77) Снижение уровня глюкозы в крови связано с повышением уровня β-эндорфина, который, как известно, отвечает за перераспределение глюкозы из тканей в клетки скелетной мускулатуры, независимо от того, выполняет ли человек упражнения или отдыхает; возможно, это связано с повышением уровня иРНК внутри GLUT4. β-эндорфин мешает синтезу глюкозы в печени, одновременно стимулируя выделение инсулина поджелудочной железой; и тем не менее, влияние агматина на эти параметры остается под вопросом. Агматин способен воздействовать на надпочечники (через рецепторы имидазолина), высвобождая оттуда β-эндорфин, опиоид, перераспределеяющий глюкозу из крови в клетки скелетной мускулатуры. Благодаря этому, агматин способен понижать уровень глюкозы в крови (вступая в реакцию с надпочечниками).
Скелетная мускулатура и физическая активность
Механизмы
Агматин, на фоне активации рецепторов имидазолина в надпочечниках, выпускает β-эндорфин в плазму. Как известно, β-эндорфин (выработке которого способствует агматин) стимулирует накопление глюкозы в клетках скелетной мускулатуры у крыс-диабетиков, независимо от того, активно животное в данный момент или пассивно, и, возможно, это связано с повышением концентрации иРНК в GLUT4 хотя β-эндорфин (сам по себе, без участия агматина) не влияет на процесс накопления глюкозы в адипоцитах;78) это предполагает наличие у агматина структурирующих свойств в отношении питательных веществ, что не доказано. Агматин также существенно снижает уровень глюкозы в крови животных-диабетиков, и ученые спорят, является ли данное свойство следствием выборочного перераспределения глюкозы в мышцы вместо ее аккумуляции в виде жировых отложений, что связано с повышением уровня β-эндорфина в крови. Пока что проведено слишком мало исследований в этом направлении (имеется в виду пероральный прием агматина).
Реакции с гормонами
Лютропин
Инъекции агматина в гипоталамус вызывают (в зависимости от дозы) выделение гормона лютропина, что считается следствием активации рецепторов имидазолина.79)
Реакции с системами органов
Глаза
В живых организмах, агматин защищает ганглиозные клетки сетчатки от апоптоза, что отмечается при местном применении агматина (смертность клеток снизилась с 55.44% до 18.65%) и связано со снижением внутриглазного давления. Данное свойство агматина также применительно к ишемической травме глаза. Агматин, при местном применении, оказывает защитное действие на глаза; пероральный прием агматина в этом отношении еще недостаточно изучен.
9.2. Желудок Агматин обычно содержится в тканях желудка (прибл. 71нг/г влажной массы), который является одним из немногих органов у крыс (не имеющих отношения к мозгу) с наивысшей концентрацией агматина (ввыше, чем в селезенке и кишечнике). Агматин накапливается в мембранах слизистой желудка (в канальцах париетальных клеток), где, благодаря высокой щелочности, является своеобразным буфером, защищающим париетальные клетки от разрушения желудочным соком. Агматин, будучи от природы высоко-щелочным соединением, является серьезным защитником нашего желудка, поскольку не дает желудочному соку разъедать клетки желудка). Инъекции 100мг/кг агматина эффективно защищают нас от ишемии желудка (вызываемой белком PI3K), однако в других областях агматин (в комбинации с алкоголем или стрессом80)) могут способствовать сильному язвообразованию, воздействуя на рецепторы имидазолина (в дозировке 20-25мг/кг); ученые до сих пор ломают голову, в чем же причина такой разницы – в объеме дозы или в контексте заболевания. α2A-рецепторы, при совместной активации с рецепторами имидазолина (которые особо не влияют на данный процесс), вызывают сокращения желудка. Агматин, как отмечают ученые, защищает желудок от повреждений (связанных с ишемией) и, в то же время, усугубляет повреждения, вызванные приемом других химических соединений или стрессом.
Кишечник
Агматин имеет прямое отношение к кишечнику, поскольку синтезируется под действием кишечной (и желудочной) бактерии и, после перорального приема, накапливается в кишечнике.
Почки
Агматин также синтезируется в почках, где способствует ускорению клубочковой фильтрации почечных тканей, вероятно, при участии I2 –рецепторов имидазолина (селективный агонист I1 неэффективен в данном случае), его дальнейшее действие зависит от NO-синтазы; альфа-2-адренергические рецепторы в данном случае не нужны,81) но активация класса рецепторов, известных как рецепторы рианодина (на которые поступают сигналы кальция), возможно, и объясняет ранее упомянутые свойства агматина. Независимо от механизма действия, нейроны в данной реакции не нужны (поскольку и инервированные, и денервированные почки функционируют одинаково). Концентрация Na+/K+ ATФазы в клетках почечного эпителия также повышается. По предварительным данным, ускорение клубочковой фильтрации почек, вероятно, защищает клетки почечного эпителия от повреждений. В основе этой реакции, возможно, лежит новый механизм, при котором агматин воздействует на рецепторы рианодина.
Мужские половые органы
Известно, что агматин вступает в реакцию с адренергическими α2A-рецепторами в семявыводящих протоках, как перед синапсом, так и после, при этом агматин (10-1,000µM) усиливает электрические спазмы, возникающие при блокировке каналов калия. Как позднее выяснилось, усиление происходило в предстательной железе, а не в придатке яичка, и наиболее интенсивные спазмы наблюдались при концентрации агматина 1mM (207.1+/-14.2% на контроле).
Реакции «биоген-биоген»
Аргинин/Цитруллин
L-аргинин и L-цитруллин – это две аминокислоты, повышающие уровень аргинина в плазме. Окислительная деактивация агматином фермента синтазы окиси азота (в данном исследовании на примере nNOS с Ki = 29µM) связана с повышенной активностью NADPH-оксидазы, снижению которой, как известно, способствует аргинин, поскольку nNOS все же усиливает действие iNOS и eNOS. В этом отношении, аргинин является антагонистом агматина, при его воздействии на nNOS (возможно поэтому пероральный прием аргинина блокирует многие неврологические его свойства), но это не относится к eNOS. Ученые не уверены, поможет ли одновременный прием одного из этих двух веществ с аргинином стимулировать систематический синтез окиси азота (через eNOS; механизм большинства реакций, связанных с артериальным давлением) или же эффект будет антагонистическим; оба варианта возможны, первый – как следствие усиленного синтеза окиси азота из eNOS, второй – вследствие ускоренной деактивации этого фермента. Аргинин (и, само собой разумеется, цитруллин) являются ингибиторами некоторых неврологических свойств перорального агматина, таких как снижение восприимчивости к опиоидам. Механизм реакции агматин-аргинин в кровеносных сосудах (и в плане «допинга» для физических упражнений) до сих пор не понятен ученым.
Алкоголь
Агматин вступает в реакцию с алкоголем как на желудочном и неврологическом уровне, так и на всех остальных, при этом агматин помогает ослабить симптомы отказа от алкоголя, но, вероятно, их не стоит сочетать. Облегчение тревожной симптоматики (анксиолизис) блокирует фермент аргинин декарбоксилазы, что предполагает также участие агматина. Повышенная тревожность, связанная с отказом от алкоголя, приходит в норму при употреблении агматина. Кроме того, анальгетичекие (обезболивающие) свойства алкоголя усиливаются после инъекций агматина у крыс, что, как считают ученые, вызвано поступлением его сигналов на рецептор имидазолина, агматин (5-20мг/кг) также снижает алкогольную гиперактивность у мышей (самцов), не влияя при этом на общую локомоцию. Агматин практически не влияет на предпочтение мест введения психически активного вещества (CPP), что свидетельствует о том, что он также не связан с мотивацией/формированием зависимости.82) Если говорить об отрицательных эффектах, то, защищая наш желудок (париетальные клетки от разрушения желудочным соком), агматин, как ни странно, усугубляет язвенные процессы, вызванные действием алкоголя, у крыс. На сегодняшний день, агматин пригодится при отказе от алкоголя. Сочетать эти два вещества крайне неразумно, поскольку, как было установлено в ходе одного из исследований, это усугубляет язвенные процессы в желудке , поэтому желательно соблюдать интервал между их приемом.
Кофеин
Разовая доза кофеина, достаточная для повышения локомоции (у мышей, ранее не пробовавших его), в комбинации с агматином (5-20мг/кг), блокирует это повышение, но только самцов.
Марихуана
Мaрихуана является каннабиоидным наркотиком, сигналы которого поступают на два рецептора, известных как эндоканнабиоидные рецепторы (CB1 и CB2); Следующая информация относится к агонистам CB1-рецептора (и, как возможное следствие, затрагивает метаболизм анандамида арахидоновой кислоты и олеамид) и отчасти перекликается с агонистами CB2-рецепторов (эхинацея). CB1-рецепторы группируются в среднем отделе головного мозга, что очень похоже на локализацию рецепторов имидазолина и агматина, а в тканях сердечной мышцы эти рецепторы, как минимум, взаимодействуют между собой. Эндоканнабиоидные рецепторы равномерно расположены вдоль рецепторов имидазолина, при этом обе группы благоприятным образом взаимодействуют между собой; марихуана является мощным активатором CB1-рецепторов, то же можно сказать об агматине в отношении рецепторов имидазолина. Установлено, что агматин синергетически усугубляет признаки гипотермии и усиливает действие двух каннабиоидных наркотиков на 300-440%, то есть снимает термическую боль (сам по себе, агматин в этом случае неэффективен).83) Этот эффект не связан с α2A-рецепторами и вряд ли является следствием ингибирование NO-синтазы или NMDA-рецептора, и сходит на нет при вмешательстве антагонистов (блокираторов) имидазолина и CB1-рецептора. Поскольку для данной реакции необходимы оба рецептора и для прикрепления антагониста CB1-рецептора (SR141716A) к своему рецептору, должна произойти активация имидазолина, не факт, что при активации рецепторов имидазолина сигналы агматина поступят на CB1-рецептор, при позитивной аллостерической модификации рецептора (рецептор меняет свою структуру в зависимости от сигналов, позитивным считается усиление сигналов агматина, по сравнению с исходной отметкой). Сигналы CB1-рецептора и сигналы рецептора имидазолина образуют синергию. Нельзя дать 100%-ных гарантий, как это работает, но оба рецептора выполняют важную функцию, и не факт, что изменение структуры CB1-рецептора при активации рецептора имидазолина вообще произойдет (если произойдет, то сигналы агматина, при поступлении на эти рецепторы, будут усиливаться). И если сегодня можно с уверенностью говорить только о синергии агматина в отношении термической боли, у него есть все шансы к образованию синергии с марихуаной, и механизмы здесь могут быть самыми разными (наиболее интересна невротическая боль).
Безопасность и токсичность
Общая информация
 Несмотря на то, что этой теме было до сих пор посвящено совсем немного исследований, по данным MSDS, разовая пероральная летальная доза LD50 агматина составляет 300мг/кг для мышей, 980мг/кг для крыс и 3200мг/кг для кроликов.
В ходе эксперимента длительностью более 51 дня, по изучению переносимости той или иной дозы агматина, в ходе которого людям с дегенеративными патологиями пояснично-крестцового отдела позвоночника, связанными с радикулопатией, трижды в день во время еды давали разные дозы препарата, а именно 1,335г (первые 10 дней) 2,67г (последующие 10 дней), 3.56г (последующие10 дней, после которых эта доза поддерживалась на протяжение последних 21 дня), не было выявлено существенного влияния разных доз перорального агматина на испытуемых, за исключением небольшого дискомфорта в ЖКТ при повышении дозы до 3,56г, который, спустя пару дней, прекратился.
В настоящее время воздействие агматина на человека изучено недостаточно хорошо, но, по предварительным данным, применение препарата не вызывает известных науке побочных эффектов. Степень токсичности агматина пока что не определена, опять же, в связи с отсутствием достаточного количества научных данных на этот счет.
Несмотря на то, что этой теме было до сих пор посвящено совсем немного исследований, по данным MSDS, разовая пероральная летальная доза LD50 агматина составляет 300мг/кг для мышей, 980мг/кг для крыс и 3200мг/кг для кроликов.
В ходе эксперимента длительностью более 51 дня, по изучению переносимости той или иной дозы агматина, в ходе которого людям с дегенеративными патологиями пояснично-крестцового отдела позвоночника, связанными с радикулопатией, трижды в день во время еды давали разные дозы препарата, а именно 1,335г (первые 10 дней) 2,67г (последующие 10 дней), 3.56г (последующие10 дней, после которых эта доза поддерживалась на протяжение последних 21 дня), не было выявлено существенного влияния разных доз перорального агматина на испытуемых, за исключением небольшого дискомфорта в ЖКТ при повышении дозы до 3,56г, который, спустя пару дней, прекратился.
В настоящее время воздействие агматина на человека изучено недостаточно хорошо, но, по предварительным данным, применение препарата не вызывает известных науке побочных эффектов. Степень токсичности агматина пока что не определена, опять же, в связи с отсутствием достаточного количества научных данных на этот счет.
:Tags
Читать еще: Акампросат (Кампрал) , Базилик Священный (Ocimum sanctum) , Диклоксациллин , Ремацемид , Стефания (Стефания четырехтычиночная) ,










